Současná strategie léčby Parkinsonovy nemoci
Parkinsonova nemoc (PN) je chronicko-progresivní degenerativní onemocnění mozku způsobené excesivním odumíráním dopaminergních neuronů pars compacta substantiae nigrae, jádra ležícího v mezencefalu, s následným deficitem dopaminu. Příznaky PN se projeví až při minimálně 50% poklesu počtu dopaminergních neuronů, kdy se hladiny dopaminu ve striatu snižují až na 20-30 % původní úrovně. Projevy bývají nejdříve nespecifické – poruchy koncentrace, depresivní ladění, zvýšená únavnost, kloubní a svalové bolesti, které někdy připomínají syndrom ztuhlého ramene. V dalším průběhu se objevují kardinální příznaky, mezi které patří třes, rigidita, hypokineze a posturální poruchy. Základním farmakoterapeutickým příznakem v léčbě PN je levodopa v kombinaci s inhibitory dekarboxylázy (benserazid, karbidopa). V počátečních stadiích onemocnění lze v závislosti na věku a kognitivních funkcích zahájit terapii agonisty dopaminu (pramipexol, ropinirol), amantadinem či selegilinem. Použití anticholinergik je v současnosti omezeno na speciální případy.
Úvod
Parkinsonova nemoc (PN) je chronicko-progresivní degenerativní onemocnění mozku způsobené excesivním odumíráním dopaminergních neuronů pars compacta substantiae nigrae, jádra ležícího v mezencefalu, s následným deficitem dopaminu. Pro PN je typické, že úbytek dopaminergních neuronů je v počátečních stadiích stranově asymetrický a více vyjádřený na synapsích v putamen, které je zapojeno do motorických okruhů bazálních ganglií. S progresí PN poté dochází k úbytku neuronů i v druhé hemisféře a k úbytku dopaminergních synapsí i v kaudatu. Úbytek dopaminergních buněk a jejich axonů, které tvoří dopaminergní nigrostriatální dráhu, je možno zobrazit pomocí radionuklidových metod. V našich podmínkách lze použít SPECT vyšetření 123I-ioflupanem (DaTSCAN), což je ligand, který se váže na presynaptický dopaminový transportér.
Příznaky PN se projeví až při minimálně 50% poklesu počtu dopaminergních neuronů, kdy se hladiny dopaminu ve striatu snižují až na 20–30 % původní úrovně. První projevy bývají nespecifické, pacienti si často stěžují např. na poruchy koncentrace, depresivní ladění, zvýšenou únavnost, kloubní a svalové bolesti, které někdy připomínají syndrom ztuhlého ramene. Teprve v dalším průběhu se objevují kardinální příznaky, mezi které patří třes, rigidita, hypokineze a posturální poruchy. Příznaky jsou v počáteční fázi nemoci v souladu s asymetrickým úbytkem dopaminergních neuronů vyjádřeny pouze na jedné straně těla nebo alespoň výrazně asymetricky.
Třes je typicky klidový, akrálně vyjádřený s frekvencí 4–6 Hz, ustupující při volním pohybu. Rigidita se projevuje zvýšeným svalovým tonem, který se objevuje v celém rozsahu aktivního i pasivního pohybu. Zvýrazňuje se pohybem kontralaterální končetiny a ustupuje ve spánku. Poruchy hybnosti charakteru hypokineze (omezení rozsahu pohybu), akineze (porucha iniciace pohybu) a bradykineze (zpomalení pohybů) jsou příznaky, které pacienty nejvíce obtěžují při běžných denních činnostech. Mezi hypokinetické příznaky se řadí i šouravá chůze, zmenšení písma, ztišení hlasu, hypomimie a ztráta synkinezí při chůzi. Mezi posturální poruchy typické pro PN patří anteflekční držení trupu a šíje, flexe končetin, pulze, freezing a festinace. Pulze jsou poruchy udržení těžiště, které se pacient snaží vyrovnat postupně se zkracujícími se a zrychlujícími se krůčky. Freezing se projevuje náhlými pohybovými blokádami při chůzi, kdy dojde jakoby k přilepení k podlaze. Festinace se projevuje zrychlováním a zkracováním kroků při chůzi. Výše uvedené posturální poruchy často končí pády.
Zatímco časné fáze rozvoje onemocnění jsou dopaminergní léčbou dobře ovlivnitelné, hlavní svízelí dlouhodobé dobré prognózy je vznik pozdních hybných i psychických komplikací. Pozdní hybné i psychické komplikace vznikají jednak progresí nemoci, jednak pod vlivem dlouhodobé antiparkinsonské terapie.
Pozdní hybné komplikace se projevují jako fluktuace hybnosti nebo jako dyskineze. Mezi fluktuace hybnosti se řadí především tzv. wearing-off a on-off fluktuace. Termín wearing-off charakterizuje stav, kdy původně uspokojivý účinek jednotlivé dávky L-DOPA, který vydržel třeba 6 hodin, se postupně zkracuje, někdy až na méně než 3 hodiny. Při on-off fluktuacích může stav dobré hybnosti přejít během několika minut do těžké parkinsonské ztuhlosti a akineze bez závislosti na aktuálním stavu medikace. Mezi dyskineze se řadí tzv. monofázické choreatické či bifázické dystonické dyskineze, které se objevují na vrcholu, respektive při vzestupu a poklesu plazmatické hladiny L-DOPA, dále pak tzv. off-dystonie, které se nejčastěji projevují ranní bolestivou křečí prstů dolní končetiny.
Dalším problémem pozdních stadií PN jsou psychické komplikace, mezi něž patří kognitivní dysfunkce a psychotické projevy. Poruchy kognitivních funkcí (zejména exekutivních) jsou dány nejspíše progresí základního onemocnění a až u 20 % pacientů mohou přerůst v globální deficit dosahující stupně demence. Psychotické komplikace bývají indukovány antiparkinsonskou medikací, avšak kognitivní dysfunkce je velkým rizikovým faktorem jejich rozvoje. Vzhledem k tomu, že většina antiparkinsonik je více či méně potenciálně „psychotogenních", kognitivní deficit či psychotická epizoda v anamnéze výrazně omezuje arzenál využitelných farmak [4].
Cílem správné strategie antiparkinsonské léčby je tedy jednak zmírnění příznaků onemocnění, jednak oddálení nástupu pozdních hybných a psychických komplikací.
Farmaka užívaná v terapii Parkinsonovy nemoci
L-DOPA
L-DOPA je prvním a stále symptomaticky nejúčinnějším přípravkem užívaným v léčbě PN. Její efekt byl poprvé popsán začátkem 60. let minulého století, symptomatického efektu bylo ale dosaženo pouze podáváním velmi vysokých dávek. Neúčinnost nízkých dávek byla způsobena rychlou konverzí L-DOPA na periferii enzymem dopa-dekarboxylázou na dopamin, který neprostupuje hematoencefalickou bariérou. Od počátku 70. let se standardně podává v kombinaci s karbidopou či benserazidem – periferně působícím inhibitorem enzymu dopa-dekarboxylázy, což umožnilo výrazně omezit denní dávky L-DOPA a její nežádoucí účinky. L-DOPA se velmi rychle vstřebává stěnou jejuna pomocí přenašeče pro aromatické kyseliny, se kterými o tento přenašeč soupeří. Strava bohatá na bílkoviny tedy omezuje dostupnost L-DOPA, která je jinak kolem 99 %. L-DOPA by tedy měla být užívána nalačno nebo s minimálně 30minutovým odstupem od bílkovinného jídla. L-DOPA dosahuje maximálních plazmatických hladin za 30–120 minut a její plazmatický poločas je 1–3 hodiny. Hlavními nežádoucími účinky L-DOPA jsou nauzea se zvracením a posturální hypotenze, které je možné zmírnit (i preventivním) podáním domperidonu při zahajování léčby. Jedinou absolutní kontraindikací léčby L-DOPA je glaukom s úzkým úhlem. Kromě základní rychle vstřebatelné formy je k dispozici i retardovaná forma.
Pozn.: Použití retardované L-DOPA v denní době sice vede ke snížení monofázických dyskinezí, ovšem za cenu zvýšení výskytu bifázických dyskinezí a off-dystonie. Užití retardované L-DOPA je proto dnes většinou vyhrazeno k pokrytí doby nočního spánku, aby se předešlo obtěžující noční akinezi.
Léčbu L-DOPA zahajujeme nízkou celkovou denní dávkou (cca 50–100 mg/den). Dávku zvyšujeme o 100 mg za 4–7 dnů do dosažení uspokojivého symptomatického efektu. Obvyklá denní dávka je 200–800 mg, maximální denní dávka je 2000 mg užitých rozděleně ve 3–4 dávkách podaných v cca 5hodinových intervalech (v pozdních stadiích až 6 dávek ve 3hodinových intervalech. Klinický efekt by měl být jasně patrný při aplikaci dávky 600–750 mg.
Oproti ostatním preparátům používaným v léčbě Parkinsonovy nemoci má L-DOPA výhodu výborného a rychle nastupujícího symptomatického efektu, bezpečnosti vzhledem k rozvoji psychotických komplikací a relativně nezávažných nežádoucích účinků. Naopak její nevýhodou je především riziko indukce pozdních hybných komplikací při dlouhodobém podávání [3, 4].
Kdy podávat L-DOPA:
– jako monoterapii u pacientů s hybnými symptomy vyžadujícími léčbu, kteří vykazují kognitivní poruchu či prodělali psychotickou epizodu;
– jako monoterapii při nesnášenlivosti nebo závažných nežádoucích účincích agonisty dopaminu;
– jako adjuvantní terapii při nedostatečném symptomatickém efektu agonisty dopaminu.
Agonisté dopaminu
Dopaminergní agonisté jsou látky, které působí přímo na dopaminových receptorech typu D1 i D2 ve striatu. Jedná se o látky, které mají po L-DOPA druhý nejsilnější symptomatický účinek v léčbě Parkinsonovy nemoci. Existují dvě skupiny – ergotové a non-ergotové preparáty. Do první skupiny patří bromokriptin, dihydroergokryptin či pergolid, do druhé skupiny pramipexol a ropinirol. V letošním roce by se nově měl objevit na českém trhu i preparát rotigotin aplikovaný pomocí náplasti. Oproti L-DOPA mají agonisté výhodu delšího plazmatického poločasu. Další výhodou je prokázané signifikantní oddálení fluktuací hybnosti a dyskinezí při jejich dlouhodobém užívání v monoterapii. Jejich neuroprotektivní efekt, který by měl podle předpokladů vznikat snížením obratu dopaminu, se zatím nepovažuje za ověřený [5].
Nevýhodou agonistů dopaminu je vyšší riziko nežádoucích účinků. Jejich užívání je zatíženo rizikem psychotických komplikací, měly by být proto nasazovány u kognitivně intaktních pacientů a nemocných bez anamnézy psychotické epizody. Pomocným kritériem pro nasazení je věk do 65 let. Mezi nežádoucí účinky patří nauzea, zvracení a ortostatická hypotenze. Tyto příznaky vznikají stimulací periferních receptorů D2 a obvykle se výrazně zmírňují po podání domperidonu – antagonisty těchto receptorů. Mezi další nežádoucí účinky patří otoky dolních končetin a imperativní usínání. Zejména imperativní usínání bývá velmi nepříjemné a obtížně řešitelné [3]. Pokud výrazně obtěžuje pacienta, doporučuje se snížení dávek nebo záměna agonisty. Záměnu agonisty je vhodné provést i při neúčinnosti nasazeného preparátu či při nezvladatelných periferních nežádoucích účincích a obvykle se provádí metodou „overnight switch", kdy se preparát zamění ze dne na den. Ergotové preparáty působí navíc vzácné, ale velmi závažné fibrotické komplikace, které se mohou projevit jako fibróza srdečních chlopní nebo plicní či retroperitoneální fibróza. Při započetí léčby novým agonistou by se proto mělo volit výhradně mezi non-ergotovými preparáty, které mají výrazně nižší riziko fibrotických komplikací. Pokud je ergotový preparát pacientovi již podáván a je dobře účinný, je možno jej ponechat, pacient ovšem musí být poučen a musí podepsat informovaný souhlas s léčbou. Dále jsou nutné půlroční echokardiografické kontroly a kontroly renálních parametrů. Poněkud výjimečným agonistou dopaminových receptorů je apomorfin, který má krátký plazmatický poločas 20–40 minut a je dostupný v injekční formě k subkutánní aplikaci. Lze jej využít v diagnostice dopaminergní odpovídavosti a terapeuticky v kontinuální s.c. infuzi při jinak nezvladatelných fluktuacích hybnosti. Indikace této léčby však patří do kompetence specializovaných pracovišť zabývajících se extrapyramidovou problematikou [1].
Kdy podávat agonistu dopaminu:
– jako monoterapii u pacientů bez kognitivního deficitu a bez anamnézy psychotické epizody do 65 let věku, po důkladném zvážení i u kognitivně intaktních starších pacientů;
– při komplexních změnách terapie u různých typů pozdních hybných komplikací u kognitivně intaktních osob a osob bez anamnézy psychotické epizody.
Selegilin
Tento inhibitor monoaminooxidázy (MAO) typu B má mírný symptomatický účinek u pacientů v počáteční fázi PN. Mezi jeho metabolity patří l-amfetamin a l-metamfetamin, které facilitují uvolňování dopaminu. MAO-B může být také enzymem zhoršujícím oxidativní stres dopaminergních neuronů, který urychluje jejich degeneraci. Předpokládaný neuroprotektivní efekt inhibitoru MAO-B se však v klinických studiích nepodařilo jednoznačně potvrdit [5].
Jeho nasazení u starších nemocných v kombinaci s dalšími antiparkinsoniky může zvyšovat riziko psychotických komplikací. Navíc komplikuje případnou terapii deprese, jelikož se nesmí kombinovat s jakýmikoliv antidepresivy a před jejich podáváním musí být dodržen odstup 3–4 týdny od ukončení léčby selegilinem. Těchto vedlejších účinků je prost více symptomaticky účinný příbuzný preparát rasagilin, který se v současnosti zavádí do moderní léčby PN.
Kdy podávat selegilin:
– v časných fázích rozvoje PN s lehkým hybným postižením u osob mladších 60 let věku (i zde je však význam jeho užití sporný a není zcela opodstatněn podle zásad medicíny založené na důkazech).
Inhibitory katechol-O-methyl transferázy
Entakapon je v současné době jediným běžně používaným periferním inhibitorem katechol-o-methyl transferázy (COMT). COMT je enzym konvertující L-DOPA na neúčinný metabolit 3-o-methyldopu. COMT inhibitory se uplatňují jako přídavek k terapii L-DOPA, užívají se většinou s každou dávkou. Zvyšují její plazmatický poločas, dostupnost pro mozek, a tím prodlužují dobu účinku. U fluktuujících pacientů navíc nasazení COMT inhibitoru umožní snížení celkové denní dávky L-DOPA. Pilotní výsledky ukazují, že snížení celkové dávky L-DOPA a menší kolísání jejích hladin při použití COMT inhibitoru vede k oddálení nástupu pozdních hybných komplikací. Potvrzení tohoto předpokladu ve velkých studiích bude současně pádným důvodem k zahájení léčby inhibitory COMT zároveň s podáváním L-DOPA v počátku terapie. Na výsledky těchto studií je však zatím nutno počkat [6].
Pacienty je třeba před začátkem léčby inhibitory COMT upozornit na oranžové zbarvení moči, které tato skupina léčiv způsobuje. Jinak se jedná o bezpečné preparáty s minimem nežádoucích účinků, které jsou tolerovány i nemocnými s kognitivním deficitem a rizikem rozvoje psychotických komplikací. V současné době je k dispozici preparát kombinující L-DOPA/karbidopa/entakapon v jedné tabletě. Druhý vyvinutý periferní i centrální COMT inhibitor, tolkapon, byl stažen z oběhu pro výskyt několika fatálních případů akutní hepatitidy. V současné době se opět objevil na trhu a je považován za rezervní preparát, který by měl být indikován pouze při intoleranci či selhání entakaponu, při jehož užívání je nutno kontrolovat jaterní funkce.
Kdy zahájit léčbu inhibitorem COMT:
– u pacientů léčených L-DOPA s počínajícím wearing-off;
– u pacientů léčených kombinací L-DOPA a agonisty dopaminu s nedostatečným symptomatickým efektem;
– u pacientů s kognitivní dysfunkcí s nedostatečným efektem L-DOPA;
– v rámci komplexních změn terapie při pozdních hybných komplikacích různého typu.
Amantadin
Byl původně vyvinut jako protichřipkový preparát. V roce 1969 bylo poprvé pozorováno symptomatické zlepšení pacienta s PN, jemuž byl amantadin podáván jako antivirový preparát. Toto pozorování bylo dále potvrzeno výsledky klinických studií. Amantadin má symptomatický efekt na parkinsonské příznaky v časné fázi rozvoje nemoci a vykazuje také antidyskinetický efekt v pozdních fázích onemocnění. Při výrazných fluktuacích hybnosti se velmi dobře uplatňuje podání série 5–10 infuzí. Účinek je zřejmě způsoben anticholinergním a navíc antiglutamátergním působením. Amantadin je v monoterapii velmi dobře snášen, nezávažnými nežádoucími účinky mohou být sucho v ústech, rozmazané vidění a edémy končetin [1]. V monoterapii je považován za bezpečný i vzhledem k riziku rozvoje psychotických komplikací, může však zvyšovat jejich riziko v kombinaci s L-DOPA a ostatními antiparkinsonskými preparáty. Intravenózní podávání amantadinu je však rizikové a je rezervováno pouze pro kognitivně intaktní pacienty bez anamnézy psychotických komplikací.
Kdy podávat amantadin:
– v časných fázích rozvoje PN s lehkým hybným postižením;
– u fluktuujících, kognitivně intaktních pacientů s dyskinezemi.
Anticholinergika
Anticholinergika byla vůbec prvními symptomaticky účinnými preparáty v léčbě PN. Účinek je dán působením na muskarinní receptory ve striatu. Mezi používané preparáty patří biperiden, procyklidin a trihexyfenidyl. Dnes mají v léčbě PN velmi omezený význam, zejména pro závažné nežádoucí účinky, a to jak periferní (tachykardie, retence moči, rozmazané vidění, xerostomie), tak centrální (kognitivní deficit, delirium, psychotické projevy). Jejich nasazení je tedy kontraindikováno u osob starších 65 let a u kognitivně postižených nemocných. Jejich náhlé vysazení, a dokonce ani záměna za dopaminergní preparáty nejsou pacienty dobře tolerovány pro prudké zhoršení příznaků dané nejspíše hypersenzitizací receptorů [1]. Vysazování léčby by proto mělo probíhat velmi pomalu. Na závěr je třeba připomenout, že jejich použití v monoterapii PN po objevu dopaminergních preparátů již není považováno za správné, lze je užít pouze jako adjuvantní léčbu.
Kdy zahájit léčbu anticholinergiky:
– u mladších, kognitivně intaktních pacientů s dominantním třesem či s freezingem nereagujícím na dopaminergní léčbu.
Strategie léčby Parkinsonovy nemoci
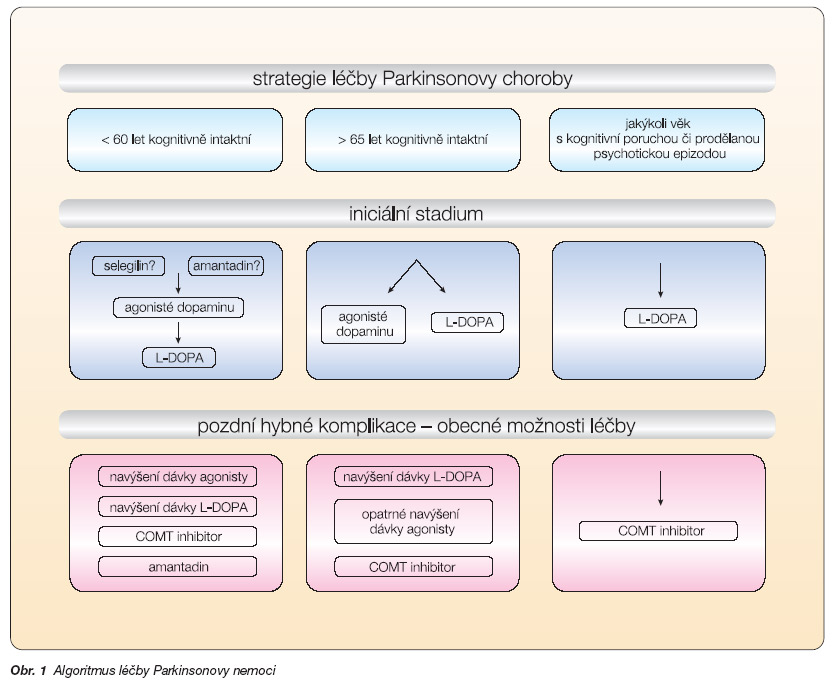
Z výše uvedeného seznamu vyplývá, že možností terapie a jejich kombinací je celá řada. Při výběru preparátu bereme v úvahu tíži a typ klinického postižení, kognitivní stav a věk, přidružená onemocnění a individuální snášenlivost preparátu. Základní strategie léčby je schematicky naznačena na obr. 1.
Zahájení terapie v časné fázi
V 90. letech minulého století se symptomatická terapie u pacientů všech věkových skupin zakládala především na podávání L-DOPA. Léčba agonisty dopaminu se doporučovala v případě rozvoje pozdních hybných komplikací. Rovněž byla velmi nadužívána anticholinergika a selegilin.
V 21. století jsou symptomatickým lékem první volby agonisté dopaminu či L-DOPA. Agonisté dopaminu se podávají vždy u kognitivně intaktního pacienta mladšího 65 let bez anamnézy prodělané psychotické epizody. Terapii agonisty lze zvážit i u staršího pacienta bez známek kognitivní deteriorace, někdy však volíme nižší dávku agonisty v kombinaci s L-DO-PA. Obecně lze říci, že v rozhodování o započetí léčby agonistou dopaminu hraje největší roli kognitivní stav pacienta, který je nejdůležitějším rizikovým faktorem rozvoje psychotických komplikací.
U pacientů jakéhokoliv věku s kognitivní poruchou zahajujeme terapii nasazením L-DOPA. Rovněž u těžkého hybného postižení při potřebě rychlé kompenzace stavu použijeme L-DOPA. Agonistu dopaminu je možno poté začít podávat v druhé vlně.
Amantadin v monoterapii lze využít u lehkého klinického postižení. Podávání selegilinu bychom se vždy měli vyhnout u kognitivně postiženého pacienta a vzhledem k jeho slabému symptomatickému efektu (a nedostatku průkazů pro neuro-protekci in vivo) je jeho použití obecně u PN v současnosti sporné. Stejná pravidla platí i pro zahájení léčby anticholinergikem, které je v současné době vyhrazeno pro speciální případy tremor-dominantní formy onemocnění u mladších, kognitivně intaktních pacientů s třesem nereagujícím dostatečně na léčbu L-DOPA [4].
Strategie léčby ve stadiu pozdních hybných komplikací
Toto stadium přichází v různé době, většinou za několik let od počátku příznaků a jeho nástup lze vhodně zvolenou terapií (t.č. především monoterapií agonisty dopaminu u osob bez výše zmíněných rizik) v počátku onemocnění oddálit [3, 6]. V terapii pozdních hybných komplikací často existuje více než jedno správné řešení a někdy je třeba empiricky zkusit několik variant léčby, než se najde ta nejoptimálnější.
Úplná ztráta dopaminergní odpovídavosti by měla vést k revizi diagnózy PN a k vyslovení suspekce na komorbiditu, např. při vaskulárním postižení mozku. U pacientů s pokročilou PN může být příčinou snížené odpovídavosti zhoršené vyprazdňování žaludku či kompetice L-DOPA s aromatickými aminokyselinami ve střevě. Doporučuje se použít režimové prostředky jako užívání L-DOPA nalačno a užívání rozpuštěné L-DOPA, odložení konzumace proteinových jídel až na večer či nasazení domperidonu.
Fluktuace hybnosti charakteru časného odeznívání dávky (tzv. wearing-off) se mohou projevit jak zhoršením hybnosti, tak různými nemotorickými symptomy. Je třeba si uvědomit, že jakýkoliv příznak senzorický, autonomní či psychiatrický (parestezie, bolest, tachykardie, pocení, dyspnoe, úzkost), objevující se pravidelně na konci intervalu dávky L-DOPA, je nejspíše projevem hypodopaminergního stavu. Možností, jak tento stav řešit, je více a spočívají ve zvýšení celkové dávky dopaminergní léčby přidáním agonisty nebo zvýšením jeho dávky, zvýšením dávek a/nebo zkrácením intervalů L-DOPA, přidáním COMT inhibitoru. Nočním a ranním akinezím lze předejít podáním dávky retardované L-DOPA před spaním, eventuálně i v kombinaci s COMT inhibitorem nebo časnou ranní dávkou rozpuštěné L-DOPA. On-off fluktuace jsou velmi nepříjemnou komplikací a projevují se náhlou změnou z dobré hybnosti do výrazné ztuhlosti a akineze nezávisle na stavu medikace. Řešení tohoto problému bývá velmi svízelné, uplatňuje se kombinace preparátů udržujících více stabilní dopaminergní stimulaci. Je možné pokusit se zvýšit dávky agonisty dopaminu, další možností je přidání COMT inhibitoru k léčbě L-DOPA. Mimovolní pohyby se nejčastěji projevují choreou v době, kdy plazmatická hladina L-DOPA dosahuje vrcholu, méně často bifázickými dystonickými dyskinezemi na začátku a konci účinku L-DOPA. Strategií řešení tohoto problému je dosáhnout co nejvyrovnanější hladiny dopaminergní stimulace: pokud je nasazena, nahradit léčbu retardovanou L-DOPA podáváním neretardovaného přípravku, co možná nejvyšší podíl dopaminergní medikace pokrýt agonisty dopaminu, zvolit léčebnou kombinaci L-DOPA + COMT inhibitor s cílem snížit celkovou denní dávku L-DOPA. Lze využít i antidyskinetického efektu amantadinu podáním perorální formy nebo série infuzí, které mohou na nějakou dobu snížit dyskineze a zlepšit hybný stav. Dystonii na konci dávky se snažíme předcházet stejně jako v případě wearing-off. Ranní dystonii lze pak zmírnit přidáním retardované L-DOPA k medikaci před spaním nebo podáním časné ranní dávky rozpuštěné L-DOPA, v krajním případě aplikací botulotoxinu [1].
Při farmakologicky nezvladatelných fluktuacích hybnosti a/nebo invalidizujících dyskinezích je na místě zvážit možnost neurochirurgické léčby – hluboké mozkové stimulace subthalamických jader, která efektem odlišným od farmakoterapie ulevuje od příznaků PN, a umožňuje tak snížit dávku dopaminergní medikace. Je však rezervována pouze pro kognitivně intaktní pacienty s dobrou compliance a se specifickým spektrem příznaků. Indikaci hluboké mozkové stimulace je nutno pečlivě zvažovat v centrech specializovaných na problematiku PN [4].
Závěr
V současné době neznáme kauzální léčbu Parkinsonovy nemoci. Doposud nebyl spolehlivě prokázán ani neuroprotektivní účinek žádného z používaných preparátů. Máme však k dispozici širokou paletu účinných symptomatických prostředků, které při správném užívání umožňují významné zlepšení kvality života pacientů s Parkinsonovou nemocí.
Obr. 1 Algoritmus léčby Parkinsonovy nemoci
Seznam použité literatury
- [1] Treatment of Parkinson´s disease. Neurol Sci 2003; 24 (Suppl. 3): S165–S213.
- [2] Agarwal P, Fahn S, Frucht SJ. Diagnosis and management of pergolide-induced fibrosis. Mov Disord 2004; 19: 699–704.
- [3] Miyasaki JM, Martin W, Suchowersky O, et al. Practice parameter: initiation of treatment for Parkinson´s disease: an evidence-based review: report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2002; 58: 11–17.
- [4] Růžička E, Roth J, Kaňovský P. Parkinsonova nemoc a parkinsonské syndromy. Galén, Praha 2000.
- [5] Schapira AH, Olanow CW. Neuroprotection in Parkinson disease: mysteries, myths, and misconceptions. JAMA 2004; 291: 358–364.
- [6] Stocchi F. Optimising levodopa therapy for the management of Parkinson´s disease. J Neurol 2005; 252 (Suppl. 4): IV43–IV48.