Současné možnosti a očekávaný vývoj terapie chronické infekce virem hepatitidy C
Celosvětová prevalence chronické hepatitidy C (HCV) se pohybuje v běžné populaci kolem 3 %. V roce 2001 bylo pomocí sérologického přehledu zjištěno, že prevalence anti-HCV reaktivity v běžné populaci ČR je 0,2 %. HCV infekce je nejčastější příčinou jaterních onemocnění ve vyspělých zemích světa. Aktuální doporučení uvádějí jako postup první volby při terapii chronické HCV infekce kombinaci interferon a ribavirin. U genotypu HCV 1 je délka terapie 48 týdnů, je-li tato kombinace použita pro genotypy HCV 2 a 3, dostačuje léčba trvající 24 týdnů. V oblasti léčby chronické HCV infekce lze v brzké době očekávat doporučení ve smyslu zkrácení roční terapie na půlroční trvání této léčby pro pacienty s nízkou virémií genotypu HCV 1, kteří dosáhnou negativní sérové HCV RNA ve 4. týdnu standardní kombinované terapie peginterferonem s ribavirinem, a naopak doporučení prodloužit terapii na 72 týdnů je očekáváno pro pacienty s pomalou odpovědí – HCV RNA pozitivní ve 12. týdnu a negativní ve 24. týdnu léčby. Tato cesta individualizace stávající standardní terapie se jeví jako cesta k dalšímu zvýšení účinnosti a efektivnosti terapie chronické HCV infekce. Problematice individualizace terapie bude věnována první část následujícího článku. Druhá se potom bude věnovat problematice nově vyvíjených preparátů, které mohou nalézt místo v terapii chronické HCV infekce v blízké budoucnosti. Zavedení nových preparátů ze skupiny modifikovaných interferonů (albinterferon -2b) či ze skupiny virostatik (inhibitory HCV RNA polymerázy, proteázy či helikázy) do běžné praxe se neočekává ještě po dobu nejméně 5–10 let.
Současná situace
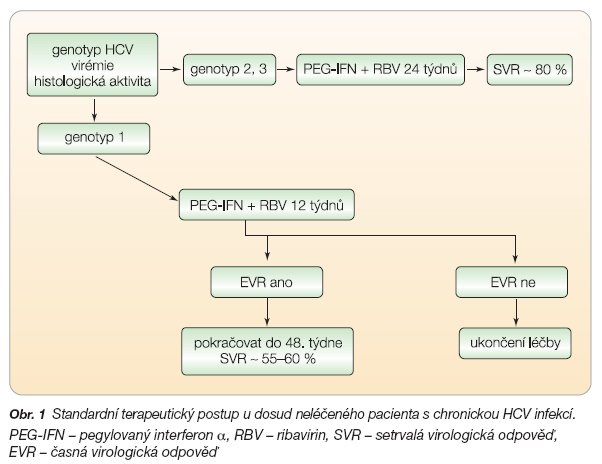
Standardním terapeutickým postupem v případech chronické infekce virem hepatitidy C (HCV) je v současné době podání kombinace pegylovaného interferonu a (PEG-IFN a) a ribavirinu (RBV). Doba trvání terapie je definována genotypem viru. Genotyp HCV 1b by měl být léčen po dobu 48 týdnů, pro genotypy HCV 2 a 3 je postačující délka léčby 24 týdnů. Na trhu jsou dostupné dva preparáty pegylovaného interferonu (PEG-IFN), pegylovaný interferon a-2a (Pegasys) a pegylovaný interferon a-2b (Pegintron). PEG-IFN a-2a je doporučován ve fixním dávkování 180 mg s.c. 1krát týdně, PEG-IFN a-2b se dávkuje podle tělesné hmotnosti, 1,0–1,5 mg/kg s.c. 1krát týdně. Ribavirin je dávkován rovněž podle tělesné hmotnosti, do 75 kg je obvyklá dávka 1000 mg p.o. denně, při hmotnosti vyšší potom 1200 mg denně. Aby byla zachována ještě průměrná účinnost celé kombinace ribavirinu (RBV) s PEG-IFN a-2b, je doporučováno 10,6 mg/kg/den jako nejnižší racionální dávka ribavirinu. Východiska pro tato standardní doporučení poskytly tři rozsáhlé klinické studie [1–3]. Tato doporučení převzal i aktuálně platný standardní postup České hepatologické společnosti pro léčbu chronické HCV, který je znázorněn na obr. 1.
Roční terapie by měla být vedena pouze v případě, že ve 12. týdnu léčby je u pacientů s genotypem HCV 1 dosaženo tzv. časné virologické odpovědi (EVR), která je definována jako negativní sérová HCV RNA, či alespoň pokles o 2 log proti výchozí virémii v tomto časovém okamžiku [4].
Během posledních dvou let byla publikována řada klinických studií, které demonstrují rozdílný přístup k problematice terapie chronické HCV infekce. Tyto studie se snaží o větší individualizaci terapeutického postupu, a to na základě analýzy virologické odpovědi během počátečních fází terapie. Je tedy jednoznačně patrný odklon od snahy predikovat efekt terapie na základě analýzy rozličných faktorů charakterizujících infekci před léčbou, a naopak jako mnohem účelnější přístup se jeví pečlivá analýza virologické odpovědi během prvních týdnů terapie. Zdá se, že první týdny terapie velmi přesně umožňují jednak předpovědět efekt léčby a jednak mohou vést k racionální modifikaci použitého schématu.
Individualizace protivirové terapie
Postupy směřující k větší individualizaci terapie se opírají o výsledky několika klinických studií z posledních let. Poměrně přesně vymezují skupiny osob s chronickou HCV infekcí, u kterých je výhodné dobu léčby zkrátit či naopak prodloužit.
Zkrácení doby terapie
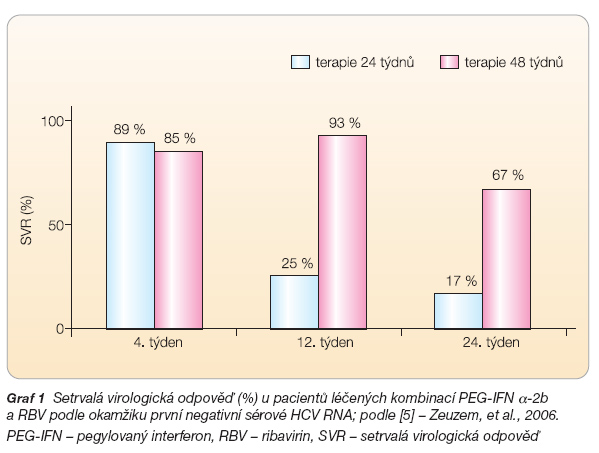
Začátkem roku 2006 byla publikována práce Zeuzema a kol. [5], která jako první ukázala na skutečnost, že pacienti charakterizovaní genotypem HCV 1 a nízkou virémií mohou být léčeni standardní kombinací pouze 24 týdnů, pokud dosáhnou negativní sérové HCV RNA ve 4. týdnu od zahájení léčby. Jde o velmi ceněnou studii, přestože jako kontrolní skupinu osob použila „historické" kontroly z registrační studie Mannse a kol. [1].
Autoři léčili 235 pacientů s genotypem 1 (nikoliv pouze 1b), kteří měli virémii ≤ 600 000 IU/ml (real time PCR), kombinací PEG-IFN a-2b 1,5 mg/kg s.c. 1krát týdně s ribavirinem podávaným v dávce 800–1400 mg p.o. denně podle tělesné hmotnosti po dobu 24 týdnů. Graf 1 ukazuje procento setrvalé virologické odpovědi (negativní sérová HCV RNA metodou PCR s detekčním limitem 50 IU/ml 24 týdnů po skončení terapie = kritérium vyléčení infekce, SVR) po 24týdenní léčbě ve vztahu k okamžiku, kdy byla poprvé negativní sérová HCV RNA. Je patrno, že při srovnání 24týdenní a 48týdenní léčby není v případě delší léčby u skupiny pacientů s virémií ≤ 600 000 IU/ml žádný statisticky významný rozdíl – tj. půlroční terapie je pro tuto podskupinu nemocných zcela dostačující.
Tyto výsledky jsou v souladu s další prospektivní studií, v rámci které byla protivirová léčba individualizována podle typu virologické odpovědi v časných fázích léčby [6].
V této studii byla virémie vyšetřována velmi často během prvních 6 týdnů terapie a podle typu odpovědi byli pacienti dále klasifikováni a individuálně léčeni. Ukázalo se, že k rozdílu v procentu SVR mezi pacienty, kteří dosáhli negativní sérové HCV RNA již ve 4. týdnu terapie a byli léčeni 24týdenní či 48týdenní léčbou, dochází až při výchozí virémii ≥≥ 800 000 IU/ml (65 % vs. 83 %). Při nižší virémii nebyl tento rozdíl statisticky významný.
Velmi podobných výsledků bylo dosaženo ve studiích s kombinací ribavirinu a PEG-IFN a-2a. Jensen a kol. [7] analyzovali faktory asociované se SVR u pacientů infikovaných genotypem HCV 1. Ukázalo se, že rychlé virologické odpovědi (RVR, negativní sérová HCV RNA ve 4. týdnu léčby) dosáhlo 24 % pacientů s genotypem HCV 1; 89 % těchto pacientů poté dosáhlo SVR při celkové délce terapie 24 týdnů, procento SVR nebylo při roční terapii zvýšeno. Jako faktory asociované s RVR autoři identifikovali virémii ≤≤ 200 000 IU/ml (OR 9,7, p < 0,0001), virémii 200 000–600 000 IU/ml (OR 5,6, p = 0,0057) a genotyp 1b (vs. 1a je OR 1,8, p = 0,0954).
Z obou studií je patrno, že RVR je dosahováno zejména mezi pacienty s výchozí virémií ≤ 600 000 IU/ml. Při vyšší výchozí virémii je RVR vzácností.
Závěr
Pacienti s HCV genotypem 1, kteří dosáhnou RVR (tj. negativní sérové HCV RNA ve 4. týdnu léčby), mohou být léčeni po dobu 24 týdnů. Dosáhnou SVR cca v 89 % případů. Data jsou obdobná pro léčbu kombinací oběma pegylovanými interferony s ribavirinem.
Prodloužení terapie
Další nová strategie používající kombinovanou terapii PEG-IFN + RBV je založena na práci Drusana a kol. [8]. Tito autoři vyvinuli matematický model, který predikoval, že pacienti infikovaní genotypem HCV 1 vyžadují souvislou periodu negativní sérové HCV RNA po dobu delší než 32 týdnů, aby dosáhli SVR s vyšší nežli 80% pravděpodobností. Standardně doporučovaných 48 týdnů terapie tedy může být pro určitou skupinu pacientů dobou příliš krátkou.
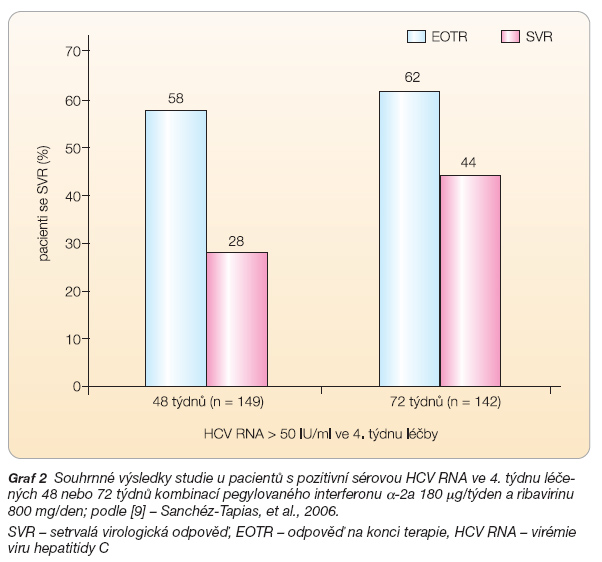
První studií na téma prodloužení terapie byla práce španělských autorů publikovaná v roce 2006 [9]. Souhrnné výsledky studie TeraViC-4 ukazuje graf 2.
Je vidět, že mezi pacienty s pozitivní sérovou HCV RNA ve 4. týdnu (tj. mezi těmi, kteří nedosáhli RVR) dochází při prodloužení terapie ze 48 na 72 týdnů k určitému zvýšení SVR (28 % vs. 44 %).
Podrobnější analýzu podskupiny s přínosem z prodloužení terapie umožnila studie vedená Bergem [10]. Prodloužení terapie nemělo význam pro skupinu osob, které dosáhly cEVR (tab. 1, tj. HCV RNA pozitivní ve 4. týdnu a HCV RNA negativní ve 12. týdnu), ale pro skupinu osob, které byly pozitivní ve 12. týdnu a negativní v týdnu 24 (pEVR, viz tab. 1). V této skupině osob bylo dosaženo setrvalé virologické odpovědi u 17 % pacientů, kteří byli léčeni po dobu 48 týdnů, u pacientů léčených 72 týdnů dosáhlo SVR 29 % z nich (p = 0,04). Největší přínos přitom znamenalo prodloužení terapie pro pacienty, jejichž virémie ve 12. týdnu léčby se pohybovala v rozmezí 50 a 6000 IU/ml (data nebyla ukázána).
Závěr
Prodloužení terapie ze 48 na 72 týdnů znamená největší přínos pro skupinu pacientů označovanou jako „slow responders", tj. osoby, které jsou ve 12. týdnu HCV RNA pozitivní a ve 24. týdnu HCV RNA negativní. Pro posouzení indikace k prodloužení léčby se z dostupných výsledků jeví jako nejvýhodnější 12. týden terapie.
Nová terminologie
Na základě posledního vývoje a znalostí o typech virologické odpovědi v prvních fázích léčby byla navržena nová terminologie hodnocení odpovědi, viz tab. 1.
Látky v klinickém vývoji
V současné době je ve světě ve stadiu preklinického zkoušení celá řada léčivých látek s výhledem na užití v terapii HCV infekce. Ne všechny látky však zatím postoupily do vyšších fází klinického zkoušení.
Nově vyvíjené látky můžeme schematicky rozdělit na tři podskupiny:
a) ‑modifikované interferony a,
b) ‑méně toxická analoga ribavirinu, inhibitory inosinmonofosfát dehydrogenázy (IMPDH),
c) ‑inhibitory nestrukturálních proteinů HCV.
Modifikované interferony a
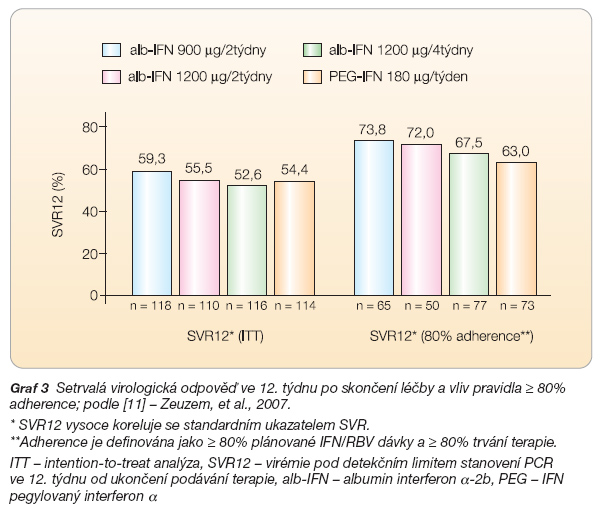
Do této skupiny patří reálně pouze tzv. albumin interferon a-2b (albinterferon a-2b). Jedná se o jedinou bílkovinnou molekulu připravenou rekombinantní technologií po fúzi genu pro lidský albumin a lidský interferon a-2b. Výsledná molekula tak kombinuje účinky interferonu a s dlouhým biologickým poločasem albuminu. Nedávno byly zveřejněny výsledky studie fáze 2b [11], na níž se podílelo rovněž několik center v ČR. Výsledky ze 12. týdne po skončení léčby ukazuje graf 3. Studie srovnávala tři různá dávkovací schémata albinterferonu a (900 mg každé dva týdny, 900 mg každé 4 týdny a 1200 mg každé 4 týdny) se standardní léčbou PEG-IFN a-2a v dávce 180 mg aplikované 1krát týdně. Ve všech větvích bylo použito stejné standardní dávkování ribavirinu 1000–1200 mg denně ve dvou dávkách.
Z dalších dostupných výsledků lze vybrat tyto závěry:
– ‑léčba oběma dávkami kombinace albumin interferonu a-2b a ribavirinu podávanými v intervalu 2 týdnů je při dosažení rychlé a časné virologické odpovědi (RVR a EVR) stejně účinná jako dosavadní standardní terapie;
– ‑léčba je dobře tolerována a kvalita života se jeví jako vyšší především pro lepší psychologický profil (SF-36) a příjemnější dávkování ve srovnání s kontrolní terapií.
Analoga ribavirinu a inhibitory IMPDH
Taribavirin
Taribavirin, dříve též označovaný jako viramidin, je látka, která byla vyvinuta na základě snah o snížení výskytu NÚ ribavirinu, především šlo o snahy minimalizovat pravděpodobnost výskytu hemolytické anémie. Taribavirin je „prodrug" ribavirinu (karboxamid ribavirinu), který je aktivován až na úrovni jaterní buňky. Na rozdíl od ribavirinu neproniká do erytrocytu a není v něm kumulován. Taribavirin v dávce 600 mg 2krát denně byl zkoušen v kombinaci s pegylovaným interferonem a-2b v dávce 1,5 mg/kg.týden po dobu 24–48 týdnů. Kontrolní skupina byla léčena standardní kombinací PEG-IFN a-2b podávanou v dávce 1,5 mg/kg.týden s ribavirinem v obvyklém dávkování. Do studie byli zahrnuti pacienti se standardně definovanou chronickou HCV infekcí. Podařilo se skutečně prokázat statisticky významně nižší výskyt taribavirinem asociované anémie, viz tab. 2 [12]. Klinický výzkum taribavirinu (viramidinu) byl vrácen do fáze 2b, když se ve studiích VISER 1 a 2 ukázalo, že podávané dávky měly minimální protivirový efekt. Vyšší dávky mající efekt protivirový vykazují zase významné nežádoucí účinky, včetně hemolytické anémie, takže další vývoj tohoto léčiva byl pravděpodobně definitivně zastaven.
Merimepodib (VX-497)
Jedná se o vysoce selektivní inhibitor IMPDH, který je dostupný v perorální formě. V buněčných kulturách má silnější protivirový účinek nežli ribavirin u HSV 1, RSV a viru parainfluenzy-3. Nedávno byly dokončeny studie fáze 1, začala studie fáze 2a u pacientů neúspěšně léčených kombinací PEG-IFN + RBV. Průběžná analýza s velmi nadějnými výsledky byla odeslána v tomto roce k tisku (J. McHutchinson). Zdá se, že by merimepodib mohl v léčbě pacientů s HCV vykazovat protivirový efekt obdobný jako ribavirin, ale s významně nižším množstvím NÚ (včetně anémie).
Inhibitory nestrukturálních proteinů HCV
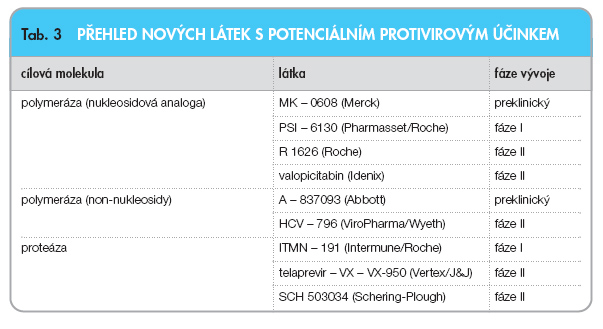
Do této skupiny virostatik patří dnes celá řada nejrůznějších nukleosidových analog, ale i látek ze skupiny tzv. non-nukleosidů. Jejich společnou vlastností je, že způsobují inhibici nestrukturálních proteinů – enzymů podílejících se na replikačním cyklu HCV. Jedná se zejména o inhibitory virové helikázy, RNA polymerázy a virových proteáz. V současné době je velmi obtížné odhadnout, který z inhibitorů představuje největší naději pro budoucnost. Většinou jsou tato virostatika známa pouze pod kódovým označením, jejich molekuly zatím nebyly pojmenovány. Jejich přehled uvádí tab. 3. Stručně se zmíníme o několika látkách.
Inhibitory proteáz
Skupina inhibitorů proteáz má dvě potenciální nevýhody z pohledu užití v terapii HCV infekce: 1) jejich účinek může být rozdílný u různých genotypů HCV; 2) prokázána byla rychle se vyvíjející rezistence.
SCH 503034
Jedná se o inhibitor virové proteázy vyvinutý firmou Schering-Plough. Zcela nedávno bylo oznámeno zahájení studií fáze II s tímto preparátem v kombinaci s PEG-IFN a-2b u pacientů s genotypem HCV 1 nereagujících na předchozí protivirovou terapii. Dosavadní analýzy studií fází I pro dávky 100 mg, 200 mg a 400 mg podávané 3krát denně ukazují na velmi dobrý protivirový efekt preparátu. Lék je dostupný v perorální formě a jeho NÚ ve studiích fáze I byly srovnatelné s placebem.
VX-950
VX-950 je vysoce selektivní reverzibilní inhibitor virové NS3/4A proteázy. VX-950 byl zkoušen v kombinaci v rámci studií fáze I u pacientů s chronickou HCV infekcí vyvolanou genotypem 1 [13]. Léčba byla vedena po dobu 2 týdnů. Na základě publikované analýzy lze konstatovat, že kombinace PEG-IFN a VX-950 vede k největší supresi virémie (medián poklesu po 14 dnech je 5,5 log IU/ml). Ve skupině léčené kombinací nebyl pozorován opětovný vzestup virémie po skončení léčby (během 14 dnů nedošlo k negativizaci, ale pouze k poklesu výchozí virémie). Nebyly pozorovány žádné závažné NÚ ve spojení s podáním VX-950. Tyto nadějné výsledky vedly k tomu, že byla již spuštěna klinická studie fáze II s VX-950.
Inhibitory HCV RNA polymerázy
Látky z této skupiny mohou být děleny na nukleosidová analoga a na látky non-nukleosidové povahy. Non-nukleosidová analoga mají pravděpodobně stejné nevýhody jako inhibitory proteáz, naopak nukleosidová analoga jsou pravděpodobně účinná u všech genotypů HCV a vznik rezistence je opožděný.
Valopicitabin
Valopicitabin je první známý inhibitor HCV polymerázy ze skupiny nukleosidových analog. Ve studiích fází I–IIa valopicitabin vykázal velmi dobrou anti-HCV aktivitu v monoterapii i v kombinaci s pegylovaným interferonem a. Z nežádoucích účinků se při podání vyskytly GIT obtíže (nauzea, zvracení, přechodný průjem). Při monoterapii s valopicitabinem se neobjevila nežádoucí anémie. Uspořádání studie fáze IIb je poměrně komplikované, publikovaná studie měla 5 větví, ve kterých se lišily dávky valopicitabinu i sekvence jeho podávání ve vztahu k pegylovanému IFN [14]. Poněkud jednodušeji interpretovatelné výsledky byly publikovány v dubnu 2007 [15], viz graf 4.
Z grafu je patrno, že procento pacientů s negativní sérovou HCV RNA ve 12. týdnu není ani pro jednu z dávek valopicitabinu významně lepší, nežli jsou výsledky kombinace ribavirinu s PEG-IFN. Výsledky studie léčby kombinací valopicitabin + PEG-IFN + ribavirin nebyly dosud publikovány.
R 1626 a R 1479
Jedná se o nukleosidová analoga, která jsou v současné době zkoušena v rámci studií fáze I (R 1626 je „prodrug" molekuly R 1479). Dávkové rozmezí ve studiích se pohybuje od 500 mg 2krát denně po 4500 mg 2krát denně. Inhibiční efekt je dávkově závislý. V prvních studiích bylo po 15 dnech dosaženo při dávkování 4500 mg 2krát denně poklesu HCV RNA až o -3,7 log10 oproti původním hladinám.
Inhibitor NS4A
Produktem NS4A genu HCV je fosfoprotein, jehož funkce nebyla dosud zcela objasněna. Syntetický antagonista označovaný jako ACH-806 vykazuje v prvních fázích klinického zkoušení výrazný inhibiční efekt již během prvních dnů podávání [16].
Závěr
V oblasti léčby chronické HCV infekce lze v brzké době očekávat doporučení ve smyslu zkrácení roční terapie na půlroční trvání této léčby pro pacienty s nízkou virémií genotypu HCV 1, kteří dosáhnou negativní sérové HCV RNA ve 4. týdnu standardní kombinované terapie PEG-IFN a-2b s RBV. Naopak doporučení prodloužit terapii na 72 týdnů je očekáváno pro pacienty s pomalou odpovědí – HCV RNA pozitivní ve 12. týdnu a negativní ve 24. týdnu léčby. Tato cesta individualizace stávající standardní terapie se jeví jako cesta k dalšímu zvýšení účinnosti a efektivnosti terapie chronické HCV infekce.
Zavedení nových preparátů ze skupiny modifikovaných interferonů (albinterferon a-2b) či ze skupiny virostatik (inhibitory HCV RNA polymerázy, proteázy či helikázy) do běžné praxe se neočekává ještě po dobu nejméně 5–10 let.
Seznam použité literatury
- [1] Manns MP, McHutchison JG, Gordon SC, et al. PEG-interferon -2b in combination with ribavirin compared to interferon -2b plus ribavirin for initial treatment of chronic hepatitis C. Lancet 2001; 358: 958–965.
- [2] Fried MW, Shiffman ML, Reddy R, et al. Peginterferon -2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002; 347: 975–982.
- [3] Hadzyiannis SJ, Sette H, Morgan TR, et al. Peginterferon- 2a and ribavirin combination therapy in chronic hepatitis C: a randomized study of treatment duration and ribavirin dose. Ann Intern Med 2004; 140 (5): 346–355.
- [4] Urbánek P, Husa P, Šperl J, Kumpel P (koordinátoři), et al. Diagnostika a léčba chronické hepatitidy C. Doporučený postup České hepatologické společnosti a Společnosti infekčního lékařství České lékařské společnosti J. E. Purkyně. Vnitřní lékařství 2005; 51 (11): 1307–1313.
- [5] Zeuzem S, Buti M, Ferenci P, et al. Efficacy of 24 weeks treatment with peginterferon -2b plus ribavirin in patients with chronic hepatitis C infected with genotype 1 and low pretreatment viremia. J Hepatol 2006; 44: 97–103.
- [6] Zeuzem S, Pawlotsky JM, Lukasiewicz E, et al. International, multicenter, randomized, controlled study comparing dynamically individualized versus standard treatment in patients with chronic hepatitis C. J Hepatol 2005; 43: 250–257.
- [7] Jensen DM, Morgan TR, Marcellin P, et al. Early identification of HCV genotype 1 patients responding to 24 weeks peginterferon -2a (40 kd)/ribavirin therapy. Hepatology 2006; 43 (5): 954–960.
- [8] Drusano GL, Preston SL. A 48-week duration of therapy with pegylated interferon -2b plus ribavirin may be too short to maximize long-term response among patients infected with genotype-1 hepatitis C virus. J Infect Dis 2004; 189: 964–970.
- [9] Sanchéz-Tapias JM, Diago M, Escartin P, et al. Peginterferon -2a plus ribavirin for 48 versus 72 weeks in patients with detectable hepatitis C virus RNA at week 4 of treatment. Gastroenterology 2006; 131 (2): 451–460.
- [10] Berg T, et al. Reduction of the relative relapse rate by prolongation of the duration of therapy with peginterferon -2a plus ribavirin in patients with genotype 1 infection up to 72 weeks. Abstract 64, AASLD 2004.
- [11] Zeuzem S, Benhamou Y, Bain V, et al. Antiviral response at week 12 following completion of treatment with albinterferon -2b plus ribavirin in genotype 1, IFN-naive, chronic hepatitis C patients. Journal of Hepatology 2007; 46 (Suppl. 1): S293 (Abstr. 779).
- [12] Benhamou Y, Pockros P, Rodriguez-Torres M, et al. The safety and efficacy of viramidine plus pegIFN -2b versus ribavirin plus pegiFN -2b in therapy-naive patients infected with HCV: phase 3 results (VISER1) Abstract 751, 41st Annual Meeting of European Association for the Study of the Liver, duben 2006.
- [13] Reesink HW, Forestier N, Weegink CJ, et al. Initial results of a 14-day study of the hepatitis C virus inhibitor VX-950, in combination with peginterferon--2a. Abstract 737, 41st Annual Meeting of European Association for the Study of the Liver, duben 2006.
- [14] Dieterich D, Lawitz E, Nguyen T, et al. Early clearance of HCV RNA with valopicitabine (NM 283) plus peginterferon in treatment-naive patients with HCV-1 infection: first results from a phase IIb trial. Abstract 736, 41st Annual Meeting of European Association for the Study of the Liver, duben 2006.
- [15] Lawitz E, Nguyen T, Younes Z, et al. Clearance of HCV RNA with valopicitabine (NM) plus PEG-interferon in treatment-naive patients with HCV-1 infection: results at 24 and 48 weeks. Journal of Hepatology 2007; 46 (Suppl. 1): S9 (abstr. 14).
- [16] Pottage JC, et al. Short term antiviral activity and safety of ACH-806 (GS-9132), an NS4A antagonist, in HCV genotype 1 infected individuals. Abstract 783, 42nd Annual Meeting of European Association for the Study of the Liver, duben 2007.