Současné možnosti kontinuální monitorace glykémie u pacientů s diabetem
Kontinuální monitorace glykémie – continuous glucose monitoring (CGM) – představuje rozvíjející se technologii, která může přinést revoluční změny v současném pojetí optimální kompenzace diabetu. Nedávno bylo schváleno hrazení CGM některými zdravotními pojišťovnami ve vymezených indikacích. Přesnost a účinnost jednotlivých systémů CGM je předmětem výzkumu. Některé studie prokázaly, že CGM signifikantně zlepšuje labilitu diabetu tím, že zkracuje čas strávený v hyperglykémii, aniž by zvyšovala riziko hypoglykémie. U pacientů, kteří používají senzor opakovaně a delší dobu, dochází ke zlepšení hladin glykovaného hemoglobinu. Pomocí CGM lze detekovat řadu hypoglykémií, aniž by docházelo ke zbytečnému alarmu varujícímu před hypoglykémií. Efektivita CGM u diabetiků 1. typu a u těhotných žen je prokázána; další studie jsou ale nutné pro optimální využití CGM u dětí a adolescentů. Aktuální otázkou zůstává také využití CGM u diabetiků 2. typu neléčených inzulinem. Na našem pracovišti máme s CGM několikaleté zkušenosti především u pacientů s hypoglykémiemi. Klíčovou roli v efektivitě CGM hraje edukace pacientů i zdravotníků v interpretaci dat získávaných při CGM a v reakcích na příslušné údaje.
Úvod
Kontinuální monitorace glykémie (CGM) představuje novou technologii, která může změnit nejen život řady
pacientů s diabetem, ale i přístup k léčbě diabetu a požadované normy pro dobrou kompenzaci. Jak technické vybavení pro CGM, tak jeho indikace a především edukace pacientů se v posledních letech vyvíjí. Mezníkem tohoto vývoje je i zavedení monitorace glykémie v reálném čase, tzv. real time (RT) CGM, která umožňuje pacientům reagovat na aktuální hodnoty glykémie i na trendy snižování či zvyšování glykémie, varuje před rizikem klinicky závažné hypoglykémie či hyperglykémie. Systém CGM je předstupněm pro vývoj uzavřeného systému monitorace spojeného s automaticky řízeným dávkováním inzulinu („umělý pankreas“).K tomu, aby se CGM rozšířila do praxe, je nutné společné úsilí výzkumných pracovníků, farmaceutických firem, zdravotníků, pacientů a v neposlední řadě i státní správy a zdravotních pojišťoven. V České republice jsou v současné době hrazeny většinou zdravotních pojišťoven čtyři kontinuální monitorace glykémie pomocí senzoru ročně u pacientů léčených inzulinem, kteří nerozpoznávají hypoglykémie, a u pacientů neuspokojivě kompenzovaných i při léčbě inzulinovou pumpou – s glykovaným hemoglobinem (HbA1c) vyšším než 5,3 %.
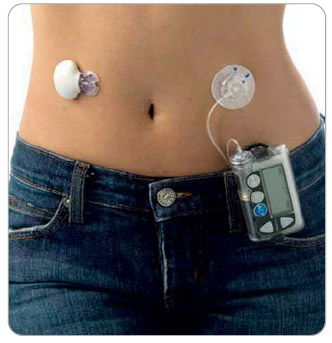 Tento výkon může vykazovat každý proškolený diabetolog, který s pomocí zdravotní sestry nejprve zaučí pacienta v obsluze přístroje, poté aplikuje senzor do podkoží pomocí speciálního aplikátoru (inserteru). Senzor je spojen s tzv. transmiterem, který bezdrátově přenáší signál do příslušného glukózového monitoru, jímž může být např. speciální inzulinová pumpa (obr. 1). Po základní edukaci pacienta a inicializaci měření se zadá kalibrační glykémie v časovém odstupu asi 120 minut od zavedení senzoru do podkoží. Po ukončení kontinuální monitorace přenese pacient nebo zdravotník údaje z monitoru do počítače a pomocí speciálního software je vytiskne. Součástí výkonu a předpokladem optimalizace terapie je také vyhodnocení výsledků monitorace a zaznamenání do dokumentace.
Tento výkon může vykazovat každý proškolený diabetolog, který s pomocí zdravotní sestry nejprve zaučí pacienta v obsluze přístroje, poté aplikuje senzor do podkoží pomocí speciálního aplikátoru (inserteru). Senzor je spojen s tzv. transmiterem, který bezdrátově přenáší signál do příslušného glukózového monitoru, jímž může být např. speciální inzulinová pumpa (obr. 1). Po základní edukaci pacienta a inicializaci měření se zadá kalibrační glykémie v časovém odstupu asi 120 minut od zavedení senzoru do podkoží. Po ukončení kontinuální monitorace přenese pacient nebo zdravotník údaje z monitoru do počítače a pomocí speciálního software je vytiskne. Součástí výkonu a předpokladem optimalizace terapie je také vyhodnocení výsledků monitorace a zaznamenání do dokumentace.
Technologie kontinuální monitorace glykémií
Zjednodušeně si můžeme představit, že většina minimálně invazivních senzorů se zavádí do podkoží, kde měří množství glukózy v intersticiální tekutině. Typy senzorů používané v současné době ukazují průměrné hodnoty glykémie v intervalech po 5–10 minutách. Pokud se hodnoty hladiny glukózy v krvi rychle mění, nemusí se shodovat s hodnotami glukózy v intersticiu, čímž mezi nimi vzniká časový posun, tzv. lagtime, většinou až 20 minut [1]. Studie na zvířatech ukázaly, že změny hladin glukózy v intersticiální tekutině korelovaly lépe s hladinami glukózy v centrální nervové soustavě než s hodnotami glykémie [2]. Současné senzory jsou schváleny pro použití v rozmezí 3–7 dnů [3]. Zkoušeny jsou již také senzory, jejichž použití se prodlužuje na 10 dní [4].
Měření hladiny glukózy senzorem je z fyzikálního hlediska založeno nejčastěji na elektrochemickém principu, u některých typů senzorů se provádí měření na mikrodialyzačním principu, na principu reverzní iontoforézy, na fluorescenčním nebo viskozimetrickém principu [5]. V současné době jsou pro klinické použití k dispozici tyto systémy monitorace glykémií: Guardian REALTime (Guardian 2, 3), Paradigm REAL-Time spojený s inzulinovou pumpou a CGMS iPro, který nahradil původní CGMS GOLD. Dále se v klinické praxi používají přístroje DexCom se senzorem na 3 dny, který je nahrazován typem DexCom SEVEN se senzorem na 7 dní, přístroj Freestyle 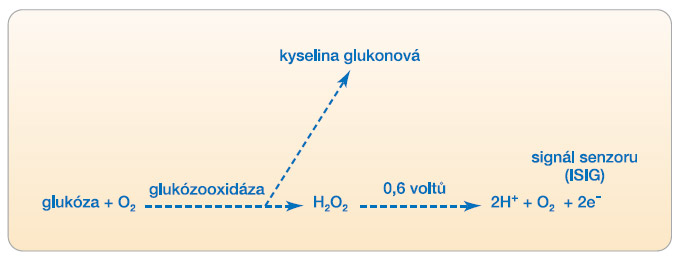 NAVIGATOR a také přístroj GLUCODAY, který je na rozdíl od předchozích založen na principu mikrodialýzy, nikoli na principu elektrochemickém. Za zmínku stojí také neinvazivní přístroj GLUCOWATCH, který je založen na principu reverzní iontoforézy. Nevýhodou tohoto přístroje je relativně dlouhá iniciační doba, časté iritace kůže a výpadky měření při pocení a v chladu. Podobně nebyl dosud rozšířen zpočátku nadějný přístroj PENDRA, který měří neinvazivním způsobem impedanci elektrolytového prostředí intersticiální tekutiny. Systémy CGM používané v současné době v klinické praxi jsou nejčastěji založeny na principu jehlového senzoru, který elektrochemicky měří produkty glukózooxidázové reakce (obr. 2).
NAVIGATOR a také přístroj GLUCODAY, který je na rozdíl od předchozích založen na principu mikrodialýzy, nikoli na principu elektrochemickém. Za zmínku stojí také neinvazivní přístroj GLUCOWATCH, který je založen na principu reverzní iontoforézy. Nevýhodou tohoto přístroje je relativně dlouhá iniciační doba, časté iritace kůže a výpadky měření při pocení a v chladu. Podobně nebyl dosud rozšířen zpočátku nadějný přístroj PENDRA, který měří neinvazivním způsobem impedanci elektrolytového prostředí intersticiální tekutiny. Systémy CGM používané v současné době v klinické praxi jsou nejčastěji založeny na principu jehlového senzoru, který elektrochemicky měří produkty glukózooxidázové reakce (obr. 2).
Vlastní senzor je tvořen platinovou elektrodou povlečenou enzymem glukózooxidázou. Elektroda je pokryta semipermeabilní membránou. Po zavedení do podkoží musí být nejprve senzor zvlhčen intersticiální tekutinou a poté začíná jeho inicializace. Glukóza a kyslík z intersticiální tekutiny difundují přes semipermeabilní membránu a reagují s glukózooxidázou na povrchu elektrody senzoru, při reakci vzniká peroxid vodíku a glukonová kyselina. Peroxid dále difunduje až na elektrodu, kde vlivem napětí na elektrodě dochází k jeho rozkladu na vodík a kyslík; přenesené elektrony z reakce vytvářejí elektrický signál, který se označuje jako ISIG a je úměrný koncentracím glukózy 2,2–22,2 mmol/l.
Podstatnou součástí CGM je kalibrace senzoru, protože měření probíhá v intersticiální tekutině a ne v krevním řečišti. Ke kalibraci jsou proto nutné hodnoty glykémie měřené glukometrem z kapilární krve po vpichu do prstu. Na senzoru je potřeba nejprve nastavit iniciální kalibraci a poté periodicky kalibrovat nejčastěji 2–4krát denně. První kalibrace se provádí většinou za 2 hodiny po inicializaci senzoru (zavedení do podkoží a zvlhčení intersticiální tekutinou), další většinou za 6 hodin a poté nejčastěji každých 12 hodin. Hodnota kalibrační glykémie by se měla zadat do monitoru do 5 minut od měření, a to manuálně nebo pomocí tzv. wizard bolusu u inzulinové pumpy Paradigm Real-Time. Důležité je upozornit pacienty, že kalibraci je nutné provádět v době, kdy glykémie rychle nestoupá ani neklesá, aby nevznikly velké časové posuny mezi intersticiální tekutinou a krví. Vhodné je proto kalibrovat ráno nalačno, před jídly nebo před spaním. Tzv. kalibrační faktor představuje koeficient, kterým se převádějí hodnoty naměřené senzorem pomocí generování proudu (ISIG) v intersticiální tekutině na hodnoty odpovídající měření glukometrem v krvi. Tento faktor se aktualizuje při každé kalibraci na podkladě současného měření i na podkladě předchozích kalibračních faktorů. Chyba kalibrace (cal error) signalizuje, že vznikla větší chyba mezi měřením glukometrem a senzorem, než je povolena. Tato chyba může být způsobena jednak „fyziologicky“, posunem mezi hodnotami glukózy v krvi a v intersticiu při rychlých změnách hladin glykémie, jednak tím, že senzor není dostatečně zvlhčen nebo je špatně zaveden do podkoží či je již méně citlivý po dlouhodobé monitoraci. Také může být chyba způsobena příliš dlouhou prodlevou mezi měřením glykémie glukometrem a zadáním hodnoty do monitoru nebo špatným měřením glukometrem.
Nezbytnou součástí CGM je pochopení funkce „varování“ – prediktivní alarm a alarm při již existující hypoglykémii nebo hyperglykémii. Pro varování, prediktivní alarm, lze zvolit určitý časový interval před nástupem skutečné hypoglykémie nebo hyperglykémie. Dále je možné nastavit určité hranice pro alarm při již přítomné hypoglykémii nebo hyperglykémii. Pokud nastavíme hranice příliš „přísné“, může je pacient ignorovat nebo ho naopak budou stále vyrušovat z běžné aktivity. Hranice pro alarm se mohou časem upravovat tak, jak se zlepšuje kompenzace diabetu. CGM navíc může ukazovat graficky průběh glykémie na monitoru a trendy poklesu či vzestupu glykémie pomocí šipek. Většinou tyto trendy vyplývají z průběhu glykémie v posledních 20 minutách. Jedna šipka v případě CGM firmy Medtronic představuje změnu 1,1–2,2 mmol/l, dvě šipky změnu > 2,2 mmol/l za posledních 20 minut.
Přesnost CGM
Posuzování přesnosti CGM srovnáváním s hodnotami glykémie v kapilární krvi nebo v žilní plazmě při měření glukometrem nebo při laboratorním stanovení glykémie je poněkud zavádějící. Nemůže totiž plně postihnout funkční význam CGM, který spočívá v informacích o změnách glykémie (výkyvech směrem k hypoglykémii nebo hyperglykémii) a také nereflektuje časový posun mezi hladinou glukózy v intersticiální tekutině a v krevním řečišti.
Pro hodnocení klinického významu odchylek měření referenční a zkoumanou metodou se nejvíce používá tzv. error grid analysis (graf 1) [6]. Pokud leží zkoumaná hodnota glykémie v oblasti:
- A, neliší se o více než 20 % od referenční glykémie nebo leží v oblasti hypoglykémie při zkoumaném i referenčním měření. Klinické následky měření jsou stejné jako při referenčním měření.
- B, liší se sice o více než 20 % od referenční metody, ale klinická rozhodnutí na základě měření nevedou k výraznějším chybám.
- C, vedou klinická rozhodnutí k výraznějším chybám, ne však zásadním (referenční metoda měří normoglykémii, zkoumané měření svědčí pro hypo- nebo hyperglykémii).
- D, vedou klinická rozhodnutí k zásadním chybám – referenční metoda měří hypo- nebo hyperglykémii vyžadující léčbu, zkoumané měření svědčí pro normální glykémii nebo mírnou hyperglykémii.
- E, vedou klinická rozhodnutí k velmi nebezpečným chybám.
![Graf 1 Hodnocení měření glykémie zkoumanou metodou (senzorem) a referenční metodou (glukometrem) pomocí tzv. error grid analysis; podle [6] – Clarke WL, et al., 1987.](https://www.remedia.cz/photo-a-27359---.jpg) Tato metoda pak byla modifikována pro CGM na tzv. continuous glucose-error grid analysis (CG-EGA) vyvinutou členy panelové diskuse [7, 8]. CG-EGA analyzuje hodnoty zkoumané i referenční metody nejen v určitém čase, tzv. point-error grid analysis (P-EGA), ale také z hlediska trendů poklesu či vzestupu glykémie – rate-error grid analysis (R-EGA) v pásmu hypoglykémier (≤ 3,9 mmol/l), normoglykémie a hyperglykémie (> 10 mmol/l). Podobně jako v klasické EGA jsou pak výsledky měření pomocí CGM a pomocí referenční metody rozděleny v mřížkovém grafu do 5 zón na základě toho, jaký je klinický dopad rozhodnutí, která učiní pacient, pokud se monitoruje pomocí CGM: v pásmu A a B se nacházejí hodnoty reprezentující správná rozhodnutí pacienta nebo „benigní“ chyby, v pásmu C hodnoty reprezentující „nadbytečné“ korekce, v pásmu D jsou hodnoty reprezentující nebezpečná selhání monitorace detekovat klinicky významné glykémie nebo změny glykémie a v pásmu E zcela chybné a nebezpečné hodnoty naměřené monitorací.
Tato metoda pak byla modifikována pro CGM na tzv. continuous glucose-error grid analysis (CG-EGA) vyvinutou členy panelové diskuse [7, 8]. CG-EGA analyzuje hodnoty zkoumané i referenční metody nejen v určitém čase, tzv. point-error grid analysis (P-EGA), ale také z hlediska trendů poklesu či vzestupu glykémie – rate-error grid analysis (R-EGA) v pásmu hypoglykémier (≤ 3,9 mmol/l), normoglykémie a hyperglykémie (> 10 mmol/l). Podobně jako v klasické EGA jsou pak výsledky měření pomocí CGM a pomocí referenční metody rozděleny v mřížkovém grafu do 5 zón na základě toho, jaký je klinický dopad rozhodnutí, která učiní pacient, pokud se monitoruje pomocí CGM: v pásmu A a B se nacházejí hodnoty reprezentující správná rozhodnutí pacienta nebo „benigní“ chyby, v pásmu C hodnoty reprezentující „nadbytečné“ korekce, v pásmu D jsou hodnoty reprezentující nebezpečná selhání monitorace detekovat klinicky významné glykémie nebo změny glykémie a v pásmu E zcela chybné a nebezpečné hodnoty naměřené monitorací.
Časový posun mezi měřením v intersticiální tekutině a v krevním řečišti může být odlišný v závislosti na technologii měření systému CGM, většinou se pohybuje kolem 20 minut při rychlých změnách glykémie [1]. Pro CGM se proto zavádí pojem prediktivní přesnost, který počítá se sledováním trendů glykémie a s příslušnou reakcí pacienta tak, aby se předešlo nepříznivým klinickým dopadům hypoglykémie nebo hyperglykémie. Prediktivní přesnost tak může kompenzovat nesrovnalosti mezi měřením CGM a referenční metodou v určitém okamžiku způsobené časovým posunem [3].
Kritéria, podle kterých se posuzují přesnosti měření, jsou ale různá. Kromě výše uvedené CG-EGA se používají např. International Standards Organisation (ISO) kritéria posuzující přesnost CGM měření podle toho, jaká část měření CMG je v rozmezích ±0,8 mmol/l při glykémiích menších než 4,2 mmol/l nebo rovných 4,2 mmol/l a jaký podíl hodnot je v rozmezích 20 % při glykémiích větších než 4,4 mmol/l. Srovnáním CGM s využitím čtyř systémů CGM – Guardian, DexCom, Navigator a Glucoday – se zabýval např. Kovatchev [8]. Jednotlivé systémy byly porovnávány během clampových studií, referenční glykémie byla odebírána každých 5 minut a měřena v arterializované venózní krvi. V první studii po euglykémii (5,6 mmol/l) následovala hypoglykémie (2,5 mmol/l) a byly testovány systémy Guardian, Navigator a DexCom, ve druhé, stejně koncipované studii, byl testován na jiném souboru pacientů Glucoday. Kritériem byly průměrné absolutní relativní odchylky (mean absolute relative differences – MARDs) v jednotlivých testovaných pásmech glykémie. Bylo zjištěno, že numerická přesnost všech čtyř systémů byla srovnatelná, avšak systém Navigator byl výhodnější při detekci hypoglykémií a numerické chyby systému DexCom byly asi o 30 % větší než u ostatních systémů. Námitkou proti této práci je referenční měření koncentrace glukózy ve venózní krvi, které se může lišit od koncentrace glukózy v kapilární krvi užívané pro kalibraci CGM. V recentní práci byl novější typ sedmidenního senzoru DexCom SEVEN při testování podstatně přesnější než předchozí typ a při hypoglykémiích lepší než systém Navigator [9].
V jiné práci, která se zabývala přesností CGM v reálném čase (RT) u diabetiků 1. typu [10], bylo zjištěno, že CGM ve spojení s inzulinovou pumpou Paradigm RT u 72 diabetiků 1. typu během ambulantní léčby vyhovovalo přesnosti 6 20 % oproti referenční metodě ve více než 75 % a že 95,9 % měření bylo v pásmu A a B podle Clarkovy EGA, což splňuje kritéria vyhovující přesnosti. Cenné na této práci je, že analyzovala retrospektivně více než 60 000 měření za běžných denních podmínek a srovnávala údaje z glukometru s měřením CGM odečítaným až po 5–10 minutách po měření glukometrem. Tyto hodnoty CGM by měly lépe odrážet časovou souvislost koncentrací glukózy (senzor načítá vždy hodnoty po dobu 5 minut a pak z nich na displeji ukazuje naměřené průměry). Přesnost měření se nesnižovala během 72 hodin monitorace. Měření byla srovnatelná u dospělých (96,3 % vyhovujících hodnot) i u adolescentů (94,5 % vyhovujících hodnot).
Kdo by měl především využívat CGM?
Na tuto otázku se snaží odpovědět nejrůznější doporučení vycházející z osobních zkušeností i ze studií. Odpověď není zdaleka jednoznačná. Např. panelová diskuse publikovaná v roce 2008 jako Consensus guidelines for CGM [3] doporučuje CGM:
- u diabetiků 1. typu, kteří i při adekvátním selfmonitoringu glykémií glukometrem nemají uspokojivé hodnoty HbA1c nebo mají variabilní glykémie;
- u pacientů, kteří mají obavy z hypoglykémií, a proto si udržují vyšší glykémie;
- u diabetiků 2. typu, jimž intermitentní CGM pomáhá poznat faktory, které ovlivňují jejich glykémie, umožňuje jim racionálně využívat selfmonitoring glukózy v době, kdy mívají výkyvy glykémie podle CGM, a nastavit co nejlépe adekvátní terapii;
- u pacientů se syndromem neuvědomování si hypoglykémie a u pacientů s častými těžkými hypoglykémiemi;
- CGM může být prospěšná také u pacientů s gastroparézou, u hospitalizovaných diabetiků, sportovců a u těhotných žen.
Z funkce CGM a z fyziologie diabetu vyplývá, že CGM může zachytit fluktuace glykémií, které jsou podle některých prací příčinou zvýšeného oxidativního stresu podobně jako dlouhodobá hyperglykémie [11]. Dále může CGM zachytit postprandiální hyperglykémie, které mají podle řady studií, např. tzv. Decode Study [11], rovněž vliv na komplikace diabetu, zejména na komplikace makrovaskulární. CGM je na jedné straně indikováno u vysoce motivovaných pacientů, na druhé straně však může motivovat i nespolupracující pacienty k lepšímu porozumění diabetu a k lepší kompenzaci. V každém případě je nezbytná speciální edukace pacientů. Doporučuje se, aby pacient prvních 3–7 dní neměnil svůj běžný režim podle CGM a teprve po analýze počáteční monitorace se zdravotníky začal používat alarmy a úpravy režimu. Další kontakt se zdravotníky by měl následovat do 2–4 týdnů.
Zvláštní pozornost je nutné věnovat stanovení individuálních cílů pro dobrou kompenzaci. Za přijatelné se podle Consensus guidelines for CGM zpočátku považují glykémie nalačno 4,5–7,2 mmol/l a po jídle 7,8–10 mmol/l. Pacient by měl být informován, že až 50 % času může mít zprvu glykémie mimo tyto hranice. Tím lze předejít negativnímu postoji k CGM a zbytečné frustraci. Dalším úkolem je nastavení hranice alarmu pro hypoglykémie nebo hyperglykémie, případně i intervalu, ve kterém bude systém pacienta předem varovat (prediktivní alarm). I zde je zpočátku vhodná větší benevolence, např. pro hypoglykémie je možné zvolit hraniční hodnotu 3,9 mmol/l. Pokud ale pacient hypoglykémie nerozpoznává, je vhodnější nastavit hodnotu 4,5 mmol/l. Pro hyperglykémie se doporučuje nejprve nastavit hodnotu kolem 14 mmol/l a po zlepšení kompenzace snížit na 10–11 mmol/l. Interval pro varování před hrozící hypoglykémií může být běžně např. 10 minut, ale u pacientů nerozpoznávajících hypoglykémie raději 30 minut. Pokud CGM upozorňuje na nízkou glykémii, doporučuje se ověřit tuto informaci glukometrem. Při hrozící hypoglykémii se doporučuje podat podle Consensus guidelines for CGM asi 10 g glukózy, při glykémii < 4 mmol/l by se podaná dávka glukózy měla zvýšit na 15–20 g (může-li pacient spolehlivě polykat). Po 15 minutách by se mělo provést nové testování glykémie z prstu. Při těžké hypoglykémii se postupuje obvyklým způsobem. Rozhodně se nedoporučuje při lehčí hypoglykémii zcela přerušit přísun bazálního inzulinu z inzulinové pumpy.
Před každou návštěvou lékaře by měl mít pacient k dispozici záznam CGM pro společnou analýzu.
Využití CGM pro zlepšení kompenzace diabetu, snížení frekvence hypoglykémií a lability diabetu
Jednou z prvních kontrolovaných randomizovaných studií, která prokázala účinnost CGM, je práce Garga publikovaná v Diabetes Care v roce 2006 [13]. Do této studie byli zahrnuti pacienti s DM 1. typu (n = 91) i s DM 2. typu (n = 16). Pacienti byli randomizováni na intervenovanou skupinu s první periodou bez monitorace a s následnými dvěma periodami s CGM (2krát po 3 dnech) a na kontrolní skupinu s běžným selfmonitoringem. Posuzován byl čas strávený v pásmu žádoucí, vysoké nebo nízké glykémie a získaná data byla porovnávána s údaji získanými v kontrolní skupině. Přesnost měření byla uspokojivá – 95 % hodnot glykémie se nacházelo v zóně A a B podle Clarkovy EGA. Pacienti s CGM měli ve srovnání s kontrolní skupinou vysoce významně (p < 0,001):
- méně hypoglykémií – o 21 %,
- méně hyperglykémií – o 23 %,
- více času v žádoucích mezích glykémie – o 26 %.
Noční hypoglykémie byly rovněž redukovány: těžší hypoglykémie < 3 mmol/l o 38 % a lehčí < 4,4 mmol/l o 33 % (p < 0,001).
K poněkud odlišným výsledkům při CGM dospěl Hirsch [14] v randomizované studii při posuzování RT CGM ve spojení s inzulinovou pumpou. Ve skupině s RT monitorací zaznamenal 5 stavů těžké hypoglykémie, v kontrolní skupině s glukometrem 3 případy těžké hypoglykémie. Autor analyzoval příčiny tohoto zjištění a dospěl k závěru, že pacienti:
- ignorovali signál RT monitorace o hypoglykémii,
- podávali následně několik bolusů a nepoužívali výpočet bolusu (tzv. wizard bolus), čímž došlo k hromadění inzulinu,
- přidávali bolusy pouze podle senzoru, nepřesvědčili se glukometrem (mohlo docházet k časovému zpoždění reakce na přidání inzulinu).
Primárního cíle, tzn. významnějšího snížení HbA1c v RT skupině za 6 měsíců, nebylo dosaženo, protože pacienti v kontrolní skupině byli edukováni a hladiny si pravidelně kontrolovali. Dalším důvodem malých rozdílů v hladinách HbA1c mezi skupinou CGM a kontrolní skupinou bylo to, že zdravotníci se teprve učili edukovat pacienty v RT monitoraci. Pacienti tedy nemuseli být řádně poučeni o tom, jak kalibrovat CGM, jak reagovat na hypoglykémie hlášené senzorem, jak ověřovat reakce na přidání inzulinu při hyperglykémii tak, aby nedocházelo k hromadění bolusů a k těžkým hypoglykémiím (protože senzor reaguje na přidání inzulinu pomalejším poklesem glykémie). Ze závěrů této studie také vyplývá, že úspěch CGM je závislý na compliance pacientů – je nutné více než 60% využití CGM v daném čase, aby došlo ke zlepšení HbA1c. Neadekvátní reakce na alarmy mohou zvýšit riziko hypoglykémie.
Zajímavá je v souvislosti s terapií inzulinovou pumpou i práce Zissera [15], který prokázal významný vzestup glykémie po přerušení bazální dávky inzulinu na inzulinové pumpě – za každou minutu přerušení vzrostla glykémie přibližně o 0,06 mmol/l. Problematikou hypoglykémií při CGM se zabývaly i další studie: Buckingham [16] zjistil, že senzor zaznamenal noční hypoglykémii o 2–4 hodiny dříve, než pacienty postihly křeče. Z toho vyplývá, že pacient má dostatek času zareagovat na alarm, který by měl být dostatečně hlasitý a zapnutý i v průběhu noci.
Pozoruhodné využití senzoru publikoval také Munir [17]. Sledoval efekt terapie u pacientů s inzulinomem a zjistil přetrvávající noční hypoglykémie po terapii diazoxidem, zlepšení po terapii oktreotidem a trvalé zlepšení po operačním řešení.
Zatím nejsouhrnnější pohled na využití CGM u diabetiků 1. typu poskytla studie prováděná The Juvenile Diabetes Research Foundation (JDRF) CGM Study Group a publikovaná v New England Journal of Medicine v roce 2008 [18]. V multicentrické randomizované studii bylo sledováno 322 diabetiků 1. typu, 98 dospělých (starších 25 let), 110 osob mezi 15 a 24 lety a 114 osob mezi 8 a 14 lety. Diabetici byli randomizováni na skupinu provádějící CGM a skupinu kontrolní s běžným selfmonitoringem. Vstupní HbA1c představoval 7–10 % dle DCCT norem. Primárního cíle, většího zlepšení HbA1c za 6 měsíců ve skupině CGM ve srovnání se skupinou se selfmonitoringem, bylo dosaženo ve skupině dospělých starších 25 let (průměrný rozdíl ve zlepšení HbA1c mezi skupinou CGM a kontrolní byl 0,53 %). Adolescenti ani děti s CGM nedosáhli signifikantně většího zlepšení HbA1c za 6 měsíců než pacienti na selfmonitoringu. Jednou z příčin těchto věkových rozdílů může být větší adherence k CGM mezi dospělými (6 a více dní v týdnu používalo senzor 83 % dospělých) než mezi adolescenty (30% adherence) a mezi dětmi (50% adherence). Výskyt těžkých hypoglykémií byl ve všech skupinách nízký. Z této studie vyplývá závěr, že u dospělých diabetiků 1. typu je CGM spojeno se zlepšením kompenzace diabetu a že jsou nutné další studie pro zjištění překážek snižujících účinnost CGM u dětí a adolescentů. Oproti běžnému selfmonitoringu může CGM u těchto diabetiků pomoci detekovat postprandiální hyperglykémie a noční hypoglykémie. CGM může také pomoci implementovat cíle intenzifikované inzulinové terapie, protože odstraňuje obavy z hypoglykémií, které mohou být jednou z příčin poruchy autonomního nervového systému asociovaného s hypoglykémiemi [19].
U těhotných diabetiček 1. typu (46 osob) i 2. typu (25 osob) léčených inzulinem prokázala randomizovaná studie publikovaná v British Medical Journal [20] zlepšení kompenzace diabetu ve 3. trimestru těhotenství (mezi 32. a 36. týdnem) ve skupině s CGM ve srovnání se skupinou s běžným selfmonitoringem (HbA1c 5,8 % vs. 6,4 %), menší průměrnou porodní hmotnost novorozence a snížené riziko makrosomie. Zajímavé je, že zlepšení kompenzace diabetu se projevilo až po skončení CGM, která probíhala po dobu 4–6 týdnů v období mezi 8. a 32. týdnem těhotenství. Běžný selfmonitoring byl doporučován 7krát denně, cílem bylo dosažení glykémií 3,5–5,5 mmol/l před jídly, do 7,8 mmol/l hodinu po jídle a méně než 6,7 mmol/l za 2 hodiny po jídle. Z této studie vyplynulo, že CGM je pokládána především za edukační prostředek, jak zvládat diabetes, a že je třeba diskutovat s těhotnými diabetičkami zkušenosti z monitorace glykémií opakovaně. Pak je možné předpokládat zlepšení kompenzace i po ukončení CGM. Proto autoři navrhují začít používat CGM ještě před koncepcí nebo co nejdříve na počátku těhotenství.
V jiné práci se zabýval Stenninger [21] významem CGM během porodu a jejím vlivem na glykémie novorozence po porodu. Plocha pod křivkou glykémií v posledních 2 hodinách před porodem i pupečníková hladina inzulinu byly asociovány s potřebou intravenózní infuze glukózy u novorozenců (podávané při glykémiích nižších než 2,2 mmol/l). Autoři proto vidí perspektivu v použití CGM během porodu, které může zlepšit kompenzaci diabetu u matek a snížit riziko hypoglykémií novorozenců.U diabetiků 2. typu, zejména neléčených inzulinem, zůstává efektivita CGM předmětem diskuse. Selfmonitoring glykémií u diabetiků 2. typu neléčených inzulinem je rovněž diskutabilní, a to zejména proto, že tito pacienti si nestanovují hladinu glukózy dostatečně často, případně provádějí monitorování v nevhodnou dobu, nejsou dostatečně edukováni v tom, jak mají porozumět příčinám, které ovlivňují naměřené hodnoty glykémií, a jak na ně reagovat. Překážkou efektivity selfmonitoringu u těchto pacientů je i nedostatečná compliance s měřením pro bolestivost vpichu do prstu, pro náročnost obsluhy glukometru a v neposlední řadě i pro menší finanční dostupnost proužků pro tuto skupinu pacientů. CGM má ve srovnání se selfmonitoringem glykémií řadu výhod i pro diabetiky 2. typu, kteří nejsou léčeni inzulinem: pomáhá jim lépe porozumět příčinám výkyvů glykémie, jako je např. jídlo, vynechání pravidelné medikace, fyzická aktivita apod. Cenné je zejména zachycení postprandiálních hyperglykémií a doby jejich přetrvávání a detekce nočních hypoglykémií nebo hyperglykémií [22]. Bylo prokázáno, že největší hyperglykémie měli diabetici 2. typu po snídani a že tyto ranní postprandiální hyperglykémie se objevovaly i u pacientů s nižšími hodnotami HbA1c. U diabetiků 2. typu s různou úrovní kompenzace podle HbA1c umožnila CGM prokázat, že postupné zhoršování diabetu se vyvíjelo od postprandiálních hyperglykémií přes ranní tzv. dawn fenomén k trvalé celodenní hyperglykémii [23]. CGM proto může pomoci nastavit racionální terapii diabetiků 2. typu, zejména převod na inzulin při selhání léčby perorálními antidiabetiky.
Nedávno provedená randomizovaná studie se 65 diabetiky 2. typu (léčenými i neléčenými inzulinem) prokázala signifikantně výraznější zlepšení HbA1c ve skupině s CGM (3 dny monitorace měsíčně po dobu 3 měsíců) ve srovnání se skupinou diabetiků provádějících selfmonitoring alespoň 4krát týdně rovněž po dobu 3 měsíců. Navíc pacienti s CGM byli více motivovaní dodržovat režimová opatření a snížili signifikantně energetický příjem i hmotnost a zvýšili dobu fyzické aktivity [24].
Vlastní zkušenosti s kontinuální monitorací glykémií v IKEM
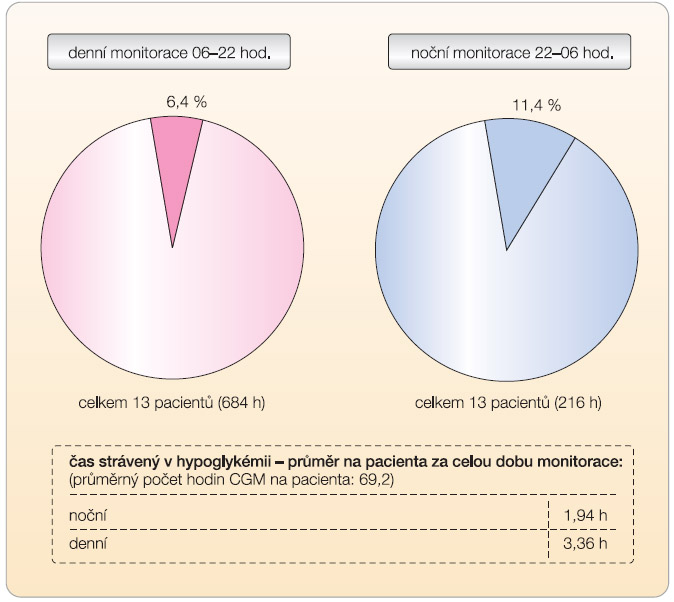 Již naše první zkušenosti s CGM, které jsme zhodnotili v roce 2003 ještě bez možnosti kontroly glykémií na monitoru v reálném čase (RT funkce), ukázaly prospěšnost kontinuální monitorace pro detekci hypoglykémií (graf 2). Během třídenní monitorace jsme ze skupiny 13 sledovaných diabetiků 1. typu zachytili hypoglykémie nižší než 3,5 mmol/l u 10 osob (77 %) v průběhu dne. U 54 % testovaných se vyskytly hypoglykémie v noci, které většinou nebyly pacientem rozpoznány (záchyt byl pouze u 15 % osob). Následující analýzu jsme prováděli v roce 2007, kdy jsme hodnotili skupinu 12 diabetiků 1. typu monitorujících se průměrně 6 dní, a zjistili jsme, že glykémie měřené senzorem byly ve 22 % mírně nižší než na glukometru a v 11% mírně vyšší, což svědčilo pro to, že nelze spoléhat na teoretické vysvětlení lag-time mezi intersticiální tekutinou a krevním řečištěm. Přesvědčili jsme se také o tom, že pacienti během CGM nemají větší technické problémy (např. „error“ při kalibraci zaznamenali pouze v 5 % měření, přitom prováděli průměrně 3 kalibrace denně). Žádný pacient ale nezadával do systému CGM údaje o jídle, inzulinu či cvičení. Usoudili jsme proto, že je bezpodmínečně nutné věnovat více pozornosti edukaci pacientů před CGM a vyškolili jsme za tím účelem specializovanou edukační sestru. Se zavedením monitorace v reálném čase jsme pak získali řadu dalších námětů ke zlepšení edukace pacientů tak, aby mohli adekvátně reagovat na zjištěné glykémie. Tato doporučení se chystáme vydat v nejbližší době jako nový edukační materiál.
Již naše první zkušenosti s CGM, které jsme zhodnotili v roce 2003 ještě bez možnosti kontroly glykémií na monitoru v reálném čase (RT funkce), ukázaly prospěšnost kontinuální monitorace pro detekci hypoglykémií (graf 2). Během třídenní monitorace jsme ze skupiny 13 sledovaných diabetiků 1. typu zachytili hypoglykémie nižší než 3,5 mmol/l u 10 osob (77 %) v průběhu dne. U 54 % testovaných se vyskytly hypoglykémie v noci, které většinou nebyly pacientem rozpoznány (záchyt byl pouze u 15 % osob). Následující analýzu jsme prováděli v roce 2007, kdy jsme hodnotili skupinu 12 diabetiků 1. typu monitorujících se průměrně 6 dní, a zjistili jsme, že glykémie měřené senzorem byly ve 22 % mírně nižší než na glukometru a v 11% mírně vyšší, což svědčilo pro to, že nelze spoléhat na teoretické vysvětlení lag-time mezi intersticiální tekutinou a krevním řečištěm. Přesvědčili jsme se také o tom, že pacienti během CGM nemají větší technické problémy (např. „error“ při kalibraci zaznamenali pouze v 5 % měření, přitom prováděli průměrně 3 kalibrace denně). Žádný pacient ale nezadával do systému CGM údaje o jídle, inzulinu či cvičení. Usoudili jsme proto, že je bezpodmínečně nutné věnovat více pozornosti edukaci pacientů před CGM a vyškolili jsme za tím účelem specializovanou edukační sestru. Se zavedením monitorace v reálném čase jsme pak získali řadu dalších námětů ke zlepšení edukace pacientů tak, aby mohli adekvátně reagovat na zjištěné glykémie. Tato doporučení se chystáme vydat v nejbližší době jako nový edukační materiál.
Práce byla podporována VZ MZO 00023001.
Seznam použité literatury
- [1] Buckingham B, Block J, Wilson DM. Continuous glucose monitoring. Curr Opin Endocrinol Diabetes 2005; 12: 273–279.
- [2] Nielsen JK, Djurhuus CB, Gravholt CH, et al. Continuous glucose monitoring in interstitial subcutaneous adipose tissue and skeletal muscle reflects excursions in cerebral cortex. Diabetes 2005; 54: 1635–1639.
- [3] Hirsch IB, Armstrong D, Bergenstal RM, et al. Clinical application of emerging sensor technologies in diabetes management: consensus guidelines for continuous glucose monitoring (CGM). Diabetes Technol Ther 2008; 10: 232–244.
- [4] Garg SK, Voelmle MK, Gottlieb P. Feasibility of 10-day use of continuous glucose-monitoring system in adults with type 1 diabetes. Diabetes Care 2009; 32: 436–438.
- [5] Brož J. Kontinuální monitorace glykémií: současnost a nástin budoucnosti. DIAstyl 2009; 5: 24–26.
- [6] Clarke WL, Cox D, Gonder-Frederick LA, et al. Evaluating clinical accuracy of systems for self-monitoring of blood glucose. Diabetes Care 1987; 10: 622–628.
- [7] Kovatchev BP, Gonder-Frederick LA, Cox DJ, Clarke WL. Evaluating the accuracy of continuous glucose-monitoring sensors: continuous glucose-error grid analysis illustrated by TheraSense Freestyle Navigator data. Diabetes Care 2004; 27: 1922–1928.
- [8] Kovatchev B, Anderson S, Heinemann L, Clarke W. Comparison of the numerical and clinical accuracy of four continuous glucose monitors. Diabetes Care 2008; 31: 1160–1164.
- [9] Garg SK, Smith J, Beatson C, et al. Comparison of Accuracy and Safety of the SEVEN and the Navigator Continuous Glucose Monitoring Systems. Diabetes Technol Ther 2009; 11: 65–72.
- [10] Mastrototaro J, Shin J, Marcus A, Sulur G. The accuracy and efficacy of real-time continuous glucose monitoring sensor in patients with type 1 diabetes. Diabetes Technol Ther 2008; 10: 385–390.
- [11] Monnier L, Mas E, Ginet C, et al. Activation of oxidative stress by acute glucose fluctuations compared with sustained chronic hyperglycemia in patients with type 2 diabetes. JAMA 2006; 295: 1681–1687.
- [12] No authors listed. Glucose tolerance and mortality: comparison of WHO and American Diabetes Association diagnostic criteria. The DECODE study group. European Diabetes Epidemiology Group. Diabetes Epidemiology: Collaborative analysis Of Diagnostic criteria in Europe. Lancet 1999; 354: 617–621.
- [13] Garg S, Zisser H, Schwartz S, et al. Improvement in glycemic excursions with a transcutaneous, real-time continuous glucose sensor: a randomized controlled trial. Diabetes Care 2006; 29: 44–50.
- [14] Hirsch IB, Abelseth J, Bode BW, et al. Sensor-augmented insulin pump therapy: results of the first randomized treat-to-target study. Diabetes Technol Ther 2008; 10: 377–383.
- [15] Zisser H. Quantifying the impact of a short-interval interruption of insulin-pump infusion sets on glycemic excursions. Diabetes Care 2008; 31: 238–239.
- [16] Buckingham B, Wilson DM, Lecher T, et al. Duration of nocturnal hypoglycemia before seizures. Diabetes Care 2008; 31: 2110–2112.
- [17] Munir A, Choudhary P, Harrison B, et al. Continuous glucose monitoring in patients with insulinoma. Clin Endocrinol 2008; 68: 912–918.
- [18] JDRF CGM Study Group, Tamborlane WV, Beck RW, et al. Continuous glucose monitoring and intensive treatment of type 1 diabetes. N Engl J Med 2008; 359: 1464–1476.
- [19] Cryer PE. Diverse causes of hypoglycemia-associated autonomic failure in diabetes. N Engl J Med 2004; 350: 2272–2279.
- [20] Murphy HR, Rayman G, Lewis K, et al. Effectiveness of continuous glucose monitoring in pregnant women with diabetes: randomised clinical trial. BMJ 2008; 337: a1680. doi: 10.1136/bmj. a1680.
- [21] Stenninger E, Lindqvist A, Aman J, et al. Continuous Subcutaneous Glucose Monitoring System in diabetic mothers during labour and postnatal glucose adaptation of their infants. Diabet Med 2008; 25: 450–454.
- [22] Harman-Boehm I. Continuous glucose monitoring in type 2 diabetes. Diabetes Res Clin Pract 2008; 82 (Suppl. 2): S118–121.
- [23] Monnier L, Colette C, Dunseath GJ, Owens DR. The loss of postprandial glycemic control precedes stepwise deterioration of fasting with worsening diabetes. Diabetes Care 2007; 30: 263–269.
- [24] Yoo HJ, An HG, Park SY, et al. Use of a real time continuous glucose monitoring system as a motivational device for poorly controlled type 2 diabetes. Diabetes Res Clin Pract 2008; 82: 73–79.