Současné možnosti léčby chronické lymfocytární leukemie
Chronická lymfocytární leukemie (CLL) je nejčastějším leukemickým onemocněním euroamerické populace. Je charakterizována klonální expanzí morfologicky zralých lymfocytů v kostní dřeni, periferní krvi a lymfatických orgánech. CLL je typická zcela mimořádnou různorodostí délky přežití, která může sahat od několika měsíců po desítky let (a tedy délkou přežití shodnou se zdravými vrstevníky). Klinické systémy stagingu dle Raie a Bineta pomocí jednoduchých a dostupných parametrů rozdělí nemocné s CLL základním způsobem dle prognózy, jejich nevýhodou je však nemožnost identifikovat nemocné v časném stadiu, kteří budou mít nepříznivý klinický průběh onemocnění. Proto se hledají nové prognostické faktory s cílem co nejpřesnějšího určení individuálního rizika. V současnosti jsou nejvýznamnějšími nepříznivými ukazateli genetické aberace (přítomnost delece 11q a zejména 17p) a nemutované geny pro variabilní část řetězce imunoglobulinu (IgVH). V léčbě CLL došlo v posledních deseti letech ke zcela zásadnímu průlomu. Paliativní chemoterapie představovaná zejména chlorambucilem byla u mladších nemocných nahrazena razantními kombinačními protokoly chemoimunoterapie na bázi purinových analog a monoklonálních protilátek, které jsou schopny u významné části nemocných navodit nejen kompletní hematologickou, ale i molekulární remisi. Kombinace fludarabinu, cyklofosfamidu a monoklonální anti-CD20 protilátky rituximabu (protokol FCR) je nyní na základě randomizovaných studií považována za standard léčby 1. linie i relapsu u mladších nemocných v dobrém stavu. Monoklonální protilátka anti-CD52 alemtuzumab je indikována u nemocných refrakterních na fludarabin a nově schválena i pro použití v 1. linii. Vysokodávkované kortikoidy představují nadějnou možnost pro refrakterní nemocné nebo pro ty, kteří nemohou být léčeni chemoterapií. Alogenní transplantace krvetvorných buněk je jedinou léčebnou alternativou s kurativním potenciálem a měla by být nabídnuta nemocným ve věku do 60–65 let s nepříznivým klinickým průběhem onemocnění, jsou-li v dobrém celkovém stavu. Pro nemocné významně komorbidní či starší 70–75 let zůstává standardem léčby chlorambucil. Nové léčebné přístupy zkoušené v rámci klinických studií zahrnují konsolidační léčbu alemtuzumabem k odstranění minimální reziduální nemoci, udržovací léčbu rituximabem a chemoimunoterapii na bázi fludarabinu u nemocných v časných klinických stadiích. V současné době je u CLL testována řada nových léčiv, mezi které patří monoklonální protilátky ofatumumab a lumiliximab, cytostatikum bendamustin, imunomodulační látky thalidomid a lenalidomid, inhibitory proteinu Bcl-2 oblimersen, obatoklax a další. Zavedení těchto preparátů do praxe v budoucnosti doufejme přinese další zlepšení léčebných výsledků vedoucí k prodloužení přežití nemocných s CLL.
Úvod
Chronická lymfocytární leukemie (CLL) je nejčastější leukemií dospělého věku v euroamerické populaci. Jde o indolentní hematologickou malignitu charakterizovanou hromaděním morfologicky zralých B-lymfocytů v kostní dřeni, periferní krvi a lymfatických orgánech [1]. CLL je onemocněním starších osob, průměrný věk v době diagnózy se pohybuje mezi 67–72 roky [2–4]. Věkově upravená incidence je v bělošské populaci USA 4,6/100 000 osob, avšak velmi výrazně stoupá s věkem (např. ve věku 70–75 let na 21,9/100 000) [5]. CLL je vzácná ve věku pod 40 let, nevyskytuje se u dětí. Onemocnění jeví významně častější výskyt u mužů, a to v poměru k ženám až 1,9 : 1 [6].
Patofyziologie
V patogenezi CLL hraje významnou úlohu porucha programované buněčné smrti – apoptózy, která vede k narušení rovnováhy mezi novotvorbou a zánikem leukemických lymfocytů; jedním ze zásadních faktorů přispívajících k poruše apoptotických signálních drah je zřejmě zvýšená exprese antiapoptotického proteinu Bcl-2 [7]. Tradiční představy o pasivním hromadění lymfocytů s poruchou apoptózy se však nyní mění díky experimentům, které ukazují na významný podíl aktivní proliferace maligního klonu na celkové nádorové populaci [8]. Tato proliferace probíhá pravděpodobně v proliferačních centrech mízních uzlin [9]. Hromadění leukemických lymfocytů u CLL je usnadněno interakcemi maligních buněk s dalšími buněčnými typy, a to pomocí přímých mezibuněčných kontaktů i prostřednictvím signálních molekul. Mezi nejdůležitější interakce patří systém CD40-CD154, chemokiny a jejich receptory a signální dráhy začínající u B-buněčného receptoru (BCR) stimulovaného různými (auto)antigeny [9]. Studie in vivo ukázaly, že v kontrastu k dřívějším představám o maligních buňkách v G0 fázi buněčného cyklu významné množství leukemického klonu proliferuje a k proliferaci dochází převážně ve zvláštních oblastech kostní dřeně a lymfatických orgánů [10, 11]. V současnosti se uplatňuje nový náhled na CLL jako na onemocnění charakterizované dynamickou rovnováhou mezi klidovými lymfocyty (odolnými vůči apoptóze), které cirkulují v periferní krvi, a proliferujícími prolymfocyty a paraimunoblasty, jež sídlí ve výhodném mikroprostředí lymfatických orgánů a tvoří proliferační centra [12, 13].
Diagnóza
 Diagnóza CLL je založena na kritériích National Cancer Institute-sponsored Working Group (NCI-WG) z roku 2008, uvedených v tab. 1 [1]. Maligní klon je možno jednoznačně stanovit průtokovou cytometrií periferní krve. Proto není pro stanovení diagnózy CLL indikováno vyšetření kostní dřeně či mízní uzliny. V případě záchytu typického klonu CD5+/19+/23+ lymfocytů v množství pod arbitrátní hranicí 5 x 109/l a při nepřítomnosti cytopenie, lymfadenopatie či splenomegalie jde o tzv. monoklonální lymfocytózu z B-lymfocytů (MBL), která představuje premaligní stav analogický s monoklonální gamapatií nejasného významu (MGUS). Pouze část z těchto nemocných progreduje do CLL (zhruba 1–2 % ročně) [1]. Jednotka lymfom z malých lymfocytů (small lymphocytic lymphoma, SLL) má zcela identický imunofenotypizační profil, hlavním rozdílem vůči CLL je nesplnění kritéria periferní lymfocytózy. Zpravidla převažuje lymfadenopatie, proto většina záchytů SLL je z histologie mízní uzliny. Vzhledem k tomu, že CLL a SLL jsou různé tkáňové projevy stejného onemocnění, aktuální klasifikace Světové zdravotnické organizace (WHO) z roku 2008 uvádí CLL a SLL pod společnou jednotkou CLL/SLL [14].
Diagnóza CLL je založena na kritériích National Cancer Institute-sponsored Working Group (NCI-WG) z roku 2008, uvedených v tab. 1 [1]. Maligní klon je možno jednoznačně stanovit průtokovou cytometrií periferní krve. Proto není pro stanovení diagnózy CLL indikováno vyšetření kostní dřeně či mízní uzliny. V případě záchytu typického klonu CD5+/19+/23+ lymfocytů v množství pod arbitrátní hranicí 5 x 109/l a při nepřítomnosti cytopenie, lymfadenopatie či splenomegalie jde o tzv. monoklonální lymfocytózu z B-lymfocytů (MBL), která představuje premaligní stav analogický s monoklonální gamapatií nejasného významu (MGUS). Pouze část z těchto nemocných progreduje do CLL (zhruba 1–2 % ročně) [1]. Jednotka lymfom z malých lymfocytů (small lymphocytic lymphoma, SLL) má zcela identický imunofenotypizační profil, hlavním rozdílem vůči CLL je nesplnění kritéria periferní lymfocytózy. Zpravidla převažuje lymfadenopatie, proto většina záchytů SLL je z histologie mízní uzliny. Vzhledem k tomu, že CLL a SLL jsou různé tkáňové projevy stejného onemocnění, aktuální klasifikace Světové zdravotnické organizace (WHO) z roku 2008 uvádí CLL a SLL pod společnou jednotkou CLL/SLL [14].
Prognostické faktory

 Systémy klinického stagingu zavedené Raiem [15] a Binetem [16], uvedené v tab. 2 a 3, jsou stále základem pro klinické posouzení nemocných s nově zjištěnou CLL, protože jsou založeny na velmi jednoduchých a levných vyšetřeních (fyzikální vyšetření, krevní obraz) a základním způsobem určí klinické riziko nemocných. I když tyto systémy rozdělí nemocné podle celkového přežití, není možné podle nich vyhledat ty nemocné, jejichž onemocnění je zjištěno v časném či v intermediárním stadiu (v současné době až 75 % všech nově diagnostikovaných nemocných!), ale kteří budou časně progredovat a mít celkově nepříznivou prognózu. Dále existují velké rozdíly v celkovém přežití v rámci jednoho klinického stadia.
Systémy klinického stagingu zavedené Raiem [15] a Binetem [16], uvedené v tab. 2 a 3, jsou stále základem pro klinické posouzení nemocných s nově zjištěnou CLL, protože jsou založeny na velmi jednoduchých a levných vyšetřeních (fyzikální vyšetření, krevní obraz) a základním způsobem určí klinické riziko nemocných. I když tyto systémy rozdělí nemocné podle celkového přežití, není možné podle nich vyhledat ty nemocné, jejichž onemocnění je zjištěno v časném či v intermediárním stadiu (v současné době až 75 % všech nově diagnostikovaných nemocných!), ale kteří budou časně progredovat a mít celkově nepříznivou prognózu. Dále existují velké rozdíly v celkovém přežití v rámci jednoho klinického stadia.
Zásadní pokrok v určení individuální prognózy nemocných s CLL přinesly dvě metody známé u CLL od konce 90. let 20. století: stanovení mutačního stavu IgVH a genetické aberace. V roce 1999 byly nezávisle ve dvou studiích prokázány diametrální rozdíly v celkovém přežití nemocných s CLL na základě vyšetření tzv. mutačního stavu genů pro variabilní část těžkého řetězce imunoglobulinu (IgVH). Nemocní s mutovanými geny pro IgVH mají zpravidla stabilní onemocnění a výrazně delší celkové přežití, na druhé straně nemocní s méně než dvouprocentní mutací IgVH genů mají významně kratší dobu do první léčby, přežití bez progrese a kratší dobu celkového přežití [17, 18]. Vzhledem k tomu, že klasické vyšetření karyotypu je u CLL málo výtěžné pro velmi nízkou mitotickou aktivitu leukemických lymfocytů in vitro, je v současnosti standardem vyšetření FISH – fluorescenční hybridizace in situ. Pomocí tohoho vyšetření lze zachytit genetické abnormality až v 80 %. Nejčastější je delece dlouhého ramene chromozomu 13, která je prognosticky příznivá. Delece části dlouhého ramene chromozomu 11 postihující gen ATM je spojena s výraznou lymfadenopatií a rychlou progresí; nejobávanější je delece krátkého ramene chromozomu 17 postihující gen p53, neboť tato změna způsobuje zpravidla rezistenci na léčbu a vysoce nepříznivou prognózu [19].
Indikace k zahájení léčby
CLL je indolentní onemocnění a v kontrastu s většinou malignit není diagnóza CLL sama o sobě rozhodně důvodem k zahájení léčby. V současné době totiž většina nemocných v době diagnózy nemá žádné klinické projevy a CLL je velmi často zjištěna náhodně při vyšetření krevního obrazu. Časná stadia (Rai 0/Binet A) jsou pouze sledována v souladu se strategií „watch and wait“, protože z randomizovaných studií provedených v 90. letech 20. století doposud nevyplynuly důkazy o prospěšnosti časného zahájení léčby [20, 21]. Intermediární stadia (Rai I-II/Binet B) jsou indikována k léčbě, pokud jsou splněna mezinárodně uznávaná kritéria aktivity CLL [1]: výrazné B-příznaky (významná únava, pocení, hubnutí či horečky neinfekčního původu), rychlý nárůst lymfocytózy (zdvojovací čas do 6 měsíců nebo nárůst hladiny lymfocytů o 50 % během 2 měsíců) či masivní/progredující lymfadenopatie či hepatosplenomegalie. U nemocných v pokročilém stadiu (Rai III-IV/Binet C) je doporučováno bez odkladů zahájit léčbu. Samotná leukocytóza (ani s hodnotami kolem 400 x 109/l) bez jiných kritérií není indikací k zahájení léčby vzhledem k tomu, že syndrom leukostázy je u CLL velmi vzácný a zpravidla se objevuje až při hodnotách vyšších než 1000 x 109/l.
Léčba CLL
Terapeutický přístup k CLL prošel v posledním desetiletí zásadními změnami. Ještě v 80. letech měl neotřesitelnou pozici v léčbě 1. linie chlorambucil (CLB), tedy alkylační cytostatikum podávané perorálně. Účinnost léčby CLB v 1. linii je nízká, zpravidla dosahuje jen parciální remise (PR) nebo stabilizace onemocnění, kompletní remise jsou vzácné. Pulzní podávání je nyní upřednostňováno před podáváním kontinuálním pro menší incidenci sekundárních myelodysplazií. Chlorambucil je v současné době vyhrazen pro použití u výrazně komorbidních či starších nemocných, kteří nemohou být léčeni intenzivnějšími protokoly. Použití kombinovaných režimů chemoterapie (cyklofosfamid, doxorubicin, prednison – CAP, cyklofosfamid, doxorubicin, vinkristin, prednison – CHOP) nepřineslo zlepšení léčebných výsledků [20]. Přidání kortikoidů k chlorambucilu nezvyšuje léčebný efekt, a naopak zvyšuje riziko oportunních infekcí, proto je jejich použití opodstatněno pouze u autoimunitních cytopenií [21].
Purinová analoga
Fludarabin představuje z hlediska CLL nejdůležitějšího zástupce skupiny purinových analog, cytostatik; jejich mechanismus účinku spočívá v komplexním blokování syntézy DNA a v poruše reparačních mechanismů DNA, v depleci ATP, v nahromadění fragmentů DNA a následné apoptóze maligních lymfocytů [22]. Fludarabin byl do léčby CLL zaveden počátkem 90. let 20. století, a to zprvu v monoterapii rezistentní choroby. Postupně byl s úspěchem vyzkoušen i v kombinaci, zejména s cyklofosfamidem, se kterým vykazuje in vitro synergismus. Velké randomizované studie neprokázaly zlepšení celkového přežití u nemocných léčených fludarabinem v monoterapii ve srovnání s chlorambucilem či s režimem CHOP, celková léčebná odpověď a přežití bez progrese však byly vyšší u fludarabinu [23]. Mezi nejvýznamnější nežádoucí účinky patří hematologická toxicita, zejména neutropenie a lymfopenie se zvýšením rizika oportunních infekcí včetně mykotických nebo pneumocystových, proto je vždy nutno zvážit antimikrobní profylaxi. Při léčbě fludarabinem může dojít k propuknutí autoimunitní hemolýzy (AIHA) či trombocytopenie. Britská randomizovaná studie však ukázala, že zejména fludarabinem vyvolaná AIHA nepředstavuje zejména u kombinace s cyklofosfamidem častý problém a její výskyt je nižší než u nemocných léčených chlorambucilem či fludarabinem v monoterapii [25]. Tato studie také ukázala, že samotná pozitivita Coombsova testu bez známek aktivní hemolýzy není kontraindikací použití fludarabinu, protože nepredikuje výskyt AIHA. U nemocných s aktivní AIHA však fludarabinové režimy nejsou doporučovány. Kladribin a pentostatin jsou dalšími purinovými analogy používanými v zahraničí v léčbě CLL. Kladribin se hojně uplatňuje zejména v Polsku, jeho účinnost je podobná fludarabinu [24]. Pentostatin, používaný některými centry v USA, není v ČR registrován.
Kombinované fludarabinové režimy
Ve srovnání s monoterapií nabízí kombinace fludarabinu s cyklofosfamidem (FC) významně vyšší účinnost při výraznější myelosupresi, ale bez vyššího výskytu infekcí. Ve třech rozsáhlých randomizovaných studiích bylo prokázáno jednoznačné zlepšení léčebné odpovědi (celková odpověď, kompletní remise) a období do progrese u kombinace FC ve srovnání s monoterapií fludarabinem [25–27]. Proto byl režim FC do zavedení chemoimunoterapie pokládán za léčbu 1. volby.
Chemoimunoterapie
Rituximab, chimérická myší/lidská monoklonální protilátka anti-CD20, byl prvním preparátem cílené léčby schváleným v hematoonkologii. Rituximab má v současné době nezastupitelné místo v léčbě nízce i vysoce maligních non-Hodgkinových lymfomů [28]. U CLL není monoterapie ve standardní dávce (375 mg/m2 i.v. á týden, 4 dávky) účinná pro nižší denzitu CD20 na leukemických lymfocytech a rychlé odstranění rituximabu z oběhu solubilním CD20. Zvýšení účinnosti je možné dosáhnout časovou nebo dávkovou eskalací, které jsou ale nevýhodné z hlediska poměru účinnosti k ceně léčby [29]. Rituximab však zvyšuje efektivitu cytostatické terapie, proto byly do léčby CLL zavedeny režimy kombinované chemoimunoterapie. V současnosti nejúčinnějším léčebným schématem u CLL je kombinace fludarabinu s cyklofosfamidem a rituximabem (FCR), vyvinutá v MD Anderson Cancer Center v texaském Houstonu. Tento režim v pilotních studiích fáze II dosáhl do té doby nevídaných výsledků jak v léčbě 1. linie (celková odpověď 95 %, kompletní remise 70 %), tak i v relapsu (celková odpověď 73 %, kompletní remise 25 %) [30, 31]. Tyto výsledky byly potvrzeny velkými randomizovanými studiemi. Německá studie s mezinárodní účastí CLL-8 ukázala vyšší účinnost 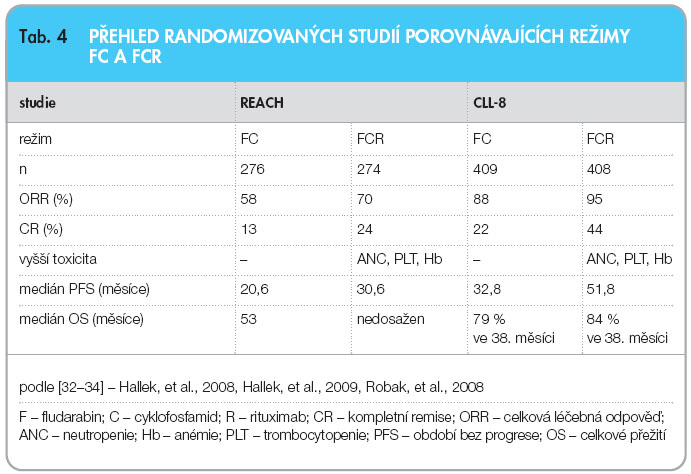 protokolu FCR (FC + rituximab 500 mg/m2 den 1 cyklu; 375 mg/m2 v 1. cyklu) v porovnání s chemoterapií FC, a to z hlediska celkové léčebné odpovědi (ORR), kompletních remisí (CR), období bez progrese (PFS), nadto – dle aktuální analýzy – také v délce celkového přežití (OS), což je zcela přelomová situace v dějinách léčby CLL [32, 33]. Obdobných výsledků v léčbě relapsu dosáhla mezinárodní studie REACH, která také potvrdila vyšší účinnost chemoimunoterapie FCR vůči FC (avšak bez prodloužení celkového přežití) [34]. Výsledky randomizovaných studií porovnávajících protokoly FCR a FC shrnuje tab. 4.
protokolu FCR (FC + rituximab 500 mg/m2 den 1 cyklu; 375 mg/m2 v 1. cyklu) v porovnání s chemoterapií FC, a to z hlediska celkové léčebné odpovědi (ORR), kompletních remisí (CR), období bez progrese (PFS), nadto – dle aktuální analýzy – také v délce celkového přežití (OS), což je zcela přelomová situace v dějinách léčby CLL [32, 33]. Obdobných výsledků v léčbě relapsu dosáhla mezinárodní studie REACH, která také potvrdila vyšší účinnost chemoimunoterapie FCR vůči FC (avšak bez prodloužení celkového přežití) [34]. Výsledky randomizovaných studií porovnávajících protokoly FCR a FC shrnuje tab. 4.
Alemtuzumab
Humanizovaná potkaní protilátka anti-CD52 alemtuzumab představuje kvalitativní posun v léčbě relapsu a refrakterní CLL. Jednou z výhod tohoto preparátu je skutečnost, že na rozdíl od chemoterapie nepoškozuje krvetvorné kmenové buňky, protože antigen CD52 se vyskytuje pouze na B- a T-lymfocytech, monocytech a makrofázích. Alemtuzumab v léčbě refrakterní a rezistentní choroby u těžce předléčených pacientů dosáhl v registrační studii ORR 33 % a CR 2 % [35], v randomizované studii v léčbě 1. linie pak ORR 83 %, CR 24 % a mediánu PFS 23 měsíců, což představovalo významně lepší účinnost vůči kontrolní skupině léčené chlorambucilem (ORR/CR 55/2 %, medián PFS 15 měsíců) [36]. Právě volba chlorambucilu do kontrolního ramene (což je v dnešní době pro nemocné v dobrém stavu považováno za obsolentní typ léčby) a absence dat pro přímé srovnání s fludarabinovými režimy typu FC a FCR zřejmě brání většímu rozšíření podávání alemtuzumabu v 1. linii. Po léčbě alemtuzumabem dochází v důsledku dlouhodobé a výrazné deplece zdravých lymfocytů B a T ke  zvýšení rizika oportunních infekcí, zejména mykotických, Pneumocystis jiroveci nebo reaktivace cytomegaloviru (CMV). Z tohoto důvodu je nutné, aby nemocní léčení alemtuzumabem užívali antimikrobiání profylaxi (sulfamethoxazol/trimetoprim, aciklovir nebo analoga) po dobu léčby a minimálně 2 měsíce po jejím skončení, dále je doporučována monitorace CMV pomocí senzitivních metod (nejčastěji kvantitativní PCR v reálném čase). Podkožní aplikace alemtuzumabu je považována za srovnatelnou s nitrožilní z hlediska účinnosti (pouze s pomalejším nástupem účinku), ale za výhodnější vzhledem k výraznému snížení vedlejších účinků spojených s infuzí (třesavky, zimnice, horečky, hypotenze) – na počátku se objeví zpravidla pouze přechodný kožní infiltrát v místě aplikace. V současné době je alemtuzumab schválen pro léčbu relabující a refrakterní CLL u nemocných v minulosti léčených alkylačními látkami, u nichž došlo k selhání chemoterapie obsahující fludarabin. Přehled v současnosti používaných režimů u CLL je v tab. 5.
zvýšení rizika oportunních infekcí, zejména mykotických, Pneumocystis jiroveci nebo reaktivace cytomegaloviru (CMV). Z tohoto důvodu je nutné, aby nemocní léčení alemtuzumabem užívali antimikrobiání profylaxi (sulfamethoxazol/trimetoprim, aciklovir nebo analoga) po dobu léčby a minimálně 2 měsíce po jejím skončení, dále je doporučována monitorace CMV pomocí senzitivních metod (nejčastěji kvantitativní PCR v reálném čase). Podkožní aplikace alemtuzumabu je považována za srovnatelnou s nitrožilní z hlediska účinnosti (pouze s pomalejším nástupem účinku), ale za výhodnější vzhledem k výraznému snížení vedlejších účinků spojených s infuzí (třesavky, zimnice, horečky, hypotenze) – na počátku se objeví zpravidla pouze přechodný kožní infiltrát v místě aplikace. V současné době je alemtuzumab schválen pro léčbu relabující a refrakterní CLL u nemocných v minulosti léčených alkylačními látkami, u nichž došlo k selhání chemoterapie obsahující fludarabin. Přehled v současnosti používaných režimů u CLL je v tab. 5.
Transplantace krvetvorných buněk
Nevyléčitelnost CLL pomocí běžné terapie vedla k podrobnějšímu zkoumání transplantačních postupů. Vysokodávkovaná chemoterapie s autologní transplantací periferních kmenových buněk má minimální peritransplantační mortalitu, avšak ani zde nejde o kurativní metodu a nemocní po autologní transplantaci po CLL mají poměrně vysoké riziko sekundárních malignit. Vzhledem k tomu, že obdobných výsledků jako autologní transplantací lze dosáhnout použitím razantních protokolů chemoimunoterapie, byla v současné době autologní transplantace u CLL prakticky opuštěna [37]. Alogenní transplantaci po klasické myeloablativní přípravě lze provést u nemocných v dobrém stavu zpravidla do 55 let, výjimečně do 60 let věku. Vede sice k dlouhodobým remisím, ale je zatížena nepřijatelnou mortalitou – až 46 % z dat evropského transplantačního registru [38]. Nadějnou metodou se jeví použití tzv. nemyeloablativního přípravného režimu. Ten spočívá v podávání nižších dávek cytostatik/záření, které zcela nezničí původní krvetvorbu, ale způsobí „pouze“ těžkou imunosupresi, jež umožní přihojení dárcovského štěpu. Tato léčebná modalita využívá imunologického efektu reakce štěpu proti leukemii (graft versus leukemia effect, GvL) schopného v řadě případů zcela eliminovat zbytkový leukemický klon. Výhodou tohoto přístupu je výrazně nižší peritransplantační mortalita (do 26 %) a možnost jejího použití u nemocných až do věku 65 (výjimečně 70) let; mezi rizika patří dlouhodobé snížení kvality života při chronické extenzivní reakci štěpu proti hostiteli (graft versus host disease, GvHD) a vyšší riziko relapsu CLL. Většina studií zatím nemá dostatečně dlouhou dobou sledování, aby bylo možno učinit definitivní závěry o účinnosti a bezpečnosti alogenní transplantace po nemyeloablativní přípravě [shrnuto v 39]. Nicméně tato metoda je v současné praxi jednoznačně upřednostňována před klasickým myeloablativním přístupem. Alogenní transplantace by měla být včas nabídnuta každému nemocnému s CLL s nepříznivým klinickým průběhem, zejména při refrakternosti na fludarabinové režimy [37].
Nové směry v léčbě CLL
Přes veškeré pokroky v léčbě CLL všichni nemocní postupně relabují a onemocnění se dříve či později stává refrakterním na léčbu. Alogenní transplantace krvetvorných buněk nabízí reálnou šanci na trvalé vyléčení, je však zatížena nezanedbatelnou mortalitou a je proveditelná pouze u malé části nemocných. Z těchto důvodů je nadále věnováno obrovské úsilí snaze o další zlepšení účinnosti léčby.
Nové léčebné kombinace
V současné době je velká pozornost věnována novým kombinacím chemoimunoterapie. Přidáním alemtuzumabu k FCR vznikl režim CFAR, který je zkoušen u relabované/refrakterní CLL i v 1. léčebné linii [40, 41]. Hlavními problémy jsou výrazná hematologická toxicita a finanční náročnost protokolu. Kombinace fludarabinu s alemtuzumabem byla použita ve studii německé CLL skupiny u 36 nemocných s relabovanou/refrakterní CLL s celkovou odpovědí (OR) 83 %, vyskytly se však dvě mykotické pneumonie a jedno časné úmrtí v důsledku sepse [42]. Použití kombinace FC s alemtuzumabem (FCC) u relapsu CLL bylo publikováno Montillem: 25 nemocných obdrželo perorální FC v kombinaci s podkožním alemtuzumabem v dávce 10–20 mg s.c. v den 1–3, podání dávky se opakovalo po 28 dnech. ORR/CR činily 79/37 %. Neutropenie IV. stupně byla přítomna ve 43 % podaných cyklů a vyskytly se 4 těžké infekce [43]. K podobným výsledkům dospěla i německá CLL skupina ve studii CLL-2L [44].
Jednou z dalších možností zvýšení účinnosti stávajících fludarabinových protokolů je přidání mitoxantronu. Španělský protokol FCM (FC + mitoxantron v dávce 6 mg/m2 i.v. 1. den cyklu) byl použit u 69 nemocných mladších 65 let v 1. linii léčby. Bylo dosaženo 90% celkové odpovědi s mediánem trvání odpovědi 37 měsíců; těžká neutropenie se vyskytla pouze u 10 % nemocných a závažné infekce jen v 1 % [45]. RFCM, tedy tentýž protokol s přidáním rituximabu (500 mg/m2 od 2. cyklu) s následnou udržovací léčbou rituximabem (375 mg/m2 á 3 měsíce) byl stejnými autory použit v 1. linii léčby u 72 nemocných do 70 let věku. Léčebná účinnost byla vynikající: ORR/CR 93/82 %. Těžká neutropenie se rozvinula u 13 % nemocných, závažné infekce v 8 % podaných cyklů [46]. V britské studii CLL201 bylo randomizováno 52 nemocných s relapsem CLL mezi protokoly FCM a RFCM. Vyššího počtu kompletních remisí (CR, 40 % vs. 12 %) bylo dosaženo ve skupině RFCM [47].
Léčba starších či komorbidních nemocných s CLL
Léčebná strategie u starších či komorbidních nemocných s CLL je vysoce důležitou problematikou, která však dosud nebyla v centru pozornosti. Průměrný věk nemocných s CLL v době diagnózy je 67–72 let; většina studií však zahrnuje pouze či převážně mladší nemocné ve věku do 65 let. Pro starší/komorbidní nemocné ale nemůžeme extrapolovat data ze studií pro „fit“ pacienty bez závažných komorbidit, např. z důvodu odlišné farmakokinetiky (zejména v důsledku sníženého vylučování fludarabinu ledvinami) a z toho vyplývající nepřijatelně vysoké toxicity a špatné tolerance léčby [48]. Fakt, že výsledky studií získané u mladší CLL populace neplatí pro starší nemocné, ukazují například výsledky dosud nejrozsáhlejší randomizované studie cílené na starší populaci – studie CLL-5 německé CLL skupiny [49]. V této studii byli dosud neléčení nemocní s CLL starší 65 let randomizováni mezi fludarabin v monoterapii (25 mg/m2 den 1–5 i.v. á 28 dní, max. 6 cyklů) a pulzní chlorambucil (0,4 mg/kg s postupným zvýšením na 0,8 mg/kg, á 14 dní po dobu 12 měsíců). I když bylo fludarabinem dosaženo významně vyšší celkové odpovědi a kompletních remisí (ORR 72 vs. 51 %; CR 7 vs. 0 %), nebyly zjištěny významné rozdíly v PFS (19 vs. 18 měsíců), a dokonce byl zaznamenán trend k delšímu celkovému přežití ve skupině chlorambucilu (46 vs. 64 měsíců, p = 0,15). Z tohoto důvodu zůstává chlorambucil nadále uznávanou standardní léčbou pro nemocné s komorbiditami či ve vyšším věku.
Slibnou možností pro starší či komorbidní nemocné je použití kombinovaných fludarabinových režimů se sníženými dávkami chemoterapie – s cílem zachovat léčebnou účinnost při snížení toxicity. Pilotní projekty využívající nízkodávkovanou kombinaci FC se vyznačovaly velmi dobrou účinností a zejména přijatelnou toxicitou [50, 51]. Logickou možností je kombinace snížených dávek chemoterapie a monoklonální protilátky rituximabu. Výsledkem byl protokol FCR Lite, v němž je použita snížená dávka fludarabinu a cyklofosfamidu (F 20 mg/m2 i.v. den 1–3, C 150 mg/m2 i.v. den 1–3), zatímco dávka rituximabu je dvojnásobná (500 mg/m2 1. i 14. den cyklu). Pilotní výsledky u selektované skupiny 49 dosud neléčených, většinou mladších nemocných s převahou středních klinických stadií a v dobrém celkovém stavu jsou vynikající: ORR/CR bylo dosaženo ve 100/85 %; závažná neutropenie se vyskytla pouze v 12 % cyklů [52]. Nízkodávkovaný protokol FCR se standardní dávkou rituximabu využívá v současnosti probíhající projekt Q-Lite české CLL skupiny zaměřený na léčbu starších či komorbidních nemocných s CLL [53].
Léčba minimální reziduální nemoci
Minimální reziduální nemoc (MRN) je definována jako zbytková maligní populace zjistitelná pouze citlivými metodami (čtyřbarevná průtoková cytometrie s citlivostí až 10-4 či PCR s primery specifickými pro individuálního nemocného a citlivostí až 10-6). Při použití alemtuzumabu k léčbě MRN bylo v přelomové studii zjištěno, že nemocní, kteří dosáhli negativity MRN, měli nejen delší PFS, ale i OS [54]. Studie německé CLL skupiny CLL-4B pro nemocné, kteří dosáhli léčebné odpovědi po fludarabinu či FC v 1. linii, randomizovala pacienty mezi sledování a konsolidační léčbu alemtuzumabem v klasické dávce 30 mg 3krát týdně po dobu maximálně 12 týdnů. Studie musela být předčasně ukončena pro život ohrožující infekce u 7 z 11 nemocných ve skupině s alemtuzumabem. Většina nemocných v konsolidační skupině dosáhla eradikace minimální reziduální nemoci, což se projevilo ve významně delším PFS i po dlouhodobém sledování [55]. Velmi těžkou infekční toxicitu s pěti úmrtími na oportunní infekce zaznamenala studie Cancer and Leukemia Group B (CALGB), kdy po 2 měsících od indukční léčby kombinací fludarabin a rituximab (FR) byli nemocní konsolidováni podkožním podáním alemtuzumabu v dávce 30 mg 3krát týdně po dobu 6 týdnů [56]. Z těchto výsledků vyplývá nutnost dalšího hledání optimálního dávkování a načasování konsolidační léčby s cílem minimalizovat závažnou infekční toxicitu. Konsolidační léčba CLL je tudíž nadále považována za experimentální postup, a neměla by tedy být používána mimo klinické studie.
Léčba refrakterní CLL
Přes výbornou účinnost kombinovaných fludarabinových režimů nedosáhne zhruba 5–10 % nemocných léčebné odpovědi v 1. linii, další nemocní se stanou refrakterními na fludarabin při léčbě relapsu. Alemtuzumab u nemocných refrakterních na fludarabin dosahuje kolem 30–40 % léčebných odpovědí. Problém vyvstává u nemocného refrakterního na fludarabin i alemtuzumab či u nemocného s masivní lymfadenopatií, kde je účinnost alemtuzumabu zpravidla nízká. Navíc podstatná část těchto nemocných má porušenou signální dráhu proteinu p53 a s tím související chemorezistenci leukemických buněk na běžnou léčbu. Jedním z možných řešení je použití vysokodávkovaných kortikoidů, které podle testů in vitro působí nezávisle na dráze p53 [57]. Britští autoři podali kombinaci vysokodávkovaného methylprednisolonu (HDMP, 1000 mg/m2 i.v. 1.–5. den) s rituximabem (375 mg/m2 i.v. 1. den, opakování po 28 dnech) 14 těžce předléčeným nemocným, většinou s masivní lymfadenopatií [58]. Léčebná odpověď byla impozantní (93 %), dva nemocní dosáhli CR. Problémem však byla relativně krátká období do progrese (medián 7 měsíců) a velmi závažná infekční toxicita přes kombinovanou profylaxi (6 ze 14 nemocných mělo závažnou oportunní infekci během léčby). Protokol z Mayo Clinic zahrnoval stejnou dávku kortikoidů, avšak rituximab byl podáván každý týden (den 1, 8, 15 a 22 cyklu). Z 37 nemocných dosáhlo 78 % léčebné odpovědi; kompletní hematologická a klinická remise nastala u 22 % léčených. Medián PFS se pohyboval kolem 12 měsíců. Infekční toxicita však byla také závažná: celkem 29 % nemocných mělo infekční komplikaci, pět nemocných (14 %) zemřelo na infekční komplikaci během 1. měsíce léčby [59]. Skupina ze San Diega léčila 14 nemocných refrakterních na fludarabin třemi cykly kombinace methylprednisolon plus rituximab. Kortikoidy byly podávány v dávce 1 g/m2 i.v. v den 1–5, rituximab v dávce 375 mg/m2 týdně, cykly byly opakovány po 4 týdnech. Bylo dosaženo ORR/CT 93/36 %. Medián doby do progrese byl 15 měsíců a medián doby do další léčby 22 měsíců [60]. Quinn a kol. publikovali výsledky kombinace rituximab a vysokodávkované kortikoidy u 12 nemocných s relapsem CLL, z nichž 6 obdrželo klasickou dávku methylprednisolonu a 6 bylo léčeno dexamethasonem (R-Dex) v dávce 40 mg. Léčebné výsledky byly obdobné (ORR 5/6 u R-HDMP vs. 4/6 u R-Dex), ale toxicita byla výrazně nižší u dexamethasonu [61]. Obdobných výsledků dosáhli čeští autoři, kteří zároveň ukázali vynikající efekt kombinace R-HDMP či R-dexa na autoimunitní cytopenie [62]. Vysokodávkovaný dexamethason, jehož ekvivalentní dávka je mnohonásobně nižší než u HDMP, by tedy mohl být bezpečnější a stejně účinnou alternativou. Kombinace vysokodávkovaných kortikoidů a alemtuzumabu, tedy dvou látek nezávislých na signální dráze p53, byla dosud publikována u pilotní skupiny pěti nemocných s delecí 17p13, s celkovou odpovědí 100 % a dosažením kompletní remise ve 3 případech. Všichni nemocní nicméně opět zaznamenali významnou infekční komplikaci [63].
Nová léčiva
Bendamustin je molekula s kombinovanými vlastnostmi alkylační látky a purinového analoga [64], jejíž heterocyklický benzimidazolový kruh zřejmě zodpovídá za jedinečné protinádorové vlastnosti [65]. Není vlastně novým léčivem, vyvinut byl již v 60. letech 20. století v tehdejší Německé demokratické republice. Nové je však systematické použití u CLL. V mezinárodní studii fáze III bylo 305 nemocných s dosud neléčenou CLL randomizováno mezi terapii bendamustinem (100 mg/m2 i.v. den 1–2, opakování á 28 dní) a chlorambucilem (0,8 mg/kg den 1 a 15, každých 28 dní) [66]. Bendamustin prokázal významně vyšší OR/CR (68/30 % vs. 39/2 %) i PFS (21,7 vs. 9,3 měsíce) a na základě těchto výsledků byl v roce 2008 schválen americkou FDA pro léčbu CLL v 1. linii. Německá CLL skupina použila kombinaci bendamustin (70 mg/m2 i.v. den 1–2) plus rituximab (BR) u 81 nemocných s relapsem CLL a mediánem věku 67 let. ORR/CR bylo dosaženo v 77/15 %, závažná neutropenie se objevila pouze v 12 % cyklů [67]. Stejná kombinace s vyšší dávkou bendamustinu (90 mg/m2 i.v. den 1–2) byla použita u 117 neléčených nemocných s dosažením ORR/CR v 91/33 % a s nižší hematologickou toxicitou v porovnání s FCR (těžká neutropenie pouze v 7 % cyklů) [68]. Tyto nadějné výsledky jsou nyní ověřovány v randomizované studii CLL-10 (FCR vs. BR v 1. linii).
Monoklonální protilátky představují oblast, která v současné době hýbe světem hematoonkologie i solidních nádorů. Ofatumumab je plně lidská anti-CD20 monoklonální protilátka, která se váže na jiný epitop antigenu CD20 než rituximab. Dle výsledků experimentálních studií je ofatumumab účinnější vůči rituximabu v léčbě myších B-buněčných lymfomů a je schopen in vitro ničit nádorové buňky necitlivé na rituximab, stejně jako účinně likvidovat lymfocyty CLL s nízkou hustotou CD20 [69]. Ve studii fáze I/II u nemocných s relapsem CLL dosáhlo léčebné odpovědi při dávce 1krát 500 mg plus 3krát 2000 mg i.v. podávané 1krát týdně 50 % z 27 nemocných, s velmi dobrou snášenlivostí. Hlavní toxicita byla spojena s infuzí. Infekce se vyskytly u 51 % nemocných, z toho většina nezávažných [70]. Na základě těchto výsledků proběhla studie fáze III u nemocných s CLL refrakterních na fludarabin a zároveň refrakterních na alemtuzumab či nevhodných k léčbě alemtuzumabem pro masivní lymfadenopatii; dávkování je 1krát 300 mg plus 7krát 2000 mg i.v. 1krát týdně, poté 4krát 2000 mg i.v. 1krát měsíčně. Výsledky byly slibné i u takto prognosticky nepříznivé skupiny nemocných: ORR byla 51 % u nemocných refrakterních jak na fludarabin, tak na alemtuzumab a 44 % (včetně jedné CR) u refrakterních na fludarabin s masivní lymfadenopatií (a tedy nevhodných k léčbě alemtuzumabem); navíc řada nemocných dosáhla stabilizace onemocnění. Medián období do další léčby činil 9, resp. 8 měsíců; medián OS pak 14, resp. 15 měsíců. Nejčastější závažnou toxicitou byly podle očekávání infekce a hematologická toxicita [71]. Ofatumumab v kombinaci s FC byl podán u 61 neléčených nemocných v randomizované studii fáze II (dávka ofatumumabu 1krát 300 mg plus 5krát 500 mg vs. 1000 mg i.v. 1. den cyklu). Dle pilotních dat bylo dosaženo 32 %, resp. 50 % CR, avšak celkové odpovědi byly relativně nízké (77 %, resp. 73 %), zřejmě v důsledku významné části nemocných, kteří kvůli hematologické toxicitě museli časně ukončit léčbu [72].
Lumiliximab, chimérická anti-CD23 protilátka s lidskou konstantní částí a variabilní částí z makaka, byl použit v dávce 500 mg/m2 i.v. v kombinaci s FCR u relapsu CLL ve studii fáze II. Tato kombinace dosáhla zvýšení CR (48 % vs. 25 %) ve srovnání s historickými kontrolami léčenými FCR, bez vyšší toxicity [73].
Mikroprostředí kostní dřeně je logickým terčem pro cílenou léčbu, neboť u CLL podobně jako u mnohočetného myelomu hrají interakce maligních buněk se stromálními buňkami a endotelem zcela zásadní roli pro jejich přežití a odolnost vůči léčebným zásahům. Hlavním zástupcem preparátů ovlivňujících mikroprostředí u CLL je lenalidomid, strukturní analog thalidomidu. Byl zkoušen v monoterapii relapsu CLL ve dvou studiích fáze II s odlišným dávkováním. Chanan-Khan a kol. podávali lenalidomid celkem 45 nemocným v dávce 25 mg denně v 1.–21. den cyklu s opakováním po 28 dnech. Dosaženo bylo 47 % OR a 9 % CR; neutropenie a trombocytopenie byly časté – vyskytovaly se v 78 % [74]. Ferrajoli a kol. podávali lenalidomid 44 nemocným s relapsem CLL v kontinuální dávce 10 mg denně s možností eskalace, která však u většiny nemocných nebyla možná pro hematologickou toxicitu. OR/CR činila 32/7 %, včetně odpovědi v 31 % u nemocných s nepříznivými cytogenetickými aberacemi [75]. V roce 2008 byly zveřejněny dvě studie s lenalidomidem v léčbě 1. linie. Kanadská studie fáze I léčila 25 nemocných [76]. Vzhledem k úmrtí na sepsi a vzhledem k rozvoji syndromu rozpadu nádoru 3.–4.stupně byla úvodní dávka snížena z 25 mg na 2,5 mg s postupnou eskalací na 10 mg po dobu 3 týdnů s týdenní přestávkou. U tří čtvrtin nemocných došlo k rozvoji únavy, vzplanutí nádoru („tumor flare“), těžká neutropenie se vyskytla ve 43 %. ORR/CR činily 65/0 %. Skupina z Houstonu léčila 43 nemocných starších 65 let [77].
Lenalidomid byl podáván kontinuálně; medián podané dávky byl 5–10 mg. Těžká myelosuprese a vzplanutí nádoru se objevily ve 26 % a 44 %. Bylo dosaženo ORR/CR 54/0 %. Problémem lenalidomidu zůstává jednak závažná hematologická toxicita (neutropenie a trombocytopenie) a také bolestivé zvětšení uzlin („tumor flare“), pozorované u řady nemocných zejména s masivní lymfadenopatií v úvodu léčby. Optimální dávkování dosud není jasné.
Flavopiridol (alvocidib), polosyntetický flavonoid, působí jako inhibitor cyklin-dependentních kináz a účinkuje nezávisle na signální dráze proteinu p53; je proto potenciálně vhodným lékem pro refrakterní nemocné s delecí 17p. Přes velmi nadějné preklinické výsledky nebyla ve studii fáze I/II s použitím kontinuální 24hodinové nitrožilní infuze podávané každé 2 týdny pozorována žádná klinická aktivita [78]. Po rozsáhlé farmakokinetické analýze byl režim změněn na 30minutovou nasycovací dávku následovanou 4hodinovou infuzí, která byla opakována týdně po dobu 4 ze 6 týdnů; tato léčba již vykázala účinnost v podobě parciální odpovědi u 45 % z celkového počtu 42 nemocných, včetně nemocných s del 17p a 11q. Medián léčebné odpovědi byl 13 měsíců. Závažnou toxicitu flavopiridolu představuje hyperakutní syndrom rozpadu nádoru s nutností dialyzační léčby, který se vyskytl u 5 z 8 nemocných s leukocytózou s hladinami leukocytů vyššími než 200 x 109/l. Nemocní s hyperleukocytózou museli být z léčby tímto protokolem vyloučeni a u všech ostatních byla nutná masivní prehydratace, alkalizace moči, monitorace kalemie a další preventivní opatření [79].
Protein Bcl-2 hraje zásadní roli v řadě maligních nádorů. Exprese tohoto silného inhibitoru apoptózy je prokazatelně zvýšena u nemocných s CLL, což vede k nerovnováze mezi pro- a antiapoptotickými proteiny a takto k ochraně leukemických buněk před programovanou buněčnou smrtí [shrnuto v 80]. V současné době se zkouší několik preparátů zasahujících do signálních drah systému Bcl-2. Oblimersen je „antisense“ oligonukleotid, který se váže na mRNA pro Bcl-2 a tím blokuje jeho translaci. Ve studii fáze III byli nemocní s relabovanou/refrakterní CLL randomizováni mezi samotnou chemoterapii FC ve standardních dávkách či FC v kombinaci s oblimersenem v dávce 3 mg/kg/den podaným v 7denní nepřetržité nitrožilní infuzi (začínající 4 dny před chemoterapií). Z 241 nemocných byla CR/nPR významně vyšší (17 %) u nemocných ve skupině oblimersenu oproti skupině samotné FC (7 %). Dosažení CR/nPR korelovalo s prodloužením PFS a OS. Častou toxicitou oblimersenu je trombocytopenie. Syndrom uvolnění cytokinů či syndrom nádorového rozpadu byly pozorovány vzácně [81].
Závěr
V léčbě chronické lymfocytární leukemie jsme v posledních letech svědky doslova revolučních změn. Paliativní léčba alkylačními látkami byla u nemocných v dobrém stavu již nahrazena vysoce účinnými protokoly chemoimunoterapie, které jsou schopny dosáhnout u významné části nemocných kompletní hematologické a dokonce i molekulární remise. Protokol FCR je v současnosti jednoznačnou léčbou volby v 1. linii i v relapsu CLL u pacientů v dobrém stavu bez závažných komorbidit. Chlorambucil však zůstává nadále základem léčby významně komorbidních či starších nemocných. Situace je výrazně složitější v léčbě refrakterní choroby, kde si získávají místo vysokodávkované kortikoidy, ofatumumab a dále se zdokonaluje transplantační péče. Vývoj nových léčebných přístupů jednoznačně směřuje k cílené léčbě se zlepšením účinnosti 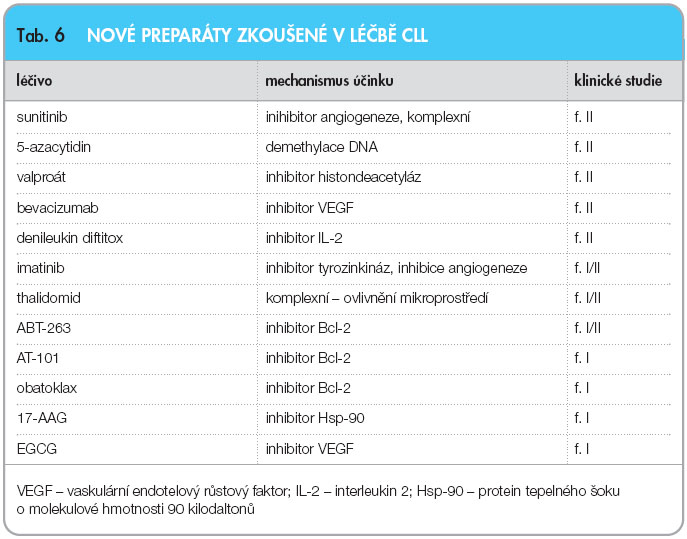 zejména současným použitím několika léků s odlišným mechanismem působení na maligní klon. Nové kombinace již známých léků (RFCM, FluCam) a stejně tak zcela nové preparáty (bendamustin, lenalidomid a další) dosáhly řady slibných výsledků, které jsou nyní testovány v rozsáhlých randomizovaných studiích. Dále probíhají pilotní studie zkoumající další účinné látky jako imatinib, sunitinib, sorafenib, valproát, 5-azacytidin a další (tab. 6), dosud známé z jiných oblastí hematologie či solidní onkologie [82]. Můžeme tedy s optimismem očekávat, že v blízké budoucnosti budeme mít k dispozici další účinná léčiva, která nám pomohou v úsilí o prodloužení celkového přežití a zlepšení kvality života nemocných s CLL.
zejména současným použitím několika léků s odlišným mechanismem působení na maligní klon. Nové kombinace již známých léků (RFCM, FluCam) a stejně tak zcela nové preparáty (bendamustin, lenalidomid a další) dosáhly řady slibných výsledků, které jsou nyní testovány v rozsáhlých randomizovaných studiích. Dále probíhají pilotní studie zkoumající další účinné látky jako imatinib, sunitinib, sorafenib, valproát, 5-azacytidin a další (tab. 6), dosud známé z jiných oblastí hematologie či solidní onkologie [82]. Můžeme tedy s optimismem očekávat, že v blízké budoucnosti budeme mít k dispozici další účinná léčiva, která nám pomohou v úsilí o prodloužení celkového přežití a zlepšení kvality života nemocných s CLL.
Poděkování a prohlášení o konfliktu zájmů: Autor dostává podporu od těchto firem: Roche – cestovní granty, honoráře za přednáškovou činnost. Bayer-Schering Pharma – cestovní granty, honoráře za přednáškovou činnost. Genzyme – cestovní granty. GlaxoSmithKline – honoráře za poradenství a přednáškovou činnost. Práce byla podpořena výzkumným záměrem MZO 00179906 Ministerstva zdravotnictví České republiky.
Seznam použité literatury
- [1] Hallek M, Cheson BD, Catovsky D, et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic leukemia updating the National Cancer Institute-Working Group 1996 guidelines. Blood 2008; 111: 5446–5456.
- [2] National Cancer Institute: SEER Cancer Statistics Review. Dostupné na http://seer. cancer.gov. Navštíveno 10. 2. 2010.
- [3] Diehl LF, Hynds-Karnell L, Menck HR. The national cancer data base report on age, gender, treatment and outcomes of patients with chronic lymphocytic leukemia. Cancer 1999; 86: 2684–2692.
- [4] Molica S, Levato D. What is changing in the natural history of chronic lymphocytic leukemia? Haematologica 2001; 86: 8–12
- [5] Ries LAG, Eisner MP, Kosary CL, et al. SEER Cancer Statistics Review, 1975–2000. National Cancer Institute, Bethesda, MD. Dostupné na http://seer.cancer.gov. Navštíveno 10. 2. 2010.
- [6] Dores GM, Anderson WF, Curtis RE, et al. Chronic lymphocytic leukaemia and small lymphocytic lymphoma: overview of the descriptive epidemiology. Br J Haematol 2007; 139: 809–819.
- [7] Schimmer AD, Munk-Pedersen I, Minden MD, Reed JC. Bcl-2 and apoptosis in chronic lymphocytic leukemia. Curr Treat Options Oncol 2003; 4: 211–218.
- [8] Messmer BT, Messmer D, Allen SL, et al. In vivo measurements document the dynamic cellular kinetics of chronic lymphocytic leukemia B cells. J Clin Invest 2005; 115: 755–764.
- [9] Ghia P, Chiorazzi N, Stamatopoulos K. Microenvironmental influences in chronic lymphocytic leukaemia: the role of antigen stimulation. J Intern Med 2008; 264: 549–562.
- [10] Richardson SJ, Matthews C, Catherwood MA, et al. ZAP-70 expression is associated with enhanced ability to respond to migratory and survival signals in B-cell chronic lymphocytic leukemia (BCLL). Blood 2006; 107: 3584–3592.
- [11] Rosati S, Kluin PM. Chronic lymphocytic leukaemia: a review of the immuno-architecture. Curr Top Microbiol Immunol 2005; 294: 91–107.
- [12] Soma LA, Craig FE, Swerdlow SH. The proliferation center microenvironment and prognostic markers in chronic lymphocytic leukemia/small lymphocytic lymphoma. Hum Pathol 2006; 37: 152–159.
- [13] Caligaris-Cappio F, Ghia P. Novel insights in chronic lymphocytic leukemia: are we getting closer to understanding the pathogenesis of the disease? J Clin Oncol 2008; 26: 4497–4503.
- [14] Muller-Hermelink HK, Montserrat E, Catovsky D, Harris NL. Chronic lymphocytic leukemia/small lymphocytic lymphoma. In: Jaffe ES, Harris NL, Stein H, Vardiman JW, eds. World Health Organization Classification of Tumours: Pathology and Genetics of Tumours of Haematopoietic and Lymphoid Tissues. Lyon, France: IARC Press; 2001: 127–130.
- [15] Rai KR, Sawitsky A, Cronkite EP, et al. Clinical staging of chronic lymphocytic leukemia. Blood 1975; 46: 219–234.
- [16] Binet JL, Auquier A, Dighiero G, et al. A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis. Cancer 1981;48: 198–206.
- [17] Damle RN, Wasil T, Fais F, et al. Ig V gene mutation status and CD38 expression as novel prognostic indicators in chronic lymphocytic leukemia. Blood 1999; 94: 1840–1847.
- [18] Hamblin TJ, Orchard JA, Ibbotson RE, et al. CD38 expression and immunoglobulin variable region mutations are independent prognostic variables in chronic lymphocytic leukemia, but CD38 expression may vary during the course of the disease. Blood 2002; 99: 1023–1099.
- [19] Dohner H, Stilgenbauer S, Benner A, et al. Genomic aberrations and survival in chronic lymphocytic leukemia. N Engl J Med 2000; 343: 1910–1916.
- [20] CLL Trialists’ Collaborative Group. Chemotherapeutic options in chronic lymphocytic leukemia: a meta-analysis of the randomized trials. J Natl Cancer Inst 1999; 91: 861–868.
- [21] Dighiero G, Maloum K, Desablens B, et al. Chlorambucil in indolent chronic lymphocytic leukemia. French Cooperative Group on Chronic Lymphocytic Leukemia. N Engl J Med 1998; 338: 1506–1514.
- [22] Pettitt AR. Mechanism of action of purine analogues in chronic lymphocytic leukaemia. Br J Haematol 2003; 121: 692–702.
- [23] Steurer M, Pall G, Richards S, et al. Purine antagonists for chronic lymphocytic leukaemia. Cochrane Database Syst Rev 2006; 3: CD004270.
- [24] Robak T. Recent progress in the management of chronic lymphocytic leukemia. Cancer Treat Rev 2007; 33: 710–728.
- [25] Catovsky D, Richards S, Matutes E, et al.; UK National Cancer Research Institute (NCRI) Haematological Oncology Clinical Studies Group; NCRI Chronic Lymphocytic Leukaemia Working Group. Assessment of fludarabine plus cyclophosphamide for patients with chronic lymphocytic leukaemia (the LRF CLL4 Trial): a randomised controlled trial. Lancet 2007; 370: 230–239.
- [26] Eichhorst BF, Busch R, Hopfinger G, et al.; German CLL Study Group. Fludarabine plus cyclophosphamide versus fludarabine alone in first-line therapy of younger patients with chronic lymphocytic leukemia. Blood 2006; 107: 885–891.
- [27] Flinn IW, Neuberg DS, Grever MR, et al. Phase III trial of fludarabine plus cyclophosphamide compared with fludarabine for patients with previously untreated chronic lymphocytic leukemia: US Intergroup Trial E2997. J Clin Oncol 2007; 25: 793–798.
- [28] Plosker GL, Figgitt DP. Rituximab: a review of its use in non-Hodgkin’s lymphoma and chronic lymphocytic leukaemia. Drugs 2003; 63: 803–843.
- [29] Cheson BD. Monoclonal antibody therapy of chronic lymphocytic leukemia. Cancer Immunol Immunother 2006; 55: 188–196.
- [30] Keating MJ, O’Brien S, Albitar M, et al. Early results of a chemoimmunotherapy regimen of fludarabine, cyclophosphamide, and rituximab as initial therapy for chronic lymphocytic leukemia. J Clin Oncol 2005; 23: 4079–4088.
- [30] Wierda W, O’Brien S, Wen S, et al. Chemoimmunotherapy with fludarabine, cyclophosphamide, and rituximab for relapsed and refractory chronic lymphocytic leukemia. J Clin Oncol 2005; 23: 4070–4078.
- [32] Hallek M, Fingerle-Rowson G, Fink AM, et al. Immunochemotherapy with Fludarabine (F), Cyclophosphamide (C), and Rituximab (R) (FCR) Versus Fludarabine and Cyclophosphamide (FC) Improves Response Rates and Progression-Free Survival (PFS) of Previously Untreated Patients (pts) with Advanced Chronic Lymphocytic Leukemia (CLL). Blood (ASH Annual Meeting Abstracts) 2008; 112: Abstract 325.
- [33] Hallek M, Fingerle-Rowson G, Fink AM, et al. First-Line Treatment with Fludarabine (F), Cyclophosphamide (C), and Rituximab (R) (FCR) Improves Overall Survival (OS) in Previously Untreated Patients (pts) with Advanced Chronic Lymphocytic Leukemia (CLL): Results of a Randomized Phase III Trial On Behalf of An International Group of Investigators and the German CLL Study Group. Blood (ASH Annual Meeting Abstracts) 2009; 114: Abstract 535.
- [34] Robak T, Moiseev SI, Dmoszynska A, et al. Rituximab, Fludarabine, and Cyclophosphamide (R-FC) Prolongs Progression Free Survival in Relapsed or Refractory Chronic Lymphocytic Leukemia (CLL) Compared with FC Alone: Final Results from the International Randomized Phase III REACH Trial. Blood (ASH Annual Meeting Abstracts) 2008; 112: Abstract 1.
- [35] Keating MJ, Flinn I, Jain V, et al. Therapeutic role of alemtuzumab (Campath-1H) in patients who have failed fludarabine: results of a large international study. Blood 2002; 99: 3554–3561.
- [36] Hillmen P, Skotnicki AB, Robak T, et al. Alemtuzumab compared with chlorambucil as first-line therapy for chronic lymphocytic leukemia. J Clin Oncol 2007; 25: 5616–5623.
- [37] Dreger P, Corradini P, Kimby E, et al. Indications for allogeneic stem cell transplantation in chronic lymphocytic leukemia: the EBMT transplant consensus. Leukemia 2007; 21: 12–17.
- [38] Michallet M, Archimbaud E, Bandini G, et al. HLA-identical sibling bone marrow transplantation in younger patients with chronic lymphocytic leukemia. European Group for Blood and Marrow Transplantation and the International Bone Marrow Transplant Registry. Ann Intern Med 1996; 124: 311–315.
- [39] Gribben JG. Stem cell transplantation in chronic lymphocytic leukemia. Biol Blood Marrow Transplant 2009; 15 (1 Suppl.): 53–58.
- [40] Wierda WG, O’Brien S, Ferrajoli A, et al. Salvage therapy with combined cyclophosphamide (C), fludarabine (F), alemtuzumab (A), and rituximab (R) (CFAR) for heavily pre-treated patients with CLL. Blood 2005; 106: (Abstract 719).
- [41] Wierda, WG, O’Brien S, Ferrajoli A, et al. Combined Cyclophosphamide, Fludarabine, Alemtuzumab, and Rituximab (CFAR), an Active Frontline Regimen for High-Risk Patients with CLL. Blood 2007; 110: (Abstract 628).
- [42] Elter T, Borchmann P, Schulz H, et al. Fludarabine in combination with alemtuzumab is effective and feasible in patients with relapsed or refractory B-cell chronic lymphocytic leukemia: results of a phase II trial. J Clin Oncol 2005; 23: 7024–7031.
- [43] Montillo M, Miqueleiz S, Tedeschi A, et al. Combined Fludarabine, Cyclophosphamide, and Alemtuzumab (FCC), an Active Regimen for Treated Patients with Chronic Lymphocytic Leukemia (CLL). Blood 2007; 110: 3133a.
- [44] Elter T, James R, Wendtner CM, et al. Treatment of patients with relapsed/refractory CLL using a combination of fludarabine, cyclophosphamide and alemtuzumab: First safety analysis of the CLL2L trial of the German CLL Study Group. J Clin Oncol 2008; 26: 7053a.
- [45] Bosch F, Ferrer A, Villamor N, et al. Fludarabine, cyclophosphamide, and mitoxantrone as initial therapy of chronic lymphocytic leukemia: high response rate and disease eradication. Clin Cancer Res 2008; 14: 155–161.
- [46] Bosch F, Abrisqueta P, Villamor N, et al. Rituximab, Fludarabine, Cyclophosphamide, and Mitoxantrone (R-FCM) Is a Highly Active Chemoimmunotherapy Regimen for Chronic Lymphocytic Leukemia. Blood (ASH Annual Meeting Abstracts) 2008 112: Abstract 2097.
- [47] Hillmen P, Pocock C, Cohenz D, et al. NCRI CLL201 Trial: a randomized phase II trial of fludarabine, cyclophosphamide and mitoxantrone (FCM) with or without rituximab in previously treated CLL. Br J Haematol 2008; 141 (Suppl. 1): 119 (Abstract 324).
- [48] Shvidel L, Shtalrid M, Bairey O, et al; Israeli Study Group on CLL. Conventional dose fludarabine-based regimens are effective but have excessive toxicity in elderly patients with refractory chronic lymphocytic leukemia. Leuk Lymphoma 2003; 44: 1947–1950.
- [49] Eichhorst BF, Busch R, Stilgenbauer S, et al. First line therapy with fludarabine compared to chlorambucil does not result in a major benefit for elderly patients with advanced chronic lymphocytic leukemia. Blood 2009; 114: 3382–3391.
- [50] Marotta G, Bigazzi C, Lenoci M, et al. Low-dose fludarabine and cyclophosphamide in elderly patients with B-cell chronic lymphocytic leukemia refractory to conventional therapy. Haematologica 2000; 85: 1268–1270.
- [51] Forconi F, Fabbri A, Lenoci M, et al. Low-dose oral fludarabine plus cyclophosphamide in elderly patients with untreated and relapsed or refractory chronic lymphocytic Leukaemia. Hematol Oncol 2008; 26: 247–251.
- [52] Foon KA, Boyiadzis M, Land SR, et al. Chemoimmunotherapy with low-dose fludarabine and cyclophosphamide and high dose rituximab in previously untreated patients with chronic lymphocytic leukemia. J Clin Oncol 2009; 27: 498–503.
- [53] http://www.cll.cz/studie-granty-projekty/. Navštíveno 10. 2. 2010.
- [54] Moreton P, Kennedy B, Lucas G, et al. Eradication of minimal residual disease in B-cell chronic lymphocytic leukemia after alemtuzumab therapy is associated with prolonged survival. J Clin Oncol 2005; 23 : 2971–2979.
- [55] Schweighofer CD, Ritgen M, Eichhorst BF, et al. Consolidation with alemtuzumab improves progression-free survival in patients with chronic lymphocytic leukaemia (CLL) in first remission – long-term follow-up of a randomized phase III trial of the German CLL Study Group. Br J Haematol 2009; 144: 95–98.
- [56] Lin TS, Donohue KA, Lucas MS, et al. Consolidation Therapy with Subcutaneous (SC) Alemtuzumab Results in Severe Infectious Toxicity in Previously Untreated CLL Patients Who Achieve a Complete Response (CR) after Fludarabine and Rituximab (FR) Induction Therapy: Interim Safety Analysis of the CALGB Study 10101. Blood 2007; 110: (Abstract 755).
- [57] Pettitt RA. Glucocorticoid-based combination therapy for chronic lymphotic leukemia: new tricks for an old dog. Leukemia and Lymphoma 2008; 49: 1843–1845.
- [58] Dungarwalla M, Evans SO, Riley U, et al. High dose methylprednisolone and rituximab is an effective therapy in advanced refractory chronic lymphocytic leukemia resistant to fludarabine therapy. Haematologica 2008; 93: 475–476.
- [59] Bowen DA, Call TG, Jenkins GD, et al. Methylprednisolone-rituximab is an effective salvage therapy for patients with relapsed chronic lymphocytic leukemia including those with unfavorable cytogenetic features. Leuk Lymphoma 2007; 48: 2412–2417.
- [60] Castro JE, Sandoval-Sus JD, Bole J, et al. Rituximab in combination with high-dose methylprednisolone for the treatment of fludarabine refractory high-risk chronic lymphocytic leukemia. Leukemia 2008; 22: 2048–2053.
- [61] Quinn J, Sajir M, Chipperfield K, et al. Efficacy of rituximab in combination with steroids in refractory chronic lymphocytic leukaemia. Leuk Lymphoma 2008; 49: 1995–1998.
- [62] Doubek M, Smolej L, Panovska A, et al. Rituximab in combination with dexamethasone or high-dose methylprednisolone in refractory chronic lymphocytic leukemia. XIII International Work-shop on Chronic Lymphocytic Leukemia; Spain, 16–18 October 2009. Haematologica 2009; 94(s3): Abstract 7.3.
- [63] Pettitt AR, Matutes E, Oscier D. Alemtuzumab in combination with high-dose methylprednisolone is a logical, feasible and highly active therapeutic regimen in chronic lymphocytic leukaemia patients with p53 defects. Leukemia 2006; 20: 1441–1445.
- [64] Ozegowski W, Krebs D. IMET 3393, (-[1-methyl-5-bis-(-chloroethyl)-amino-benzimidazolyl-(2)]-butyric) acid hydrochloride, a new cytostatic agent from among the series of benzimidazole mustard compounds. Zbl Pharm1971; 110: 1013–1019.
- [65] Hartmann M, Zimmer C. Investigation of cross-link formation in DNA by the alkylating cytostatic IMET 3106, 3393 and 3943. Biochim Biophys Acta 1972; 287: 386–389.
- [66] Knauf WU, Lissichkov T, Aldaoud A, et al. Bendamustine Versus Chlorambucil in Treatment-Naive Patients with B-Cell Chronic Lymphocytic Leukemia (B-CLL): Results of an International Phase III Study. Blood 2007; 110: (Abstract 2043).
- [67] Fischer K, Stilgenbauer S, Schweighofer CD, et al. Bendamustine in Combination with Rituximab (BR) for Patients with Relapsed Chronic Lymphocytic Leukemia (CLL): A Multicentre Phase II Trial of the German CLL Study Group (GCLLSG). Blood (ASH Annual Meeting Abstracts) 2008 112: Abstract 330.
- [68] Fischer K, Cramer P, Stilgenbauer S, et al. Bendamustine Combined with Rituximab (BR) in First-Line Therapy of Advanced CLL: A Multicenter Phase II Trial of the German CLL Study Group (GCLLSG). Blood (ASH Annual Meeting Abstracts) 2009; 114: Abstract 205.
- [69] Teeling JL, French RR, Cragg MS, et al. Characterization of new human CD20 monoclonal antibodies with potent cytolytic activity against non-Hodgkin lymphomas. Blood 2004; 104:1 793–800.
- [70] Coiffier B, Lepretre S, Pedersen LM, et al. Safety and efficacy of ofatumumab, a fully human monoclonal anti-CD20 antibody, in patients with relapsed or refractory B-cell chronic lymphocytic leukemia: a phase 1-2 study. Blood 2008; 111: 1094–100.
- [71] Osterborg A, Kipps T, Mayer, J et al. Ofatumumab (HuMax-CD20), a Novel CD20 Monoclonal Antibody, Is An Active Treatment for Patients with CLL Refractory to Both Fludarabine and Alemtuzumab or Bulky Fludarabine-Refractory Disease: Results from the Planned Interim Analysis of An International Pivotal Trial. Blood (ASH Annual Meeting Abstracts) 2008; 112: Abstract 328.
- [72] Wierda WG, Kipps TJ, Durig J, et al. Ofatumumab combined with fludarabine and cyclophosphamide (O-FC) shows high activity in patients with previously untreated chronic lymphocytic leukemia (CLL): results from a randomized, multicenter, international, two-dose, parallel group, Phase II trial. Blood (ASH Annual Meeting Abstracts) 2009; 114: Abstract 1725.
- [73] Byrd JC, Kipps TJ, Flinn IW, et al. Phase 1/2 study of lumiliximab combined with fludarabine, cyclophosphamide, and rituximab in patients with relapsed or refractory chronic lymphocytic leukemia. Blood 2009 (ePub ahead of print).
- [74] Chanan-Khan A, Miller KC, Musial L, et al. Clinical efficacy of lenalidomide in patients with relapsed or refractory chronic lymphocytic leukemia: results of a phase II study. J Clin Oncol 2006; 24: 5343–5349.
- [75] Ferrajoli A, Lee BN, Schlette EJ, et al. Lenalidomide induces complete and partial remissions in patients with relapsed and refractory chronic lymphocytic leukemia. Blood 2008; 111: 5291–5297.
- [76] Chen C, Paul H, Xu W, et al. A phase II study of lenalidomide in previously untreated, symptomatic chronic lymphocytic leukemia (CLL). Blood (ASH Annual Meeting Abstracts) 2008; 112: 23 (Abstract 44).
- [77] Ferrajoli A, O’Brien S, Wierda W, et al. Lenalidomide as initial treatment of elderly patients with chronic lymphocytic leukemia (CLL). Blood (ASH Annual Meeting Abstracts) 2008; 112: 23 (Abstract 45).
- [78] Flinn IW, Byrd JC, Bartlett N, et al. Flavopiridol administered as a 24-hour continuous infusion in chronic lymphocytic leukemia lacks clinical activity. Leuk Res 2005; 29: 1253–1257.
- [79] Byrd JC, Lin TS, Dalton JT, et al. Flavopiridol administered using a pharmacologically derived schedule is associated with marked clinical efficacy in refractory, genetically high-risk chronic lymphocytic leukemia. Blood 2007; 109: 399–404.
- [80] Reed JC. Bcl-2-family proteins and hematologic malignancies: history and future prospects. Blood 2008; 111: 3322–3330.
- [81] O’Brien S, Moore JO, Boyd TE, et al. Randomized phase III trial of fludarabine plus cyclophosphamide with or without oblimersen sodium (Bcl-2 antisense) in patients with relapsed or refractory chronic lymphocytic leukemia. J Clin Oncol 2007; 25: 1114–1120.
- [82] http://www.clinicaltrials.gov. Navštíveno 10. 2. 2010.