Současné možnosti léčby diabetické senzomotorické neuropatie
Diabetická neuropatie je častou komplikací u diabetiků. Její léčba zasluhuje pozornost jak ze strany lékaře, tak pacienta. Měla by být vždy komplexní. Lze ji rozdělit na všeobecná a specifická opatření. Hlavní důraz spočívá na zajištění co nejdokonalejší kompenzace diabetu. Specifické postupy zahrnují léčbu symptomatickou, paliativní a podpůrnou a směřují především k odstranění subjektivních obtíží. Léčba vycházející ze znalostí etiopatogeneze diabetické neuropatie nenalezla dosud výraznější uplatnění.
Úvod
Diabetická neuropatie (DN) je podle mezinárodně uznávané definice charakterizována jako postižení periferních somatických a vegetativních nervů u pacientů s onemocněním diabetes mellitus (DM), které se projevuje objektivními a/nebo subjektivními příznaky a jsou vyloučeny jiné příčiny polyneuropatie [1, 2]. Subjektivní příznaky, zvl. neuropatické bolesti, uvádí jen 15–20 % diabetiků (13–26 % dle [3], 15–16 % dle [4]). Většina pacientů obtíže nemá, i když u nich neuropatie dosáhla již závažného stupně [5].
Diabetická neuropatie zahrnuje celou řadu klinických obrazů postižení periferního nervového systému. Patří sem nejčastěji symetrická distální senzitivně-motorická polyneuropatie s postižením převážně silných vláken, akutní bolestivá neuropatie postihující tenká vlákna, formy smíšené, fokální a multifokální neuropatie zahrnující parézy mozkových nervů, proximální motorickou neuropatii a thorakoabdominální neuropatii. Je třeba zdůraznit potřebu včasné diagnostiky DN, aby mohla být zahájena komplexní léčba [6].
Kompenzace diabetu
Řada klinických, epidemiologických, elektrofyziologických a experimentálních studií věnovaných diabetu dokazuje, že poruchy metabolismu v důsledku nedostatku inzulinu nebo hyperglykemie jsou hlavními momenty v patogenezi diabetické neuropatie u člověka. Prospektivními studiemi je pak doloženo, že při zlepšené kompenzaci diabetu může být příznivě ovlivněn průběh orgánových komplikací včetně diabetické neuropatie, a to zvláště jejich časných stadií [7, 8].
Proto prvním krokem v léčbě pacientů s diabetickou polyneuropatií je snaha o dosažení optimální kompenzace diabetu. Nejde však jen o optimalizaci glykemie nalačno, ale také o vyvarování se příliš velkých výkyvů glykemie po jídle a během dne [9]. Léčebná opatření, která by měla zlepšit kompenzaci DM, pak záležejí na tom, o jaký typ diabetu jde a jaký léčebný postup je nejvhodnější. V případě diabetu 1. typu jsou namístě intenzifikované inzulinové režimy, u DM 2. typu užívání per-orálních antidiabetik, případně i jejich podávání v kombinaci s inzulinem.
Příznivý účinek úpravy metabolismu glukózy na periferní diabetickou neuropatii potvrzují i nálezy u nemocných po úspěšné kombinované transplantaci pankreatu a ledviny. Ke zmírnění neuropatických obtíží, ale i ke zlepšení objektivního nálezu může dojít i u těžších stupňů polyneuropatie. Na tomto zlepšení se podílí jak odstranění uremie v důsledku funkce ledvinného štěpu, tak dlouhodobá úprava metabolismu glukózy v důsledku funkce štěpu pankreatu [10].
Léčba vycházející z patogenetických poznatků
Řada prací zaměřených na léčbu DN se zabývá možnostmi léčby, jež by vycházela z patogenetických poznatků [1, 11]. Mezi první látky patřily inhibitory aldózo-reduktázy (ARI). Jejich předpokládaný účinek je založen na pozorování zvýšeného metabolismu polyolů u zvířat s experimentálně navozeným diabetem. Tyto léky by měly zasahovat do metabolických pochodů, v nichž prvním článkem, který spustí celou řadu patologických biochemických mechanismů, je přeměna glukózy na sorbitol působením enzymu aldózoreduktázy. Z mnohých studií, které proběhly, lze uzavřít, že příznivé účinky ARI se projevily tam, kde metabolická porucha ještě nevedla k těžším strukturálním změnám periferních nervů [12]. Patogeneze DN je však příliš složitá, aby ovlivnění jen jednoho z možných patogenetických pochodů vedlo k alespoň částečné úpravě funkčních či strukturálních poruch periferních nervů. V České republice nebyly ARI podávány ani zkoušeny, ve světě se užívají jen v několika málo zemích, v USA registrovány nejsou [11].
V patogenezi DN hraje významnou roli oxidativní stres, jehož důsledky vedou k endoneurální hypoxii s poruchou funkce nervových vláken. V posledním desetiletí bylo publikováno několik studií, které se zabývaly příznivým účinkem kyseliny alfa-li-poové na průběh periferní i autonomní diabetické neuropatie [3,13–16]. Kyselina alfa-lipoová je antioxidační látka, která se v Německu podává jako léčba u symp-tomatické DN již více než 40 let. Kyselina alfa-lipoová je účinným „zametačem“ volných kyslíkových radikálů. Léčba se zahajuje desetidenním, eventuálně třítýdenním podáváním v intravenózní infuzi s navazující tříměsíční perorální terapií. V multicentrických randomizovaných studiích s různě dlouhou dobou podávání léku se prokázalo především subjektivní zmírnění neuropatických příznaků. Dobrá snášenlivost léku byla pozorována ve všech studiích. V těchto klinických sledováních byli zařaze-ni jen diabetici 2. typu [3, 13]. Naše zkušenosti s podáváním kyseliny alfa-lipoové jsou rovněž příznivé. I u těžších polyneuropatií pozorujeme zpravidla významné zmírnění subjektivních obtíží. Objektivní neurologický, případně elektromyografický nález však zůstává beze změny.
Dalšími potenciálními látkami, které byly zkoušeny v léčbě DN, jsou aminogua-nidin, N-acetyl-L-karnitin, nervový růstový faktor, kyselina gama-linolenová (GLA) a nejnověji ruboxistaurin (inhibitor proteinkinázy C subtypu beta). Zatím však žádná z těchto látek nebyla uvedena jako lék do rutinní klinické praxe [11, 17].
Léčba bolestí u diabetické neuropatie
Léčba neuropatických bolestí a jiných nepříjemných subjektivních příznaků je někdy velmi svízelná a zasluhuje ze strany lékaře i pacienta velkou trpělivost. Při léčbě neuropatických bolestí se používá řada různých léků, avšak jednoznačně účinná léčba subjektivních neuropatických příznaků chybí. Ovlivnění bolestivých příznaků běžnými analgetiky (acylpyrin, paracetamol), případně léky typu nesteroidních antirevmatik (ibuprofen, indometacin), bývá zpravidla málo účinné a často je provázeno i závažnými nežádoucími účinky [18], zvláště u diabetiků s postižením ledvin.
Více se osvědčilo podávání antidepresiv, která mají i analgetické účinky a ovlivňují řadu biochemických pochodů, jako je blokáda zpětného vychytávání noradrenalinu a 5-hydroxytryptaminu, přímý a nepřímý účinek na opioidní receptory, inhibice hista-minových, cholinergních, 5-hydroxytryptaminových a N-methyl-D-aspartátových (NMDA) receptorů a iontových kanálů [19].
Nejdéle jsou z této skupiny léků používána tricyklická antidepresiva (TCA) – ami-triptylin, nortriptylin a imipramin, která jsou doposud většinou autorů považována u neuropatických bolestí za léky první volby. Jejich nevýhodou jsou však nežádoucí účinky především anticholinergní, jako je obstipace, sucho v ústech, retence moči, dále ortostatická hypotenze a srdeční arytmie. Tyto nežádoucí účinky by měly být méně vyjádřeny u nortriptylinu než u ami-triptylinu. TCA jsou kontraindikována u převodních poruch srdečních, u nemocných, kteří v posledních 6 měsících prodělali infarkt myokardu, a u pacientů s glaukomem s uzavřeným úhlem. Nežádoucí účinky jsou zvláště závažné u diabetiků vyššího věku, kteří mohou navíc trpět poruchami rovnováhy a zhoršením kognitivních funkcí. Pacienti ve věku nad 40 let by před zahájením léčby měli být vyšetřeni elektrokardiograficky. Při podávání léků tlumících neuropatickou bolest je nutno dodržovat určité zásady a postupy. V případě podávání TCA je vždy třeba začít s malými dávkami na noc (10–25 mg amitriptylinu) a zvyšovat je jen velmi pozvolna, zpravidla o 25 mg po týdnu, až do dosažení účinku nebo do nástupu nežádoucích projevů. Dávka 150 mg/den by neměla být překročena. Obvyklou chybou léčby bývá příliš rychlé zvyšování dávek a předčasné vynechání léku před dosažením účinné dávky [20, 21].
Pokud jsou TCA kontraindikována, je možno přistoupit k podávání selektivních inhibitorů zpětného vychytávání serotoninu (SSRI) – citalopramu, fluoxetinu, paroxetinu, v léčbě neuropatické bolesti však nejsou tak účinné jako TCA. Nejsou proto vhodné jako monoterapie. Jejich výhodou jsou však méně vyjádřené vedlejší účinky.
Z dalších antidepresiv se u diabetiků s bolestivou neuropatií osvědčily inhibitory zpětného vychytávání serotoninu a nor-adrenalinu duloxetin a venlafaxin. Léčba duloxetinem je však zvláště na počátku provázena řadou nežádoucích účinků (nauzea, ospalost, závratě, zácpa), nezpůsobuje však (na rozdíl od gabapentinu a pregabalinu) přírůstek hmotnosti. Nežádoucím účinkům by se patrně dalo předejít, pokud by počáteční dávka byla 30 mg denně, což však není možné, protože v České republice jsou k dispozici pouze 60mg tablety. Výhodou venlafaxinu je chybění vedlejších anticholinergních účinků [21]. Podávání antidepresiv u diabetiků s neuropatií je odůvodněné i proto, že je známo, že tito pacienti často trpí depresemi [11, 22, 23].
Dlouhou dobu byla v léčbě bolestí u DN používána antikonvulziva fenytoin a karbamazepin, působící hlavně u bolestí
neuralgického typu. Tyto léky však také mohou mít výrazné nežádoucí účinky (závratě, psychický útlum, mozečkové příznaky), především při podávání vyšších dávek. Fenytoin však u diabetiků suprimuje sekreci inzulinu a může uspíšit rozvoj hyperosmolárního kómatu [11]. Navíc při dlouhodobém podávání může být sám příčinou neuropatie (uvádí se asi v 10 %), v současnosti již nelze jeho užívání u diabetiků v žádném případě doporučit. Při léčbě karbamazepinem je třeba zahájit léčbu nízkými dávkami – 100 mg podávaných na noc – s postupným zvyšováním dle účinku. Vždy je při této léčbě nutné sledovat krevní obraz a jaterní funkce. Někteří autoři postrádají dostatek důkazů pro jeho účinnost u neuropatické bolesti [15].
V posledním desetiletí byly u bolestivých neuropatií opakovaně publikovány velmi dobré zkušenosti s podáváním antikonvulziva gabapentinu. Jedním z jeho velmi významných farmakologických účinků je ovlivnění napěťově závislých kalciových kanálů s inhibičním účinkem v postsynap-tických neuronech zadních rohů míšních [24]. Studie s podáváním gabapentinu ukázaly nejen příznivé ovlivnění neuropatických příznaků, ale zdůrazňovaly i jeho dobrou snášenlivost, minimum nežádoucích účinků (ospalost, závratě, ataxie) a lékových interakcí. Začíná se s dávkou 300 mg večer a dávku lze postupně navyšovat až na 900 mg denně rozdělených do 3 dávek, což je zpravidla dostačující [18]. Jde o dávku podstatně nižší, než jaká bývá obvykle doporučována (až 1800–2400 mg denně). U nemocných s postižením ledvin je nutno dávky gabapentinu upravit. Velmi dobré klinické zkušenosti jsou též s podáváním pregabalinu v dávce 75 mg 2krát denně s možným postupným zvyšováním dávky až do 600 mg denně [24]. Osvědčila se i kombinace malé dávky TCA a gabapentinu na noc [4].
Podávání dalších antikonvulziv, jako je lamotrigin, valproát, topiramát, tiagabin a levetiracetam, není u bolestivé DN běžnou klinickou praxí a opírá se jen o několik málo studií [24].
Někdy přispěje ke zmírnění bolestí i agonista endogenních opiátových receptorů tramadol. Z dalších opioidů jsou také dobré zkušenosti s oxykodonem. Tyto léky lze přidat i k původně podávané léčbě, pokud není dostatečně účinná [16].
Jako lék druhé volby, jestliže selhalo užívání antidepresiv a antikonvulziv, je možno u bolestivé DN podat klonidin, což je a2-adrenergní agonista, jehož účinky spočívají ve stimulaci inhibiční bulbospinální dráhy bolesti, jejímž transmiterem je nor-adrenalin. Podává se v dávce 0,1 mg večer. Pacient musí být upozorněn na možné nežádoucí účinky – především na hypotenzi (jde o účinné antihypertenzivum), útlum a sucho v ústech. Je lépe tolerován mladšími pa-cienty.
Podávání opiátů u diabetiků s bolestivou neuropatií je zmiňováno spíše ojediněle a mělo by být vyhrazeno jen pro krajní případy zcela neúspěšných ostatních léčebných postupů.
Pro porovnání účinnosti jednotlivých léků podávaných u bolestivé neuropatie je někdy používán ukazatel Number Needed to Treat (NNT), jenž vyčísluje, kolik osob muselo být léčeno, aby bylo dosaženo poklesu neuropatické bolesti o 50 % alespoň u jednoho pacienta. V případě DN (ve studii byla sledována i účinnost léčiv u postherpetické neuralgie) bylo pořadí účinnosti léčiv následující: TCA 1,4 osoby, karbamazepin 2,3 osoby (málo údajů), tramadol 3,4 osoby, gabapentin 3,7 osoby, pregabalin 4,2 osoby, duloxetin 4,9 osoby, SSRI 6,7 osoby. V případě lokálně používaného kapsaicinu to bylo 8,1 osoby [15].
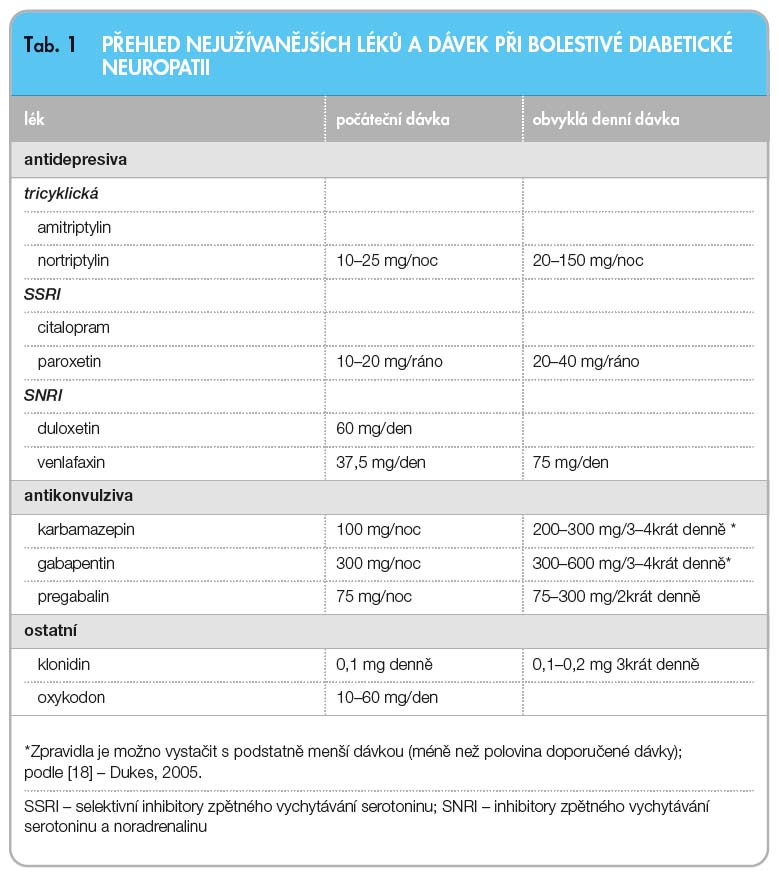 V tab. 1 je uveden přehled a způsob dávkování léků používaných při bolestech u DN.
V tab. 1 je uveden přehled a způsob dávkování léků používaných při bolestech u DN.
U některých diabetiků, kteří byli dosud léčeni perorálními antidiabetiky a u nichž byla zjištěna polyneuropatie, je po poradě s diabetologem vhodná léčba krátkodobě působícím inzulinem (nejlépe systémem více dávek) alespoň na přechodnou dobu, eventuálně při hospitalizaci. Tato intenzivní inzulinová terapie se osvědčila zvláště v případě neuropatických bolestí. Vinik [11] doporučuje u diabetiků s bolestivými projevy způsobenými patrně postižením A-delta vláken (bolest lokalizovaná v hloubce a špatně definovatelná) kontinuální intravenózní infuzi inzulinu v dávce 0,8–1 IU/hod. Ke zmírnění bolestí dojde zpravidla během 48 hodin a infuze je pak ukončena. Účinnost této léčby není projevem úpravy metabolické kompenzace, ale vysvětluje se přímým účinkem inzulinu na nervovou tkáň patrně v důsledku stimulace neuro-transmiterů.
Podávání lokálních léčiv, jako je kapsai-cin, lidokain, klonidin a isosorbiddinitrát, by mělo být, podle různých studií, účinné hlavně u neuropatických bolestí, které jsou způsobeny postižením tenkých C-vláken.
Ostatní léčba
Recentně byly publikovány studie o příznivém vlivu podávání inhibitorů ACE (ACEI) u diabetiků, zvláště 2. typu. Experimentálně bylo prokázáno, že aktivace osy renin-angio-tenzin-aldosteron hraje důležitou úlohu při rozvoji mikro- a makrovaskulárních komplikací. Podávání ACEI se opírá o poznatky, že ACEI mají nejen účinky antihypertenz-ní, ale i specifické, orgánoprotektivní, které u diabetiků působí zlepšení funkce ledvin, srdce, mozkových cév i periferních nervů. Tento příznivý efekt ACEI je důsledkem inhibice hemodynamických a tkáňových vlivů angiotenzinu II [25].
Součástí léčby DN by měla být i přiměřená pohybová aktivita diabetika se cvičením dolních končetin, optimální je svižná chůze, dále léčba rehabilitační, fyzikální, případně lázeňská. U diabetiků, u nichž v klinické symptomatice převažuje postižení tenkých vláken s poruchami tepelné citlivosti, je však třeba zvýšené opatrnosti při aplikaci tepelných procedur.
Jsou referovány i příznivé výsledky s ovlivněním bolestivé neuropatie při trans-kutánní nervové stimulaci. U některých zvlášť bolestivých a refrakterních DN byla aplikována spinální stimulace, avšak pro účinnost nefarmakologických léčebných postupů nejsou dosud žádné uspokojivé důkazy [16].
Nezbytná je při léčbě DN i dokonalá hygiena, péče o dolní končetiny a režimová opatření včetně zanechání kouření, jež se, jak dokazují četné studie, podílí na rozvoji i tíži diabetických komplikací.
Závěr
DN je velmi častou orgánovou komplikací diabetu, která může významně ovlivňovat morbiditu i mortalitu diabetiků. Její časná diagnostika je velmi důležitá, neboť časná stadia mohou být u některých forem neuropatie ještě reverzibilní. Její vznik a rozvoj lze do určité míry terapeuticky ovlivnit především správnou kompenzací diabetu. Léčba subjektivních neuropatických obtíží je zpravidla jen symptomatická a uplatňují se při ní některá antidepresiva, antikonvulziva i opioidy. Pro možné časné ovlivnění, případně zastavení rozvoje neuropatie je zapotřebí další studium patogenetických procesů, které se podílejí na vzniku neuropatie. Jen tak můžeme v budoucnu očekávat nové poznatky, které by se mohly uplatnit i v nových léčebných postupech.
Seznam použité literatury
- [1] Boulton AJM, Vinik AI, Arezzo JC, et al. Diabetic Neuropathies. Diabetes Care 2005; 28: 956–962.
- [2] Brownlee M, Aiello LP, Cooper ME, et al. Complication of Diabetes Mellitus. In Kronenberg HM, Melhep S, Polonsky KS, Larsen PR. Williams Textbook of Endocrinology. Edition 11, Saunders Elsevier 2008. 1453–1469.
- [3] Ziegler D. Painful Diabetic Neuropathy. Diabetes Care 2009; 32: S414–S419.
- [4] Benbow SJ, Daousi C, MacFarlane IA. Painful diabetic neuropathy. In: Diabetes. Best Practice Research Compendium. Elsevier, Oxford 2006: 127–136.
- [5] Duby JJ, Campbell RK, Setter SM, et al. Diabetic neuropathy: An intensive review. Am J Health Syst Pharm 2004; 61: 160–173.
- [6] Bloomgarden ZT. Diabetic Neuropathy. Diabetes Care 2008; 31: 616-621.
- [7] Diabetes Control and Complications Trial Research Group. The effect of intensive Treatment on the development and progression of long-term complications in insulin-dependent diabetes mellitus. New Engl J Med 1993; 329: 977–986.
- [8] Diabetes Control and Complications trial (DCCT) Research Group. Effect of Intensive Diabetes Treatment on Nerve Conduction in the Diabetes Control and Complications Trial. Ann Neurol 1995; 38: 869–880.
- [9] American Diabetes Association: Standards of Medical Care in Diabetes 2011. Diabetes Care 2011; 34: S11–S49.
- [10] Kožnarová R, Saudek F, Sosna T, Vondrová H. Průběh pozdních komplikací diabetu po úspěšné kombinované transplantaci ledviny a pankrea-tu – výsledek 5letého sledování. V. konference Transplantace orgánů a tkání Brno 2002. Sborník abstrakt 2002: 26.
- [11] Vinik AI, Pittenger GL, Barlow P, Mehrabyan A. Diabetic Neuropathies. In: LeRoith D, Taylor SI, Olefsky JM. Diabetes Mellitus 3rd Edition Lippincott Williams Wilkins 2004: 1331–1364.
- [12] Hotta N, Akanuma Y, Kawamori R, et al. Long-term clinical effects of epalrestat, an aldose reductase inhibitor, on diabetic peripheral neuropathy: the 3-year, multicenter, comparative Aldose Reductase Inhibitor-Diabetes Complications Trial. Diabetes Care 2006; 29: 1538–1544.
- [13] Ziegler D, Hanefeld M, Ruhnau KJ, et al. The ALADIN III Study Group: Treatment of Symptomatic Diabetic Polyneuropathy With the Antioxidant Alfa-Lipoic Acid. Diabetes Care 1999; 22: 1296–1301.
- [14] Ziegler D, Nowak H, Kempler P, et al. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha-lipoic acid: a meta-analysis. Diabet Med 2004; 21: 114–121.
- [15] Ziegler D. Treatment of Diabetic Neuropathy and Neuropathic Pain. Diabetes Care 2008; 31: S255–S261.
- [16] Tesfaye S, Boulton AJM, Dyck PJ, et al. Diabetic Neuropathies: Update on Definitions, Diagnostic Criteria, Estimation of Severity, and Treatments. Diabetes Care 2010; 33: 2285–2293.
- [17] Tesfaye S, Tandan R, Bastyr EJ, et al. Factors That Impact Symptomatic Diabetic Peripheral Neuropathy in Placebo-Administered Patients From Two 1-Year Clinical trials. Diabetes Care 2007; 30: 2626–2632.
- [18] Dukes E, Gore M, Leslie D, et al. Clinical characteristic and pain management in patients with painful diabetic neuropathy (PDN) in general practice settings in the United Kingdom. 41th EASD Annual Meeting Athens, 10-15 September 2005; PS: 88 Neuropathy: Treatment, Abstract 964.
- [19] Sawynok J, Esser MJ, Reid AR. Antidepressants as analgesics: an overview of central and peri-pheral mechanisms of action. J Psychiatry Neurosci 2001; 26: 21–29.
- [20] Ambler Z, Bednařík J, Keller O. Doporučený postup pro léčbu neuropatické bolesti. Čes Slov Neurol Neurochir 2002; 3: 135–138.
- [21] Vaillancourt PD, Langevin HM. Painful Peripheral Neuropathies. Med Clin North Am 1999; 83: 627–642.
- [22] Vileikyte L, Leventhal H, Gonzales JS. Diabetic Peripheral Neuropathy and Depressive Symptoms: the association revisited. Diabetes Care 2005; 28: 2378–2383.
- [23] Lin EH, Rutter CM, Katon W, et al. Depression and Advanced Complications of Diabetes. Diabetes Care 2010; 33: 264–269.
- [24] Vinik A. Use of Antiepileptic Drugs in the Treatment of Chronic Painful Diabetic Neuropathy. J Clin Endocrinol Metab 2005; 90: 4936–4945.
- [25] Cordonnier DJ, Zaoui P, Halimi S. Role of ACE inhibitors in patients with diabetes mellitus. Drugs 2001; 61: 1883–1892.