Současné možnosti léčby mnohočetného myelomu
Současný pohled na stále se rozšiřující možnosti léčby mnohočetného myelomu (MM), který je podán v předloženém sdělení, dokládá, že zejména v poslední dekádě došlo k neobyčejnému pokroku. Zatímco v 80. letech minulého století byl MM různě rychle progredujícím onemocněním s nízkou kvalitou života pacientů a s délkou přežití 2,5–3 roky, v současnosti má možnost dosáhnout kompletní remise přibližně 50 % nemocných s mediánem celkového přežití zhruba 5 let a 20 % pacientů s pravděpodobností přežití delší než 10 let. Hlubší pochopení složité biologie MM vneslo do léčby působky se zcela novým, biologickým účinkem (thalidomid, bortezomib a lenalidomid) a s novými terapeutickými terči, zahrnujícími vedle buněčných mechanismů i zásah do interakcí nádorových buněk s mikroprostředím kostní dřeně. Současná léčba zahrnuje: vysoce účinné a vcelku dobře snášené chemoterapeutické a hybridní režimy kombinující klasické chemoterapeutické a nové imunomodulační působky; u vybraných nemocných vysokodávkovanou chemoterapii s podporou autologní transplantace kmenových buněk, navazující na novou a vysoce účinnou indukční léčbu hybridními režimy; komplexní a vysoce účinnou podpůrnou terapii zlepšující podstatně kvalitu života. Prozatím není optimálně vyřešena otázka udržovací terapie v případě dosažení velmi dobré léčebné odezvy ani problematika minialogenní transplantace kmenových krvetvorných buněk. Diskutována je i otázka individuálního výběru terapeutického postupu a léčebná strategie v jednotlivých fázích průběhu MM nejen z hlediska současných, ale i z pohledu budoucích, stále se rozšiřujících léčebných možností.
Problematice léčby mnohočetného myelomu (MM) je věnována v odborném písemnictví stále vzrůstající pozornost, a to úměrně prohlubujícím se znalostem patogeneze nemoci a rychlému rozšiřování léčebného armamentaria, které umožňuje stále účinnější, individuálně a komplexně pojatou terapii. MM je neobyčejně heterogenní a prognosticky velmi různorodé onemocnění způsobené nekontrolovanou klonální proliferací a akumulací neoplasticky transformovaných elementů plazmocelulární série v kostní dřeni (KD); vyznačuje se tvorbou monoklonálního imunoglobulinu (MIg) prokazatelného v séru a/nebo v moči a projevy orgánové dysfunkce „CRAB“ (C – hyperkalcemie, R – renální insuficience, A – anémie, B – projevy myelomové kostní nemoci, tj. „bone disease“) [1–5]. MM tvoří přibližně 10 % všech hematologických malignit, jeho roční incidence je 4–5/100 000 obyvatel a vyskytuje se především ve vyšším věku (medián 63 let) s lehkou převahou u mužů [4, 6, 7].
Diagnostika a prognostická stratifikace
K rozpoznání MM a odlišení především od MGUS (monoclonal gammopathy of undetermined significance), případně i od solitární formy plazmocytomu, primární makroglobulinemie a primární systémové AL-amyloidózy se využívá především diagnostických kritérií IMWG (International Myeloma Working Group), eventuálně i SWOG (South West Oncology Group). Tato diagnostika je založena na průkazu > 10 % monoklonálních plazmocytů v KD, na detekci MIg v séru a/nebo detekci Bence-Jonesovy (B-J) bílkoviny v moči a na přítomnosti alespoň jednoho specifického projevu postižení životně důležitého orgánu zahrnutého v příznakovém komplexu CRAB [1–3, 7]. Obzvláštní pozornost musí být při diagnóze MM věnována vedle vyloučení MGUS a ostatních monoklonálních gamapatií (MG) rozlišení iniciální/asymptomatické fáze MM (dříve „doutnající“ MM) od rozvinuté/symptomatické formy nemoci. Iniciální/asymptomatická fáze MM se vyznačuje přítomností MIg v séru a/nebo v moči, výskytem 10–30 % klonálních plazmocytů v KD a nepřítomností některého ze znaků příznakového komplexu CRAB [1, 3]. Klinické projevy MM jsou ve srovnání s ostatními hemoblastózami mnohem pestřejší a individuálně značně odlišné a vyplývají z podstaty nemoci: z infiltrace KD myelomovými plazmocyty vedoucí k pancytopenii a imunosupresi (únavový a anemický syndrom, recidivující zánětlivé stavy a případné projevy hemoragické diatézy), z vysoké produkce MIg (renální insuficience, hyperviskózní syndrom, AL-amyloidóza) a z rozvoje myelomové kostní nemoci (MKN) v oblasti osového skeletu (kostní bolesti, patologické fraktury, zlomeniny obratlů s případnou kompresí míchy a hyperkalcemie) [1–4]. K rozhodnutí o započetí a volbě léčby je nutná znalost stupně pokročilosti, tj. stadia nemoci a konstelace klíčových prognostických faktorů (PF). I v současnosti je k nepřímému odhadu nálože nádorové masy používán stážovací systém dle Durieho-Salmona (D-S), který rozděluje nemocné do tří klinických stadií (I–III) založených na zhodnocení výše MIg v séru a/nebo na odbytu B-J bílkoviny močí, hodnoty Hb, S-Ca a na zhodnocení stupně osteolytického postižení skeletu, a dvou podstadií A, B (v podstadiu B je hladina S-kreatininu > 177 mmol/l) [2, 3, 8]. V současnosti nabývá na významu taktéž třístupňový, prognosticky ale významnější stratifikační systém dle International Staging System (ISS), založený na hodnocení hladin β2-mikroglobulinu (β2-m) a albuminu v séru [2, 3, 9]. K vyčlenění prognosticky vysoce rizikových nemocných („high risk“) s krátkým celkovým přežitím (OS, overall survival) a k určení léčebné taktiky se vedle hodnocení klinického stadia (dle D-S a ISS), věku (hranice 65 let) a stavu klinické kondice („performance status“ 0–3) používá především výsledků cytogenetického vyšetření včetně metody FISH (fluorescence in situ hybridization), morfologického typu myelomových plazmocytů a jejich proliferačního indexu (PI), hladin S-kreatininu, β2-m, S-LDH, počtu cirkulujících plazmocytů v obvodové krvi a koncentrace hladin volných lehkých řetězců kappa/lambda v séru, s perspektivním použitím výsledků genové expresní analýzy a proteomiky [2, 3, 10]. Prognosticky vysoce nepříznivá forma MM „high risk“, nereagující obvykle na konvenční terapii (KT) a nedostatečně reagující na vysokodávkovanou chemoterapii s transplantací autologních kmenových buněk (VDT/ATKB), která vyžaduje intenzivní, zcela nově pojatou léčbu, se vyznačuje přítomností delece chromozomu 13, delecí 17p-, hypodiploidií, translokací typu t(4;14) nebo t(14;16), vysokou hodnotou PI a plazmoblastickým typem myelomových buněk [3, 10–12]. K východiskům výběru optimální léčby patří i zhodnocení klinické fáze nemoci, tj. fáze indolentní/ asymptomatické vs. aktivní/symptomatické vs. pozdní/terminální fáze MM.
Léčba mnohočetného myelomu
MM je stále lépe léčitelné, ale i v současnosti nevyléčitelné onemocnění mnoha tváří, vyznačující se nejen výraznými rozdíly v klinickém obraze, v dosažení hloubky a trvání léčebné odezvy, ale i ve stupni citlivosti k chemoterapii podmíněné biologickými vlastnostmi nádorové tkáně a mikroprostředím KD [2]. Bytostným cílem léčby MM je dosažení co nejdelší kompletní remise (KR) s co nejnižší úrovní zbytkové nemoci jako východiska vysoké kvality života a dlouhodobého přežití, zcela legitimním požadavkem nedaleké budoucnosti je perspektiva úplného vyléčení. Současné pokroky v poznání etiopatogeneze MM, založené na výsledcích molekulární biologie, 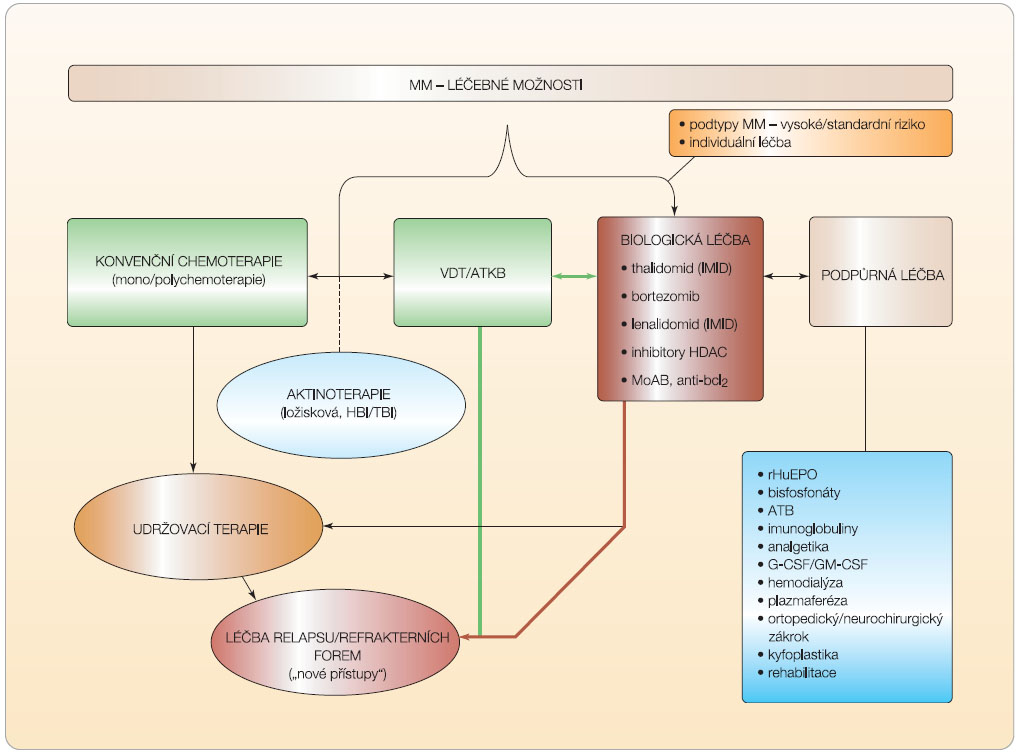 genové expresní analýzy a proteomiky, vedly k odhalení nádorově specifických cest regulujících růst a přežití myelomových buněk včetně mechanismů spuštění apoptotické signální kaskády; byly objeveny molekulární terče pro léky zcela nové generace s „necytostatickým“ biologickým účinkem, které ovlivňují přežití nádorových buněk prostřednictvím imunomodulačního účinku s aktivací cytotoxických NK (natural killers) buněk, modulací adheze myelomových buněk k elementům mikroprostředí KD a produkce plejády antiapoptotických, růstových a angiogenních působků [13, 14]. Došlo tak k podstatné změně dosavadní léčebné filosofie přijetím terapeutického paradigmatu, v němž léčebným terčem nejsou pouze myelomové plazmocyty, ale i elementy a působky mikroprostředí KD a procesy vycházející z interakce nádorové tkáně a celého organismu. Ve stále větší míře se uplatňuje perspektivní požadavek cílené, individuálně pojaté terapie používající individuálně pojaté „koktejly“ speciálně vybraných působků s terčovým zásahem do vlastního myelomového procesu [14]. Přehled současných postupů používaných v léčbě MM ukazuje obr. 1.
genové expresní analýzy a proteomiky, vedly k odhalení nádorově specifických cest regulujících růst a přežití myelomových buněk včetně mechanismů spuštění apoptotické signální kaskády; byly objeveny molekulární terče pro léky zcela nové generace s „necytostatickým“ biologickým účinkem, které ovlivňují přežití nádorových buněk prostřednictvím imunomodulačního účinku s aktivací cytotoxických NK (natural killers) buněk, modulací adheze myelomových buněk k elementům mikroprostředí KD a produkce plejády antiapoptotických, růstových a angiogenních působků [13, 14]. Došlo tak k podstatné změně dosavadní léčebné filosofie přijetím terapeutického paradigmatu, v němž léčebným terčem nejsou pouze myelomové plazmocyty, ale i elementy a působky mikroprostředí KD a procesy vycházející z interakce nádorové tkáně a celého organismu. Ve stále větší míře se uplatňuje perspektivní požadavek cílené, individuálně pojaté terapie používající individuálně pojaté „koktejly“ speciálně vybraných působků s terčovým zásahem do vlastního myelomového procesu [14]. Přehled současných postupů používaných v léčbě MM ukazuje obr. 1.
Terapie nově rozpoznaného MM
V případě odhalení MM patří k základnímu kroku vyčlenění nemocných s iniciální/asymptomatickou formou MM (dříve doutnající MM), tj. stadia I (dle D-S). Tuto skupinu tvoří asi 20 % jedinců s MM vyznačujících se dlouhodobě neměnnou hodnotou MIg a stabilitou („plateau“ fáze MM) s nepřítomností osteolytického postižení skeletu, u níž by předčasné zahájení chemoterapie zhoršilo kvalitu života bez prodloužení OS a přispělo naopak k selekci chemorezistentních klonů (přístup „wait and see“) [2, 3, 7, 15]. V případě osteoporózy je vhodné zahájení antiresorpční terapie bisfosfonáty [3]. Vzhledem k obtížně předvídatelné progresi nemoci je ale nezbytná systematická dispenzární péče s kontrolami ve 3–6měsíčních intervalech s pečlivou monitorací stěžejních laboratorních ukazatelů nemoci, zejména hodnoty MIg v séru nebo v moči, s vyloučením jakýchkoliv klinických projevů progrese nemoci a s nepromeškáním vhodného okamžiku k okamžitému zahájení indukční terapie [11].
Vysokodávkovaná chemoterapie s autologní transplantací kmenových buněk
V případě rozvinuté, symptomatické formy MM je důležité rozhodnutí, zdali pacient splňuje standardní indikační kritéria VDT/ATKB, nebo je kandidátem KT. Vcelku liberální kritéria VDT/ATKB splňuje bezmála 50 % nemocných s nově rozpoznaným MM; patří k nim: věk < 65 let se zohledněním „biologického“ věku, chybění předchozí terapie 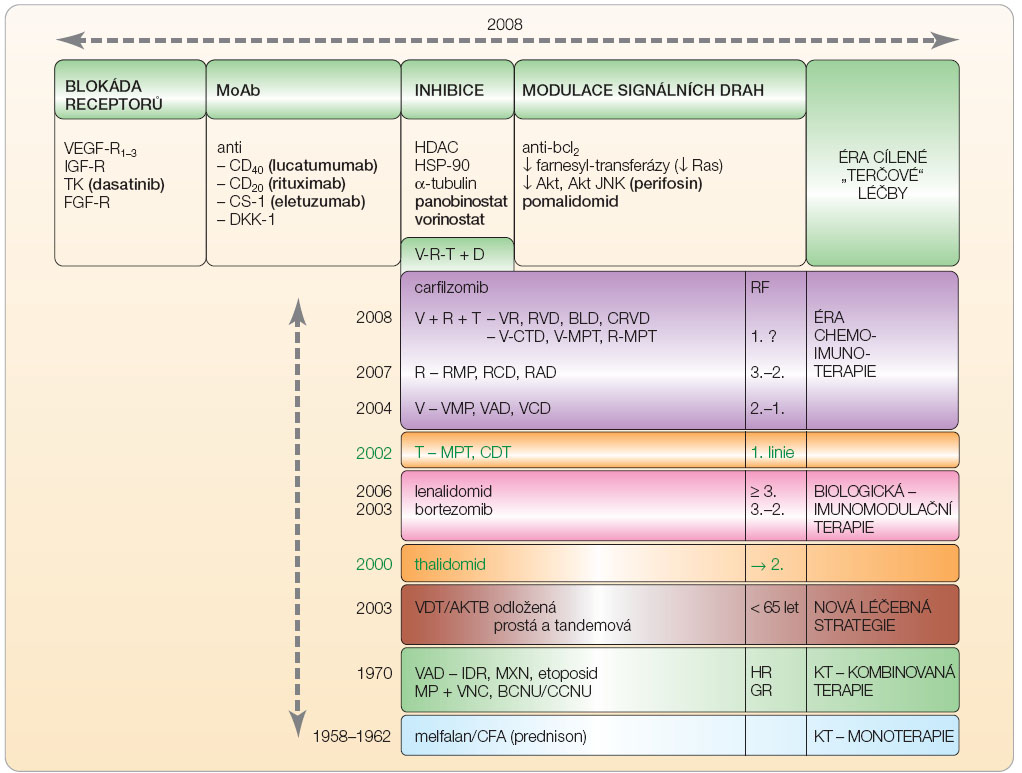 alkylačními látkami či rozsáhlé aktinoterapie, nepřítomnost závažného plicního, kardiovaskulárního a jaterního postižení a vyloučení fokálního ložiska nebo skryté infekce [16–18]. Cílem indukční, předtransplantační léčby je co nejhlubší snížení nádorové masy. Skládá se tradičně ze 4–6měsíční terapie jedním, případně i více léčebnými režimy s následnou fází stimulační, zaměřenou na sběr periferních kmenových buněk po stimulaci G-CSF (granulocyte colony-stimulating factor) a většinou i na podání vysoké dávky cyklofosfamidu (3–6 g). Pokusy o očištění kmenových CD34+ buněk od kontaminace myelomovými elementy nebyly přínosné [18]. Nejčastěji používaným, dnes zcela standardním přípravným režimem sdruženým s převodem autologních kmenových krvetvorných buněk je podání vysoké, myeloablativní dávky melfalanu – 200 mg/m2. Pokusy o zlepšení léčebného účinku myeloablativní terapie jsou spojovány s dalším zvýšením dávky melfalanu s podáním cytoprotektivních působků (např. aminofostinu), s přidáním radioizotopů s terčovým skeletálním účinkem (např. samarium nebo holmium), zkouší se i kombinace melfalanu s
alkylačními látkami či rozsáhlé aktinoterapie, nepřítomnost závažného plicního, kardiovaskulárního a jaterního postižení a vyloučení fokálního ložiska nebo skryté infekce [16–18]. Cílem indukční, předtransplantační léčby je co nejhlubší snížení nádorové masy. Skládá se tradičně ze 4–6měsíční terapie jedním, případně i více léčebnými režimy s následnou fází stimulační, zaměřenou na sběr periferních kmenových buněk po stimulaci G-CSF (granulocyte colony-stimulating factor) a většinou i na podání vysoké dávky cyklofosfamidu (3–6 g). Pokusy o očištění kmenových CD34+ buněk od kontaminace myelomovými elementy nebyly přínosné [18]. Nejčastěji používaným, dnes zcela standardním přípravným režimem sdruženým s převodem autologních kmenových krvetvorných buněk je podání vysoké, myeloablativní dávky melfalanu – 200 mg/m2. Pokusy o zlepšení léčebného účinku myeloablativní terapie jsou spojovány s dalším zvýšením dávky melfalanu s podáním cytoprotektivních působků (např. aminofostinu), s přidáním radioizotopů s terčovým skeletálním účinkem (např. samarium nebo holmium), zkouší se i kombinace melfalanu s 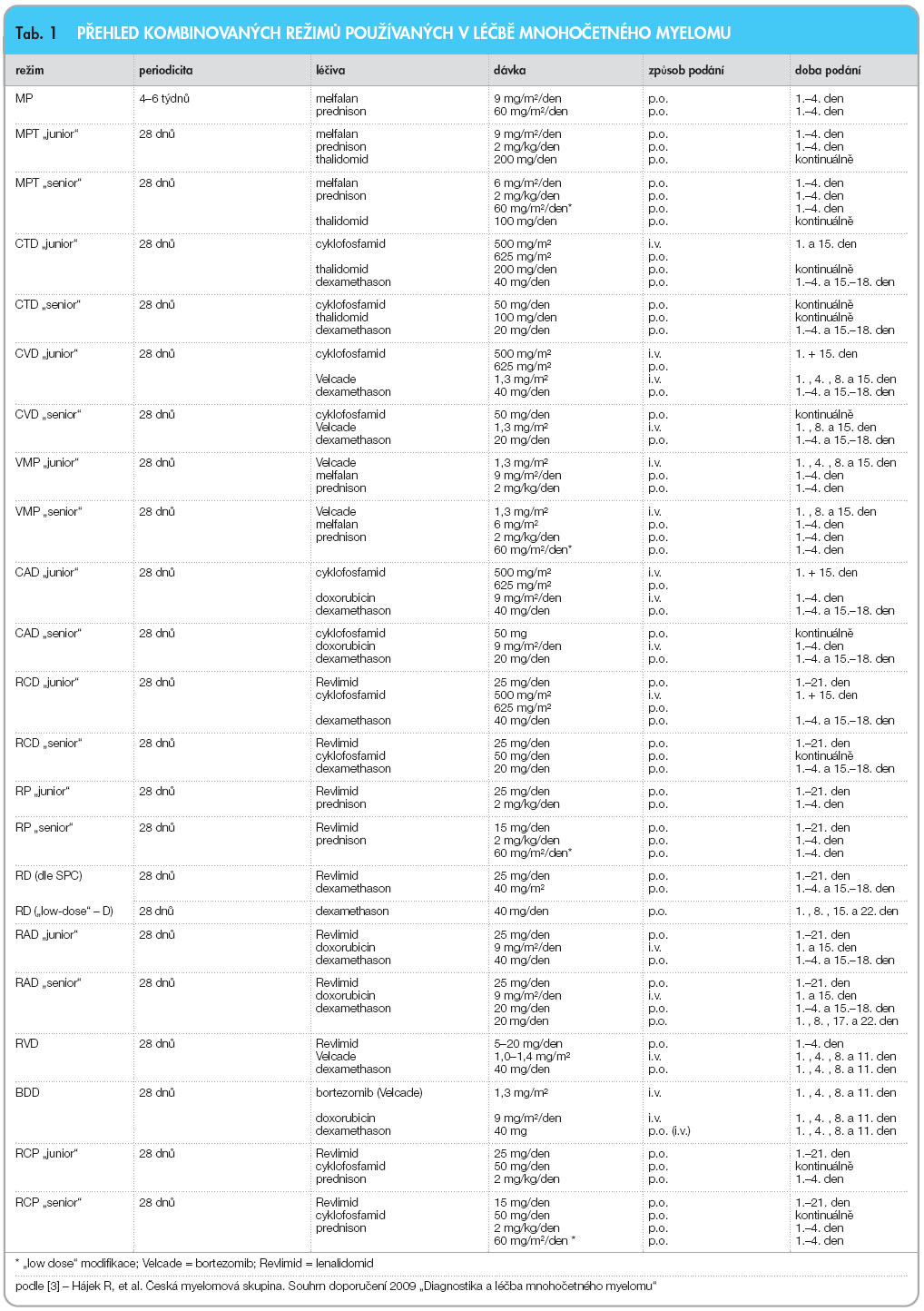 bortezomibem [3, 15, 18]. Indukční terapie by měla vést k co nejhlubšímu potlačení aktivity nemoci, být co nejméně toxická a s minimální časnou mortalitou (TRM, treatment related mortality), neměla by omezovat dostatečný sběr kmenových CD34+ buněk, ale umožňovat navíc i případné pokračování v této léčbě při nutnosti odkladu VDT/ATKB [15, 19]. Nejpříznivější výsledky VDT/ATKB se vyskytují u nemocných v klinickém stadiu I, při nízké hodnotě β2-m, u IgG typu MIg, ve věku nižším než 50 let a v případě dosažení KR [16]. Vzhledem k nesplnění většiny požadavků na optimální indukční terapii, zejména ale pro vysokou toxicitu byl z praktického použití vyřazen dříve standardní indukční režim VAD (vinkristin, doxorubicin, dexamethason) a byl nahrazen režimem se začleněním nových biologických působků, tj. thalidomidu, bortezomibu a lenalidomidu, v kombinaci s pulzní léčbou dexamethasonem, případně i s některými klasickými chemoterapeutickými působky (obr. 2, tab. 1) [15, 20].
bortezomibem [3, 15, 18]. Indukční terapie by měla vést k co nejhlubšímu potlačení aktivity nemoci, být co nejméně toxická a s minimální časnou mortalitou (TRM, treatment related mortality), neměla by omezovat dostatečný sběr kmenových CD34+ buněk, ale umožňovat navíc i případné pokračování v této léčbě při nutnosti odkladu VDT/ATKB [15, 19]. Nejpříznivější výsledky VDT/ATKB se vyskytují u nemocných v klinickém stadiu I, při nízké hodnotě β2-m, u IgG typu MIg, ve věku nižším než 50 let a v případě dosažení KR [16]. Vzhledem k nesplnění většiny požadavků na optimální indukční terapii, zejména ale pro vysokou toxicitu byl z praktického použití vyřazen dříve standardní indukční režim VAD (vinkristin, doxorubicin, dexamethason) a byl nahrazen režimem se začleněním nových biologických působků, tj. thalidomidu, bortezomibu a lenalidomidu, v kombinaci s pulzní léčbou dexamethasonem, případně i s některými klasickými chemoterapeutickými působky (obr. 2, tab. 1) [15, 20].
Thalidomid je imunomodulační působek s velmi širokým spektrem účinků, které zahrnují: inhibici tvorby TNF-α(faktoru nekrotizujícího tumory α), stimulaci proliferace a aktivity T buněk a zejména cytotoxicity NK buněk, inhibici proliferace a podporu apoptózy myelomových buněk, modulaci exprese cytoadhezivních molekul, zvýšení tvorby INF-gamma (interferon gamma) a IL-2 i účinek antiangiogenní [12, 18]. Nemyelosupresivní léčebný profil předurčuje použití thalidomidu jako součásti vícelékových režimů používaných ve všech fázích průběhu MM. Obvyklá dávka je v současnosti 100–200 mg/den s dosažením léčebné odezvy u přibližně 30 % předléčených nemocných, v 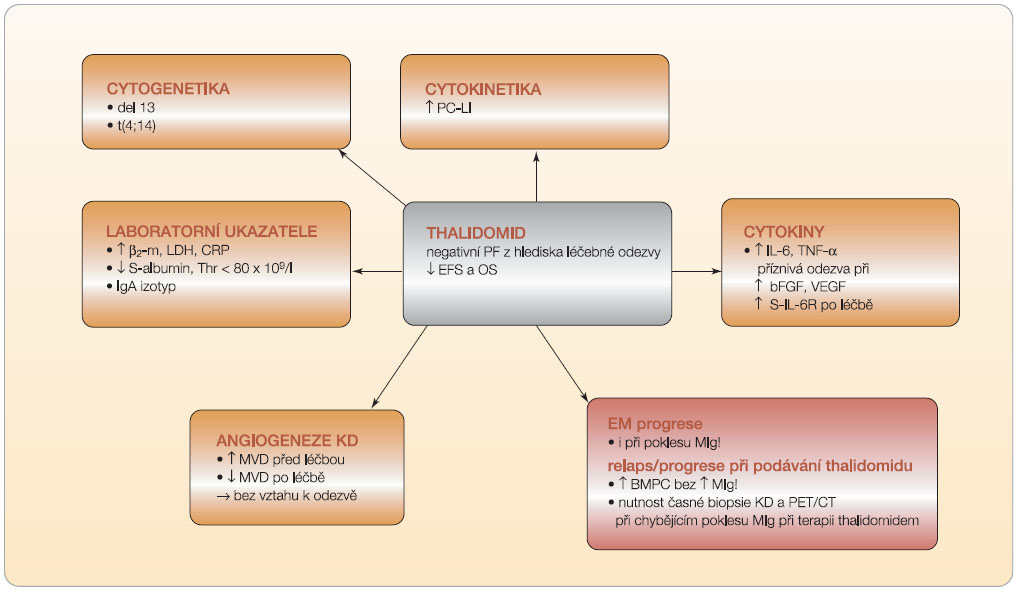 kombinaci s dexamethasonem u 40–55 % nemocných, po přidání alkylačních látek u 55–76 % pacientů. Jeho neobyčejnou výhodou je zanedbatelná myelotoxicita, k limitujícím faktorům patří naopak jeho nežádoucí účinky, jež se vyznačují různě rychlým rozvojem obvykle nevratné periferní senzomotorické neuropatie, obstipace, pocitu celkové slabosti a duševního útlumu, ale i výskytem kožního exantému, bradykardie a ve spojení s kortikosteroidy i rozvojem naléhavé hrozby žilní trombózy [3, 7, 15]. Faktory limitující jeho účelné léčebné využití vyplývají z obr. 3.
kombinaci s dexamethasonem u 40–55 % nemocných, po přidání alkylačních látek u 55–76 % pacientů. Jeho neobyčejnou výhodou je zanedbatelná myelotoxicita, k limitujícím faktorům patří naopak jeho nežádoucí účinky, jež se vyznačují různě rychlým rozvojem obvykle nevratné periferní senzomotorické neuropatie, obstipace, pocitu celkové slabosti a duševního útlumu, ale i výskytem kožního exantému, bradykardie a ve spojení s kortikosteroidy i rozvojem naléhavé hrozby žilní trombózy [3, 7, 15]. Faktory limitující jeho účelné léčebné využití vyplývají z obr. 3.
Bortezomib je selektivní inhibitor proteazomu s terapeutickým zásahem do proliferace a apoptózy myelomových buněk prostřednictvím modulace signální transdukce, exprese některých genů a inhibice nukleárního faktoru kappaB (NF-kappaB). Podílí se i na inhibici syntézy DNA, útlumu angiogeneze a exprese cytoadhezivních molekul, moduluje imunitní odezvu, mikroprostředí kostní dřeně a interakci mnoha cytokinů. Vyznačuje se vysokou účinností u refrakterních/relabujících forem nemoci s léčebnou odezvou u zhruba 30 % ne-mocných [18, 21, 22]. Obvyklá dávka je 1,3 mg/m2 v jednorázové nitrožilní aplikaci 1., 4., 8., a 11. den v rámci 6–8 cyklů podávaných ve 4týdenních intervalech. K nežádoucím účinkům patří celková slabost, trombocytopenie, GIT dyskomfort a především periferní senzitivní, většinou uspokojivě reverzibilní neuropatie [22]. V kombinované terapii s dexamethasonem a dalšími antimyelomovými působky patří v současnosti ke stěžejním nejúčinnějším přípravkům použitelným s výjimkou udržovací terapie ve všech léčebných fázích MM. Jde o lék, který se prosadil i v léčbě 1. linie s dosažením léčebné odezvy u 30–60 % nemocných, v kombinovaných režimech u 80 % nemocných [22]. K jeho přednostem patří i skutečnost, že v rámci indukční terapie před VDT/ATKB nesnižuje sklizeň kmenových buněk.
Lenalidomid, analog thalidomidu, patří mezi moderní imunomodulační působky (IMID) s podstatně vyšším imunomodulačním účinkem, nežli má thalidomid. Podílí se i na útlumu syntézy TNF-α, na modulaci cytokinů, stimulaci proliferace T buněk, na inhibici proliferace a vzestupu apoptózy i na snížení adheze myelomových buněk a na snížení zvýšené produkce INF-gamma a IL-2. Ve srovnání s thalidomidem není teratogenní, má nižší antiangiogenní potenciál a jeho podávání provází nižší výskyt nežádoucích účinků, nevede k periferní neuropatii, takže je vítaným lékem u nemocných s přítomností této komplikace [18]. Nejvýznačnějším nežádoucím účinkem léčby lenalidomidem je jeho myelosupresivní účinek, kdy trombocytopenie, především ale neutropenie, vyžaduje pečlivou modifikaci dávky a nezřídka i podpůrné použití G-CSF. Podávání lenalidomidu v kombinaci s dexamethasonem je provázeno zvýšeným výskytem hluboké žilní trombózy (8–15 % jedinců). Terapie kombinací lenalidomidu a dexamethasonu dosahuje u nepředléčených nemocných léčebné odezvy charakteru ≤ parciální remise (PR) u 67–91 % jedinců [12, 23, 24].
Vzhledem ke stále omezené dostupnosti bortezomibu a lenalidomidu v rámci standardní indukční terapie nepředléčených nemocných v našich podmínkách, tedy v rámci léčby 1. linie, jsou běžně stále používány do jisté míry méně účinné režimy charakteru thalidomid/dexamethason (TD), CTD nebo i režim CAD (tab. 1), dosahující léčebné odezvy u 63–72 % nemocných [3, 7, 10]. Z dosavadních studií vyplývá, že zejména léčba založená na kombinaci bortezomibu s dexamethasonem (VD, Velcade a dexamethason) a lenalidomidu/dexamethasonu (RD, Revlimid a dexamethason) dosahuje podstatně příznivějších léčebných výsledků nežli běžně dostupná léčba TD, a to z hlediska celkové léčebné odezvy (80–90 %) a s podstatně vyšším výskytem VGPR (very good partial remission) v předtransplantační i potransplantační fázi a se snížením potřeby sekvenční/tandemové VDT/ATKB [3, 7, 10, 20, 25, 26]. Samotná VDT/ATKB je přes některé relativizující názory [27, 28] považována za vysoce efektivní a standardní iniciální léčbu MM. Při srovnání s KT se vyznačuje podstatně vyšší léčebnou odezvou s dosažením KR ve 22–44 % vs. 5–8 %, delší EFS (event free survival) i delším OS o 12–30 měsíců a s minimální, přibližně 1% TRM [17, 19, 22, 29]. Jde o terapii, jež při splnění indikačních kritérií a souhlasu nemocného je iniciální léčbou volby [3, 16]. Bylo ale zjištěno, že odklad VDT/ATKB do období relapsu MM není překvapivě provázen zkrácením OS, i když časná VDT/ATKB je spojena s lepší kvalitou života [30]. Druhá, tj. sekvenční/tandemová VDT/ATKB, je v současnosti rezervována především pro nemocné, u nichž nebylo dosaženo po 1. VDT/ATKB alespoň VGPR, nebo pro pacienty v relapsu či s progresí MM, neboť klinický přínos dokumentovaný prodloužením OS v rámci iniciální dvojité VDT/ATKB nepřevyšoval přínos druhé, odložené autologní transplantace [3, 31, 32].
Alogenní transplantace kmenových krvetvorných buněk je u MM prozatím přes přítomnost „graft-versus myeloma disease“ (GvMD) efektu pouze potenciálně kurativní léčebnou metodou, neboť je ve své klasické podobě provázena vysokou toxicitou a neakceptabilní časnou potransplantační mortalitou (TRM byla v prvních pilotních studiích 30–50 %) [33–35]. V současnosti je tedy jednoznačnou léčbou volby u nově zjištěného mnohočetného myelomu VDT s autologní TKB, zatímco alogenní TKB se používá v současnosti pouze u 6 % transplantovaných nemocných [22]. Probíhající klinické studie zaměřené na použití nemyeloablativní, „minialogenní“ TKB v rámci iniciální léčby u přísně vybraných, vesměs vysoce rizikových nebo relabujících nemocných s případnou tandemovou návazností na předchozí VDT/ATKB nejsou doposud uzavřeny [36]. Alogenní TKB ve srovnání s autologní TKB se vyznačuje u přežívajících nemocných vyšším výskytem KR, delší EFS i OS, jejímu praktickému využití však brání přes počáteční entuziasmus stále závažná toxicita s vysokým výskytem nežádoucích projevů, včetně akutní i chronické formy GvHD („graft-versus host disease“) s vysokou TRM (nyní zhruba 11 %) [16].
Konvenční terapie
Samotná konvenční chemoterapie bez začlenění TKB je indikována u nemocných starších 65 let nebo i u mladších jedinců nesplňujících indikační kritéria VDT/ATKB a je používána v současnosti u nadpoloviční části nemocných [6]. Do zavedení VDT/ATKB byla standardní terapií MM intermitentní perorální léčba kombinací melfalanu a prednisonu (režim MP, obr. 2, tab. 1). Jde o jednoduchou, levnou a dobře snášenou léčbu, podávanou do dosažení setrvalé, „plateau“ léčebné odezvy, tj. se stabilitou MIg po aplikaci obvykle 8–12 cyklů. Režim MP dosahoval léčebné odezvy u přibližně 50 % jedinců, ale KR pouze u méně než 10 % nemocných s mediánem přežití 3–3,5 roku [6, 11]. V současnosti je tato léčebná modalita používána již značně rezervovaně, a to vesměs u nemocných starších (75–80 let) s nemožností použití nových imunomodulačních působků, především thalidomidu [3]. Prakticky již byla opuštěna podstatně agresivnější léčba kombinovanými polychemoterapeutickými režimy s přidáním vinkristinu (VMP), cyklofosfamidu (VMCP) a se začleněním doxorubicinu či karmustinu (VBAP), idarubicinu (VID), či dříve nejpoužívanější režim VAD (vinkristin, doxorubicin a dexamethason) (obr. 2), neboť rozsáhlé metaanalytické studie, jež analyzovaly kohorty 3814 [37] a 6663 nemocných [38] s MM, neprokázaly přes vyšší (60–70 %) a rychlejší léčebnou odezvu, ovšem při podstatně vyšší toxicitě léčby oproti režimu MP, přínos z hlediska délky OS.
V současnosti jsou považovány v našich podmínkách za standardní konvenční terapii 1. linie u netransplantabilních nemocných režimy se začleněním thalidomidu, tj. režim MPT nebo CTD ve verzi „junior“ a u nemocných starších 65 let ve verzi „senior“ (tab. 1) [3, 15, 39, 40]. Ukázalo se, že při srovnání režimu MPT vs. MP byl zjištěn vyšší výskyt ORR (celkové léčebné odezvy, tj. overall response rate), u 76 % vs. 48 % nemocných, dosažení KR + nKR (nearly KR) u 28 % vs. 7 %, delší EFS (ve 2letém odstupu u 54 % vs. 27 %) a vyšší výskyt 3letého OS (80 % vs. 64 %) [39]. Za důležité je nutno považovat zjištění, že dosažené výsledky léčby vyzněly příznivě i při srovnání s režimem MP u nemocných starších 70 let: PR 76–83 % vs. 39–48 %, KR + nKR 15–22 % vs. 2–8 % a OS 45 vs. 27 měsíců [39, 40]. Nevýhodou režimů se začleněním thalidomidu je ale podstatně vyšší výskyt závažných nežádoucích projevů nežli při terapii MP (48 vs. 25 %). Nevítanou komplikací terapie je především většinou nevratná senzomotorická periferní neuropatie DKK, únavový syndrom s depresí a častý výskyt tromboembolické nemoci vyžadující profylaktickou terapii nízkomolekulárním heparinem. Jeho podávání vede k poklesu výskytu z 20 % na 3 %, zatímco někdy doporučované podávání kyseliny acetylsalicylové je považováno za málo vhodné [3, 10, 39]. Podstatně účinnější nežli začlenění thalidomidu do kombinované léčby nemocných starších 65 let je použití bortezomibu (režim VMP nebo VCP) či lenalidomidu (režim R-D či RP, tab. 1), dosahující ≥ PR u 88 % a 81 % nemocných a KR+ nKR u 43 % a 24 % nemocných [41, 42]. V současnosti se staly tyto velmi účinné léčebné režimy (VMP, VCP, R-D nebo RD) v některých zemích již běžně používanými postupy 1. volby. Za naprosto standardní režimy současnosti jsou u nemocných v seniorském věku (> 65 let) považovány režimy MPT či CTD „senior“, k jejichž výhodám patří perorální forma léčby a při nízkém dávkování thalidomidu i uspokojivá terapeutická snášenlivost [3], a ve vybraných situacích i léčebné režimy se začleněním bortezomibu či lenalidomidu.
U vysoce rizikových nemocných s nepříznivou prognózou („high risk“), s renální insuficiencí, s přítomností trombofilního stavu nebo u těch nemocných, kteří nemohou být léčeni thalidomidem, je indikována i v našich podmínkách kombinace MP se začleněním bortezomibu (VMP) nebo režimy VCP, VAD nebo i kombinace s lenalidomidem (RD, RPC či RCD) [43]. V příznivém světle je také diskutován režim LD-RD (low dose dexamethasone s lenalidomidem) se sníženou, intermitentní dávkou dexamethasonu (40 mg 1krát týdně), který dosáhl v primární léčbě, a to i u jedinců starších 65 let, ≥ PR u 91 % nemocných a dokonce vyšší ORR (96 %) nežli standardní režim RD (86 %), s 3letým přežitím u 85 % nemocných a s nižší toxicitou včetně nižšího výskytu hluboké žilní trombózy (21 % vs. 6 %) [10, 11, 24]. Z uvedených důvodů je režim LD-RD doporučován pro standardní léčbu nejen v primární konvenční terapii všech nemocných, ale i jako vhodný indukční režim před VDT/ATKB [10]. Vzhledem k vyšší toxicitě a účinnosti léčby hybridními režimy se začleněním bortezomibu a lenalidomidu se doporučuje v úvodní terapii obvykle 6–8 léčebných cyklů se zohledněním stupně léčebné odezvy i tolerance léčby [3]. Konvenčně pojatá terapie se podává obvykle do dosažení „plateau fáze“, definované jako 2–4měsíční stabilita hodnoty MIg v séru a/nebo v moči s nepřítomností jakýchkoliv klinicko-laboratorních známek aktivity [11]. V případě ohraničeného ložiskového plazmocelulárního procesu, nereagujícího adekvátně na chemoterapii, nebo s perzistencí bolesti či s osteolýzou s vysokým rizikem patologické zlomeniny je indikována ložisková aktinoterapie v dávce 20–30 Gy, rozložená obvykle do 10 frakcí. Nutno mít ale na paměti, že rozsáhlejší radioterapie je provázena snížením rezervy kostní dřeně, což omezuje následně nejen intenzitu chemoterapie, ale i úspěšnost sběru kmenových buněk před ATKB [6, 11].
K léčbě nemocných s přítomností negativních PF při diagnóze („high risk“), zejména s nepříznivými výsledky cytogenetického vyšetření, je nutno přistupovat značně individuálně, neboť v případě použití pouze standardní KT nebo VDT/ATKB dochází k dosažení pouze omezené a krátkodobé léčebné odezvy [44]. U těchto nemocných je doporučováno před VDT/ATKB zahájení intenzivní indukční terapie s použitím nových léčebných režimů se začleněním bortezomibu a/nebo lenalidomidu (např. režimu VD, VAD, VCD, RD, RAD, RCP či RVD), jež mohou vést k překonání nepříznivých PF a k případnému posunu provedení VDT/ATKB až do období progrese nebo relapsu nemoci [15].
Vysoce rizikoví nemocní s nedostatečnou odezvou k použité léčbě jsou ale současně i kandidáty pro léčbu v rámci klinických studií, umožňujících použití nových léčebných přípravků, např. působků potlačujících účinek VEGF (vaskulárního endotelového růstového faktoru, tj. bevacizumabu, sorafenibu či sunitinibu), inhibitorů histon deacetylázy (HDAC), inhibitorů mTOR (mammalian target of rapamycin, tj. temsirolimu), inhibitorů p38, monoklonálních protilátek proti CD56 nebo cytokinu IL-6, nových typů inhibitorů proteazomu (carfilzomib), inhibitorů bcl2 (obatoclax), inhibitorů Hsp-90 (heat shock protein, geldanamycin), 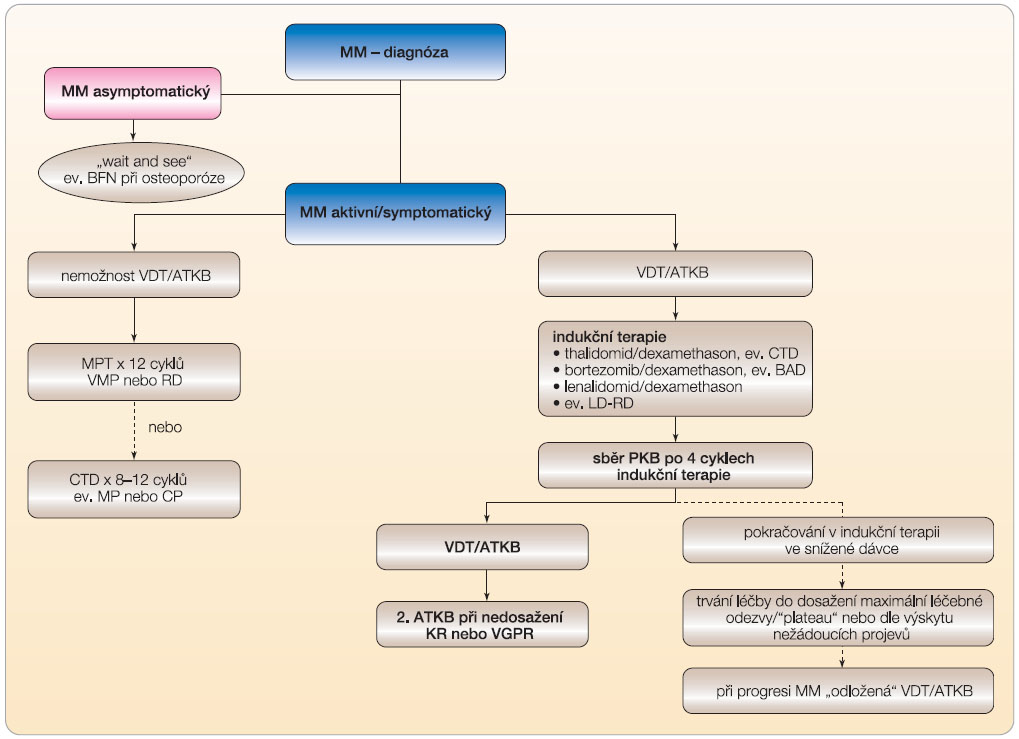 inhibitoru P13k/Akt dráhy (perifosin), inhibitorů farnesyltransferázy (tipifarnib), inhibitoru IGF-1 (insulin growth factor), receptoru růstového faktoru fibroblastů, nového alkylfosfolipidu perifosinu a dalších, zatímco použití 2-methoxyestradiolu či arsen trioxidu se prozatím neuplatnilo (obr. 2) [12, 18]. U vybrané skupiny vysoce rizikových mladých nemocných je nutno zvážit i možnost VDT/ATKB s následnou nemyeloablativní, tj minialogenní transplantací kmenových buněk [6, 15]. Racionální postup používaný při individuálním výběru léčby a léčebné strategie u nově rozpoznaných MM vyplývá z obr. 4.
inhibitoru P13k/Akt dráhy (perifosin), inhibitorů farnesyltransferázy (tipifarnib), inhibitoru IGF-1 (insulin growth factor), receptoru růstového faktoru fibroblastů, nového alkylfosfolipidu perifosinu a dalších, zatímco použití 2-methoxyestradiolu či arsen trioxidu se prozatím neuplatnilo (obr. 2) [12, 18]. U vybrané skupiny vysoce rizikových mladých nemocných je nutno zvážit i možnost VDT/ATKB s následnou nemyeloablativní, tj minialogenní transplantací kmenových buněk [6, 15]. Racionální postup používaný při individuálním výběru léčby a léčebné strategie u nově rozpoznaných MM vyplývá z obr. 4.
Udržovací léčba
Stále nevyřešeným problémem léčby MM je krátkodobé, v průměru jen asi 1,5–2,5leté trvání léčebné odezvy. Ukázalo se, že vhodným řešením vedoucím k prodloužení OS není léčba s použitím intenzifikačních cyklů chemoterapie [3] ani dlouhodobá intermitentní terapie INF-a (3 miliony IU 3krát týdně podkožně) podávaná do progrese myelomu, která vede k prodloužení délky EFS a podle některých studií i OS o 5–7 měsíců [45]. Vzhledem k tomu, že některé studie tyto výsledky nepotvrdily a udržovací léčba INF-a je provázena řadou nežádoucích účinků a je navíc dosti nákladná, v současnosti se v této indikaci již nedoporučuje [6, 11, 18, 46]. S praktickým úspěchem a s rozšířením se nesetkala ani dlouhodobá udržovací terapie kortikosteroidy (prednison 10–50 mg ob den), a to přes jisté prodloužení EFS a OS v některých studiích [10, 47]. U vysoce rizikových nemocných lze po ukončení KT s nedosažením KR použít v udržovací terapii léčbu thalidomidem, případně v kombinaci s prednisonem, perspektivně se jeví velmi nadějně především lenalidomid. Naděje vkládané do udržovací terapie thalidomidem (100 mg/den po dobu 12 měsíců, nebo dle individuální tolerance) u nemocných, u nichž nebylo po VDT/ATKB dosaženo ≤ VGPR, je nutno ověřit, neboť dosavadní zkušenosti vyzněly rozporuplně. U nemocných s příznivou konstelací PF („good risk“) existují zprávy o podstatném prodloužení doby do progrese nemoci (40měsíční EFS u 70 % nemocných) a OS při udržovací terapii thalidomidem [10, 48], zatímco jiné studie upozorňují na úskalí snížené citlivosti k reindukční léčbě v období relapsu nemoci [49]. O reálném postavení thalidomidu v udržovací léčbě MM rozhodnou zřejmě až výsledky probíhajících randomizovaných studií. Předběžné výsledky hodnocení přínosu udržovací léčby po VDT/ATKB prozatím nedokládají přínos bortezomibu, v podstatně příznivějším světle se jeví opětovně přínos udržovací terapie lenalidomidem. Zkoumán je i význam imunomodulační terapie s použitím vakcín připravených s pomocí dendritických buněk [18].
Léčba relabujících a refrakterních forem MM
Stále svízelnou situací v terapii MM je léčba refrakterních forem nemoci, a to forem prvotně rezistentních či forem relabujících, neboť dosažená remise má stále pouze krátkodobý charakter. Klíčovým momentem při volbě léčby u nemocných s relapsem po předchozí chemoterapii je hloubka i délka trvání předchozí léčebné odezvy, charakter relapsu, počet a složení předchozích léčebných cyklů i přítomnost nepříznivých PF včetně věku a stavu klinické kondice, aktuální stav rezervy kostní dřeně, případně přítomnost a hloubka neutropenie a trombocytopenie. Za klíčové aspekty volby je však považována přítomnost vysoce rizikových cytogenetických změn a zejména složení předchozí terapie s tím, že se dává přednost působkům, které nebyly v předchozí terapii použity. V rámci 1. relapsu může být využita řada léčebných postupů.
V případě časného relapsu/progrese do 6 měsíců od ukončení léčby zůstává nadále léčbou volby použití VDT/ATKB, a to i když nepředchází VDT/ATKB. Nutno vždy ale zvážit, zdali je nemocný schopen transplantační léčbu podstoupit [50, 51]. U netransplantabilních nemocných se obvykle v rámci časného relapsu používají kombinované léčebné režimy s využitím pulzní léčby dexamethasonem v kombinaci s novými imunomodulačními působky. Nejčastěji je volen některý z následujících režimů: bortezomib nebo lenalidomid, případně i thalidomid s vysokými dávkami dexamethasonu, obohacené o melfalan, cyklofosfamid nebo doxorubicin včetně jeho liposolubilní formy (např. režim CTD, CVD, VMP, RP, RD, RCD, RCP, RAD, tab. 1) [52–54]. U nemocných v seniorském věku je používána obvykle verze „senior“ s nižší dávkou dexamethasonu, např. 20–40 mg/ den 1krát týdně (režim LD-RD), nebo je dána přednost prednisonu (režim RP, RCP nebo pouze VD či RD) [3, 10]. Výběrově lze použít při selhání předchozích kombinovaných režimů i vzájemné kombinace nových biologických působků, např. režim RVD, RVT (tab. 1, obr. 2).
V případě pozdního relapsu nebo progrese nemoci se dává přednost opakování počáteční terapie, jejíž délka podávání záleží na léčebné odezvě a toleranci. Nutno ale počítat s tím, že každý další relaps a nebo progrese nemoci jsou provázeny narůstající rezistencí s poklesem hloubky i délky trvání léčebné odezvy. Za vysoce rizikové nemocné („high risk“) je nutno považovat jedince relabující do 12 měsíců od VDT/ATKB a s přítomností vysoce rizikových cytogenetických změn, u nichž přichází v úvahu při selhání léčby režimy s použitím bortezomibu, lenalidomidu nebo jejich kombinace, v případě exprese znaku CD20 na myelomových elementech (CD20 fenotyp), začlenění monoklonální protilátky anti-CD20 (rituximab), nebo experimentální terapie v rámci klinických studií s použitím zcela nových, do léčby teprve zaváděných léčebných látek (obr. 2) [18].
Podpůrná terapie
Integrální, velice významnou součástí terapie MM je podpůrná léčba, podílející se významně na zvládání průvodních projevů nemoci a zlepšení kvality života (obr. 1). U nemocných s významnými klinickými projevy anemického syndromu lze namísto krevních převodů použít působky s erytropoetickým účinkem, nejběžněji rekombinantní lidský erytropoetin (rHuEPO 150–300 IU/kg 1–3krát týdně), případně i darbepoetin; při jejich podávání se léčebná odezva dostavuje po vyloučení, nebo léčebném podchycení nedostatku železa, kyseliny listové nebo vitaminu B12 asi u 70 % jedinců v průběhu 4–6 týdnů. V současnosti je přistupováno k léčbě rHuEPO, a to zejména při terapii thalidomidem nebo lenalidomidem, pro vysoké riziko tromboembolické nemoci nanejvýš obezřetně. Používá se především při významné chudokrevnosti přetrvávající přes účinnou chemoterapii nebo při přítomnosti chronické renální insuficience s tím, že terčovou hodnotou Hb je 100–110 g/l [15]. V případě závažné febrilní neutropenie, zejména v důsledku intenzivní chemoterapie či aktinoterapie je plně indikováno použití leukocytárních růstových působků (především G-CSF), které zkracuje trvání neutropenie a významně tak přispívá ke zvládnutí zánětlivých komplikací. Při léčbě nebo profylaxi rekurentních infekcí podmíněných významnou hypoimunoglobulinemií lze s úspěchem použít nitrožilního podání imunoglobulinu (0,4 g/kg/měsíc) [3, 6]. V rámci profylaxe bakteriálních zánětů a infekce Pneumocystis carinii a virových infektů (zejména reaktivace pásového oparu) v potransplantačním období se používá profylaktické podání kombinace cotrimoxazolu nebo fluorochinolonových přípravků, antimykotik a antivirových působků, doporučována je i vakcinace proti Streptococcus pneumoniae, Haemophilus influenzae a očkování proti chřipce. Renální insuficience (RI) se u pacientů s MM vyznačuje multifaktoriální etiologií: vedle paraproteinemické nefropatie s obliterací tubulů odlitky lehkých řetězců se může uplatnit i hyperkalcemie, dehydratace, hyperviskozita, léčba nesteroidními antirevmatiky a dalšími přípravky s nefrotoxickým potenciálem, vzácněji i koexistence s AL-amyloidózou. RI u MM by měla být řešena velmi rychle a aktivně, neboť u velmi významné části nemocných lze dosáhnout úpravy renální funkce. Základním imperativem je agresivní hydratace (přísun ~ 2,5–3,5 litru tekutin denně) s případným podáním kličkového diuretika, úprava hyperurikemie s pomocí allopurinolu a pH moče podáním bikarbonátu, ke zvládnutí hyperkalcemie přispívá nitrožilní aplikace kortikosteroidů a bisfosfonátu, např. pamidronátu nebo kyseliny zoledronové [3, 6, 11, 15]. Namísto plazmaferézy je v současnosti doporučována ke snížení zátěže volnými lehkými řetězci (kappa nebo lambda) eliminace s pomocí hemodialýzy s použitím tzv. high cut-off speciálních dialyzátorů (HCO-HD), umožňujících eliminovat velké množství volných lehkých řetězců a část nemocných vyvést ze závislosti na chronické hemodialýze [55]. Základním imperativem je ale okamžité zahájení antimyelomové léčby, v současnosti nejraději kombinací bortezomibu, dexamethasonu, případně i doxorubicinu [7, 18]. Nemocní s pokročilou, perzistující renální insuficiencí jsou zařazováni do chronického dialyzačního programu nebo do programu CAPD (chronická ambulantní peritoneální dialýza), v případě dosažení kompletní remise byla ojediněle použita úspěšně i transplantace ledviny. Význačným přínosem v řešení hyperviskózního syndromu je velkoobjemová plazmaferéza sdružená s intenzivní chemoterapií. Integrální součástí terapie zejména II.–III. stadia (dle D-S) MM s radiografickými projevy MKN je dlouhodobá terapie bisfosfonáty se současnou suplementací vápníku, a to perorální terapií kyselinou klodronovou, v současnosti ale raději pozvolnou nitrožilní aplikací 90 mg pamidronátu nebo 4 mg kyseliny zoledronové v intervalu 3–4 týdnů [3, 55]. Tato léčba přispívá inhibicí kostní resorpce ke snížení bolestí v oblasti skeletu a především k poklesu výskytu osteolytických lézí a patologických zlomenin včetně kompresivních zlomenin obratlů [57]. Prozatím nevyřešena zůstává délka terapie bisfosfonáty a ojedinělý výskyt osteonekrózy čelisti zejména v návaznosti na zubní extrakci, zaznamenaný především při léčbě kyselinou zoledronovou [22, 56]. Významným přínosem v řešení kompresivních zlomenin obratlů je provedení vertebroplastiky a kyfoplastiky, přispívající k restauraci výšky obratlových těl, ke snížení bolesti a ke zlepšení statodynamických funkcí páteře. U vybraných nemocných je nezbytný operační fixační zákrok v případné kombinaci s ložiskovou radioterapií, indikovaný k prevenci nebo i léčbě patologických zlomenin v oblasti osteolytické léze. Nedílnou součástí léčby MKN je i účinná analgetická terapie se začleněním opioidů, zpevnění páteře korzetem a v případě neúspěchu chemoterapie ložisková aktinoterapie, nutno dbát i na individuálně pojatou rehabilitaci [3, 58].
Nutno uvést, že velmi podrobnou informaci o problematice diagnostiky a současné léčby MM je možno nalézt v „Souhrnu doporučení 2009 – Diagnostika a léčba mnohočetného myelomu“, vypracovaném čelnými představiteli České myelomové skupiny s originálním konceptem léčebných režimů „junior“ a „senior“, zohledňujících věkově odlišnou toleranci k jednotlivým složkám hybridních režimů a v podstatě zpřístupňujících biologickou terapii nemocným v seniorském věku [3].
Závěr
Z předloženého sdělení vyplývá, že navzdory významnému pokroku, kterého bylo dosaženo na poli léčby mnohočetného myelomu zejména v posledním desetiletí, zůstává stále mnoho otevřených výzev. I když došlo k významné změně léčebného paradigmatu MM v důsledku začlenění nových biologických působků, je nepochybné, že řada dílčích léčebných cílů zůstala nevyřešena. Především je nezbytné nalézt vhodnější přípravný režim před VDT/ATKB, efektivnější a důslednější způsob eliminace myelomových elementů a zejména jejich prekurzorových forem; je třeba vyvinout mnohem bezpečnější formu alogenní TKB a navzdory současné, dosti široké paletě používaných léků vnést do terapie MM zcela nové, ještě účinnější přípravky, jež by umožnily sestavování individuálně specificky volených léčebných „koktejlů“, s víceterčovým účinkem. Je nasnadě, že zcela legitimním perspektivním cílem léčby MM je vyléčení nemocných postižených touto těžkou a doposud stále nevyléčitelnou, i když stále lépe zvládatelnou chorobou.
Seznam použité literatury
- [1] International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Brit J Haematol 2003; 121: 749–757.
- [2] Kyle RA, Rajkumar SV. Criteria for diagnosis, staging, risk stratification and response assessment of multiple myeloma. Leukemia 2009; 23: 3–9.
- [3] Hájek R, Adam Z, Maisnar V, et al., Česká myelomová skupina. Souhrn doporučení 2009 „Diagnostika a léčba mnohočetného myelomu“. Transfuze Hematol dnes 2009; 15 (suppl. 2): 1–80.
- [4] Adam Z, Krejčí M, Vorlíček J, et al. Hematologie. Přehled maligních hematologických onemocnění. 2. vyd. Praha, Grada, 2008.
- [5] Špička I, et al. Mnohočetný myelom a další monoklonální gamapatie. 1. vyd. Praha, Galén, 2005.
- [6] Kyle RA, Rajkumar SV. Multiple myeloma. Blood 2008; 111: 2962–2972.
- [7] Rajkumar SV, Kyle RA. Treatment of multiple myeloma and related disorders. 1st edit. Cambridge: Cambridge University Press, 2009.
- [8] Durie BGM, Salmon SE. A clinical staging system for multiple myeloma. Correlation of measured myeloma cell mass with presenting clinical features, response to treatment, and survival. Cancer 1975; 36: 842–854.
- [9] Greipp PR, San Miguel J, Durie BGM, et al. International staging system for multiple myeloma. J Clin Oncol 2005; 23: 3412–3420.
- [10] Dispenzieri A, Rajkumar SV, Gertz MA, et al. Treatment of newly diagnosed multiple myeloma based on Mayo stratification of myeloma and risk-adapted therapy (mSMART): Consensus statement. Mayo Clin Proc 2007; 82: 323–341.
- [11] Kyle RA, Rajkumar SV. UpToDate: Chemotherapy in multiple myeloma./topics (1).htm.
- [12] San Miguel JF, Mateos MV, Pandiella A. Novel drugs for multiple myeloma. Hematology 2006; 2: 205–211.
- [13] Hideshima T, Anderson KC. Molecular mechanisms of novel therapeutic approaches for multiple myeloma. Nat Rev Cancer 2002; 2: 927–937.
- [14] Anderson KC, Kyle RA, Rajkumar SV, et al. Clinically relevant end points and new drug approvals for myeloma. Leukemia 2008; 22: 231–239.
- [15] Kumar S, Rajkumar SV, Anderson KC. Current treatment of multiple myeloma. Clin Oncol News, www.myeloma.org; www.multiplemyeloma.org
- [16] Gahrton G, Durie BGM, Samson DM. Multiple myeloma and related disorders. 1st edit. London: Arnold, 2004. 466 p.
- [17] Harousseau JL, Attal M. The role of autologous hematopoietic stem cell transplantation in multiple myeloma. Semin Hematol 1997; 34 (Suppl. 1): 61–66.
- [18] Lonial S. Myeloma therapy. Pursuing the plasma cell. 1st edit. Totowa: Humana Press, 2008.
- [19] Attall M, Harousseau JL, Stoppa AM, et al. A prospective, randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma. Intergroupe Francais du Myelome. N Engl J Med 1996; 335: 91–97.
- [20] Harousseau J-L, Marit G, Caillot D, et al. VELCADE/Dexamethasone (Vel/Dex) versus VAD as induction treatment prior to autologous stem cell transplantation (ASCT) in newly diagnosed multiple myeloma (MM): an interim analysis of the IFM 2005-01 randomized multicenter Phase III trial. ASH Annual Meeting Abstracts 2006; 108(11): abstract 56.
- [21] Richardson PG, Barlogie B, Berenson J, et al. A phase 2 study of bortezomib in relapsed refractory myeloma. N Engl J Med 2003; 348: 2609–2617.
- [22] Denz U, Haas PS, Wäsch R, et al. State of the art therapy in multiple myeloma and future perspectives. Eur J Cancer 2006; 42: 1591–1600.
- [23] Palumbo A, Dimopoulos M, San Miguel J, et al. Lenalidomide in combination with dexamethasone for treatment of relapsed or refractory multiple myeloma. Blood Reviews 2009; 23: 87–93.
- [24] Rajkumar SV, Jacobus S, Callander N, et al. Phase III trial of lenalidomide plus high-dose dexamethasone versus lenalidomide plus low-dose dexamethasone in newly diagnosed multiple myeloma (E4A03): a Trial coordinated by the Eastern Cooperative Oncology Group. J Clin Oncol 2007; 25: LBA8025.
- [25] Jagannath S, Durie BGM, Wolf J, et al. Bortezomib therapy alone and in combination with dexamethasone for previously untreated symptomatic multiple myeloma. Br J Haematol 2005; 129: 776–783.
- [26] Cavo M, Zamagni E, Tosi P, et al. Superiority of thalidomide and dexamethasone over vincristine-doxorubicin-dexamethasone (VAD) as primary therapy in preparation for autologous transplantation for multiple myeloma. Blood 2005; 106: 35–39.
- [27] Blade J, Rosin~ol L, Sureda A, et al. High-dose therapy intensification compared with continued standard chemotherapy in multiple myeloma patients responding to the initial chemotherapy: long-term results from a prospective randomized trial from Spanish cooperative group PETHEMA. Blood 2005; 106: 3755–3759.
- [28] Fermand JP, Katsahian S, Divine M, et al. High-dose therapy and autologous blood stem-cell transplantation compared with conventional treat-ment in myeloma patients aged 55 to 65 years: long-term results of a randomized control trial from the Group Myelome-autograffe. J Clin Oncol 2005; 23: 9227–9233.
- [29] Child JA, Morgan GJ, Davies FE, et al. High-dose chemotherapy with hematopoietic stem cell rescue for multiple myeloma. N Engl J Med 2003; 348: 1875–1883.
- [30] Fermand JP, Ravaud P, Chevret S, et al. High-dose therapy and autologous peripheral blood stem transplantation in multiple myeloma: up-front or rescue treatment? Result of multicenter sequential randomized clinical trial. Blood 1998; 92: 3131–3136.
- [31] Attal M, Harousseau JL, Facon T, et al. Single versus double autologous stem-cell transplantation for multiple myeloma. N Engl J Med 2003; 349: 2495–2502.
- [32] Cavo M, Cellini C, Zamagni E, et al. Superiority of double over single autologous stem cell transplantation as first-line therapy for multiple myeloma. ASH Annual Meeting Abstracts 2004; 104: 536.
- [33] Bensinger WI, Buckner CD, Anasetti C, et al. Allogeneic marrow transplantation for multiple myeloma: an analysis of risk factors on outcome. Blood 1996; 88: 2787–2793.
- [34] Björkstrand BB, Ljungman P, Svensson H, et al. Allogeneic bone marrow transplantation versus autologous stem cell transplantation in multiple myeloma: a retrospective case-matched study from the European Group for Blood and Marrow Transplantation. Blood 1996; 88: 4711–4718.
- [35] Tricot G, Vesole DH, Jagannath S, et al. Graft-versus-myeloma effect: proof of principle. Blood 1996; 87: 1196–1198.
- [36] Garban F, Attal M, Michallet M, et al. Prospective comparison of autologous stem cell transplantation followed by dose-reduced allograft (IFM99-03 trial) with tandem autologous stem cell transplantation (IFM99-04) in high risk de novo multiple myeloma. Blood 2006; 107: 3474–3480.
- [37] Gregory WM, Richards MA, Malpas JS. Combination chemotherapy versus melphalan and prednisolone in the treatment of multiple myeloma: an overview of published trials. J Clin Oncol 1992; 10: 334–342.
- [38] Myeloma Trialists’ Collaboration Group. Combination therapy versus melphalan plus prednisone as treatment for multiple myeloma: an over-view of 6,633 patients from 27 randomized trials. J Clin Oncol 1998; 16: 3832–3842.
- [39] Palumbo A, Bringhen S, Caravita T, et al. Oral melphalan and prednisone chemotherapy plus thalidomide compared with melphalan and prednisone alone in elderly patients with multiple myeloma: a randomised controlled trial. The Lancet 2006; 367: 825–831.
- [40] Facon T, Mary JY, Hulin C, et al. Major superiority of melphalan-prednisone (MP) + thalidomide (THAL) over MP and autologous stem cell transplantation in the treatment of newly diagnosed elderly patients with multiple myeloma. Blood 2005; 106: 230–239.
- [41] Mateos MV, Hernández JM, Hernández MT, et al. Bortezomib plus melphalan and prednisone in elderly untreated partients with multiple myeloma: results of a multicenter phase 1/2 study. Blood 2006; 108: 2165–2172.
- [42] Palumbo A, Falco P, Corradini P, et al. Melphalan, prednisone, and lenalidomide treatment for newly diagnosed myeloma: a report from the Gimena Italian Multiple Myeloma Network. J Clin Oncol 2007; 25: 4459–4465.
- [43] San Miguel JF, Schlag R, Khuageva NK, et al. Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma. New J Engl Med 2008; 359: 906–917.
- [44] Gertz MA, Lacy MQ, Dispenzieri A, et al. Clinical implications of t(11;14) (q13;q32), t(4;14) (p16.3;q32), and -17p13 in myeloma patients treated with high-dose therapy. Blood 2005; 106: 2837–2840.
- [45] The Myeloma Trialists’ Collaborative Group. Interferon as therapy for multiple myeloma: an individual patient data overview of 24 randomized trials and 4012 patients. Br J Haematol 2001; 113: 1020–1034.
- [46] Cunningham D, Powles R, Malphas J, et al. A randomized trial of maintenance interferon following high-dose chemotherapy in multiple myeloma: long-term follow-up results. Br J Haematol 1998; 102: 495–502.
- [47] Berenson JR, Crowley JJ, Grogan JM, et al. Maintenance therapy with alternate-day prednisone improves survival in multiple myeloma patients. Blood 2002; 99: 3163–3168.
- [48] Attal M, Harousseau JL, Leyvraz S, et al. Maintenance therapy with thalidomide improves survival in patients with multiple myeloma. Blood 2006; 108: 3289–3294.
- [49] Owen RG, Child JA, Jackson GH, et al. MRC Myeloma IX: preliminary results from the intensive pathway study. XIIth International myeloma workshop 2009, Washington, Abstract book: No: 546.
- [50] Vesole DH, Crowley JJ, Catchatourian R, et al. High-dose melphalan with autotransplantation for refractory multiple myeloma: results of a Southwest Oncology Group phase II trial. J Clin Oncol 1999; 17: 2173–2179.
- [51] Rajkumar SV, Fonseca R, Lacy MQ, et al. Autologous stem cell transplantation for relapsed and primary refractory myeloma. Bone Marrow Transplant 1999; 23: 1267–1272.
- [52] Jagannath S, Barlogie B, Berenson JR, et al. Bortezomib in recurrent and/or refractory multiple myeloma. Cancer 2005; 103: 1195–1200.
- [53] Weber DM, Chen Ch, Niesvizky R, et al. Lenalidomide plus dexamethasone for relapsed multiple myeloma in North America. New Engl J Med 2007; 357: 2133–2142.
- [54] Richardson PG, Sonneveld P, Schuster M, et al. Extended follow-up of phase 3 trial in relapsed multiple myeloma: final time-to-event results of the Apex trial. Blood 2007; 110: 3557–3560.
- [55] Hutchinson CA, Bradwell AR, Cook M, et al. Treat-ment of acute renal failure secondary to multiple myeloma with chemotherapy and extended high cut-off hemodialysis. Clin J Am Soc Nephrol 2009: 4: 745–754.
- [56] Lacy MQ, Dispenzieri A, Gertz MA, et al. Mayo Clinic consensus statement for the use of bisphosphonates in multiple myeloma. Mayo Clin Proceedings 2006; 81: 1047–1053.
- [57] Berenson JR, Lichtenstein A, Porter L, et al. Long term pamidronate treatment of advanced multiple myeloma patiens reduces skeletal events. Myeloma Aredia Study Group. J Clin Oncol 1998; 16: 593–602.
- [58] Shrive DC. The role of radiotherapy In: Mehta J, Singhal S, editors. Myeloma. 1st edit. London, Martin Dunitz Publisher, 2002: 367–383.