Současné možnosti léčby osteoartrózy
Osteoartróza (OA) je heterogenní skupinou degenerativních kloubních onemocnění, která mají podobný klinický a morfologický obraz. Z hlediska počtu nemocných představuje OA nejčastější kloubní onemocnění. Ve své podstatě se jedná o fokální proces degenerativní přestavby kloubní chrupavky s reaktivními změnami v přilehlých měkkých tkáních a subchondrální kosti. Terapie OA vychází částečně ze znalosti rizikových faktorů vzniku a progrese a dále z výsledků velkých klinických studií, provedených v posledních letech. Jsou zde popsána dvě zásadní doporučení pro léčbu gonartrózy a koxartrózy, která byla částečně vytvořena na základě průkazných zjištění v rámci medicíny založené na důkazech. Jde o Doporučení Evropské ligy proti revmatismu (EULAR) a Doporučení Organizace pro výzkum artrózy (OARSI). Komplexní léčba OA zahrnuje nefarmakologická opatření a farmakoterapii.
Úvod
Osteoartróza (OA) představuje heterogenní skupinu kloubních onemocnění s podobným klinickým a morfologickým obrazem, jež jsou závažnou příčinou chronické muskuloskeletální bolesti, zhoršení funkce a disability lidí staršího věku [1]. Jedná se o nejčastější kloubní onemocnění – postihuje až 12 % populace a s věkem jeho výskyt stoupá. V populaci starší 65 let trpí bolestmi kyčelních nebo kolenních kloubů až 40 % osob. 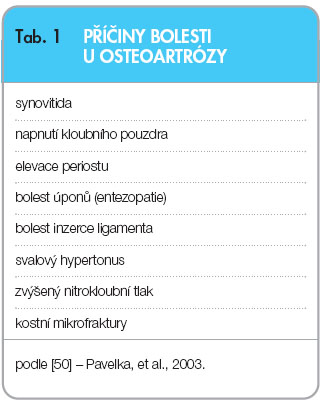 Nejčastější lokalizací OA jsou kolenní klouby, následují klouby kyčelní, drobné klouby rukou a klouby na páteři, ale v principu může být osteoartrózou postižen kterýkoliv kloub [2]. Při osteoartróze dochází k poruše rovnováhy mezi anabolickými a degradačními pochody ve prospěch degradace, což vede k destrukci chrupavky. Kromě degradace však dochází i k reaktivním změnám v přilehlých kloubních tkáních – v subchondrální kosti (hyperemie, „kostní hypertenze“, tvorba osteofytů, vznik mikrofraktur, kostních pseudocyst), v synoviální membráně (synovitida s tvorbou výpotku a distenzí kloubního pouzdra), meniscích, vazech i přilehlých svalových skupinách. V chrupavce dochází k
Nejčastější lokalizací OA jsou kolenní klouby, následují klouby kyčelní, drobné klouby rukou a klouby na páteři, ale v principu může být osteoartrózou postižen kterýkoliv kloub [2]. Při osteoartróze dochází k poruše rovnováhy mezi anabolickými a degradačními pochody ve prospěch degradace, což vede k destrukci chrupavky. Kromě degradace však dochází i k reaktivním změnám v přilehlých kloubních tkáních – v subchondrální kosti (hyperemie, „kostní hypertenze“, tvorba osteofytů, vznik mikrofraktur, kostních pseudocyst), v synoviální membráně (synovitida s tvorbou výpotku a distenzí kloubního pouzdra), meniscích, vazech i přilehlých svalových skupinách. V chrupavce dochází k 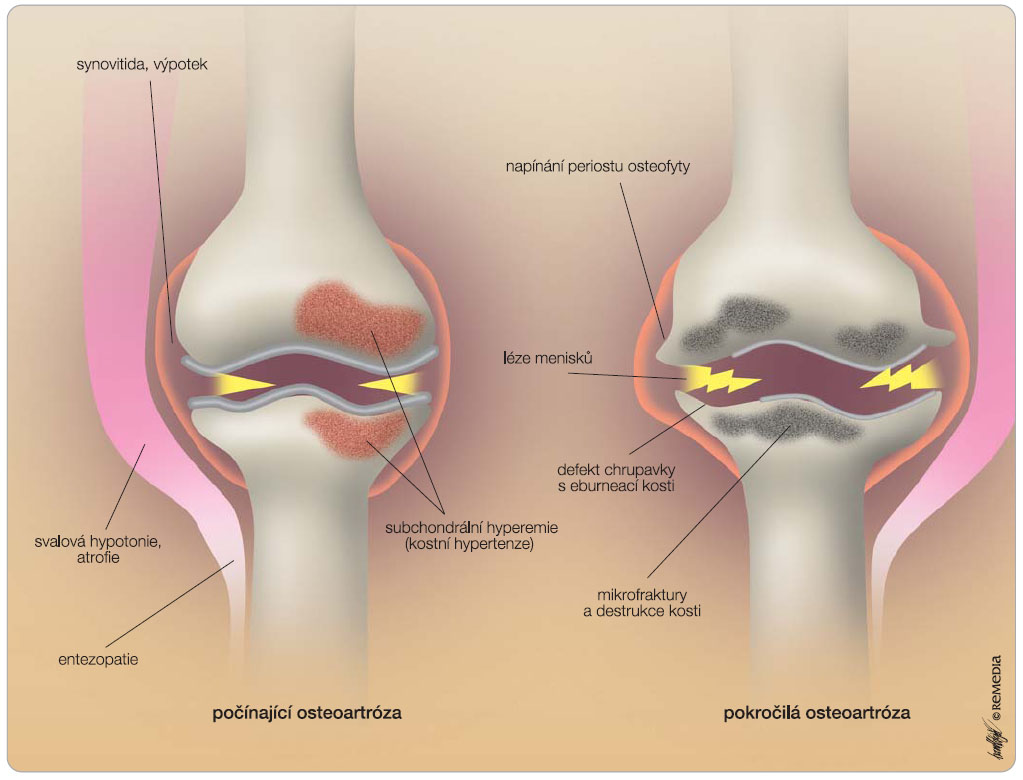 poruše metabolismu mezibuněčné hmoty chrupavky a ke zhoršení její kvality. V důsledku zvýšené degradace a nedostatečné novotvorby se snižuje množství a molekulová hmotnost proteoglykanů, je poškozena kolagenní síť, zvyšuje se obsah vody. Tyto zásadní změny nejsou ale samy o sobě zdrojem bolesti, neboť chrupavka nemá nervové zásobení. Bolest začne pacient pociťovat právě teprve při postižení okolních kloubních tkání (tab. 1, obr. 1). Právě bolest a později ztuhlost, omezená hybnost a instabilita v postiženém kloubu jsou hlavními příznaky osteoartrózy, které přivádějí pacienta do ordinace lékaře.
poruše metabolismu mezibuněčné hmoty chrupavky a ke zhoršení její kvality. V důsledku zvýšené degradace a nedostatečné novotvorby se snižuje množství a molekulová hmotnost proteoglykanů, je poškozena kolagenní síť, zvyšuje se obsah vody. Tyto zásadní změny nejsou ale samy o sobě zdrojem bolesti, neboť chrupavka nemá nervové zásobení. Bolest začne pacient pociťovat právě teprve při postižení okolních kloubních tkání (tab. 1, obr. 1). Právě bolest a později ztuhlost, omezená hybnost a instabilita v postiženém kloubu jsou hlavními příznaky osteoartrózy, které přivádějí pacienta do ordinace lékaře.
Terapie osteoartrózy vychází tedy částečně ze znalosti rizikových faktorů vzniku a progrese onemocnění a dále z výsledků velkých klinických studií provedených v posledních letech. Terapie OA by měla být komplexní a individuálně navržená s ohledem na lokalizaci artrózy, stadium choroby, příznaky zánětu (výpotek), stupeň bolesti a disability, rizikové faktory progrese gonartrózy a koxartrózy (věk, obezita, nepříznivé mechanické faktory, fyzická aktivita). Dále je nutné vzít v úvahu spolupráci pacienta, přidružená interní onemocnění a souběžnou terapii.
Léčba osteoartrózy kolenních a kyčelních kloubů by se měla tedy zaměřit na dosažení následujících cílů: zmenšení bolesti a ztuhlosti, uchování a zlepšení pohyblivosti, zmenšení fyzické disability a hendikepu, zlepšení k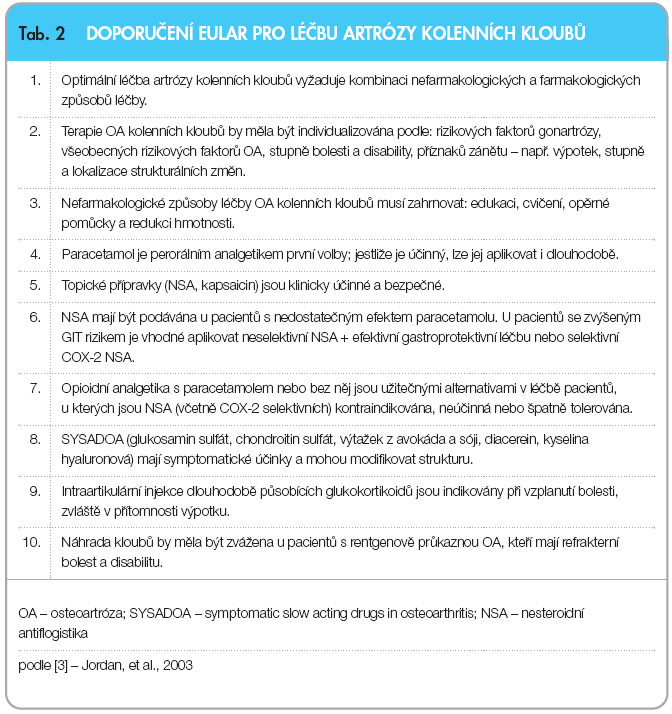 vality života závislé na zdraví, omezení progrese kloubní destrukce a vzdělávání a informování pacientů o charakteru onemocnění a principech léčby. V nedávné době byla přepracována a novelizována evropská a mezinárodní doporučení pro léčbu OA, která vycházejí ze zkušeností zúčastněných odborníků. Evropská liga proti revmatismu (European League Against Rheumatism – EULAR) vydala v roce 2003 na základě principů založených na důkazech Doporučení pro léčbu gonartrózy [3] (tab. 2). Mezinárodní organizace pro výzkum osteoartrózy (OsteoArthritis Research Society International – OARSI) vydala svá nová doporučení pro léčbu gonartrózy a koxartrózy v roce 2008 [4]. Pracovní skupina OARSI se skládala ze 16 expertů pocházejících z 6 zemí 2 kontinentů a mezi odborníky byli zastoupeni praktičtí lékaři, ortopedi, revmatologové
vality života závislé na zdraví, omezení progrese kloubní destrukce a vzdělávání a informování pacientů o charakteru onemocnění a principech léčby. V nedávné době byla přepracována a novelizována evropská a mezinárodní doporučení pro léčbu OA, která vycházejí ze zkušeností zúčastněných odborníků. Evropská liga proti revmatismu (European League Against Rheumatism – EULAR) vydala v roce 2003 na základě principů založených na důkazech Doporučení pro léčbu gonartrózy [3] (tab. 2). Mezinárodní organizace pro výzkum osteoartrózy (OsteoArthritis Research Society International – OARSI) vydala svá nová doporučení pro léčbu gonartrózy a koxartrózy v roce 2008 [4]. Pracovní skupina OARSI se skládala ze 16 expertů pocházejících z 6 zemí 2 kontinentů a mezi odborníky byli zastoupeni praktičtí lékaři, ortopedi, revmatologové  a výzkumníci. Tato skupina provedla revizi databáze od roku 1945 do roku 2006 pomocí Delfské metody. Výběr doporučení byl založen na kritickém zhodnocení stávajících doporučení, systematickém přehledu vědeckých důkazů a na shodě zkušeností těchto odborníků. Tímto způsobem bylo vydáno 25 doporučení, která zahrnují nefarmakologické, farmakologické a chirurgické postupy (tab. 3).
a výzkumníci. Tato skupina provedla revizi databáze od roku 1945 do roku 2006 pomocí Delfské metody. Výběr doporučení byl založen na kritickém zhodnocení stávajících doporučení, systematickém přehledu vědeckých důkazů a na shodě zkušeností těchto odborníků. Tímto způsobem bylo vydáno 25 doporučení, která zahrnují nefarmakologické, farmakologické a chirurgické postupy (tab. 3).
Dle prvního bodu tohoto dokumentu musí být léčba osteoartrózy vždy komplexní a vyžaduje kombinaci nefarmakologických a farmakologických postupů. Velikost účinku pro úlevu od bolesti byla i u nefarmakologické léčby v randomizovaných studiích signifikantně vyšší než u placeba, ale jen mírná (ES 0,25; 95% CI: 0,16–0,34), při hodnocení farmakologických postupů pro úlevu od bolesti byla velikost střední (ES 0,39; 95% CI: 0,31–0,47).
Nefarmakologické postupy
Všichni pacienti by měli být dostatečně informováni o charakteru onemocnění, možnostech jeho léčby a významu úpravy životního stylu, pravidelného cvičení, redukci hmotnosti a jiných postupech vedoucích k odlehčení postižených kloubů. Zpočátku je třeba se zaměřit na samoléčení pacientem a na jeho aktivní přístup k terapii, je potřeba věnovat pozornost a dostatečné úsilí motivaci pacienta ke spolupráci při nefarmakologické léčbě. Pacienti by měli být odesláni k fyzioterapeutovi, který zhodnotí stav pacienta a poskytne instruktáž ke cvičení zaměřenému na snížení bolesti a zlepšení funkční kapacity kloubu. Pacientům by mělo být doporučeno pravidelné cvičení (aerobní cvičení, cvičení na posilování svalstva a cvičení ke zlepšení rozsahu hybnosti v postiženém kloubu). U nemocných s koxartrózou je vhodné též cvičení ve vodě. Pacienti s nadváhou by se měli pokusit o redukci hmotnosti a snažit se ji udržovat na co nejnižší úrovni. Použití opěrných pomůcek může snížit bolest v kloubu, pacienty je nutno instruovat o použití holí a berlí a jejich uchopení a manipulaci s kontralaterální končetinou. U pacientů s bilaterálním postižením jsou vhodná chodítka. U pacientů s gonartrózou s mírnou až středně závažnou varózní či valgózní instabilitou kolenního kloubu může ortéza zmírnit bolest, zlepšit stabilitu kloubu a tak snížit riziko pádu. Všechny pacienty s koxartrózou a gonartrózou je třeba poučit o výběru vhodné obuvi, vložky do bot mohou snížit bolest a zlepšit chůzi. Některé formy kryoterapie a termoterapie mohou mít krátkodobý symptomatický efekt stejně jako transkutánní elektrická nervová stimulace (TENS) a akupunktura.
Farmakoterapie
Farmakoterapie je indikována při nedostatečném efektu nefarmakologických opatření a je v podstatě doplňkem nefarmakologické léčby. Cílem farmakoterapie je zmírnit subjektivní potíže spojené s OA (symptomatický efekt) a zpomalit další progresi onemocnění (strukturální efekt).
Z farmakologických modalit jsou doporučeny: paracetamol, COX-2 selektivní i neselektivní nesteroidní antiflogistika (NSA), topicky používaná NSA a kapsaicin, intraartikulární aplikace glukokortikoidů a kyseliny hyaluronové, glukosamin sulfát a chondroitin sulfát pro symptomatický i strukturální efekt u gonartrózy, diacerein pro strukturální efekt u bolestivé koxartrózy a u neovlivnitelné bolesti (refrakterní bolesti) opioidní analgetika. V současné době je k symptomatické léčbě mírné až středně silné bolesti u gonartrózy a koxartrózy doporučován jako lék první volby paracetamol v maximální dávce 4 g/den. Bylo publikováno několik metaanalýz, které srovnávaly účinnost paracetamolu a NSA u OA [5, 6]. Zhang ve své metaanalýze z roku 2004 došel k závěrům, že paracetamol je účinný v léčbě bolesti u OA (ES 0,21; 95% CI: 0,02–0,41) [6], ale novelizovaná revize Cochranovy databáze zahrnující sedm studií kontrolovaných placebem [7] signifikantní snížení bolesti neprokázala (ES 0,13; 95% CI: 0,04–0,22). Ani ve studii GUIDE, která byla publikována po kompletaci Cochranovy databáze v roce 2007, nebyl prokázán signifikantní efekt na redukci bolesti u gonartrózy [8]. Zároveň podle současných dostupných údajů se ukazuje, že paracetamol nemá signifikantní účinek na ztuhlost (ES 0,16; 95% CI: -0,05–0,37), ani na funkční zdatnost (ES 0,09; 95% CI: -0,03–0,22) u pacientů s gonartrózou [9].
I přes výše uvedená zjištění by z bezpečnostních důvodů měl být paracetamol lékem první volby při bolesti u OA (a pokud je dostatečně účinný, měl by být podáván i dlouhodobě), ovšem v dávce nižší než 4 g/den a v maximální jednotlivé dávce 650 mg dle doporučení amerického Úřadu pro potraviny a léky. Vzhledem k jeho krátkému poločasu je nutné ho aplikovat 4–6krát denně. Paracetamol lze též kombinovat s NSA nebo opioidy, je také relativně velmi levný.
Při nedostatečné odpovědi nebo u bolesti spojené se zánětem je třeba zvážit jiné možnosti farmakoterapie s ohledem na jejich účinnost a bezpečnost, komorbiditu pacienta a souběžnou medikaci. Podáváme NSA v co nejnižších dávkách a po co nejkratší dobu.
Nový systematický přehled terapie perorálními NSA, který byl publikován v roce 2007 [10], zahrnuje data ze 27 studií kontrolovaných placebem. Velikost účinku NSA na bolest byla jen malá (ES 0,20; 95% CI: 0,22–0,35), ale přesto byla dvakrát větší než účinnost paracetamolu (ES 0,14; 95% CI: 0,05–0,23) [7]. Důkaz, že NSA jsou účinnější než paracetamol v ovlivnění bolesti, poskytuje i Zhangova metaanalýza [6]. Autor dospěl k závěrům, že NSA jsou účinnější než paracetamol (ES 0,20; 95% CI: 0,1–0,3), a rovněž počet pacientů, kteří preferují NSA, je vyšší než těch, kteří dávají přednost paracetamolu (RR 2,46; 95% CI: 1,5–4,12). NSA ale vyvolávají častěji gastrointestinální (GIT) nežádoucí účinky (RR 1,35; 95% CI: 1,05–1,75). Metaanalýza 10 velkých, randomizovaných, dvojitě slepých studií s více než 10 tisíci pacienty prokázala účinnost NSA oproti placebu, nicméně velikost účinku byla relativně malá (ES 0,32; 95% CI: 0,24–0,39) [11]. U pacientů se zvýšeným rizikem zažívacích nežádoucích účinků (vyšší věk, vředová choroba nebo NSA gastropatie v anamnéze, souběžná terapie glukokortikoidy, antikoagulancii a inhibitory SSRI) je tedy třeba podávat neselektivní NSA současně s gastroprotektivy (inhibitory protonové pumpy, PPI) nebo indikovat selektivní inhibitory COX-2. Riziko hospitalizace pro GIT toxicitu u pacientů užívajících neselektivní NSA bylo 2krát větší než u pacientů, kteří dostávali COX-2 selektivní celekoxib (2,18; 95% CI: 1,82–2,61) nebo neselektivní NSA společně s PPI (2,21; 95% CI: 1,51–3,24) [12]. Recentní randomizované studie ukazují, že zatímco léčba samotným celekoxibem byla zatížena 9% rizikem opakovaného GIT krvácení u pacientů s anamnézou GIT krvácení, současné užití PPI toto riziko snižuje [13]. Toto zjištění bylo podpořeno daty z 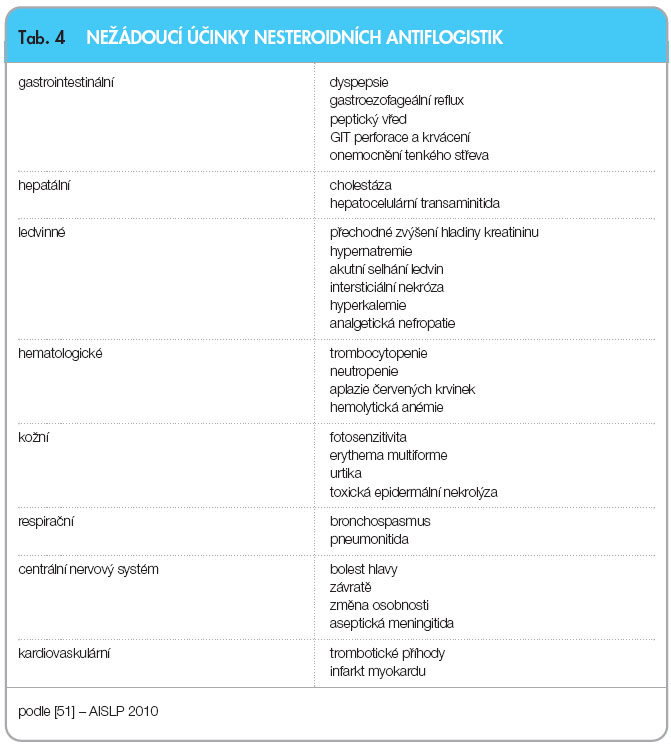 retrospektivní kohortové studie, ve které bylo riziko GIT krvácení sníženo při současném podávání PPI a celekoxibu o 30 % u pacientů starších 75 let [14]. Nedávná analýza ve státní zdravotní péči v UK prokázala, že současná tříměsíční preskripce PPI s tradičními i COX-2 selektivními inhibitory byla nákladově efektivnější [15].
retrospektivní kohortové studie, ve které bylo riziko GIT krvácení sníženo při současném podávání PPI a celekoxibu o 30 % u pacientů starších 75 let [14]. Nedávná analýza ve státní zdravotní péči v UK prokázala, že současná tříměsíční preskripce PPI s tradičními i COX-2 selektivními inhibitory byla nákladově efektivnější [15].
Kromě poměrně značné GIT toxicity mají NSA i nežádoucí účinky na kardiovaskulární a renální systém [16] (tab. 4). Vyšší výskyt kardiovaskulárních (KV) trombotických příhod po aplikaci celekoxibu [17] a etorikoxibu není jednoznačný [18]. Srovnávací metaanalýza řady studií nepotvrdila signifikantní rozdíl ve výskytu KV příhod mezi COX-2 selektivními a neselektivními NSA [12]. Současné doporučení EMA kontraindikuje použití koxibů u pacientů s ischemickou chorobou srdeční (ICHS) nebo cévní mozkovou příhodou a nabádá k velké opatrnosti u pacientů s rizikovými faktory ICHS (hypertenze, hyperlipidemie, diabetes a kouření, ischemická choroba končetin) [19].
-
Podávat NSA až v případě nedostatečného účinku nefarmakologických opatření a paracetamolu.
-
Používat NSA v nejnižších účinných dávkách po nejkratší možnou dobu (např. po dobu vzplanutí bolesti).
-
Používat na principu „on demand“ (jen v případě potřeby, nikoliv fixně). Vybrat podle aktuální potřeby pro pacienta NSA s vhodným biologickým poločasem.
-
Respektovat GIT a KV rizika. U pacientů s GIT riziky používat tzv. efektivní gastroprotektivní princip, tzn. buď aplikaci koxibů (u pacientů bez KV rizika), anebo kombinaci neselektivního NSA s inhibitory protonové pumpy.
Lokální NSA byla doporučována pro léčbu gonartrózy v 7 z 9 existujících doporučení revidovaných v roce 2006 a jsou součástí i novějších doporučení Národního centra chronických stavů (National Collaborating Centre for Chronic Conditions – NICE) [20] a OARSI [4]. Dřívější studie, které prokázaly, že lokální NSA byla stejně účinná jako perorální NSA, ale bezpečnější [21, 22], jsou značně podpořeny nedávnou randomizovanou klinickou studií srovnávající lokální a perorální ibuprofen v léčbě chronické bolesti kolenních kloubů u starších nemocných [23]. Metaanalýza kontrolovaných studií však prokázala účinnost lokálních NSA pouze u gonartrózy a OA rukou, nikoliv u koxartrózy [24].
Při neúčinnosti, intoleranci nebo kontraindikacích paracetamolu a NSA jsou podávána slabší nebo středně silná opioidní analgetika. U pacientů s kontraindikací NSA mohou být tato léčiva používána i jako lék první volby [25]. Podávání opioidů je doporučováno ve všech výše uvedených doporučeních EULAR i OARSI, ale i další, pozdější metaanalýza 18 randomizovaných studií kontrolovaných placebem, publikovaná v roce 2007, prokázala poměrně dobrý efekt na snížení bolesti (ES 0,79; 95% CI: 0,59–0,98), ale jen malý vliv na zlepšení funkce (0,31 95% CI: 0,24–0,39) [26]. Mezi jednotlivými studiemi byly ale velké rozdíly podle typu užitého opioidu a typu studie. Prospěch z užívání opioidů byl limitován častými nežádoucími účinky, které zahrnovaly nauzeu (30 %), zácpu (23 %), závratě (20 %), somnolenci (18 %) a zvracení (13 %). Celkem 25 % pacientů ve skupině s opiáty přerušilo léčbu pro nežádoucí účinky oproti 7 % léčených placebem. Přerušení léčby však bylo častější, nastalo v 31 % při podávání silných opioidů (oxymorfon, oxykodon, fentanyl, deriváty morfinu), zatímco při užívání slabých opioidů (tramadol, tramadol/paracetamol, kodein, propofyxen) se objevilo v 19 %. Další metaanalýza 6 studií kontrolovaných placebem s opioidy (tramadol, morfin, kodein, oxykodon a oxymorfon) u 1057 pacientů s gonartrózou se středně silnou bolestí (průměrná hodnota na vizuální analogové škále VAS = 64,3 mm) prokázala pouze malé snížení bolesti (10,5 mm, 95% CI: 7,4–13,7) ve srovnání s placebem, které bylo maximální ve 2.–4. týdnu léčby [10]. Jiná metaanalýza 44 randomizovaných klinických studií pro chronickou nemaligní bolest, zahrnující 6019 pacientů, z nichž 80 % mělo OA rukou, bolest zad nebo revmatoidní artritidu, prokázala, že pouze silné opioidy byly signifikantně mnohem účinnější než paracetamol nebo NSA (ES 0,34; 95% CI: 0,01–0,67) [27]. Silné opioidy by tedy měly být aplikovány jen v případě velmi silné bolesti nereagující na ostatní prostředky a pouze na časově omezenou dobu. Příkladem může být tzv. průlomová bolest při finální destrukci kloubů u pacientů, kteří čekají na chirurgické řešení endoprotézou nebo při kontraindikaci chirurgické léčby. Aplikace opioidů u OA by se měla řídit obecnými návody pro aplikaci opioidů u chronické nemaligní bolesti.
Doplňkem komplexní terapie OA, která se provádí nejčastěji při zánětlivé iritaci gonartrózy, je intraartikulární aplikace (i.a.) glukokortikoidů (GK).
Lokální aplikace glukokortikoidů je součástí všech doporučení pro léčbu kolenních kloubů. Přestože jsou glukokortikoidy používány v této indikaci přes padesát let, randomizovaných studií bylo provedeno relativně málo. Od roku 2006 byly publikovány pouze 2 metaanalýzy [10, 28]. Velikost účinku na snížení bolesti nezávisle na počtu aplikovaných dávek nebo na hodnocené době po aplikaci byla 0,58 (0,34–0,82) [10]. Metaanalýzu 13 studií kontrolovaných placebem s glukokortikoidy aplikovanými i.a. u gonartrózy provedl v rámci Cochranovy analýzy Bellamy a kol. [28]. Účinek na snížení bolesti byl týden po jedné injekci GK relativně velký (ES 0,72; 95% CI: 0,42–1,01), nicméně tento efekt klesl na 0,28 (-0,17–0,73) po 4 týdnech a na 0,21 (-0,17–0,59) po 6 týdnech. Zatímco tyto výsledky ukazují, že by byly potřeba častější intervaly k udržení účinku, dlouhodobé studie s i.a. aplikací GK každé 3 měsíce po dobu 2 let prokázaly, že snížení bolesti bylo dosaženo po prvním roce (ES 0,67; 95% CI: 0,18–1,17), ale už ne po dvou letech (ES 0,25; 95% CI: 0,23–0,74). Aplikace glukokortikoidů i.a. neměla signifikantní vliv na funkční schopnosti (ES 0,20; 95% CI: -0,14–0,53), ani na ztuhlost (ES 0,25; 95% CI: -0,23–0,74).
Efekt léčby i.a. GK u koxartrózy podporují pouze dvě randomizované klinické studie. Lokální aplikaci GK tedy lze doporučit u pacientů s gonartrózou, u kterých nebyl zaznamenán dostatečný účinek perorální léčby (např. NSA), nebo u pacientů s přítomností výpotku. Injekce by se neměla opakovat častěji než 4krát do roka.
SYSADOA
Pomalu působící léky OA (symptomatic slow acting drugs in osteoarthritis – SYSADOA) jsou látky, které jsou schopny specifickým zásahem do metabolismu artrotické chrupavky zmírnit symptomy doprovázející OA, především bolest, ztuhlost a funkci. SYSADOA stimulují produkci proteoglykanů, kyseliny hyaluronové a kolagenu a inhibují katabolické enzymy, které se podílejí na biodegradaci mezibuněčné hmoty chrupavky. Většina má i protizánětlivý efekt, jehož podstatou není inhibice prostaglandinů, jako je tomu u NSA, ale interakce s buněčnými receptory prozánětlivých elementů nebo inhibice prozánětlivých cytokinů (např. IL-1). Nespornou výhodou je etiopatogenetický přístup k léčbě OA, velmi dobrá tolerance a prakticky absence závažných nežádoucích účinků. Nevýhodou je pozvolný nástup účinku (2–8 týdnů podle typu léčiva), ale pak se jejich analgetická schopnost vyrovnává s NSA. Dosažené zlepšení však přetrvává po dobu 2–3 měsíců po ukončení léčby [29]. Do této skupiny léků patří glukosamin sulfát, chondroitin sulfát, diacerein a výtažek z avokáda a sojových bobů (ASU). U některých z nich byl prokázán i účinek strukturální. Mechanismus účinku spočívá většinou v přímé interakci těchto léčiv s chondrocyty [30, 31].
Glukosamin
Glukosamin (GS) existuje ve formě sulfátu a hydrochloridu. Většina randomizovaných studií byla provedena s GS sulfátem. Důkazy o účinnosti GS ve formě nutritivních doplňků jsou sporadičtější. Metaanalýza zahrnující 20 randomizovaných dvojitě slepých studií ukázala 28% zmírnění bolesti (ES 0,61; 95% CI: 0,28–0,95) a 21% zlepšení funkce (ES 0,07; 95% CI: 0,08–0,21) [32]. Po roce 2006 byl publikován jeden systematický přehled [33] a 3 nové randomizované klinické studie [8, 34, 35], které zkoumaly důkazy pro symptomatický účinek glukosaminu u OA. Metaanalýza randomizovaných klinických studií včetně těch publikovaných po roce 2006, v nichž byl podáván GS (sulfát nebo hydrochlorid), prokázala mírný symptomatický účinek (ES 0,46; 95% CI: 0,23–0,69). Účinek GS na snížení bolesti byl signifikantní (ES 0,58; 95% CI: 0,30–0,87), ale nesignifikantní při aplikaci GS hydrochloridu (ES 0,02; 95% CI: -0,15–0,11). Údaje o možném strukturu modifikujícím efektu glukosaminových produktů u pacientů s gonartrózou a koxartrózou zůstávají kontroverzní. Byly publikovány dvě randomizované tříleté klinické studie, v nichž bylo podáváno 1500 mg GS denně (1 s gonartrózou a 1 s koxartrózou) [30, 36]. Strukturální efekt byl malý, ale signifikantní pro gonartrózu (ES 0,24; 95% CI: 0,04–0,43), ale ne pro koxartrózu (ES 0,03; 95% CI: -0,06–0,12) [36]. Tento efekt však bude nutné potvrdit v dalších studiích s novějšími zobrazovacími metodami.
Chondroitin
Chondroitin sulfát (CS) byl rovněž zkoušen v řadě studií a byla provedena řada metaanalýz a přehledných prací. Poslední metaanalýza 20 studií s 3846 pacienty, která byla publikována v roce 2007 [37], prokázala poměrně velkou úlevu od bolesti (ES 0,75; 95% CI: 0,50–0,99). Studie, které zkoumaly, zda má chondroitin sulfát i strukturu modifikující efekt, byly systematicky revidovány v roce 2008 [38]. Do této analýzy byly zahrnuty 4 randomizované studie pacientů s gonartrózou. Shromážděné výsledky potvrdily sice malý, ale signifikantní efekt CS na zpomalení rentgenové progrese za rok ve srovnání s placebem (ES 0,26; 95% CI: 0,16–0,36). Jedna z těchto studií byla v plném znění publikována v roce 2009 a potvrdila strukturální efekt po více než 2 letech [39].
Diacerein
Diacerein je antrachinonový derivát, který inhibuje syntézu IL-1 ve studiích in vitro [40], a má tedy pomalu působící, perzistující symptomatický účinek na kloubní chrupavku u pacientů s OA kolen [29] a kyčlí [41]. Efekt v těchto studiích na redukci bolesti byl malý (ES 0,22; 95% CI: 0,01–0,42), zato signifikantním problémem byl průjem (RR 3,98; 95% CI: 2,90–5,47). V roce 2006 byly publikovány dvě souhrnné práce [42, 43] a v roce 2007 nejnovější NSA kontrolovaná randomizovaná studie [44]. Aktualizovaný ES pro úlevu od bolesti založený na 6 studiích byl 0,24 (95% CI: 0,08–0,39) a relativní riziko průjmu ve srovnání s placebem bylo 3,51 (2,55–4,83). Ve studii Dougadose a kol. byl prokazatelný efekt na zpomalení progrese koxartrózy [45].
Výtažek z avokáda a sojových bobů (ASU)
Symptomatická účinnost ASU (300 mg podávaných denně po dobu 3–12 měsíců) byla hodnocena v nedávném systematickém přehledu 4 randomizovaných klinických studií zahrnujícím 272 pacientů s artrózou kyčle a 392 pacientů s artrózou kolene [46]. Zlepšení bolesti bylo mírné (ES 0,39; 95% CI: 0,01–0,76). Léčba ASU byla také spojena s mírným zlepšením Lequesnova indexu (ES 0,45; 95% CI: 0,21–0,70). Po léčbě ASU bylo ve srovnání s placebem zaznamenáno zlepšení u dvojnásobného počtu pacientů (RR 2,19; p = 0,007).
SYSADOA – shrnutí
Přípravky ze skupiny SYSADOA jsou většinou velmi dobře tolerované, jejich podávání je provázeno minimálními nežádoucími účinky a prakticky nevyvolávají závažné nežádoucí účinky. Tím se výrazně liší od NSA, což je velmi výhodné zvlášť u starších pacientů. Téměř všechna SYSADOA mají vliv na metabolismus chrupavky, takže lze předpokládat, že mají i tzv. chorobu modifikující efekt.
Intraartikulární aplikace kyseliny hyaluronové a jejích derivátů
Viskosuplementace těmito přípravky je v léčbě osteoartrózy kolenních kloubů účinná, pozitivně ovlivňuje bolest, funkci i celkový stav pacienta a toto zlepšení není pozorováno pouze bezprostředně po aplikaci, ale přetrvává 5–13 týdnů po poslední aplikaci [47]. Kyselina hyaluronová (KH) je nesulfatovaný glykosaminoglykan, polymer disacharidových jednotek složených z N-acetyl-D-glukosaminu a kyseliny D-glukuronové, který se nachází v řadě tkání, ale zvláště ve tkáních pojivových. Tato kyselina tvoří hlavní součást synoviální tekutiny, v extracelulární matrix chrupavky (ECM) se podílí na agregaci proteoglykanových monomerů. KH má zásadní roli v zachování strukturální a funkční integrity ECM a dalších biologických tekutin. Má důležitou úlohu v homeostáze vody a v pojivových tkáních. Viskoelastická funkce synoviální tekutiny je přímo úměrná koncentraci KH. Exogenní KH se váže na receptory na řadě buněk (chondrocyty, synoviocyty, leukocyty) a má mnoho jiných funkcí: vazbou na zánětlivé buňky snižuje jejich aktivitu, redukuje množství zánětlivých mediátorů, inaktivuje volné kyslíkové radikály. Vazbou na chondrocyty působí preventivně proti degeneraci chrupavky. Chondrocyty stimuluje i přímý vliv na nervová zakončení. V léčivých přípravcích se KH vyskytuje jako sodná sůl (natrii hyaluronas).
Externě aplikovaná do kloubů při OA se KH používá již přes 25 let. Bylo provedeno minimálně 17 systematických přehledů a metaanalýz ke stanovení účinnosti KH i.a., většina z nich u pacientů s gonartrózou. Největší a nejkomplexnější je přehled Cochranovy databáze z roku 2006 [47], kde bylo revidováno 76 studií, z nichž 15 používalo jako srovnávací přípravky KH aplikovanou i.a. Bylo prokázáno snížení bolesti oproti placebu v 1.–4. týdnu (ES 0,60; 95% CI: 0,37–0,83), zlepšení funkční zdatnosti (ES 0,61; 95% CI: 0,35–0,87) a zkrácení doby ztuhlosti (ES 0,54; 95% CI: -0,17–1,26). Po aplikaci série 3–5 injekcí docházelo k maximální úlevě od bolesti mezi 5.–13. týdnem a tato redukce činila proti bazálním hodnotám 28–54 %, u funkce pak redukce představovala 9–32 %. Mezi studiemi však existuje velká heterogenita, což je dáno několika faktory; patří k nim např. existence velkého množství preparátů KH, které se liší molekulovou hmotností a původem, dále pak typem studií, indikačními kritérii a použitými ukazateli účinnosti. Novější metaanalýza [48] 13 randomizovaných klinických studií porovnávajících účinnost i.a. KH s vyskou molekulární hmotností proti standardním přípravkům obsahujícím KH neprokázala signifikantní účinnost vysokomolekulárních přípravků na snížení bolesti (ES 0,27; 95% CI: -0,01–0,55), mezi těmito studiemi však panovala značná heterogenita. Toto zjištění je podpořeno nedávnou metaanalýzou 7 klinických randomizovaných studií u pacientů s OA kolen, ve kterých bylo podávání KH porovnáváno s i.a. terapií GK [49]. Po léčbě GK došlo k největšímu zmírnění bolesti ve druhém týdnu (ES 0,39; 95% CI: 0,12–0,65). Léčba KH byla provázena zmírněním bolesti po 8 týdnech (ES 0,22; 95% CI: -0,5–0,49) a statisticky významný rozdíl oproti GK byl zaznamenám v týdnu 12 (ES 0,35; 95% CI: 0,03–0,66) a 26 (ES 0,39; 95% CI: 0,18–0,59).
Obecně lze říci, že monoterapie KH je indikována u bolestivé gonartrózy, u které kombinovaná léčba nefarmakologickými postupy a analgetiky nebo NSA nepřinesla dostatečný efekt. Kladné stanovisko k aplikaci KH i.a. zaujímá osm z devíti publikovaných doporučení včetně EULAR a OARSI [3, 4].
Chirurgické postupy
V pokročilejších stadiích OA kolenních a kyčelních kloubů a při neúspěchu konzervativní léčby jsou indikovány chirurgické postupy. Z chirurgických modalit jsou doporučeny totální kloubní náhrady, unikompartmentální náhrady kolenního kloubu, korekční osteotomie a preventivní chirurgické výkony k záchraně povrchu kloubní chrupavky, kloubní laváž a artroskopické očištění chrupavky (débridement) a artrodéza kloubu jako záchranné řešení v případě selhání aloplastiky.
Závěr
Seznam použité literatury
- [1] Peat G, Mc Camey R, Croft P. Knee pain and osteoarthritis in older adults: a review of community burden and current use of primary health care. Ann Rheum Dis 2001; 60: 91–97.
- [2] Dawson J, Linsell L, Zondervan K, et al. Epidemiology of hip and knee pain and its impact on overall health status in older adults. Rheumatology 2004; 43: 497–504.
- [3] Jordan KM, Arden NK, Doherty M, et al. EULAR recommendations 2003: An evidence based approach to the manegment of knee OA. Ann Rheum Dis 2003; 62: 1145–1155.
- [4] Zhang W, Moskowitz RW, Nuki G, et al. OARSI recommendations for the management of hip and knee osteoarthritis, Part II: OARSI evidence-based, expert konsensus guidelines. Osteoarthritis Cartilage 2008; 16: 137–162.
- [5] Pavelka K. Symptomatická léčba osteoartrózy: paracetamol nebo nesteroidní antirevmatika? Česká Revmatol 2004; 12: 14–19.
- [6] Zhang W, Jones A, Doherty M, et al. Does paracetamol (acetaminophen) reduce the pain of osteoarthritis? A metaanalysis of randomised controlled trials. Ann Rheum Dis 2004; 63: 901–907.
- [7] Towheed TE, Maxwell L, Judd MG, et al. Acet-aminophen for osteoarthritis. Cochrane Database Syst Rev 2006: CD004257.
- [8] Herrero-Beaumont G, Ivorra JA, Del Carmen Trabado M, et al. Glucosamine sulfate in the treatment of knee osteoarthritis symptoms: a randomized, double-blind, placebo-controlled study using acetaminophen as a side comparator. Arthritis Rheum 2007; 56: 555–567.
- [9] Zhang W, Nuki G, Moskowitz RW, et al. OARSI recommendations for the management of hip and knee osteoarthritis Part III: changes in evidence following systematic cumulative update of research published through january 2009. Osteoarthritis and cartilage 2010; 18: 476–499.
- [10] Bjordal JM, Klovning A, Ljunggren AE, et al. Short term efficacy of pharmacotherapeutic interventions in osteoarthritis knee pain: a metaanalysis of randomised placebo controlled trials. Eur J Pain 2007; 11: 125–138.
- [11] Bjordal JM, Ljungren AE, Klovning A, et al. Non steroidal antiinflammatory drugs, including cyclooxygenase 2 inhibitors, in osteoarthritic knee pain: metaanalysis of randomised placebo controled trials. BMJ 2004; 329: 1317–1320.
- [12] Rahme E, Barkun A, Nedjar H, et al. Hospitalizations for upper and lower GI events associated with traditional NSAIDs and acetaminophen among the erderly in Quebec, Canada. Am J Gastroenterol 2008; 103: 872–882.
- [13] Chan FK, Wong VW, Suen BY, et al. Combination of a cyclo-oxygenase-2 inhibitor and a proton-pump inhibitor for prevention of recurrent ulcer bleeding in patients at very high risk: a double-blind, randomised trial. Lancet 2007; 369: 1621–1626.
- [14] Rahme E, Barkun AN, Toubouti Y, et al. Do proton-pump inhibitors confer additional gastrointestinal protection in patients given celecoxib? Arthritis Rheum 2007; 57: 748–755.
- [15] Latimer N, Lord J, Grant LR, et al. Cost effectiveness of COX 2 selective inhibitors and tradi-tional NSAIDs alone or in combination with a proton-pump inhibitor for people with osteoarthritis. BMJ 2009; 339: b2538.
- [16] Kearney PM, Baigent C, Godwin J, et al. Do selective cyclo-oxygenase inhibitors and tradi-tional nonsteroidal antiinflammatory drugs increase risk of atherothrombosis? Metaanalysis of randomised trials. BMJ 2006; 332: 1302–1308.
- [17] Caldwell B, Aldington S, Weathearal M. Risk of cardiovascular events and celecoxib: a systematic review and meta-analysis. J R Soc Med 2006; 99: 132–140.
- [18] Cannon P, Curtis SP, FitzGerald GA, et al. Cardiovascular outcomes with etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Long-term (MEDAL) programme: a randomised comparison. Lancet 2006; 368: 1771–1781.
- [19] EMEA/CHMP/410051/2006. EMEA/H/A-5.3/800 opinion of the committee for medicinal products for human use pursuant to article 5(3) of regulation (EC) No 726/2004, for nonselective non streriodal anti-inflammatory drugs (NSAIDs).
- [20] National Collaborating Centre for Chronic Conditions. Osteoarthritis: National clinical guideline for care and management in adults. London: Royal College of Physicians; 2008 (Ref. type: report).
- [21] Evans JM, MacDonald TM. Tolerability of topical NSAIDs in the elderly: do they really convey a safety advantage? Drugs Aging 1996; 9: 101–108.
- [22] Tugwell PS, Wells GA, Shainhouse JZ. Equivalence study of a topical diclofenac solution (Pennsaid) compared with oral diclofenac in symptomatic treatment of osteoarthritis of the knee: a randomised controlled trial. J Rheumatol 2004; 10: 2002–2012.
- [23] Underwood M, Ashby D, Cross P, et al. Advice to use topical or oral ibuprofen for chronic knee pain in older people: radndomised controlled trial and patient preference study. BMJ 2008; 336: 138–142.
- [24] Lin J, Zhang W, Jones A, Doherty M. Efficacy of topical non-steroidal anti-inflammatory drugs in the treatment of osteoarthritis: meta-analysis of randomised controlled trials. BMJ 2004; 329: 324.
- [25] Pavelka K. Opioidy v léčbě chronické bolesti u revmatických onemocnění. Remedia 2005; 15: 4–5.
- [26] Avouac J, Gossec L, Dougados M. Efficacy and safety of opioids for osteoarthritis: a metaanalysis of randomized controlled trials. Osteoarthritis Cartilage 2007; 15: 957–965.
- [27] Furlan AD, Sandoval JA, Mailis-Gagnon A, et al. Opioids for chronic noncancer pain: a meta-analysis of effectiveness and side effects. CMAJ 2006; 174: 1589–1594.
- [28] Bellamy N, Campbel J, Robinson V, et al. Intraarticular corticosteroid for treatment of osteoarthritis of the knee. Cochrane Database Syst Rev 2006; (2): CD005328.
- [29] Pavelka K, Trč T, Karpat K, et al. The efficacy and safety of diacerein in the treatment of painful osteoarthritis of the knee. A randomized, multicenter, double-blind, placebo-controlled study with primary end points at two months after the end of three-month treatment period. Arthritis Rheumatism 2007; 56, 12: 4055–4064.
- [30] Pavelka K, Gatterová J, Olejárová M, et al. Glucosamine sulphate use and delay of progression of knee osteoarthritis: a 3 year, randomized, placebo-controlled, double-blind study. Arch Intern Med 2002; 162: 2113–2123.
- [31] Jung RW, Piba S, Beinat L, et al. Structure modification in osteoarthritis with intra-articular so-dium hyaluronate of mol. 500-730 kDa. Ann Rheum Dis 2001; 60 (Suppl. 1): 46.
- [32] Towheed TE, Maxwell L, Anastasiades TP, et al. Glucosamine therapy for treating osteoarthritis. Cochrane Database Syst Rev 2005; (1): CD002946.
- [33] Vlad SC, LaValley MP, McAlindon, et al. Glucosamine for pain in osteoarthritis: why do trial results differ? Arthritis Rheum 2007; 56: 2267–2277.
- [34] Clegg DO, Reda DJ, Harris CL, et al. Glucos-amine, chondroitin sulfate, and the two in combination for painful knee osteoarthritis. N Eng J Med 2006; 354: 795–808.
- [35] Rozendaal RM, Koes BW, van Osch GJVM, et al. Effect of glucosamine sulfate on hip osteoarthritis: a randomized trial. Ann Intern Med 2008; 148: 268–277.
- [36] Reginster JY, Deroisy R, Rovati LC, et al. Long-term effects of glucosamine sulphate on osteoarthritis progression: a randomized, placebo-controlled clinical trial. Lancet 2001; 357: 251–223.
- [37] Reichenbach S, Sterchi R, Scherer M, et al. Metaanalysis: chondroitin for osteoarthritis of the knee or hip. Ann Intern Med 2007; 146: 580–590.
- [38] Hochberg MC, Zhan M, Langenberg P. The rate of decline of join space with in patients with osteo-arthritis of the knee: a systematic review and meta-analysis of randomized placebo-controlled trials of chondroitin sulfate. Curr Med Res Opin 2008, in press.
- [39] Kahan A, Uebelhart D, De Vathaire F, et al. Long-term effects of chondroitins 4 and 6 sulfate on knee osteoarthritis: the study on osteoarthritis progression prevention, a two-year, randomized, double-blind, placebo controlled trial. Arthritis Rheum 2009; 60: 524–533.
- [40] Solignac M. Mechanisms of action of diacerein, the first inhibitor of interleukin-1 in osteoarthritis. Presse Medicale 2004; 33: t-2.
- [41] Nguyen M, Dougados M, Berdah L, Amor B. Diacerhein in the treatment of osteoarthritis of the hip. Arthritis Rheum 1994; 37: 529–536.
- [42] Fidelix TS, Soares BG, Trevisani VF. Diacerein for osteoarthritis. Cochrane Database Syst Rev 2006: CD005117.
- [43] Rintelen B, Neumann K, Leeb BF. A meta-analysis of controlled clinical studies with diacerein in the treatment of osteoarthritis. Arch Intern Med 2006; 166: 1899–1906.
- [44] Louthrenoo W, Nilganuwong S, Aksaranugraha S, et al. Thai Study Group. the efficacy, safety and carry-over effect of diacerein in the treatment of painful knee osteoarthritis: a randomized, double-blind, NSAID-controlled study. Osteoarthritis Cartilage 2007; 15: 605–614.
- [45] Dougados M, Nguyen M, Berdah L, et al. Evalua-tion of the structure-modifying effect of diacerhein in hip OA. Artrhitis Rheum 2001; 44: 2539–2547.
- [46] Christensen R, Bartels EM, Astrup A, Bliddal H. Symptomatic efficacy of avocado-soybean uns-aponifiables (ASU) in osteoarthritis (OA) patients: a meta-analysis of randomized controlled trials. Osteoarthritis Cartilage 2008; 16: 399–408.
- [47] Bellamy N, Campbell J, Robinson V, et al. Viscosupplementation fot the treatment of osteoarthritis of the knee. Cochrane Database Syst Rev 2006; (2): CD005321.
- [48] Reichenbach S, Blank S, Rutjes AW, et al. Hylan versus hyaluronic acid for osteoarthritis of the knee: a systematic review and meta-analysis. Arthritis Rheum 2007; 57: 1410–1418.
- [49] Bannuru RR, Natov NS, Obadan IE, et al. Therapeutic trajectory of hyaluronic acid versus corticosteroids in the treatment of knee osteoarthritis: a systematic review and meta-analysis. Arthritis Care Res 2009; 61: 1704–1711.
- [50] Pavelka K, Adam M, Olejárová M. Osteoartróza. Kap. 35, str. 396. In Pavelka K, Rovenský J a kol. Klinická revmatologie. První vydání, Galén, 2003.
- [51] Automatizovaný informační systém léčivých přípravků. MV AISLP 2010.4. Souhrny údajů o přípravcích (SPC).