Současné možnosti léčby pokročilého/ metastazujícího nemalobuněčného karcinomu plic
Konvenční chemoterapií nemalobuněčného karcinomu plic (NSCLC) je dosahováno průměrné doby přežití 8–10 měsíců. Naším cílem je zlepšení těchto výsledků, a to stanovením co nejúčinnější individuální léčby. K tomu nám pomáhají nové metody molekulární biologie, které umožňují ovlivňovat nádorovou buňku na subcelulární úrovni. Do popředí zájmu se tak dostává biologicky cílená léčba. Je rovněž vyvíjeno značné úsilí identifikovat prognostické a prediktivní faktory. V poslední době se dle klinických studií jako prediktivní faktory jeví histologie a mutace genu EGFR (receptor epidermálního růstového faktoru). Nově je na základě výsledků klinických studií zmiňována možnost udržovací léčby, jejímž cílem je oddálení progrese a prodloužení doby přežití.
Úvod
Bronchogenní karcinom je onemocněním s vysokou incidencí a je nejčastější příčinou úmrtí ze všech zhoubných nádorů. Ročně ve světě umírá v důsledku onemocnění bronchogenním karcinomem asi 1,2 milionu lidí. Pětileté přežití zůstává pod hranicí 15 %. Pokračuje nárůst incidence u žen, mírný pokles incidence byl zaznamenán u mužů. V době diagnózy se asi v 75 % jedná o onemocnění lokálně pokročilé či generalizované, kdy jsou již přítomny vzdálené metastázy. U většiny pacientů je proto indikována systémová léčba.
První linie léčby
Standardní léčbu pokročilého nemalobuněčného karcinomu plic (NSCLC) v první linii představuje kombinovaná chemoterapie platinovým derivátem s cytostatikem 3. generace (paklitaxel, docetaxel, gemcitabin, vinorelbin). Doporučovaný počet cyklů je 4–6. Medián celkového přežití dosahovaný touto léčbou je 8–10 měsíců.
V roce 2008 byla publikována dvojitě zaslepená klinická studie fáze III JMDB autora Scagliottiho a kol. [1], která prokázala účinnost pemetrexedu v 1. linii léčby NSCLC. Celkem 1725 dosud neléčených pacientů bylo randomizováno do ramen léčených dvojkombinací pemetrexed + cisplatina nebo gemcitabin + cisplatina. Hlavním cílem bylo stanovení celkového přežití (OS). V této studii byla předem naplánována analýza dle histologických typů,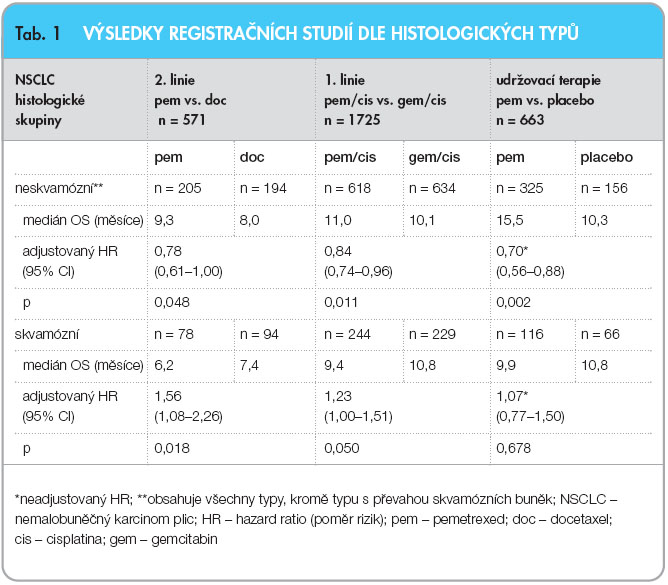 což se ukázalo jako klíčové, neboť OS bylo u obou ramen identické, a to 10,3 měsíce. Výsledky se lišily pro jednotlivé histologické typy NSCLC. Kombinace s pemetrexedem prokázala lepší celkové přežití u adenokarcinomu, kde byl medián přežití 12,6 vs. 10,9 měsíce (p = 0,033). Ještě větší rozdíl byl zjištěn u velkobuněčného karcinomu, kde medián přežití představoval 10,4 vs. 6,7 měsíce (p = 0,027) pro pemetrexed. U dlaždicobuněčného karcinomu se ukázala jako výhodnější léčba kombinací gemcitabin + cisplatina, medián přežití dosáhl 10,8 vs. 9,4 měsíce (p = 0,050). Kombinace pemetrexed + cisplatina prokázala statisticky významně lepší celkové přežití u skupiny nádorů nedlaždicobuněčné histologie (11,8 vs. 10,4 měsíce), viz tab. 1.
což se ukázalo jako klíčové, neboť OS bylo u obou ramen identické, a to 10,3 měsíce. Výsledky se lišily pro jednotlivé histologické typy NSCLC. Kombinace s pemetrexedem prokázala lepší celkové přežití u adenokarcinomu, kde byl medián přežití 12,6 vs. 10,9 měsíce (p = 0,033). Ještě větší rozdíl byl zjištěn u velkobuněčného karcinomu, kde medián přežití představoval 10,4 vs. 6,7 měsíce (p = 0,027) pro pemetrexed. U dlaždicobuněčného karcinomu se ukázala jako výhodnější léčba kombinací gemcitabin + cisplatina, medián přežití dosáhl 10,8 vs. 9,4 měsíce (p = 0,050). Kombinace pemetrexed + cisplatina prokázala statisticky významně lepší celkové přežití u skupiny nádorů nedlaždicobuněčné histologie (11,8 vs. 10,4 měsíce), viz tab. 1.
Biologická léčba v první linii
Bevacizumab, monoklonální humanizovaná protilátka proti VEGF (vaskulární endoteliální růstový faktor), byl prvním biologickým lékem, který zvýšil účinnost léčby NSCLC přidáním k chemoterapii (k dvojkombinaci s platinovým derivátem). Ve studii fáze II [2] přidání bevacizumabu k léčbě první linie ve složení karboplatina + paklitaxel signifikantně zlepšilo léčebnou odpověď a přežití bez progrese. Klinická studie fáze III E4599 [3] potvrdila, že přidání bevacizumabu ke konvenční chemoterapii karboplatinou s paklitaxelem prodlužuje medián přežití (12,3 vs. 10,3 měsíce; HR 0,80, p = ![Graf 1 Celkové přežití u pacientů léčených konvenční chemoterapií (paklitaxel + karboplatina, PC) a u pacientů léčených konvenční chemoterapií s bevacizumabem (B). Přidání bevacizumabu ke konvenční chemoterapii prodlužuje medián přežití (12,3 vs. 10,3 měsíce); podle [3] – Sandler, et al., 2010.](https://www.remedia.cz/photo-a-28248---.jpg) 0,003), medián přežití bez progrese (6,2 vs. 4,5 měsíce; HR 0,99) a odpověď (35 % vs. 15 %) ve srovnání s chemoterapií samotnou, viz graf 1. Mimořádného výsledku bylo dosaženo v celkovém přežití u pacientů s adenokarcinomem (14,2 vs. 10,3 měsíce v kontrolním rameni). Ve studii BO17704 (AVAIL) [4] bylo primárním cílem hodnocení přežití bez progrese. Signifikantního prodloužení bylo dosaženo v rameni, ve kterém byl podáván bevacizumab v dávce 7,5 mg/kg spolu s chemoterapií (cisplatina + gemcitabin) ve srovnání s chemoterapií samotnou (6,7 vs. 6,1 měsíce; HR 0,75). Ve studii fáze IV MO19390 (SAIL) [5] byl bevacizumab podáván s dvojkombinací standardní chemoterapie dle volby řešitele. Bylo zařazeno více než 2000 pacientů a byla prokázána bezpečnost této léčby. Předběžná data ukazují střední přežití bez progrese v délce 7,8 měsíce a celkové přežití 14,6 měsíce.
0,003), medián přežití bez progrese (6,2 vs. 4,5 měsíce; HR 0,99) a odpověď (35 % vs. 15 %) ve srovnání s chemoterapií samotnou, viz graf 1. Mimořádného výsledku bylo dosaženo v celkovém přežití u pacientů s adenokarcinomem (14,2 vs. 10,3 měsíce v kontrolním rameni). Ve studii BO17704 (AVAIL) [4] bylo primárním cílem hodnocení přežití bez progrese. Signifikantního prodloužení bylo dosaženo v rameni, ve kterém byl podáván bevacizumab v dávce 7,5 mg/kg spolu s chemoterapií (cisplatina + gemcitabin) ve srovnání s chemoterapií samotnou (6,7 vs. 6,1 měsíce; HR 0,75). Ve studii fáze IV MO19390 (SAIL) [5] byl bevacizumab podáván s dvojkombinací standardní chemoterapie dle volby řešitele. Bylo zařazeno více než 2000 pacientů a byla prokázána bezpečnost této léčby. Předběžná data ukazují střední přežití bez progrese v délce 7,8 měsíce a celkové přežití 14,6 měsíce.
Hledají se specifické biomarkery, které mohou predikovat účinnost léčby a tak umožnit její optimální výběr. Dle výsledků studií je takovým slibným prediktivním faktorem mutace genu receptoru epidermálního růstového faktoru (EGFR). Klinicky významné jsou aktivační mutace intracelulární tyrozinkinázové domény receptoru, a to delece exonu 19 nebo bodová mutace v exonu 21. Při jejich přítomnosti lze očekávat větší účinnost při léčbě inhibitory tyrozinkinázy EGFR.Tyto mutace jsou nejčastěji detekovány v buňkách adenokarcinomu a u nekuřáků. V evropské populaci jsou přítomny asi u 10 % nemocných, v asijské populaci je četnost jejich výskytu vyšší, asi 30–60 %.
V roce 2009 byly publikovány výsledky studie fáze III IPASS (Iressa Pan Asia Study) [6] porovnávající účinnost gefitinibu v první linii léčby s chemoterapií (karboplatina + paklitaxel). Byla provedena subanalýza pacientů s mutacemi EGFR. Při léčbě gefitinibem u těchto pacientů došlo k signifikantnímu prodloužení přežití bez progrese (HR 0,48), zvýšení celkové odpovědi (71 % vs. 47,3 %) a ke zlepšení kvality života. Hodnocení celkového přežití, které bylo v loňském roce prezentováno na 35. kongresu ESMO, však bylo bez signifikantních rozdílů, což je vysvětlováno následnou léčbou.
![Graf 2 Srovnání účinnosti erlotinibu s chemoterapií (karboplatina + gemcitabin) v 1. linii léčby u pacientů s aktivační mutací EGFR; podle [7] – Zhou, et al., 2010.](https://www.remedia.cz/photo-a-28249---.jpg) Na 35. kongresu ESMO byly rovněž prezentovány výsledky studie OPTIMAL [7], která srovnávala účinnost erlotinibu s chemoterapií (karboplatina + gemcitabin) v 1. linii léčby u pacientů s aktivační mutací EGFR (graf 2). Bylo randomizováno 165 pacientů ve 23 centrech v Číně; střední doba přežití bez progrese dosáhla 13,1 vs. 4,6 měsíce (HR 0,16), celková odpověď na léčbu v rameni s erlotinibem byla 83 % vs. 36 % v rameni s chemoterapií, doba celkového přežití dosud nebyla hodnocena.
Na 35. kongresu ESMO byly rovněž prezentovány výsledky studie OPTIMAL [7], která srovnávala účinnost erlotinibu s chemoterapií (karboplatina + gemcitabin) v 1. linii léčby u pacientů s aktivační mutací EGFR (graf 2). Bylo randomizováno 165 pacientů ve 23 centrech v Číně; střední doba přežití bez progrese dosáhla 13,1 vs. 4,6 měsíce (HR 0,16), celková odpověď na léčbu v rameni s erlotinibem byla 83 % vs. 36 % v rameni s chemoterapií, doba celkového přežití dosud nebyla hodnocena.
Udržovací léčba
Optimální délka léčby pacientů s NSCLC zůstává předmětem diskusí. Doporučená délka chemoterapie je obvykle 4 cykly, při léčebné odpovědi 6 cyklů. Z klinické praxe víme, že pouze necelá polovina pacientů s pokročilým NSCLC podstoupí léčbu druhé linie. Udržovací léčba by měla teoreticky umožnit pacientům přístup k více liniím účinné léčby. Řada studií hodnotí výsledky udržovací léčby cytostatikem nebo biologickým lékem podaným ihned po skončení 1. linie léčby u pacientů, kteří měli léčebnou odpověď či stabilizaci onemocnění. Léčba může pokračovat stejným lékem, který byl součástí indukčního režimu, nebo lékem jiným (označována také jako časná léčba druhé linie) s cílem zabránit progresi a prodloužit přežití bez progrese nemoci.
Významného prodloužení přežití bez progrese bylo dosaženo s docetaxelem při jeho podání ihned po 4 cyklech chemoterapie kombinující karboplatinu s gemcitabinem oproti docetaxelu podanému až při progresi [8].
Ve studii JMEN [9] byly pemetrexed nebo placebo podávány nemocným, kteří neměli progresi po 4 cyklech chemoterapie založené na platině. Léčba byla podávána až do zjištěné progrese. Také v této studii se uplatnila prospektivně plánovaná randomizace dle histologických typů. Studie prokázala významné zlepšení jak přežití bez progrese (4,2 vs. 2,0 měsíce; HR 0,60), tak celkového přežití (13,4 vs. 10,6 měsíce; HR 0,79) v rameni s pemetrexedem a lepší účinnost pemetrexedu ve skupině s nedlaždicobuněčným karcinomem, kde došlo ke statisticky významnému prodloužení přežití bez progrese (4,4 vs. 1,8 měsíce; HR 0,47) i k prodloužení celkového přežití (15,5 vs. 10,3 měsíce; HR 0,70), viz tab. 1. U pacientů s adenokarcinomem dosáhlo přežití bez progrese 4,6 měsíce a celkové přežití 16,8 měsíce.
Rovněž v klinických studiích s bevacizumabem bylo dosaženo lepšího výsledku, pokud byl bevacizumab v první linii podáván v kombinaci s chemoterapií a pak následovalo jeho podávání „do progrese“.
Studie ATLAS [10] hodnotila účinnost bevacizumabu samotného oproti jeho kombinaci s erlotinibem v udržovací léčbě. Medián přežití bez progrese byl výrazně delší u nemocných léčených dvojkombinací (4,8 vs. 3,7 měsíce; HR 0,722), přičemž nebyl zjištěn žádný doposud nepopsaný nežádoucí účinek.
Ve studii SATURN [11] byl erlotinib porovnáván s placebem v udržovací léčbě. Bylo randomizováno 889 nemocných, přežití bez progrese bylo výrazně vyšší ve skupině nemocných užívajících erlotinib (HR 0,71). Rovněž odpověď na léčbu byla vyšší ve skupině s erlotinibem (12 % vs. 5 %). U pacientů léčených erlotinibem bylo dosaženo i vyššího stupně kontroly nemoci (kompletní + parciální remise + stabilizace nemoci > 12 týdnů), a sice 40,8 % vs. 27,4 %. Prospěch z léčby byl prokázán rovněž u nemocných s dlaždicobuněčným karcinomem.
Druhá linie léčby
U pacientů s pokročilým NSCLC je indikována druhá linie léčby, jestliže dojde k relapsu onemocnění nebo je-li onemocnění refrakterní na první linii léčby. Indikována je monoterapie, kombinovaná léčba v metaanalýze studií sice zaznamenala větší léčebnou odpověď, nedošlo však ke zlepšení přežití bez progrese ani ke zlepšení celkového přežití.
Výsledky studie JMEI [12], dvojitě zaslepené studie fáze III u pacientů s pokročilým NSCLC, byly publikovány v roce 2004. Celkem 571 nemocných bylo randomizováno do dvou ramen, kde jim byl podáván pemetrexed nebo docetaxel. Ve studii byla prokázána noninferiorita, neboť medián přežívání představoval 8,3 vs. 7,9 měsíce (bez statistické významnosti), výsledky se však lišily nižší toxicitou v rameni s pemetrexedem.
V roce 2007 publikoval Peterson a kol. [13] retrospektivní analýzu této studie s cílem zaměřit se na histologické typy NSCLC a účinnost pemetrexedu v jednotlivých skupinách. Medián přežití byl u velkobuněčného karcinomu 12,8 měsíce, u adenokarcinomu činil 9 měsíců a u dlaždicobuněčného karcinomu 6,3 měsíce. Výsledky prokázaly v podskupině s nedlaždicobuněčným karcinomem signifikantně delší přežití u skupiny s pemetrexedem než s docetaxelem (p = 0,04), viz tab. 1.
Na základě těchto studií je docetaxel indikován ve druhé linii léčby u pacientů s dlaždicobuněčným karcinomem a pemetrexed je indikován u pacientů s jiným histologickým typem než predominantně dlaždicobuněčným.
Účinnost erlotinibu byla potvrzena v randomizované, placebem kontrolované studii BR 21 [14] u pacientů s lokálně pokročilým nebo metastazujícím NSCLC po selhání alespoň jednoho režimu chemoterapie. Celkové přežití bylo signifikantně delší v rameni s erlotinibem (6,7 vs. 4,7 měsíce). Studie prokázala i příznivý vliv na zlepšení kvality života.
Recentně byly publikovány 2 studie fáze III přímo srovnávající biologickou léčbu erlotinibem proti chemoterapii ve druhé a vyšších liniích léčby. Studie TITAN [15] srovnávala erlotinib s chemoterapií dle volby lékaře (docetaxel nebo pemetrexed) ve 2. linii léčby NSCLC se závěrem, že léčba v obou ramenech má podobnou účinnost (HR 0,96), ale léčba erlotinibem přináší méně nežádoucích účinků.
Studie HORG [16] srovnávala léčbu erlotinibem a pemetrexedem ve druhé a vyšších liniích léčby NSCLC opět se závěrem obdobné účinnosti (HR 0,92) a nižších nežádoucích účinků při biologické léčbě erlotinibem.
Třetí linie léčby
Lékem volby ve třetí linii léčby NCSLC je inhibitor tyrozinkinázy EGFR, pokud nebyl podán v první nebo druhé linii léčby. Účinnost erlotinibu byla prokázána ve výše zmíněné studii BR 21.
Závěr
Potřeba zlepšit léčebné výsledky u pacientů s nemalobuněčným kacinomem plic vede ke snaze zvolit pro konkrétního pacienta co nejúčinnější léčbu, tedy k její personalizaci. Výběr léku a přidání biologické léčby ke konvenční chemoterapii dle histologického typu nádoru umožnilo posunout dobu celkového přežití za hranici dvanácti měsíců. Role udržovací léčby není ještě zcela vyjasněna. Zdá se, že prospěch z ní mají pacienti, kteří při léčbě první linie dosáhli pouze stabilizace onemocnění. Bude proto nutné vyčkat výsledků dalších studií. Výsledky studií, do nichž byli zařazeni pacienti s aktivačními mutacemi tyrozinkinázové domény EGFR, opravňují k podání inhibitorů tyrozinkinázy EGFR také v první linii léčby. Na rozdíl od konvenční chemoterapie je biologická léčba cílena na identifikovanou strukturu nádorové buňky, je méně toxická, a proto je možno ji podávat delší dobu. Nadále probíhají výzkumné aktivity a klinické studie, jejichž snahou je vyvinout účinné látky, které by působily na více receptorů.
Seznam použité literatury
- [1] Scagliotti GV, Parikh P, von Pawel J, et al. Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy naive patiens with advanced-stage non-small-cell lung cancer. J Clin Oncol 2008; 92: 205–221.
- [2] Johnson DH, Fehrenbacher L, Novotny WF, et al. Randomized phase II trial comparing bevacizumab plus carboplatin and paclitaxel with carboplatin and paclitaxel alone in previously untreated locally advanced or metastatic non-small-cell lung cancer. J Clin Oncol 2004; 22: 2184–2191.
- [3] Sandler A, Yi J, Dahlberg S, et al. Treatment outcomes by tumor histology in Eastern Cooperative Group Study E4599 of bevacizumab with paclitaxel/carboplatin for advanced non-small cell lung cancer. J Thorac Oncol 2010; 5: 1416–1423.
- [4] Reck M, von Pawel J, Zatloukal P, et al. Phase III trial of cisplatin plus gemcitabine with either placebo or bevacizumab as first-line therapy for nonsquamous non-small-cell lung cancer: AVAIL. J Clin Oncol 2009; 27: 1227–1234.
- [5] Crin`o L, Dansin E, Garrido P, et al. Safety and efficacy of first-line bevacizumab-based therapy in advanced non-squamous non-small-cell lung cancer (SAiL, MO19390): a phase 4 study. Lancet Oncol 2010; 11: 733–740.
- [6] Mok T, To KF, Srimuninimit V, et al. Clinical outcomes of patiens with epidermal growth factor receptor (EGFR) mutations in IPASS (Iressa Pan Asia Study) [abstract B9.5]. J Thorac Oncol 2009; 4 (suppl 1): S351.
- [7] Zhou C, Wu Y-L, Chen G, et al. OPTIMAL (CTONG 0802) study comparing first-line erlotinib versus carboplatin (CBDCA) plus gemcitabine (GEM), in Chinese advanced non small-cell lung cancer (NSCLC) patients (pts) with EGFR activating mutations. Ann Oncol 2010; 21 (Suppl. 8): viii6 (Abstract LBA13).
- [8] Fidias PM, Dakhil SR, Lyss AP, et al. Phase III study of immediate compared with delayed docetaxel after front-line therapy with gemcitabine plus carboplatin in advanced non-small-cell lung cancer. J Clin Oncol 2009; 27: 591–598.
- [9] Ciuleanu TE, Brodowicz T, Belani CP, et al. Maintenance pemetrexed plus best supportive care (BSC) versus placebo plus BSC: a phase III study. J Clin Oncol 2008; 26 (Suppl 15): 426.
- [10] Miller V, O’Connor P, Soh C, Kabbinavar F, on behalf of the ATLAS Investigators. A randomized, double-blind, placebo-controlled, phase IIIB trial (ATLAS) comparing bevacizumab (B) therapy with or without erlotinib (E) after completion of chemotherapy with B for first-line treatment of locally advanced, recurrent, or metastatic non-small cell lung cancer (NSCLC) [abstract LBA8002]. Proc Am Soc Clin Oncol 2009; 27: 799 s.
- [11] Cappuzzo F, Coudert B, Wierzbicki R, et al. Efficacy and safety of erlotinib as first/line maintenance in NSCLC following non-progression with chemotherapy: results from phase III SATURN study [abstract A2.1]. J Thorac Oncol 2009; 4 (suppl 1): S289.
- [12] Hanna N, Shepherd FA, Fossella FV, et al. Randomized phase III trial of pemetrexed versus docetaxel in patients with non-small-cell lung cancer previously treated with chemotherapy. J Clin Oncol 2004; 22: 1589–1597.
- [13] Peterson P, Park K, Fossella FV, et al. 12th World Conference on Lung Cancer. Is pemetrexed more effective in adenocarcinoma and large cell lung cancer than in squamous cell carcinoma? A retrospective analysis of a phase III trial of pemetrexed vs docetaxel in previously treated patients with advanced non-small cell lung cancer (NSCLC). 12th World Conference on Lung Cancer; pp. P2–328. abstract.
- [14] Shepherd FA, Rodrigues Pereira J, Ciuleanu T, et al. Erlotinib in previously treated non-small-cell lung cancer. N Engl J Med 2005; 353: 123–132.
- [15] Ciuleanu T, Stelmakh L, Cicenas S, Esteban E. Efficacy and safety of erlotinib versus chemotherapy in second-line advanced non-small-cell lung cancer (NSCLC) with poor prognosis: The phase III TITAN study, Oral presentation, Chicago Multidisciplinary Symposium in Thoracic Oncology, 2010, Abstract 88PD.
- [16] Vamvakas L, Agelaki S, Kentepozidis NK, et al. Pemetrexed (MTA) compared with erlotinib (ERL) in pretreated patients with advanced non-small cell lung cancer (NSCLC): Results of a randomized phase III Hellenic Oncology Research Group trial. J Clin Oncol 28: 15s, 2010 (suppl; abstr 7519).