Současné možnosti monitorování glykémie
Monitorování glykémie je vedle pravidelného vyšetření HbA1c základním prostředkem kontroly optimálnosti nastavené léčby diabetu. Je dostatečně prokázáno, že chronické komplikace diabetu souvisí s mírou a délkou trvání hyperglykémie a že intenzivní kontrola glykémie vhodně zvolenou léčbou snižuje riziko rozvoje dlouhodobých komplikací diabetu [1, 2]. Zatímco pro tuto chvíli je HbA1c nástrojem více lékařovým, tíha kontroly glykemických profilů leží s výjimkou případných pobytů v nemocnici zcela na pacientovi. I přes výrazný pozitivní posun v kompenzaci diabetu, který přenosné glukometry a tzv. selfmonitoring přinesly, neposkytují ani tyto přístroje komplexní obraz exkurzí glykémií. Dlouhodobý vývoj a výzkum přinesl v posledních letech nový typ zařízení umožňující podstatně častější (z pohledu současných možností téměř spojité) sledování denních hodnot glykémií. Viděno prizmatem kontroly glykémie, lze s mírnou nadsázkou říci, že žijeme v éře glukometrů a stojíme na prahu éry kontinuálních monitorů. Zajímavé a v dnešní době snad inspirující je, že základ pro existenci dnešních sofistikovaných přístrojů položil český vědec. První elektrochemickou metodu používající registraci elektrického proudu jako měřené veličiny v analytické detekci – voltametrii (elektroanalytická metoda orientovaná na stanovení látek, které lze oxidovat či redukovat) – objevil v roce 1922 Jaroslav Heyrovský. Tato metoda byla podstatou jím později vyvinuté polarografie (1924), za kterou v roce 1959 získal Nobelovu cenu.
Stručně z historie
Současné možnosti terapie i její kontroly s využitím moderních technologií a především rychlost, se kterou jsou vyvíjeny a zpřístupňovány, více vyniknou v porovnání s možnostmi léčby před sto lety. Pro zajímavost krátký text z Thomayerovy učebnice vnitřního lékařství vydané v roce 1909:
„Léčení. Rollo doporučil v r. 1797 při diabetu přísnou masitou stravu. Tohoto druhu dieta je dodnes hlavním terapeutickým výkonem naším při nemoci této. Při masité stravě ve veliké většině případů množství vyloučeného cukru se zmenší, v mnohých pak případech úplně z moči vymizí. Jísti tedy smí čisté masité polévky, všeho druhu maso, máslo, slaninu (poněvadž diabetik nemá tratiti na váze a chřadnouti, jelikož by si život ohrozil, má zejména účast másla a tuků v potravě býti pokud možno značná), vejce, sýr, čistou smetanu, rosoly, ořechy, houby, mandle, smí píti: kávu neslazenou čistou či se smetanou, podobná thé, trpká vína (např. rakouská), minerální vody, dále smí jísti takové zeleniny, které neobsahují cukry (špenát, okurky, chřest), v malém množství mrkev, jahody a maliny. Při takovéto dietě se však nemocnému obyčejně po moučné potravě zasteskne." [3]
V té době byla kontrola léčby odkázána pouze na semikvantitativní nemocniční stanovení odpadu glukózy do moči, které můžeme v tomto ohledu považovat za historický ekvivalent sledování hodnot glykémie, pacient sám žádný kontrolní mechanismus k dispozici neměl. Principiálně první měření glykosurie použil v roce 1780 ve formě fermentačního testu, který sám vyvinul, skotský lékař Francis Home [4].
Možnost rutinního stanovení koncentrace glukózy v krvi se objevila mezi světovými válkami, byla ovšem vázána na laboratoř, tedy na dostupnost většího nemocničního zařízení. V běžném životě kontroloval pacient nastavení léčby stále vyšetřováním glykosurie. Nepraktické chemické zkoušky (objevené v první polovině 19. století Fehlingem) byly postupně vystřídány prefabrikovanými tabletovými a v dalším kroku posléze papírkovými testy [4].
Zásadním krokem znamenajícím posun kontroly výsledků léčby směrem k dnešnímu stavu bylo v roce 1965 dokončení vývoje prvního přenosného přístroje Ames Dextrostix (E. C. Adams). Na proužek byl kápnut vzorek krve, po 60 sekundách prudce spláchnut proudem vody a výsledné zbarvení pacient porovnal s přiloženou barevnou škálou. Výsledkem byla přibližná hodnota glykémie. První glukometr vyvinutý A. H. Clemensem (Ames Reflectance Meter, obr. 1) byl patentován v roce 1971. Přístroj navazoval na typ Dextrostix, avšak odečet výsledné hodnoty koncentrace glukózy již nebyl prováděn subjektivně pacientem, ale byl stanoven přístrojově fotometrickou metodou. Tento glukometr měřil glykémie v rozpětí 0,6–22 mmol/l, byl napájen ze sítě a před použitím bylo třeba 30minutové „zahřátí" [5].
Metody používané ke stanovení koncentrace glukózy
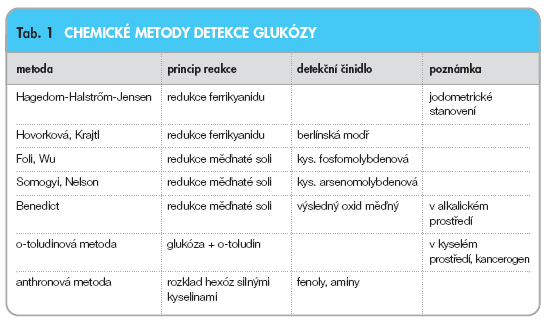
V historii byla využita celá řada technik vyšetření koncentrace krevního cukru. Společným jmenovatelem první skupiny metod moderní éry je fotometrický princip, kdy je veličina stanovena nepřímo jako barevný výsledek detekce produktu reakce glukózy s příslušnými látkami (tab. 1) [6, 7].
Možnost kontroly glykémie pacientem, kdekoliv je třeba, byla umožněna nejenom rychlou miniaturizací v elektrotechnice a vznikem přenosných měřicích přístrojů – glukometrů, ale zejména vývojem tzv. suché metody stanovení glukózy, kdy byly reagující látky stabilizovány do suché vrstvy a naneseny na testační proužky v podobě, jak je známe dnes.
První typy glukometrů využívaly některou z fotometrických cest stanovení koncentrace krevního cukru, dnešní glukometry využívají již prakticky všechny tzv. elektrochemické metody detekce se specifickými enzymatickými metodami [8].
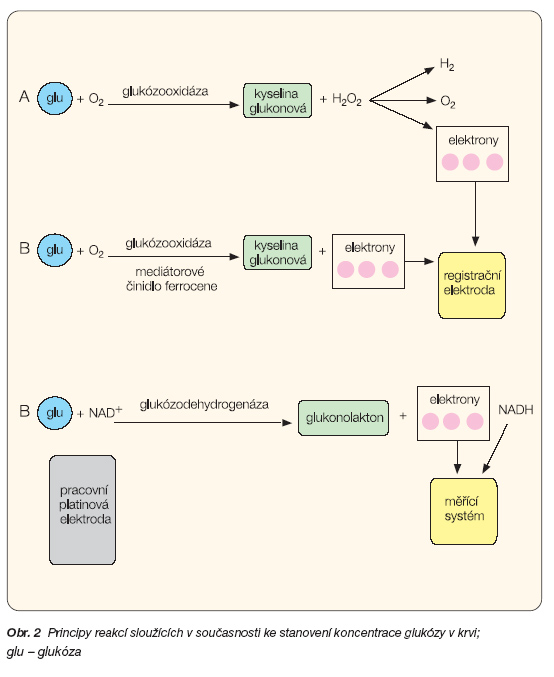
Historicky nejstarším a dodnes ve většině přístrojů využívaným enzymem je glukózooxidáza, která katalyzuje reakci glukózy a kyslíku. Sledovaným produktem této reakce je peroxid vodíku, který byl ve starších přístrojích pomocí detekčního činidla stanovován fotometricky (Trinderova metoda) [9], v novějších pak elektrochemicky (obr. 2A), kdy velikost zaznamenávaného elektrického proudu vznikajícího jeho rozkladem je přímo úměrná koncentraci glukózy. Určitý zkreslující vliv v této metodě má též rozpadem peroxidu vznikající kyslík, který není kvantifikován.
Jednou z modifikací metody je sledování konsumpce kyslíku v reakci. Tato metoda je využívána v nitrožilních senzorech dostupných zatím pouze pro klinické využití v rámci experimentu [10]. Další modifikací této metody je přímé měření proudu elektronů z reakce cestou mediátoru (obr. 2B) bez vzniku peroxidu vodíku. Odpadá tak znepřesňující vliv unikajícího kyslíku.
Základem novější metody používané pro některé glukometrové testační proužky je reakce katalyzovaná enzymem glukózodehydrogenázou. Zatímco ve velkých laboratorních přístrojích užívajících tuto metodu je vzniklý NADH odpovídající koncentraci glukózy stanovován fotometricky, v přenosných glukometrech jde opět o elektrochemický proces (obr. 2C). Principiální výhodou metody oproti glukózo-oxidázové reakci je přímé měření elektronového toku bez zkreslujících vedlejších produktů (kyslíku).
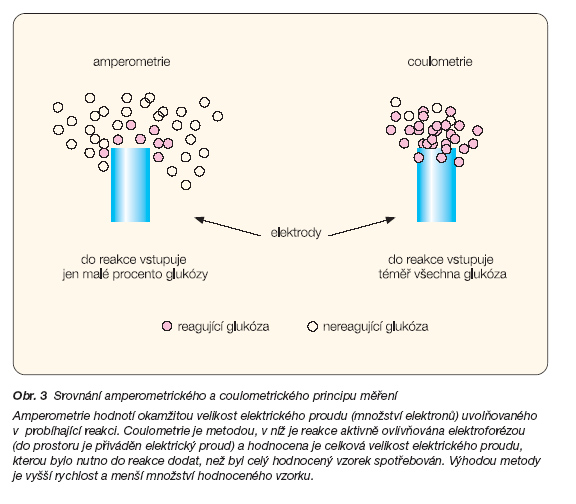
Významnou otázkou rutinního domácího monitorování je množství krve potřebné k získání dostatečné přesnosti měření. Na konci 60. let bylo množství krve potřebné k stanovení koncentrace glukózy okolo 100 ml, dnes se pohybuje mezi 1–10 ml. Tento pokles byl samozřejmě způsoben technologickým postupem umožňujícím zpřesnění užívaných metod. Výrobci některých glukometrů dokonce deklarují menší množství krve potřebné k měření (0,3 ml) [11]. V některých těchto přístrojích je běžná amperometrická metoda stanovení velikosti elektrického proudu nahrazena metodou coulometrickou (obr. 3).
Přesnost přenosných glukometrů
Přesnost výsledků měření osobními glukometry samozřejmě nedosahuje standardů velkých referenčních laboratorních přístrojů. Přesto musí být dostatečně vysoká, aby byla zajištěna smysluplnost jejich použití pro rozhodování o úpravě terapie, a především minimalizováno riziko hypoglykémie z příliš velké diskrepance mezi výsledkem měření a skutečnou hodnotou v pásmu glykémií při dolní hranici normy. Každý systém, než je uveden na trh, musí výše uvedené požadavky deklarovat.
Sledování přesnosti glukometrů užívaných v letech 1989–1999 oproti standardní laboratorní metodě (21 950 jednotlivých měření odebraných za kontrolovaných podmínek školeným personálem) prokázalo její pokles v letech 1990–1997 (Clarkova analýza odchylek > 90 % v letech 1989, 1997, 1998, 1999) a návrat k předpokládaným parametrům až v roce 1999 [12]. Závěry této práce vybízejí věnovat určitou pozornost míře přesnosti rovněž u přístrojů používaných v současnosti.
Větší než deklarovaná chyba měření může být též způsobena špatnou technikou odběru (menší množství krve [13], nečistota na povrchu kůže apod.) či nečistotou přístroje: moderní přístroje jsou vybaveny celou řadou kontrolních mechanismů, z nichž některé dokážou část těchto faktorů eliminovat či na ně alespoň upozornit. Nutná je i edukace pacienta o správném použití přístroje a pravidelných kalibracích a kontrolách přesnosti při ranních odběrech v laboratoři [12].
Selfmonitoring – schémata měření
Selfmonitoring glykémií je díky existenci přenosných glukometrů základním nástrojem kontroly léčby. Umožňuje okamžité odhalení hyperglykémie i hypoglykémie, je potvrzením správnosti léčby či upozorňuje na její nesprávné nastavení a v delším časovém horizontu poskytuje data potřebná k její optimalizaci. Ze všech výše uvedených důvodů je patrná i jeho významná role motivační [14].
Stojí za pozornost, že ze zjevných historických, sociopsychologických a v neposlední řadě i ekonomických důvodů byl selfmonitoring glykémií nejenom u nás dlouho doménou téměř výhradně pacientů léčených intenzifikovaným inzulinovým režimem či pomocí inzulinové pumpy. Zejména díky výsledkům několika epidemiologických studií ať již v USA (období 1988–2000) [15] či v některých evropských zemích [16–18], které i přes významné posuny v možnostech terapie neukázaly zlepšení kompenzace u pacientů s DM 2. typu, je vyvíjen stále větší tlak na implementaci selfmonitoringu i do terapie pacientů s diabetem 2. typu neléčených inzulinem a díky posledním změnám v úhradách testačních proužků bude snadnější stupňovat tento tlak i na naše pacienty.
Odhlédneme-li od ekonomických faktorů, je zásadním důvodem pro nízkou frekvenci měření našich pacientů vedle určité namáhavosti procedury bolestivost v místě vpichu. Tomu lze předejít důslednou edukací o technice odběru – výběr laterálních stran prstu, odběry především z 3–5 prstů a v posledních letech i odběry z alternativních míst – předloktí, paže, stehna [19], o nichž bude zmínka v následující kapitole.
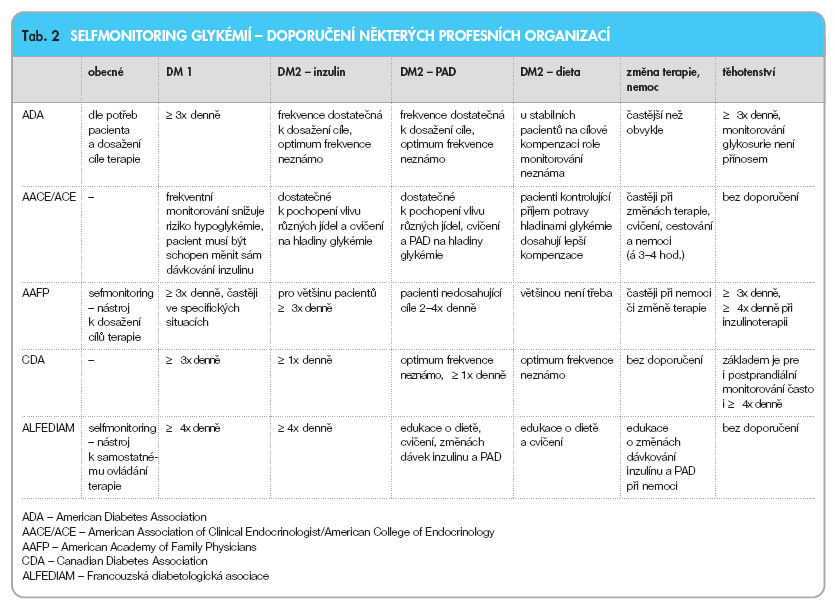
Doporučení ohledně frekvence selfmonitoringu jsou kvůli nedostatku konkrétních dat nejednoznačná. Pro srovnání uvádíme v tab. 2 pravidla selfmonitoringu glykémií některých významných profesních organizací [20].
Otázkami monitorování výsledků terapie a především selfmonitoringem glykémií se v říjnu 2004 zabývala mezinárodní konference za účasti expertů WHO, International diabetes center, Americké asociace diabetologických edukátorů a Výbor pro diabetologický výzkum a edukaci (CADRE). I přes částečnou obecnost jsou závěry tohoto jednání přínosem jak pro každodenní diabetologickou praxi, tak i pro obecné úvahy o vztahu pacient-lékař, zejména co se týče dostatečné edukace a tedy samostatnosti pacientova rozhodování o terapii [14].
Vybrané závěry a doporučení týkající se selfmonitoringu glykémií
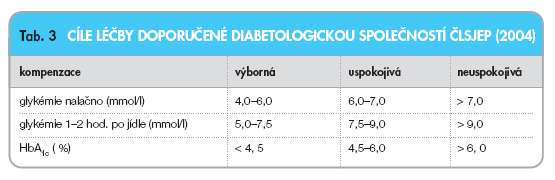
1. ‑Vyšetření HbA1c i selfmonitoring glykémií jsou základními předpoklady dosažení kompenzace diabetu (HbA1c hodnotí dlouhodobou kompenzaci, glykemické profily ukazují aktuální vzorec pre- a postprandiálních glykémií).
2. ‑Selfmonitoring glykémií se musí stát integrální součástí léčby všech pacientů s diabetem bez ohledu na typ onemocnění.
3. ‑Selfmonitoring je základní komponentou péče o diabetiky léčené inzulinem, u kterých snižuje riziko hypoglykémie a umožňuje rychlou optimalizaci terapie.
4. ‑Vyšetření glykosurie nenahrazuje selfmonitoring glykémií a mělo by být omezeno pouze na situace, kdy je glukometr nedostupný.
5. ‑Frekvence monitorování glykémií pro pacienty nad horní hranicí doporučených hodnot HbA1c:
a) ‑pacienti s intenzifikovaným inzulinovým režimem či inzulinovou pumpou: minimálně 3–4x denně, optimálně lačné hodnoty doplnit postprandiálními (1–2 hod. po jídle), před spaním (7bodový profil) a příležitostně noční hodnoty (02.00–03.00);
b) ‑pacienti léčení nefarmakologicky: 7bodový profil alespoň 1x týdně, noční kontrola dle potřeby;
c) ‑pacienti léčení perorálními antidiabetiky + 1 denní dávkou inzulinu: alespoň 2x denně.
6. ‑Frekvence monitorování glykémií pro pacienty dosahující cílových hodnot HbA1c:
a) ‑pacienti léčení perorálními antidiabetiky či jednou dávkou inzulinu: alespoň 1x denně + 8bodový profil 1x týdně (výše uvedený 7bodový profil + noční kontrola);
b) ‑pacienti léčení perorálními antidiabetiky a 1 dávkou inzulinu denně: alespoň 1x denně + 8bodový profil alespoň 2x týdně;
c) ‑pacienti s intenzifikovaným inzulinovým režimem či inzulinovou pumpou: ve stejném schématu jako v bodě 5a.
7. ‑Doporučené frekvence měření musí být optimalizovány vzhledem k dosažené kompenzaci diabetu a zvláštním klinickým situacím (frekvence hypoglykémií, méně obvyklé inzulinové režimy apod.).
8. ‑Kontrola glykémií by měla probíhat v různé denní doby, preprandiálně a 1–2 hodiny postprandiálně.
9. J‑sou-li lačné glykémie v doporučených mezích, ale kompenzace diabetu (HbA1c) není uspokojivá, těžiště selfmonitoringu by se mělo posunout směrem k postprandiálnímu měření.
Alternativní místa měření
Krev pro stanovování koncentrace glukózy je získávána nejčastěji z konečků prstů, kde se glykémie pohybuje v hodnotách blízkých hodnotám v krvi arteriální. Vzhledem k vysoké hustotě nervových zakončení v těchto oblastech je však odběr pro pacienta obvykle velmi bolestivý a to bývá překážkou častějších kontrol glykémií.
Limitujícím faktorem pro odběr z jiných míst těla, kde je méně nepříjemný (tzv. alternativní místa) [21, 22], bylo množství krve potřebné pro vyhodnocení vzorku. Vzhledem k malému objemu takto získané krve (≤≤ 0,3 ml/min.) bylo využití alternativních bodů donedávna nepraktické až nemožné.
Zlom přinesl vývoj několika glukometrů pro stanovení glykémie ze vzorku o velikosti 0,3–2,6 ml, které umožnily odběr z předloktí, paží, břicha, stehen či lýtek [11].
Díky odlišné cirkulaci v dermálním oběhu mezi prsty a těmito alternativními místy (až 5x větší průtok v oblasti prstů v porovnání s předloktím) prokázala řada autorů signifikantní rozdíl v koncentracích glykémií ve chvílích její rychleji se měnící koncentrace. Výsledkem měření glykémie v alternativním místě může tedy být vyšší riziko hypoglykémie v důsledku ještě relativně vysoké koncentrace glukózy v odebrané kapilární krvi v porovnání s krví arteriální [11, 23, 24].
Z těchto důvodů se odběr z alternativních míst ve chvílích zvýšeného rizika hypoglykémie (potvrzení klinických příznaků hypoglykémie, sport, delší lačnění apod.) nedoporučuje.
Preprandiální a postprandiální měření glykémie
Důraz kladený v posledních letech na častější kontrolu postprandiální glykémie u pacientů s diabetes mellitus 2. typu má dvě základní příčiny. První z nich bylo zjištění, že postprandiální hyperglykémie je spojena se zvýšeným kardiovaskulárním rizikem [25–28]. Je též prokázáno, že hyperglykémie v období akutního infarktu myokardu [29, 30] i cévní mozkové příhody [31, 32] má nepříznivý vliv na prognózu pacienta. Existuje několik intervenčních studií ukazujících pozitivní vliv snížení postprandiálních glykémií jednak na kardiovaskulární riziko (léčba acarbosou) [33], jednak na zlepšení rizikových faktorů aterosklerózy, jako je tloušťka intimy/medie a. carotis při léčbě acarbosou [34] či repaglinidem a glibenclamidem [35]. Byl též podán důkaz redukce tloušťky intimy/medie a. carotis signifikantně spojené s poklesem postprandiální, a ne lačné glykémie [35].
Druhou příčinou zvýšeného zájmu o postprandiální kontrolu glykémií byly výsledky studií prokazující, že měření koncentrace glykémie v těchto časových bodech koreluje s kompenzací choroby (HbA1c), a to v některých případech lépe než hodnoty lačné glykémie [36, 37]. Několik studií též ukázalo zlepšení kompenzace pacientů s diabetes mellitus 2. typu (HbA1c), je-li cílem terapie minimalizace hodnot postprandiálních glykémií [38–40]. Nedávno publikovaná studie dokonce naznačila, že riziko vývoje diabetické retinopatie může být zohledněno hodnotami postprandiálních koncentrací glykémie lépe než hodnotami HbA1c [41].
Cílové hodnoty koncentrací glukózy jsou uvedeny v tab. 3.
Monitorování glykémie in vivo
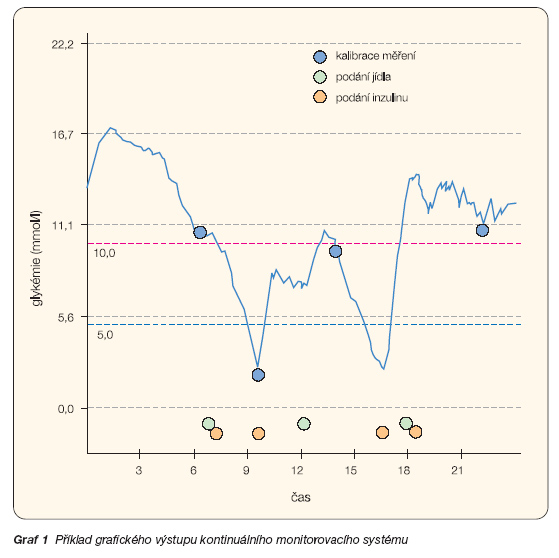
Dosažení spojité či blízce spojité kontroly glykemických hodnot bylo cílem práce řady vědeckých týmů. První reálné klinické výsledky přinesl kontinuální monitorovací systém CGMS (graf 1) [42].
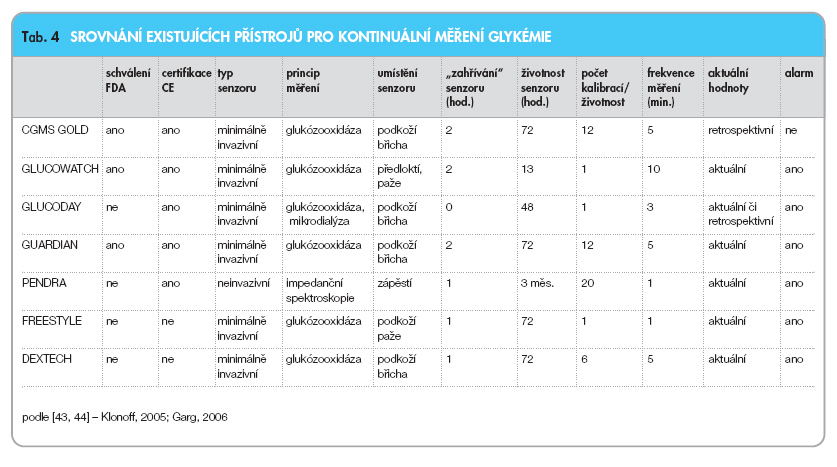
V současné době existuje 5 systémů kontinuálního monitorování certifikovaných ke klinickému použití v USA či Evropě. Jsou to CGMS GOLD (Medtronic MiniMed Inc.), GLUCOWATCH (Biografer, Cygnus Inc.), GUARDIAN REAL TIME GLUCOSE MONITORING SYSTEM (Medtronic MiniMed Inc.), GLUCODAY (A. Menarini Diagnostic) a PENDRA (Pendragon Medical). Další systém FREESTYLE NAVIGATOR GLUCOSE MONITORING SYSTEM (Abbott Laboratories) je posuzován v rámci schvalování FDA [43], recentně byla publikována studie prokazující bezpečnost a přesnost kontinuálního monitoru DEXTECH GMS [44]. Srovnání základních parametrů uvedených zařízení shrnuje tab. 4.
1. CGMS GOLD umožňuje až 5denní měření glykémií (jedna hodnota glykémie á 5 minut získaná průměrem velikosti elektrického proudu odečtené á 10 s). Přístroj neposkytuje aktuální hodnoty koncentrace glukózy, ty jsou po skončení měření zobrazeny v příslušném počítačovém programu. Zařízení pracuje na bázi reakce katalyzované glukózooxidázou (obr. 2A). Jednorázově používaný senzor (deklarovaná přesnost měření po dobu 5 dnů) je zaveden do podkoží a snímá koncentraci glukózy v intersticiální tekutině. Zde je třeba upozornit na odstup v koncentraci glukózy mezi intersticiálním prostředím a arterií při rychlé změně (např. postprandiálně). Tento odstup dle různých prací dosahuje 5–30 minut [45, 46]. Přístroj je nutno kalibrovat zadáním 4 hodnot glykémií denně.
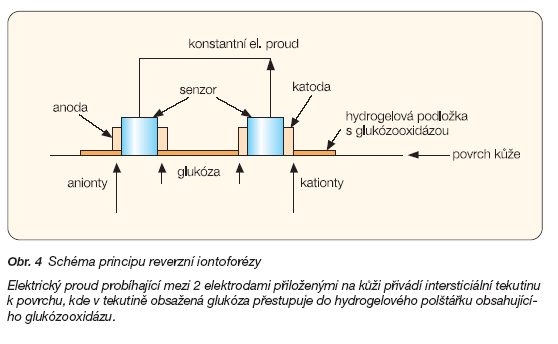
2. GLUCOWATCH je systém založený na principu reverzní iontoforézy (obr. 4). Elektrický proud probíhající mezi 2 elektrodami přiloženými na kůži přivádí intersticiální tekutinu k povrchu a zde z ní glukóza přestupuje do hydrogelového polštářku obsahujícího glukózooxidázu, kde probíhá obvyklá reakce (obr. 2A) [47]. Poslední verze přístroje zobrazí aktuální hodnotu glykémie každých 10 minut. Určitým nedostatkem přístroje je relativně dlouhá iniciační doba (3 hod.), časté iritace kůže a výpadky měření při pocení a chladu.
3. GLUCODAY je systém založený na mikrodialyzační technice, kdy je z podkoží speciálním roztokem intersticiální tekutina vymývána a vyvedena k mimotělně umístěnému senzoru. Zde je opět na principu glukózooxidázové reakce (obr. 2A) stanovena koncentrace glukózy v krvi. Zpoždění stanovení výsledku nepřekračuje oproti době odběru vzorku 2 minuty. Výhodou je okamžitá inicializace přístroje.
4. GUARDIAN REAL TIME GMS je novější variantou CGMS Gold, která v bezdrátovém provedení poskytuje aktuální hodnoty glykémie. Je vybavena alarmem a ve verzi spojené s inzulinovou pumpou MiniMed Paradigm 522, 722 umožňuje i aktuální zobrazení trendu glykémie v době mezi vygenerovanými hodnotami (á 5 minut), což je výhodné z hlediska prevence hypoglykémie (např. při větší tělesné aktivitě). Doporučená frekvence kalibrací získaných hodnot glykémie vložením z glukometru je 4x denně. Při frekvenci kalibrací 2–3x denně je přesnost přístroje dle výrobce ještě dostatečná.
5. PENDRA je neinvazivní systém měřící elektroimpedanci elektrolytového prostředí intersticiální tekutiny v podkoží a výpočtem určuje hodnotu glykémie. Je vyráběn ve formě náramkových hodinek. Výhodou je neinvazivnost a dlouhá doba životnosti senzoru (měsíce).
6. FREESTYLE NAVIGATOR GMS je systém pro kontinuální měření umožňující aktuální zobrazení glykémií. Jeho výhodou je minimální počet kalibrací nutných pro činnost systému.
7. DEXTECH GMS je minimálně invazivní systém určující koncentraci glykémie v intersticiálním prostředí. Výhodou jsou pouze 2 požadované kalibrační hodnoty denně [44].
V této chvíli již donedávna čistě experimentální stadium vývoje kontinuálních monitorů přineslo klinické výsledky a k dispozici je několik přístrojů poskytujících podrobnější obraz exkurzí glykémií v průběhu dne. I přes občasné výhrady k jejich přesnosti poskytují lepší vhled do tajů exkurzí glykémií [43, 48] a možnost jejich využití je pro pacienty velmi povzbuzující [44].
Budoucnost monitorování glykémie in vivo
Alternativními cestami v oblasti minimálně invazivních senzorů jsou dlouhodobě pracující do podkoží implantované senzory radiově přenášející data do zobrazovacího přístroje. Miniaturní verze těchto přístrojů přibližně velikosti malého monočlánku jsou zkoušeny firmou DexCom, Inc. [49].
Existuje již i nitrožilní systém, jehož senzor je zaveden do horní duté žíly, kde vyhodnocuje glykémii každou minutu. Tento systém je s prokázanou dostatečnou přesností funkční po řadu měsíců a je testován jako detekční zařízení koncentrace glykémie v žilní krvi pro uzavřené okruhy s využitím implantabilní inzulinové pumpy [10].
Neinvazivní typy senzorů využívající infračervenou spektroskopii mají zatím pro svoji nepřesnost daleko ke klinickému použití.
Mnohem slibnější se nyní zdají být fluorescenční metody, které využívají různých mediátorů měnících s koncentrací glukózy své fluorescenční vlastnosti [50]. Některé přístroje již byly testovány na zvířatech, fluorescenční změny podkožně zavedených senzorů jsou snímány speciálním zařízením transdermálně.
Významným krokem je objevení autofluorescenčních vlastností NADPH (na rozdíl od nefluorescenčního NADP), které potenciálně umožňuje neinvazivní transdermální monitorování glykémie, studie in vitro prokázaly u některých buněk (fibro-blasty) možnost detekce koncentrace glykémie na nitrobuněčné úrovni [51].
Práce byla podpořena grantem IGA NR/8226-3 a MSM 0021620814.
Seznam použité literatury
- [1] The diabetes control a complication trial research group: the effect of intensive treatment of diabetes on development and progression of long term complications in insulin-dependent patients. N Engl J Med;1993; 329: 977–986.
- [2] UK Prospective diabetes study group, UKPDS 33. Lancet 1999; 352: 837–853.
- [3] Thomayer J. Pathologie a Therapie nemocí vnitřních. Bursík a Kohout, 1909.
- [4] Schadewaldt H. Die Geschichte des Diabetes. Allergie Immun Forsch 1968; S 9–22.
- [5] United States Patent 3; 604: 815.
- [6] Burrin JM, Alberti KGMM. What is blood glucose: can it be measured? Diabet Med 1990; 7: 199–206.
- [7] Syllaba J. Diabetes mellitus. Praha, Avicenum, 1972; 85–86.
- [8] Pickup J, et al. Textbook of diabetes mellitus. Blackwell Science 1998; 30. 3.
- [9] Trinder P. Determination of glucose in blood using glucose oxidase with an alternative oxygen acceptor. Ann Clin Biochem 1969; 6: 24–27.
- [10] Renard E, Shah R, Miller M, et al. Accuracy of real time blood glucose measurement by long-term sensor system allows automated insulin delivery in diabetic patiente. Diabetes 2002; 51(suppl2): 126A.
- [11] Jungheim K, Koschinsky T. Risk delay of hypoglycemia detection by glucose monitoring at the arm. Diabetes Care 2002; 25: 956–960.
- [12] Bohme P, Flotiot M, Sirceaux M, et al. Evolution of analytical performance in portable glucose meters in the last decade. Diabetes Care 2003; 26: 1170–1176.
- [13] Yared Z, Aljaberi K, Renouf N, et al. The effect of blood sample volume on 11 glucose monitoring system. Diabetes Care 2005; 28: 1836.
- [14] Bergenstal RM, Gavin III. JR. The role of selfmonitoring of blood glucose in the care of people with diabetes: report of global consensus conference. Am J Med 2005; 118: 1S–6S.
- [15] Koro CE, Bowlin SJ, Burgeois, et al. Glycemic control from 1988 to 2000 among US adults diagnosed with Type 2 diabetes. Diabetes Care 2004; 291: 335–342.
- [16] Ubink-Veltmaat LJ, Bilo HJ, Groenier KH, et al. Prevalence, incidence and mortality of type 2 diabetes mellitus revisited: a prospective population-based study in the Neatherlands. Eur J Epidemiol 2003; 18: 793–800.
- [17] Gatling W, Budd S, Walter D, et al. Evidence proof an increasing prevalence of diagnosed diabetes mellitus in the Poole area from 1983 to 1996. Diabetes Med 1998; 15: 1015–1021.
- [18] Berger B, Stenstrom G, Sundkvist G. Incidence, prevalence, and mortality of diabetes in a large population: a report from Skaraborg diabetes registry. Diabetes Care 1999; 22: 773–778.
- [19] Maydfield J, Havas S. A physician´s guide to blood glucose monitoring, 2005.
- [20] Renard E. Monitoring glycemic control: the impertence of self-monitoring of blood glucose. The Am J Med 2005; 118 (12–19S).
- [21] Cunningham DD, Henning TP, Shain EB, et al. Vacuum-assisted lancing of the forearm: an effective a less painful approach to blood glucose monitoring. Diabetes Technol Ther 2001; 2: 541–548.
- [22] Fineberg SE, Bergenstal RM, Bernstein RM, et al. Use of an automated device for alternative site blood glucose monitoring. Diabetes Care 2001; 24: 1217–1220.
- [23] Ellison JM, Janet M, Stegmann MS, et al. Rapid changes in postprandial blood glucose produce concentration differences at finger, forearm, and thigh sampling sites. Diabetes Care 2001; 24: 1303–1304.
- [24] Lucidarme NC, Alberti CI, Zaccaria I, et al. Alternate-site testing is reliable in children and adolescents with type 1 diabetes, except at the forearm for hypo-glycemia detection. Diabetes Care 2005; 28: 710–711.
- [25] De Vegt F, Dekker JM, Ruh`e HG, et al. Hyper-glycaemia is associated with all-cause and cardiovascular mortality in the Hoorn population: the Hoorn Study. Diabetologia 1999; 42: 926–931.
- [26] Donahue RP, Abbott RD, Reed DM, et al. Postchallenge glucose concentration and coronary heart disease in men of Japanese ancestry: Honolulu Heart Program. Diabetes 1987; 46: 669–689.
- [27] The DECODE Study Group, the European Diabetes Epidemiology Group: Glucose tolerance and mortality: comparison of WHO and American Diabetes Association Diagnostic Criteria. Lancet 1999; 354: 617–621.
- [28] Coutinho M, Gerstein HC, Wang Y, et al. The relationship between glucose and incident cardiovascular events: a metaregression analysis of published data from 20 studies of 95,783 individuals followed for 12.4 years. Diabetes Care 1999; 22: 233–240.
- [29] Bellodi G, Manicardi V, Malavasi V, et al. Hyper-glycemia and prognosis of acute myocardial infarction in patients without diabetes mellitus. Am J Cardiol 1989; 64: 885–888.
- [30] O´ Sullivan JJ, Conroy RM, Robinson K, et al. In hospital prognosis of patients with fasting hyper-glycemia after first myocardial infarction. Diabetes Care 1991; 14: 758–760.
- [31] Gray CS, Taylor R, French JM, et al. The prognostic value of stress hyperglycaemia and previously unrecognized diabetes in acute stroke. Diabet Med 1987; 4: 237–240.
- [32] Gray CS, French JM, Bates D, et al. Increasing age, diabetes mellitus and recovery from stroke. Postgrad Med J 1989: 65; 720–742.
- [33] Chiasson JL, Josse RG, Gomis R, et al. The STOP-NIDDM Trial Research Group: Acarbose treatment and the risk of cardiovascular disease and hypertension in patients with impaired glucose tolerance: the STOP-NIDDM trial. JAMA 2003; 290: 486–494.
- [34] Hanefeld M, Chiasson JL, Koehler C, et al. Acarbose slows progression of intima-media thickness of the carotid arteries in subjects with impaired glucose tolerance. Stroke 2004; 35: 1073–1078.
- [35] Esposito K, Giugliano D, Nappo F, Marfella R. Regression of carotid atherosclerosis by control of postprandial hyperglycemia in type 2 diabetes mellitus. Circulation 2004; 29: 2978 –2984.
- [36] Avignon A, Radauceanu A, Monnier L. Nonfasting plasma glucose is a better marker of diabetic control than fasting plasma glucose in type 2 diabetes. Diabetes Care, 1997; 20: 1822–1826.
- [37] Monnier L, Lapinski H, Colette C. Contributions of fasting and postprandial plasma glucose increments to the overall diurnal hyperglycemia of type 2 diabetic patients: variations with increa-sing levels of HbA1c. Diabetes Care 2003; 26: 881–885.
- [38] Feinglos MN, Thacker CH, English J, et al. Modification of postprandial hyperglycemia with insulin lispro improves glucose control in patients with type 2 diabetes. Diabetes Care 1997; 20: 1539–1542.
- [39] Bastyr EJ, Stuart CA, Brodows RG, et al. Therapy focused on lowering postprandial glucose, not fasting glucose, may be superior for lowering HbA1c. Diabetes Care 2000; 23: 1236–1241.
- [40] De Veciana M, Major CA, Morgan MA, et al. Postprandial versus preprandial blood glucose monitoring in women with gestational diabetes mellitus requiring insulin therapy. N Engl J Med 1995; 333:1239–1241.
- [41] Toshihiko S, Hideaki K, Takeshi M, et al. Postprandial hyperglycaemia is a better predictor of the progression of diabetic retinopathy than HBA1c in japanese type 2 diabetic patiens. Diabetes Care 2005; 28: 2806–2807.
- [42] Mastrototare J, et al. The Mini Med Continuous Glucose monitoring System. Diab Technol Ther 2002; (Suppl 1): 13–18.
- [43] Klonoff D. Continuous glucose monitoring. Diabetes Care 2005; 28: 1231–1239.
- [44] Garg SK, Zisser H, Schwartz S, et al. Improvement in glycemic excursions with a transcutaneous, real-time continuous gluxose sensor. Diabetes Care 2006; 29: 44–51.
- [45] Claremont J, Sambrook IE, Penton C, et al. Subcutaneous implantation of ferrocene –mediated glucose sensor in pigs. Diabetologie 1986; 29: 217–218.
- [46] Aussedat B, Dupirie-Angel M, Gifford R, et al. Intersticial glucose concentration and glycaemia: implication for continuous glucose monitoring. Am J Physiol 2000; 278: E 716-E 728.
- [47] Tamada JA, Garg S, Jovanovic L, et al. Noninvasive glucose monitoring. Comprehensive clinical results. JAMA 1999; 282: 1839–1844.
- [48] Pickup J, Hussain F, Evans N, et al. In vivo glucose monitoring: the clinical reality and the promise. Biosensors and Bioelectronics 2005; 20: 1897–1902.
- [49] Garg SK, Potts RO, Ackerman NR, et al. Improved glucose excursion using an implantable real-time continuous gluxose sensor in adults with type 1 diabetes. Diabetes Care 2004; 27: 734–738.
- [50] Lakowitz JR. Principles of Fluorescence Spectroscopy 1999; Plenum press, New York.
- [51] Evans ND, Gnudi L, Rolinski OJ, et al. Non-invasive glucose? Monitoring by NAD (P)H autofluorescence spectroscopy in fibroblasts and adipocytes: a model for skin glucose sensing. Diab Technol Ther 2003; 5: 807–816.