Současné možnosti systémové léčby nádorů hlavy a krku
Souhrn:
Brančíková D. Současné možnosti systémové léčby nádorů hlavy a krku. Remedia 2021; 31: 232–235.
Systémová léčba nádorů hlavy a krku se týká především pokročilých stadií, recidiv a metastatických nádorů. Základem kurativního postupu u inoperabilních nálezů je stále konkomitantní léčba radioterapií a platinovým režimem, kde nepřekonané nejlepší výsledky má cisplatina podávaná v dávce 100 mg/m2 každých 21 dní třikrát po dobu radioterapie. Cetuximab v této indikaci nepotvrdil očekávání lepšího nebo stejného výsledku při nižší toxicitě, a to ani pro podskupinu méně rizikových nádorů, pozitivních na lidský papilomavirus. V indukční léčbě, vždy indikované striktně individuálně, jsou nejúčinnější triplety cytostatik cisplatina, docetaxel a 5‑fluorouracil. V léčbě paliativní je pro první linii u nádorů s expresí ligandu receptoru programované buněčné smrti 1 (PD‑L1) dle kombinovaného pozitivního skóre (CPS) ≥ 1 vhodný pembrolizumab samostatně nebo v kombinaci, při kontraindikaci imunoterapie nebo CPS ≤ 1 režim docetaxel, cisplatina a cetuximab. Ve druhé linii po selhání léčby platinovým derivátem prokázaly dobrý efekt a nižší toxicitu nivolumab i pembrolizumab proti srovnávacímu rameni s cytostatiky.
Summary:
Brancikova D. Current possibilities of systemic treatment of head and neck cancer. Remedia 2021; 31: 232–235.
Systemic treatment of head and neck cancer mainly concerns advanced stages, recurrences and metastatic tumors. The basis of the curative procedure for inoperable findings is still concomitant treatment of radiotherapy and platinum regimen, where cisplatin has unsurpassed best results at dose 100 mg/m2 every 21 days three times during radiotherapy. Cetuximab has not fulfilled expectations of a better or the same result with lower toxicity in this indication, not even for a subset of low‑risk HPV‑positive patients. In induction therapy, always indicated strictly individually, the most effective triplet is cisplatin, docetaxel and 5‑fluorouracil. In palliative care, pembrolizumab alone or in combination is suitable for first‑line tumors with programmed cell death receptor ligand 1 (PD‑L1) expression according to combined positive score (CPS) ≥ 1. When immunotherapy is contraindicated or CPS ≤ 1, a regimen of docetaxel, cisplatin and cetuximab is suitable. In the second line, after failure of treatment with platinum derivates, both nivolumab and pembrolizumab showed a good effect against the cytostatic control arm and also lower toxicity.
Key words: recurrent and metastatic squamous cell carcinoma of the head and neck, immunotherapy, cetuximab, cisplatin
Úvod
Incidence nádorů hlavy a krku (head and neck cancer, HNC) se zvyšuje celosvětově [1]. Ačkoliv hlavními epidemiologickými faktory asociovanými s výskytem těchto nádorů jsou stále abúzus alkoholu a kouření, čím dál větší význam má v etiologii rozvoje HNC (hlavně dutiny ústní a orofaryngu) infekt lidským papilomavirem (human papillomavirus, HPV). Karcinomy ve spojitosti s výskytem papilomavirové infekce (tzv. HPV pozitivní HNC) mají odlišné chování a obecně lepší odpovědi na léčbu i lepší prognózu [2]. HPV pozitivních HNC je v České republice 45-65 % dle jednotlivých lokalit [1]. Systémová léčba HNC se týká lokálně pokročilých, recidivujících a diseminovaných nádorů. Tito nemocní mívají velmi často již při zahájení léčby obtíže způsobené tumorem – hmotnostní úbytek, kdy ztráta 5 % tělesné hmotnosti představuje samostatný rizikový faktor zhoršující efekt léčby a prognózu [3], dále poruchy polykání a obstrukci horních dýchacích cest, někdy s nutností zavedení tracheostomie nebo výživné jejunostomie, ev. gastrostomie, což zvyšuje riziko výskytu lokálních infekčních komplikací. K faktorům, které přispívají k rizikům podávání systémové léčby, patří samozřejmě anamnéza dlouhodobého kouření a s ním spojené komplikace, chronický abúzus alkoholu, rovněž komorbidity a sociální status pacienta, jež souvisejí se zajištěním podpůrné péče [4].
Lokálně pokročilé onemocnění
Pacient s lokálně pokročilým inoperabilním HNC je kandidátem léčby konkomitantní – radioterapie a chemoterapie, případně radioterapie a bioterapie současně. Optimálním a doposud nepřekonaným režimem pro konkomitanci se jeví monoterapie cisplatinou ve vysoké dávce, tedy 100 mg/m2 každé tři týdny spolu s radioterapií, v celkem třech podáních [5]. Dalšími zkoušenými režimy v této indikaci byly cisplatina v týdenní dávce 40 mg/m2 po dobu radioterapie, karboplatina s 5 fluorouracilem (5 FU) a paklitaxel samostatně nebo v týdenní kombinaci s karboplatinou [6-8]. Rozsáhlá metaanalýza jednotlivých režimů uplatněných v 87 studiích zahrnujících 17 346 pacientů prokázala přínos konkomitantně podávané chemoterapie (poměr rizik [HR] 0,88; p < 0,0001) s absolutním přínosem 4,5 % na dobu pěti let. Přínos konkomitantní chemoterapie byl hodnocen jako vyšší ve srovnání s přínosem indukční chemoterapie [9]. Prospěch se snižuje s věkem, kdy jsou u pacientů starších 75 let výsledky stejné jako u samostatné radioterapie. To se týká i konkomitance radioterapie s cetuximabem, která nemá tak dobré výsledky jako kombinace s cisplatinou, a to ani u pacientů HPV pozitivních s dobrou prognózou [10]. Dle studie De ESCALaTE, v níž byli randomizováni HPV pozitivní pacienti, nebyl pro konkomitantní léčbu cisplatinou anebo cetuximabem zaznamenán významný rozdíl v toxicitě, ale promítl se do dvouletého přežití - 97,5 % pro rameno s cisplatinou vs. 89,4 % pro rameno s cetuximabem (HR 5,0). Možnost konkomitance s cetuximabem tedy zůstává jen pro vybrané pacienty [11]. Rozdíly v efektu u konkomitance s karboplatinou a paklitaxelem jsou podobné, nicméně přínos této konkomitance je malý, rozdíly v pětiletém přežití oproti standardnímu rameni s radioterapií jsou 22 % vs. 16 % [7].
Indikace indukční chemoterapie, která předchází operaci nebo kurativní radioterapii, je možná, ale není zde jednoznačně doložen příznivý efekt. Cílem bývá zachovat funkční orgán - nejčastěji larynx - či docílit zmenšení nádoru, který se iniciálně hraničně vejde do ozařovaného objemu. Indikace je tedy na hranici mezi pokusem o kurativní postup a první linií paliativní léčby. Nejúčinnějšími režimy v této indikaci jsou kombinace cisplatiny a 5 FU s docetaxelem v podání celkem třikrát každých 21 dní a poté následuje znovu zvážení kurativního postupu dle dosažené odpovědi. Pokud je cisplatina během indukce podána v plné dávce, je režim zatížen značnou toxicitou, především rozvojem neutropenie (riziko rozvoje neutropenie stupně 4 činí 31 % a febrilní neutropenie 11 %), a nefrotoxicitou, avšak vzhledem k farmakokinetice cisplatiny se radiopotenciační efekt může uplatnit pouze při konkomitantním podání spolu s radioterapií [12]. Z tohoto důvodu další záchovná rozvaha znamená možnost konkomitance jen málokdy, ve studiích byl zaznamenán podíl do 20 % pacientů s různými režimy, nejčastěji s karboplatinou, přínos ani toxicita však nebyly u této podskupiny zvláště hodnoceny.
Další možností konkomitantního
režimu podaného po indukci je cetuximab. Tento postup byl
analyzován v randomizované studii fáze II TREMPLIN se 156
pacienty, v níž byly podány tři série režimu TPF:
docetaxel 75 mg/m2 a cisplatina 75 mg/m2 v den
1, poté kontinuálně 5 FU 750 mg/m2 120 hodin,
a to každých 21 dní po tři cykly. Následně byli
pacienti s odpovědí menší než parciální remise minimálně
o 50 % rozděleni do ramen s radioterapií do 70
Gy aplikovanou konkomitantně s cisplatinou v dávce
100 mg/m2 každých 21 dní po tři cykly
anebo s cetuximabem 400 mg/m2 sytící dávky
podané týden před započetím radioterapie a poté v dávce
250 mg/m2 jednou týdně. Ačkoliv v rameni
s cetuximabem bylo více podaných cyklů a méně
přerušení léčby, bylo zaznamenáno více relapsů než v rameni
s cisplatinou a celkové přežití (overall survival, OS)
bylo stejné, přínos cetuximabu v konkomitanci byl tedy menší
než u podané chemoterapie [13]. Přímé srovnání režimů,
v nichž by byla podávána indukce ve třech sériích
režimem TPF a následně konkomitance s cisplatinou nebo
s karboplatinou, provedeno nebylo. Některé studie hodnotí
zařazení tří cyklů indukce následované konkomitancí
s chemoterapií nebo bioterapií jako přínosné, byly však
provedeny u poměrně malého počtu pacientů a jejich
výsledky nejsou konzistentní [14]. Pro rutinní praxi nelze
indukční léčbu standardně doporučit, i když může být
zvažována ve výše uvedených indikacích [15]. Pokud je
multioborovou komisí tento postup doporučen, je
optimální podání kombinačních režimů s docetaxelem, jak
udává tabulka 1.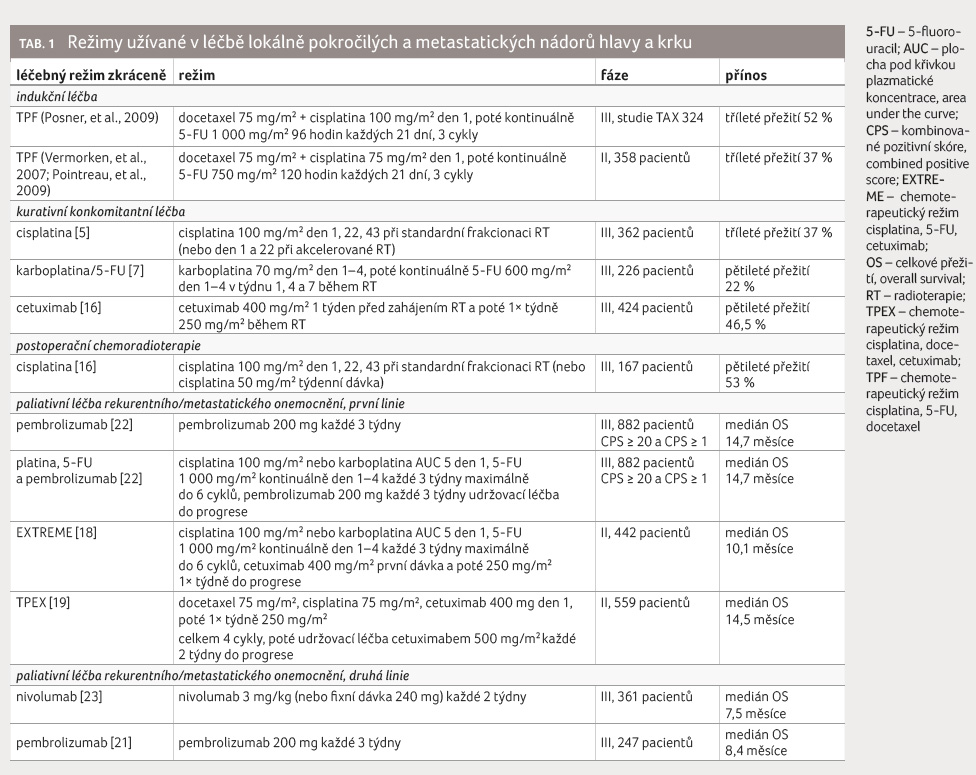
V případě spinocelulárních operabilních HNC se adjuvantní postoperační systémová léčba podává konkomitantně s radioterapií a standardní dávkou cisplatiny 100 mg/m2 den 1, 22 a 43, nebo jednou týdně dávka 40 mg/m2. Účinnost obou typů dávkování je srovnatelná [16]. Oproti radioterapii bez systémové léčby se sníží riziko rozvoje lokálního relapsu z 31 % na 18 % v horizontu pěti let, OS však zůstává stejné [17].
Systémová léčba rekurentního
a metastatického karcinomu
První linie
Rekurentní a metastatický spinocelulární HNC je léčen individuálně dle rozsahu a lokalizace ložiskového postižení, symptomatologie a celkového stavu pacienta. Prvním režimem, který v této indikaci prokázal dobrý efekt, je režim dle studie EXTREME s kombinací cisplatiny, 5 FU a cetuximabu, který se stal standardem [18]. Uvedená kombinace byla následně modifikována a ve studii TPEX byl místo 5 FU podáván taxan – docetaxel v dávce 75 mg/m2 plus cisplatina 75 mg/m2, cetuximab 400 mg v den 1, poté jednou týdně 250 mg/m2 celkem čtyři cykly a následně pokračovala léčba cetuximabem v dávce 500 mg/m2 každé dva týdny do progrese onemocnění. Dosažený efekt představovalo OS 14,5 měsíce, avšak v rameni se standardním režimem dle studie EXTREME (cisplatina 100 mg/m2 nebo karboplatina AUC [plocha pod křivkou] 5 v den 1, 5 FU 1 000 mg/m2 kontinuálně v den 1–4 každé tři týdny maximálně šestkrát, cetuximab 400 mg/m2 první dávka a poté 250 mg/m2 jednou týdně do progrese) bylo dosaženo OS dokonce 13,4 měsíce [19]. Uvedené režimy prolomily hranici jednoho roku mediánu OS a staly se standardem pro léčbu recidivujícího a metastatického HNC.
Vzápětí se ale pro léčbu první linie objevily také další léčebné možnosti v podobě imunoterapie. První efekt monoterapie pembrolizumabem u HNC ukázala studie fáze Ib KEYNOTE 012, kde bylo dosaženo léčebné odpovědi u 22 % pacientů, s expresí ligandu receptoru programované buněčné smrti (programmed cell death ligand 1, PD L1) ≥ 1 % [20]. Další byla KEYNOTE 040, klinická studie fáze III, v níž byl pembrolizumab v dávce 200 mg/m2 postaven proti konvenční chemoterapii u předléčených pacientů (metotrexát, docetaxel nebo též cetuximab) a bylo dosaženo významného rozdílu u pacientů se skóre nádorového podílu (tumor proportion score, TPS) ≥ 50 %, mediánu OS 11,6 měsíce ve srovnání se 7,9 měsíce pro pacienty léčené chemoterapií [21].
Do léčby první linie posunula pembrolizumab studie KEYNOTE 048, kde byl podáván v jednom rameni v dávce 200 mg/m2 každé tři týdny, v dalším rameni v kombinaci se šesti cykly cisplatiny v dávce 100 mg/m2 nebo karboplatiny AUC 5 v den 1 a 5 FU v dávce 1 000 mg/m2 v den 1-4 kontinuálně každých 21 dní ve srovnání se standardním režimem dle studie EXTREME s cetuximabem v týdenním podání se sytící dávkou. Pacienti byli rozděleni dle kombinovaného pozitivního skóre (combined positive score, CPS) na skupiny s CPS ≥ 20, CPS 1-20 a CPS ≤ 1. Kombinace s pembrolizumabem ve skupině s CPS > 20 zaznamenala největší efekt na OS, a to 14,7 měsíce vs. 11,0 měsíce v rameni s režimem dle studie EXTREME. V hodnocené skupině s CPS 1-20 činilo OS 13,6 měsíce vs. 10,4 měsíce v rameni s cetuximabem. V úhrnu pro všechny hodnocené pacienty bez ohledu na CPS však byl efekt pouze non inferiorní s mediánem OS 11,5 pro ramena s pembrolizumabem ve srovnání s 10,7 měsíce pro rameno s cetuximabem [22].
Druhá linie
V současné době dominuje léčbě druhé linie po selhání režimu založeného na platině imunoterapie. Registrační studií pro užití nivolumabu byla CheckMate 141, randomizované dvojitě zaslepené hodnocení fáze III s 361 pacienty, v němž byl nivolumab v dávce 3 mg/kg každé dva týdny podáván nemocným po selhání platinového režimu. Ve srovnávacím rameni byly užity metotrexát, docetaxel nebo cetuximab. Léčba vykázala pro tuto linii přesvědčivý efekt na OS - 7,5 měsíce (95% interval spolehlivosti [CI] 5,5-9,1) pro nivolumab oproti 5,1 měsíce pro chemoterapii nebo cetuximab (95% CI 4,0-6,0). Rozdíl v jednoletém přežití činil 36,0 % vs. 16,6 %, s příznivou toxicitou stupně 3–4, která byla ve skupině s nivolumabem zaznamenána u 13,1 % léčených oproti 35,1 % v rameni srovnávacím [23].
Rovněž pembrolizumab byl zkoušen ve druhé linii léčby recidivujících a metastatických HNC v randomizované studii fáze III po standardní cytostatické léčbě. Jedná se o studii KEYNOTE 040 se zařazenými 247 pacienty, v níž byl pembrolizumab v dávce 200 mg každé tři týdny podáván pacientům předléčeným platinovým režimem. Ve srovnávacím rameni byly metotrexát, docetaxel nebo cetuximab [21]. I tato léčba byla účinná s dosaženým mediánem OS 8,4 měsíce (95% CI 6,4–9,4) v rameni s pembrolizumabem a 6,9 měsíce (5,9–8,0) ve standardním rameni (HR 0,80; 95% CI 0,65–0,98; p = 0,0161). Také zde byla zaznamenána poměrně nízká toxicita - 13 % pro pembrolizumab oproti 36 % pro srovnávací rameno. Nejčastějším nežádoucím účinkem u pembrolizumabu byla autoimunitní tyreoiditida s hypofunkcí u 13 % pacientů a únava ve standardním rameni u 18 % léčených.
Diskuse
V kurativní léčbě HNC se zatím uplatnila klasická cytostatika, kombinace platinových derivátů, taxanů a 5 FU. Efekt cetuximabu jako potenciačního radiosenzibilizujícího léčebného postupu má nakonec skromné využití pouze pro pacienty bez možnosti užití platinových derivátů v konkomitanci (například pro preexistující neurologické nebo nefrologické onemocnění). Ani studie De ESCALaTE, která se pokusila využít nižší toxicity cetuximabu oproti platinovým derivátům, nepotvrdila dostatečnou účinnost. Zda lze očekávat naději u konkomitancí, nebo při adjuvantním podání imunoterapie, na to v budoucnu snad odpovědí aktuálně probíhající studie, například JAVELIN head & neck 100 (NCT02952586) s atezolizumabem nebo KEYNOTE 412 (NCT03040999) s pembrolizumabem v této indikaci. Ačkoliv má imunoterapie v paliativní léčbě spinocelulárního HNC velmi dobrý efekt, týká se jen podskupin pacientů s expresí prediktoru PD L1, který se navíc stanovuje odlišně u jednotlivých imunoterapeutik. Imunoterapie posunula i tuto diagnózu do přístupu podle zásad tzv. tumor agnostic therapy, tedy léčby dle kritické nádorové mutace bez ohledu na tkáňový původ a histologii.
Závěr
Systémová léčba spinocelulárního HNC se týká hlavně nádorů lokálně pokročilých, recidivujících a metastatických. Zatímco z cytostatik si dominantní místo udržuje cisplatina, zvláště v kurativní léčbě, novější cytostatika jako taxany se uplatnily pouze v indukci nebo v léčbě paliativní. Z biologické léčby nalezl uplatnění jen inhibitor receptoru pro epidermální růstový faktor cetuximab, zatímco panitumumab účinnost neprokázal [24]. Novou strategii, která však zatím do kurativního postupu nezasahuje, přináší imunoterapie, včetně příznivého bezpečnostního profilu. Se zavedením nových metod se postupně daří dosáhnout i v léčbě recidivujícího a metastatického HNC pokroku a na pacienty s dobrou odpovědí na imunoterapii lze již nahlížet jako na chronicky nemocné s očekávaným výhledem přežití delšího než jeden rok.
Seznam použité literatury
- [1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018; 68: 394−424.
- [2] Michaud DS, Langevin SM, Eliot M, et al. High‑risk HPV types and head and neck cancer. Int J Cancer 2014; 135: 1653−1661.
- [3] Fakhry C, Krapcho M, Eisele DW, et al. Human Papillomavirus Testing in Head and Neck Carcinomas: ASCO Clinical Practice Guideline Endorsement of the College of American Pathologists Guideline. J Clin Oncol 2019; 37: 261.
- [4] Oosting SF, Haddad RI. Best Practice in Systemic Therapy for Head and Neck Squamous Cell Carcinoma. Front Oncol 2019; 9: 815.
- [5] Adelstein DJ, Li Y, Adams GL, et al. An intergroup phase III comparison of standard radiation therapy and two schedules of concurrent chemoradiotherapy in patients with unresectable squamous cell head and neck cancer. J Clin Oncol 2003; 21: 92−98.
- [6] Medina JA, Rueda A, de Pasos AS, et al. A phase II study of concomitant boost radiation plus concurrent weekly cisplatin for locally advanced unresectable head and neck carcinomas. Radiother Oncol 2006; 79: 34–38.
- [7] Denis F, Garaud P, Bardet E, et al. Final results of the 94‑01 French Head and Neck Oncology and Radiotherapy Group randomized trial comparing radiotherapy alone with concomitant radiochemotherapy in advanced‑stage oropharynx carcinoma. J Clin Oncol 2004; 22: 69–76.
- [8] Suntharalingam M, Haas ML, Conley BA. The use of carboplatin and paclitaxel with daily radiotherapy in patients with locally advanced squamous cell carcinomas of the head and neck. Int J Radiat Oncol Biol Phys 2000; 47: 49−56.
- [9] Winquist E, Agbassi C, Meyers BM, et al. Systemic therapy in the curative treatment of head and neck squamous cell cancer: a systematic review. J Otolaryngol Head Neck Surg 2017; 46: 29.
- [10] Gillison ML, Trotti AM, Harris J, et al. Radiotherapy plus cetuximab or cisplatin in human papillomavirus‑positive oropharyngeal cancer (NRG Oncology RTOG 1016): a randomised, multicentre, non‑inferiority trial. Lancet 2019; 393: 40−50.
- [11] Mehanna H, Robinson M, Hartley A, et al. Radiotherapy plus cisplatin or cetuximab in low‑risk human papillomavirus‑positive oropharyngeal cancer (De‑ESCALaTE HPV): an open‑label randomised controlled phase 3 trial. Lancet 2018; 393: 51–60.
- [12] Fointreau Y, Garaud P, Chapet S, et al. Randomized trial of induction chemotherapy with cisplatin and 5‑fluorouracil with or without docetaxel for larynx preservation. J Natl Cancer Inst 2009; 101: 498–506.
- [13] Lefebvre JL, Pointreau Y, Rolland F, et al. Induction chemotherapy followed by either chemoradiotherapy or bioradiotherapy for larynx preservation: the TREMPLIN randomized phase II study. J Clin Oncol 2013; 31: 853−859.
- [14] Ghi MG, Paccagnella A, Ferrari D, et al. Induction TPF followed by concomitant treatment versus concomitant treatment alone in locally advanced Head and Neck Cancer. A phase II−III trial. Ann Oncol 2017; 28: 2206−2212.
- [15] Ma J, Liu Y, Yang X, et al. Induction chemotherapy in patients with resectable head and neck squamous cell carcinoma: a meta‑analysis. World J Surg Oncol 2013; 11: 67.
- [16] Bernier J, Domenge C, Ozsahin M, et al. Postoperative irradiation with or without concomitant chemotherapy for locally advanced head and neck cancer. N Engl J Med 2004; 350: 1945–1952.
- [17] Noronha V, Joshi A, Patil VM. Once‑a‑week versus once‑every‑3‑weeks cisplatin chemoradiation for locally advanced head and neck cancer: a phase III randomized noninferiority trial. J Clin Oncol 2018; 36: 1064–1072.
- [18] Vermorken JB, Mesia R, Rivera F, et al. Platinum‑based chemotherapy plus cetuximab in head and neck cancer. N Engl J Med 2008; 359: 1116–1127.
- [19] Guigay J, Fayette J, Mesia R, et al. TPExtreme randomized trial: TPEx versus Extreme regimen in 1st line recurrent/metastatic head and neck squamous cell carcinoma (R/M HNSCC). J Clin Oncol 2019; 37(Suppl): 6002−6002.
- [20] Seiwert TY, Burtness B, Mehra R, et al. Safety and clinical activity of pembrolizumab for treatment of recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE‑012): an open‑label, multicentre, phase 1b trial. Lancet Oncol 2016; 17: 956–965.
- [21] Cohen EEW, Soulières D, Le Tourneau C, et al. Pembrolizumab versus methotrexate, docetaxel, or cetuximab for recurrent or metastatic head‑and‑neck squamous cell carcinoma (KEYNOTE‑040): a randomised, open‑label, phase 3 study. Lancet 2019; 393: 156–167.
- [22] Rischin D, Harrington KJ, Greil R, et al. Protocol‑specified final analysis of the phase 3 KEYNOTE‑048 trial of pembrolizumab (pembro) as first‑line therapy for recurrent/metastatic head and neck squamous cell carcinoma (R/M HNSCC). J Clin Oncol 2019; 37: 6000.
- [23] Ferris RL, Blumenschein G Jr., Fayette J, et al. Nivolumab for Recurrent Squamous‑Cell Carcinoma of the Head and Neck. N Engl J Med 2016; 375: 1856–1867.
- [24] Siano M, Molinari F, Martin V, et al. Multicenter Phase II Study of Panitumumab in Platinum Pretreated, Advanced Head and Neck Squamous Cell Cancer. Oncologist 2017; 22: 782−e70.