Současné možnosti v substituční terapii syndromu suchého oka
Syndrom suchého oka je v současnosti definován jako onemocnění očního povrchu s komplexní etiopatogenezí, které je charakterizováno očními symptomy vyvolanými nestabilitou slzného filmu nebo jeho hyperosmolaritou. V současnosti je zařazován mezi jedno z nejčastějších očních onemocnění. Léčba suchého oka je symptomatická a konzervativní způsob léčby spočívá v substituci nedostatečného přirozeného slzného filmu tzv. umělými slzami, tedy arteficiálně vyrobenými přípravky. Cílem nejnovějších substitučních preparátů je pak nahradit maximum vlastností všech tří složek fyziologického slzného filmu.
Úvod
Syndrom suchého oka patří k nejčastějším očním onemocněním. Podle aktuální definice se jedná o onemocnění očního povrchu s komplexní etiopatogenezí. Syndrom suchého oka je charakterizován očními symptomy, které jsou vyvolány nestabilitou slzného filmu nebo jeho hyper-osmolaritou [1, 2] . Prevalence syndromu suchého oka se v současnosti podle výsledků četných studií pohybuje v rozmezí 14,4–33 % [3] .
Podle Madridské dekalogické klasifikace lze příčiny syndromu suchého oka etiopatogeneticky rozdělit do 10 skupin – věkem podmíněné, hormonální, imunologické, farmakologické, hyponutriční, dysgenetické, traumatické, zánětlivé, neurodeprivantní a tantalické [2, 4] .
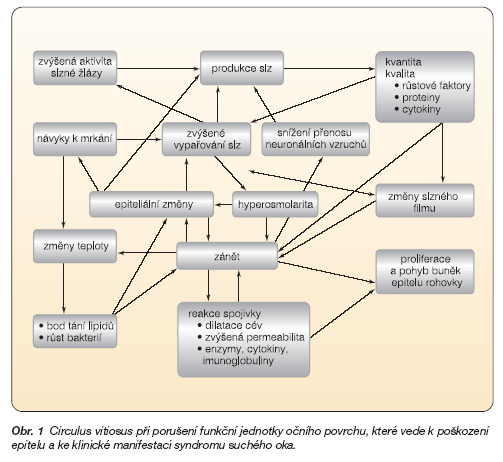
Slzný film, epitel rohovky a spojivky, slzné žlázy a víčka pracují společně jako funkční jednotka (tab. 1).
Jednotlivé komponenty této funkční jednotky mají vzájemnou anatomickou kontinuitu a současně sdílejí stejné zpětnovazebné mechanismy. Výsledkem této kontinuity je pak simultánní reakce všech složek (obr. 1).
Oční povrch reprezentuje přechodovou oblast (interface) mezi okem a vnějším okolím. Je jednak garantem kvality refrakčního povrchu oka k zajištění dokonale ostrého vidění, dále pak musí být oční povrch schopen rychlé reakce na eventuální poškození a k ochraně očních struktur. Z tohoto důvodu je oční povrch jako funkční jednotka, ale i jeho jednotlivé části permanentně ve vysoce dynamickém stavu, připraveny uspokojovat měnící se zevní i vnitřní potřeby organismu. Ze všech složek zmíněné funkční jednotky je právě slzný film nejvíce dynamickou strukturou. Slzný film by z jistého hlediska mohl být považován za jakousi extracelulární matrix, která komplexně a aktivně reguluje epiteliální funkce rohovky a spojivky a podílí se též aktivně na interakcích s okolními tkáněmi. Produkce a „obrat" slz je zásadním faktorem pro udržení zdravého a fyziologického očního povrchu při měnících se zevních (zejména enviromentálních), ale i vnitřních podmínkách. Slzy čistí, zvlhčují a vyživují povrch oka, podílejí se také na fyzikální a imunologické ochraně očního povrchu proti infekci. Malá změna stability slzného filmu může mít za následek podstatnou alteraci kvality retinálního obrazu [5–7] .
Mrkáním dochází k roztírání slzné tekutiny na povrchu oka s následným vytvořením komplexně strukturovaného preokulárního slzného filmu. Sekvenční spoluprací orbikulárního očního svalu a zvedače horního víčka se slzy roztírají na povrchu oka a dochází k neustálé rekonstrukci architektury slzného filmu, který je naopak neustále narušován evaporací a enviromentální kontaminací v období mezi jednotlivými mrknutími [5, 8] .
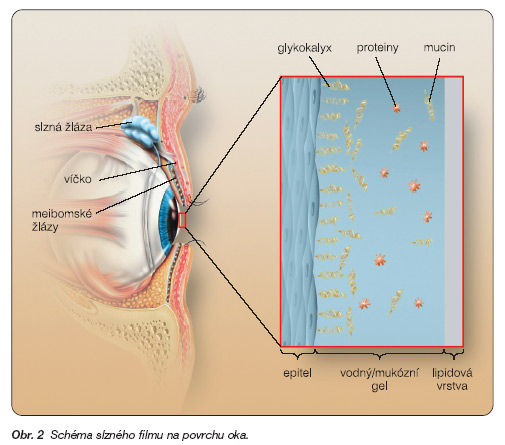
Slzný film je roztok, který obsahuje vodu, enzymy, proteiny, imunoglobuliny, lipidy, různé metabolity, odloupané epiteliální a polymorfonukleární buňky. Slzný film je charakterizován vysokou a permanentní dynamikou změn, proto jeho jednoznačně přesné složení definovat nelze. Specifický obsah slzného filmu závisí na aktuálních nárocích, kterým je oční povrch jako funkční jednotka vystaven, a mění se podle nich. Podle Wolffa je slzný film složen ze tří základních vrstev: mukózní (vnitřní), vodní (střední) a lipidové (zevní) (obr. 2) [5, 9] . Současné poznatky již ale spíše ukazují na skutečnost, že slzný film je dvouvrstevný, složený z povrchní vrstvy lipidové a uvnitř uloženého vodněmukózního gelu, ve kterém gradient mucinu směrem od epitelu k povrchu klesá [5, 10] . Vlastnosti jednotlivých složek a možnosti jejich substituce budou dále konkrétně popsány.
Mukózní (vnitřní) vrstva slzného filmu
Je tvořena pohárkovými buňkami spojivky a epiteliálními buňkami rohovky a spojivky [5, 11] . Produktem povrchních buněk epitelu rohovky a podpovrchové části epitelu spojivky je tzv. mucin-like glykoprotein (MUC1), který na apikálním povrchu epitelu tvoří tzv. glykokalyx. Jedná se o velmi delikátní strukturu, která spojuje slzný film s povrchem epitelu [5, 12] . Nezralost nebo poškození epiteliálních buněk (např. jako následek těžkého poleptání) má za následek absenci glykokalyxu s následnou špatnou adhezí slzného filmu k epitelu očního povrchu [5, 13] . Epitel očního povrchu je hydrofobní, a proto nezanedbatelnou funkcí glykokalyxu je vytvoření „přechodu" mezi hydrofobním epitelem rohovky a spojivky a vodní hydrofilní vrstvou slzného filmu. Pokud glykokalyx není přítomen, slzy nemohou dokonale adherovat k povrchu oka, a může tak dojít k poškození epitelu – i přesto, že vodná složka slzného filmu je tvořena normálně. Glykokalyx hraje roli i při roztírání slzného filmu, ale jeho zásadní funkcí je správné zvlhčení očního povrchu. Zabraňuje ale i adhezi cizích buněk a patogenů. Další, většinová část mucinu obsaženého v slzném filmu je tvořena pohárkovými buňkami spojivky. Skupina mucinů má dále specifické fyzikální newtonovské viskoelastické (tzv. pseudoplastické) reologické vlastnosti, které jsou zcela zásadní proto, aby byla umožněna kontinuální změna viskozity slz v souvislosti s procesem mrkání. Pseudoplasticita znamená vysokou klidovou viskozitu tekutiny a současnou schopnost redukce viskozity při zvýšení průtoku – molekuly mění sféroidní konformaci, stávají se ploššími a orientovanými ve směru toku. Pseudoplastické vlastnosti zabraňují při mrkání vzniku nadměrného tření mezi povrchem oka a vnitřní stranou víčka. Tyto vlastnosti mucinu jedinečně umožňují zachovat dioptrickou integritu slzného filmu v období mezi mrknutími a současně působí jako ochranná vrstva při mrknutí [5, 14, 15] .
Vodná (střední) vrstva slzného filmu
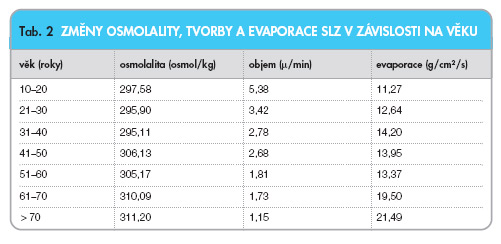
Vodná část slzného filmu je tvořena hlavní slznou žlázou a přídatnými slznými žlázami. Bazální (nereflektorická) sekrece se fyziologicky pohybuje kolem 7–10 ml/den a s věkem klesá (tab. 2).
Tato vrstva je z hlediska kvantity nejdůležitější, tvoří asi devět desetin objemu slzného filmu. Je hlavním prostředím pro přenos kyslíku ze zevního prostředí k povrchu rohovky a látek potřebných pro výživu rohovky, dále umožňuje odstraňování epiteliální debris a toxických elementů. Změny jejího složení jako odpověď na zevní (environmentální) nebo vnitřní podněty se projevují poměrně rychle – s následným vlivem na proliferaci a maturaci povrchových buněk epitelu. Vodná složka slzného filmu obsahuje řadu růstových faktorů, které zásadním způsobem ovlivňují fyziologii rohovky, a dále také řadu prozánětlivých faktorů (HLA DR, IL-6, IL-8) produkovaných lokálně nebo v přilehlých strukturách [5, 16] . Bylo prokázáno, že slzná žláza není schopna kompenzovat nadměrné ztráty vodní vrstvy slzného filmu způsobené zvýšenou evaporací. Následkem tohoto procesu je pak zvýšená osmolarita slz, která pak může působit jako jeden z faktorů epiteliálního poškození [5, 17] .
Lipidová (zevní) vrstva slzného filmu
Lipidová vrstva slzného filmu je produktem meibomských žláz, které jsou uloženy v tarzálních ploténkách víček a jejich vývody ústí na margu víček (oblast přechodu vnitřní víčkové spojivky a zevní kůže víček). Hlavní funkcí zevní vrstvy slzného filmu je stabilizace slzného filmu snížením povrchového napětí s výsledným zabráněním nadměrné evaporaci [5, 18, 19] . Přítomnost intaktní lipidové vrstvy je esenciální pro zachování optimálních podmínek pro lom světla na optickém rozhraní a pro vznik ostrého obrazu na sítnici [5, 20] . Je prokázáno, že mrkací reflex je důležitý pro uvolňování sekretu meibomských žláz. Rychlé a usilovné mrkání, např. jako reflexivní odpověď na cizí těleso na rohovce, zvyšuje tloušťku lipidové vrstvy slzného filmu. Opakem je tzv. office eye syndrom nebo monitor eye syndrom (subjektivní i objektivní známky podobné suchému oku, zejména u pracujících v kanceláři a na počítači), které jsou typicky vyvolány prolongací období bez mrknutí při soustředěné práci, při kterém dojde ke ztenčení zevní lipidové vrstvy slz [5, 21] .
Lze říci, že oční povrch jako funkční jednotka představuje jakýsi imunologický mikrokosmos, ve kterém fungují imunologické i paraimunologické obranné systémy podobné slizničním. Tyto sehrané, sofistikované a vzájemně se ovlivňující obranné systémy zahrnují přítomnost fyziologické mikroflóry, neporušenou anatomickou bariéru včetně slzného filmu, sekreci hlenu a určitých chemických bakteriostatik a bakteriolytik, lokální sekreci protilátek a lokální buněčnou imunitu zprostředkovanou T lymfocyty [5, 22] .
Přehled látek používaných k substituční terapii syndromu suchého oka
Skupina látek s nízkou viskozitou (lehčí formy suchého oka)
Povidon – polyvinylpyrolidone (PVP)
PVP je souborný název pro nízkomolekulární syntetický homopolymer o různé délce řetězců s odlišnou molekulární hmotností a jejich rozdílnou viskozitou v roztoku. V preparátech na léčbu suchého oka je používán již více než třicet let. Skládá se z lineárních 1-vinyl-2- pyrolidonových skupin a rozsah polymerizace vede ke vzniku polymeru s molekulární hmotností, která kolísá od 1000 do 70 000. Povidon pomáhá udržovat slzný film, ale jeho viskozita ve vodném roztoku je nízká [23] . PVP nemá prakticky žádnou povrchovou aktivitu, při své lineární struktuře má pouze minimální mukoadhezivní vlastnosti a negativní ferning test (proces krystalizace při zasychání se vznikem typického vzoru na podložném sklíčku – výsledek interakce elektrolytů a glykoproteinů s vysokou molekulární hmotností (mucinů) fyziologicky obsažených v slzách) [24, 25] . Z uvedené charakteristiky také vyplývá, že retenční (kontaktní) čas této látky na očním povrchu je relativně krátký.
Polyvinylalkohol (PVA)
Lineární hydrofilní polymer. Jeho hlavní využívanou vlastností v terapii syndromu suchého oka je skutečnost, že polyvinylalkohol zvyšuje viskozitu přípravku, ve kterém je obsažen, a tím prodlužuje kontaktní čas s rohovkou.
Hydroxypropylmethylcelulosa (HPMC) a karboxymethylcelulosa (CMC)
Mají podobné vlastnosti jako polyvinylalkohol. Ferning test je negativní.
Skupina látek s vysokou viskozitou (těžší formy suchého oka)
Karbomer (kyselina polyakrylová)
Jedná se o syntetický karbovinylpolymer s vysokou molekulární hmotností, ve kterém jsou polymery kyseliny akrylové napříč spojeny molekulami polyalkoholů nebo polyalkenylových éterů. Je charakteristický velmi dobrými zvlhčujícími a bioadhezivními vlastnostmi, které umožňují dlouhý kontaktní (retenční) čas s rohovkou. Ve srovnání s PVA je retence karbomeru v slzném filmu 7x delší, čímž se signifikantně snižuje potřebná frekvence aplikace [26] . Soli obsažené fyziologicky v slzách postupně narušují gelovou strukturu kyseliny polyakrylové, a tím vzniká potřebná a dlouhodobá lubrikace očního povrchu.
Kyselina hyaluronová
Vysoce hydrofilní (ve vodě rozpustný), bioadhezivní (i k epitelu rohovky), fyziologický polymer s mukomimetickými vlastnostmi (pozitivní ferning test). Jedná se o lineární polysacharidovou kyselinu ze skupiny glykosaminoglykanů, která tvoří viskózní roztok s gelovou strukturou. Její citlivost na změnu pH je vysoká. Při vysokém pH dochází ke kolapsu molekulární struktury a ke tvorbě méně viskózního roztoku, při nízkém pH je struktura kyseliny hyaluronové naopak imobilizována tvorbou dalších vnitřních vazeb [27] .
Xyloglukan (TSP – tamarind seed polysacharide – polysacharid semen tamaryšku indického)
TSP (xyloglukan) je ve vodě rozpustná neutrální čištěná polysacharidová frakce s vysokou molekulární hmotností. Jedná se o polymerickou molekulu vysoce hydrofilního galaktosyl-glukanu se síťovou strukturou (na rozdíl od ostatních preparátů), ve které je hlavní lineární řetězec tvořen opakujícími se molekulami glukózy, vedlejší řetězce jsou pak tvořeny xylózou a xylózo-galaktózou. Konfigurace TSP je ve srovnání s ostatními preparáy nejvíce podobná mucinu fyziologicky obsaženému v slzách, zejména MUC1 (mucin přítomný na rohovkovém a spojivkovém epitelu očního povrchu), a nabízí proto optimální mukoadhezivní vlastnosti, mezi které patří i schopnost tvorby různých typů vazeb s fyziologicky přítomným mucinem obsaženým v slzách. Absence elektrického náboje a síťová struktura látky umožňují snadnou tvorbu vazeb s mucinem glykokalyxu i s mucinem v slzném filmu a rovněž snadnou adhezi k epitelovým buňkám rohovky a spojivky. TSP má i tzv. pseudoplastické reologické vlastnosti – jeho viskozita při mrkání progresivně klesá, čímž dochází k optimálnímu změkčování abrazivní síly, která vzniká při každém mrknutí. Výsledkem popsané bioadhezivity, mukoadhezivity a viskoelastických vlastností TSP je skutečnost, že roztok TSP nabízí ve srovnání s jinými slznými substituenty delší kontaktní čas na povrchu oka. I při poměrně velké změně pH okolí je roztok TSP velmi stabilní (na rozdíl od kyseliny hyaluronové) a vlastní pH roztoku TSP se pohybuje mezi 6–7. Osmolalita se pohybuje kolem 300 mOsm/kg, je tedy srovnatelná s osmolalitou přirozeného slzného filmu (293–318 mOsm/kg). In vivo byl pozorován stimulační efekt TSP na proliferaci keratocytů i pozitivní vliv na adhezi buněk spojivky k matrix s obsahem lamininu [27] .
Další účinné látky užívané v substituční terapii suchého oka
Dexpanthenol (panthenol)
Prekurzor kyseliny pantothenové (vitaminu B5). Kyselina pantothenová vzniká z dexpanthenolu fyziologicky v organismu a je složkou acetylkoenzymu A, který se podílí na metabolismu lipidů, sacharidů i aminokyselin. Acetylkoenzym A se vyskytuje ve zvýšených koncentracích ve tkáních s intenzivním metabolismem. Dexpanthenol působí antiflogisticky a podporuje proces hojení neinfekčních zánětů oka.
Retinol
Retinol je známý svou schopností regulovat aktivitu a diferenciaci epiteliálních buněk rohovky a pohárkových buněk spojivky.
Hydroxypropylguar
Látka, která se váže na hydrofobní povrch epitelových buněk v místě chybění glykokalyxu a spolu se slzným filmem tvoří ochrannou viskózní vrstvu.
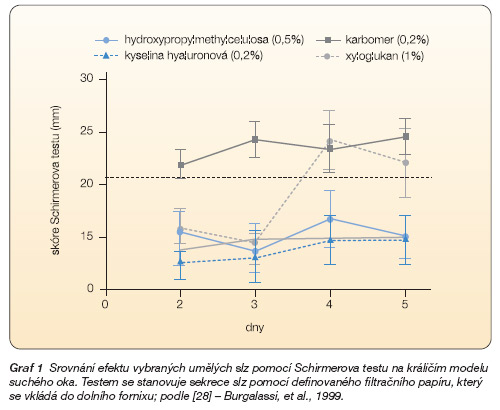
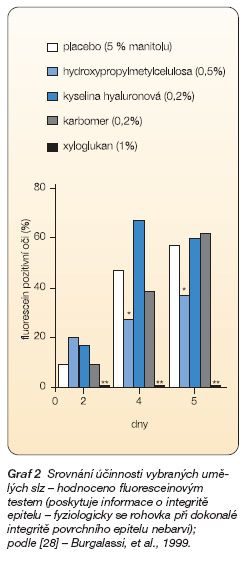
Účinnost vybraných složek umělých slz na králičím modelu suchého oka ukazuje graf 1, 2.
Kombinace látek
Hydroxypropylmethylcelulosa (HPMC) + dextran
Hydroxypropylmethylcelulosa (HPMC) + dextran (tzv. Duasorb) je ve vodě rozpustný nízkomolekulární polymerní systém, který se mísí s existujícím slzným filmem, zvyšuje stabilitu slzného filmu a přispívá k lubrikaci očního povrchu.
Hydroxypropylmethylcelulosa + dexpanthenol
HPMC upravuje viskozitu přípravku, dexpanthenol napomáhá přirozeným metabolickým procesům.
Polyvinylalkohol + dexpanthenol
Viz HPMC + dexpanthenol.
Kyselina hyaluronová + dexpanthenol
Viz HPMC + dexpanthenol.
Karbomer + povidon (+ lipidy se středně dlouhým řetězcem)
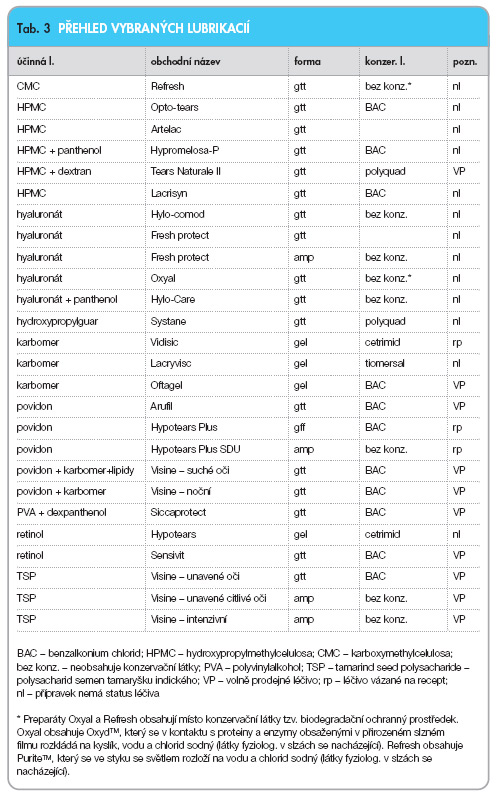
Přehled přípravků na trhu uvádí tab. 3.
Závěr
Symptomatická léčba suchého oka spočívá v substituci nedostatečného přirozeného slzného filmu tzv. umělými slzami, tedy arteficiálně vyrobenými přípravky. Cílem terapie nejnovějšími preparáty je pak nahradit maximum vlastností všech tří složek fyziologického slzného filmu, tedy lipidové, vodné i mucinové vrstvy, a obnovit slzný film tak, aby co nejvíce všemi vlastnostmi nahrazoval nedostatečný přirozený slzný film [28] .
Prevalence syndromu suchého oka je vysoká a dále se zvyšuje, neboť je potencována vlivy vnějšího prostředí, které zjevně souvisejí se životním stylem a vedou k nadměrnému vysušování očního povrchu (znečištění zevního prostředí – výfukové plyny, cigaretový kouř), klimatizace, centrální vytápění, práce s počítačem, nošení kontaktních čoček, užívání některých léků). Většinou se naštěstí jedná o mírnou formu, která pacienta obtěžuje zejména subjektivně, a objektivní oční nález je poměrně chudý či zcela minimální – zejména v případě pouze intermitentní expozice vyvolávajícím faktorům. Závažná forma suchého oka je nepochybně méně častá a obvykle souvisí s celkovým onemocněním. Tato forma tohoto onemocnění vyžaduje jednak intenzivní terapii pod kontrolou oftalmologa, neboť potenciálně ohrožuje zrakové funkce, jednak interdisciplinární spolupráci [29] .
Seznam použité literatury
- [1] Kaercher T. Syndrom suchého oka. Abstrakta sympozia Suché oko, 2002.
- [2] Pitrová Š. Syndrom suchého oka. Bulletin syndromu suchého oka, 2002; 1: 3–9.
- [3] Lee AJ, Lee J, Saw S M, et al. Prevalence and risk factors associated with dry eye symptoms: a population based study in Indonesia. Br J Ophthalmol 2002, 86. 1347–1351.
- [4] Murube J, Nemeth J, Hoh H, et al. The triple classification of dry eye for practical clinical use. Eur J Ophthalmol. 2005;15: 660–667.
- [5] Rolando M, Zierhut M. The ocular surface and tear film and their dysfunction in dry eye disease. Surv Ophthalmol 2001; 45 (Suppl 2): 203–210.
- [6] Rieger G. The importance of the precorneal tear film for the quality of optica imaging. Br J Ophthalmol 1992; 76: 157–158.
- [7] Rolando M, Iester M, Macri A, Calabria G. Low spatial – contrast sensitivity in dry eyes. Cornea 1998; 17: 376–379.
- [8] Doane MG. Blinking and the mechanics of lacrimal drainage system. Ophthalmology 1981; 88: 844–851.
- [9] Wolff E. Anatomy of the Eye and Orbit. New York, Blackstone Co, 1954.
- [10] Dilly PN. Structure and function of the tear film. Adv Exp Med Biol 1994; 350: 239–247.
- [11] Chao CC, Vergnes JP, Freeman IL, Brown SI. Biosynthesis and partial characterization of tear film glycoproteins. Exp Eye Res 1980; 30: 411–425.
- [12] Gibson IK, Inatomi T. Cellular origin of mucins of the ocular surface tear film. Adv Exp Med Biol 1998; 438: 221–227.
- [13] Danjo Y, Watanabe H, TisdaleAS, et al. Alteration of mucin in human conjunctival epithelia in dry eye. Invest Ophthalmol Vis Sic 1988; 39: 2602–2609.
- [14] Dilly PN. Contribution of the epithelium, to the stability of the tear film. Trans Ophthalmol Soc UK 1985; 104: 381–389.
- [15] Tiffany JM. Composition and biophysical properties of the tear film: knowledge and uncertainly. Adv Exp Med Biol 1994; 350: 231–238.
- [16] Thakur A, Willcox MD, Stapleton F. The proinflammatory cytokines and arachidonic acid
- [17] Lemp MA. Report of the National Eye Institute/ Industry workshop on clinical trials in dry eyes. CLAO J 1995; 21: 221–232.
- [18] Rolando M, Refojo MF, Kenyon KR. Tear water evaporation and eye surface diseases. Ophthalmologica 1985; 190: 147–149.
- [19] Rolando M, Refojo MF. Tear evaporimeter for measuring water evaporation rate from the tear film under controlled conditions in humans. Exp Eye Res 1983; 36: 25–33.
- [20] Dursun D, Monroy D, Knighton R, et al. The effects of experimental tear film removal on corneal surface regularity and barrier function. Ophthalmology 2000; 107: 1754–1760.
- [21] Franck C. Fatty layer of the precorneal film in the office eye syndrome. Acta Ophthalmol (Copenh) 1991; 69: 737–743.
- [22] Chandler JV, Gillette TE. Immunologic defense mechanisms of the ocular surface. Ophthalmology 1983; 90: 585–591.
- [23] Holly FJ. Arteficial tear formulations. Int Ophthalmol Clin 1979; 20: 171–184.
- [24] Duchene D, Touchard F, Peppas NA. Pharmaceutical and medical aspects of bioadhesive systems for drug administration. Drug Dev Ind Pharm 1988; 14: 283–318.
- [25] Lemp MA, Holly FJ. Ophthalmic polymers as ocular wetting agents. Ann Ophthalmol 1972; 4: 15–20.
- [26] Marquardt R, Christ T. Corneal contact time of artificial tear solutions. Klin Monatsbl Augenheilkd, 1986,189. 254–257.
- [27] Bux AV, Scalinci SZ, Scorolli L, et al. Comparison between two artificial tear substitutes in wearers of contact lenses.
- [28] Burgalassi S, Panichi L, Chetoni P, et al. Development of a simple dry eye model in the albino rabbit and evaluation of some tear substitutes. Ophthalmic Res 1999; 31: 229–235.
- [29] Chiambaretta F, Pouliquen P, Menerath JM, et al. Efficacy and safety of a fluid carbomer gel versus a conventional carbomer gel in dry eye treatment. J Fr Ophthalmol 2004; 27: 130–135.