Současné trendy v léčbě IBD
V rámci letošního 33. českého a slovenského gastroenterologického kongresu, kterému propůjčil prostory pražský Clarion Congress Hotel Praha, probíhala i zajímavá firemní sympozia. V podvečer 13. listopadu se na žižkovské televizní věži konalo sympozium společ-nosti MSD zaměřené na současné trendy v léčbě pacientů s idiopatickými střevními záněty (inflammatory bowel disease, IBD). Přednáše-jící se věnovali aktuálním otázkám terapie.
Monitorování farmakokinetiky
V úvodu sympozia se prof. MUDr. Milan Lukáš, CSc., z pražského centra ISCARE věnoval problematice monitorování farmakokinetiky infliximabu v léčbě IBD. „V současné době je monitorování farmakokinetiky aktuálním tématem. Jeví se jako nadějný pomocník při optimalizaci léčby biologiky a jako významná možnost, jak dosáhnout lepších výsledků dlouhodobé terapie,“ uvedl téma profesor Lukáš.
Biologická léčiva podle něj často nepůsobí jen jedním mechanismem účinku nebo, jak se ukazuje, tento nebývá ještě plně objasněn. Vlastní působení a účinnost léčiva se také může lišit v různých indikacích – v revmatologické oproti gastroenterologické.
Stanovení hladiny biologického léčiva se stává významným ukazatelem pro klinickou praxi. Může se uplatnit jako prediktor primární odpovídavosti na léčbu. Pokud v rámci indukčního režimu změříme před podáním první udržovací dávky sérovou koncentraci léčiva označovanou jako tzv. trough level (nejnižší možná hladina dosažená před podáním další dávky) a zjistíme u pacienta detekovatelnou hladinu léku, znamená to pro něj lepší prognózu a zvýšení pravděpodobnosti dosažení dlouhodobé remise.
Hodnota trough level může být také prognostickým ukazatelem případného sekundárního selhání léčby – tedy ztráty odpovědi na původně účinnou léčbu; pokud pacient odpověděl na úvodní léčbu, ale vykazuje velmi nízkou hodnotu (např. pro infliximab je jako minimální stanovena sérová koncentrace 3 µg/ml), je ohrožen vysokým rizikem sekundární ztráty odpovědi. Ta by se měla následně řešit navýšením dávky nebo zkrácením intervalu podání další dávky (zejména u adalimumabu). Zatím se v klinické praxi běžně neuplatňuje, ale je potenciální metodou optimalizace léčby.
U přípravků působících proti tumor nekrotizujícímu faktoru (tzv. anti‑TNF přípravky) je specifikem, že část pacientů, zvláště dosud neléčených biologiky – naivních, na léčbu nereaguje. Klinickým faktorem, který se uplatňuje při selhání léčby (jak primární neodpovídavosti, tak sekundární ztráty účinnosti), je kromě vlastního chování nemoci také lokalizace onemocnění. Pacienti s Crohnovou chorobou vykazují při postižení tenkého střeva významně nižší odpovídavost na léčbu oproti pacientům s lokalizací onemocnění v tlustém střevě. Důležitá je i délka trvání nemoci před zahájením biologické léčby. Pokud je biologická léčba zahájena do dvou let od stanovení diagnózy, je odpověď na léčbu až dvojnásobně vyšší.
Na základě klinického hodnocení je doporučena konkomitantní terapie s imunosupresivy, při které pacienti vykazovali vyšší míru klinické odpovědi, remise, slizničního hojení, vyšší trough level i nižší produkci protilátek. Dochází k potenciaci protizánětlivého účinku, k potlačení imunogenicity infliximabu a k zamezení tvorby protilátek. Dále se uplatňuje i předcházející léčba anti‑TNF přípravky – odpověď na léčbu druhým anti‑TNF přípravkem je zhruba poloviční, v případě podávání třetího anti‑TNF přípravku je odpověď zanedbatelná.
Významný z hlediska účinnosti léčby je celkový stav pacienta a aktivita nemoci. Tyto ukazatele je možné monitorovat prostřednictvím hypoalbuminemie a hodnoty C‑reaktivního proteinu (CRP).
Hypoalbuminemie je prediktorem neúspěchu biologické léčby (klinické odpovědi) – při hodnotě albuminu nižší než 30 g/l je vhodnější podat dávku daleko vyšší, než je dávka běžně stanovená na kilogram tělesné hmotnosti. Vysoká hodnota CRP je předpokladem zvýšené tvorby TNF, který vyváže léčivo, jež pak nemůže dále působit na imunokompetentních buňkách. V tomto případě se také diskutuje o tom, zda by vyšší dávkování bylo spojeno s vyšší účinností.
Kromě těchto známých klinických faktorů existují farmakologické faktory ovlivňující účinnost léčby. Jedním z nich je neimunogenně navozená porucha farmakokinetiky, kdy pacient dostává „správnou“ dávku, ale v těle se účinná látka neobjevuje, léčba není účinná, ač pacient nevykazuje tvorbu protilátek. Tento jev může být způsoben enormní clearance v retikuloendotelovém systému – infliximab váží alotypické protilátky, komplex je vychytáván, nebo se prokáže obrovská vazba na Fc fragment některými imunokompetentními buňkami. Nejedná se o autoimunitní proces, ale o nespecifickou reakci, která vede k eliminaci bílkoviny z těla.
Další příčinou neúspěchu léčby je porucha farmakodynamiky, kdy léčba nemá žádný klinický efekt, i když koncentrace léčiva v plazmě je dostatečná (vysoká hodnota trough level) a nedochází k tvorbě protilátek. U těchto pacientů je pravděpodobné, že patogeneze zánětu není řízena TNFα, účastní se zde pravděpodobně jiný patogenetický mechanismus a v léčbě by mohly být účinné jiné než anti‑TNF přípravky, např. léčiva blokující adhezi leukocytů na kapilární stěnu (antiintegrinové protilátky).
A konečně příčinou předznamenávající neúspěch léčby může být imunogenicita přípravku, kdy detekujeme vysokou koncentraci protilátek proti léčivu a nulovou koncentraci vlastního léčivého přípravku, přičemž farmakoterapie zůstává bez klinické odezvy. V tomto případě je nutná změna léčivého přípravku (tzv. switch), např. přechod na léčbu jiným biologikem.
Monitorování farmakokinetiky léčiva je významné pro optimalizaci léčby a pro zvýšení její účinnosti – úprava dávkování (intenzifikace, eskalace léčby, naopak deeskalační postup při slizničním hojení nebo úprava dávky z pohledu farmakoekonomiky při „zbytečně“ vysoké plazmatické koncentraci léčiva). Dle klinických zkušeností pacienti vykazují setrvalejší odpověď a menší zásahy do léčby. Plazmatickou koncentraci léčiva ovlivňují hodnoty albuminu, CRP a tvorba protilátek.
Tento přístup monitorování nachází praktické využití také u těhotných a novorozenců – zejména pro očkování živými vakcínami, kdy u novorozenců je v pupečníkové krvi zjišťována několikanásobně vyšší plazmatická koncentrace než u matky (preferenční shromažďování imunoglobulinů) a očkovat by se mělo až po vymizení cirkulujícího léčiva (obecně doporučeno po 6 měsících).
Časná biologická léčba pacientů s IBD v klinické praxi
V následující prezentaci se doc. MUDr. Vladimír Zbořil, CSc., z Fakultní nemocnice Brno zaměřil na problematiku časného podání biologické léčby pacientům s IBD a představil i vlastní zkušenosti z brněnského pracoviště.
Od vstupu biologické léčby do klinické praxe se představa o tom, jaká bude potřeba anti‑TNF terapie, velmi vyvíjela. Koncept tzv. časné Crohnovy nemoci – charakterizované manifestním zánětem, ale bez přítomnosti závažného poškození trávicí trubice – umožnuje časnou intervenci. Existuje spousta důkazů o tom, že čím dříve léčbu (biologickou i imunosupresivní) zahájíme, tím vyšší je šance na klinickou odpověď – vysoké procento pacientů v remisi, slizniční hojení při časně zahájené léčbě, snížení nutnosti chirurgické intervence, menší poškození trávicí trubice.
Docent Zbořil polemizoval nad otázkou existujících důkazů pro vedení léčby a jejich zakomponování do klinické praxe: „Problém je v tom, že z hlediska klinické praxe jsou pro nás kritéria časné diagnostiky a terapie velmi obtížně přijatelná a u pacienta prakticky nemůžeme zahájit například léčbu podobnou top‑down, protože by nám ji patrně pojišťovna neschválila. Ač existují důkazy o tom, že tento postup by byl optimální.“
Uplatnění kritérií časné léčby v praxi eliminuje množství pacientů, v úvahu je třeba vzít i otázku schválení úhrady pojišťovnou. Obecně se jako vhodná k zahájení biologické léčby ukazuje doba do dvou let trvání choroby.
Analýza klinických zkušeností pracoviště měla za cíl zjistit příčiny nízké účinnosti biologické léčby. Z dat vyplývá, že biologická léčba byla zahájena významně později – u ulcerózní kolitidy po deseti letech, u Crohnovy choroby zhruba po osmi letech trvání nemoci.
Problematika se týká i další farmakoterapie – například délky trvání kortikoterapie, byť přerušované (trvání i 4 roky). Dle doporučených postupů Evropské organizace pro Crohnovu chorobu a ulcerózní kolitidu (European Crohn’s and Colitis Organization, ECCO) by měl být při extenzivní kolitidě refrakterní na léčbu kortikosteroidy indikován jako varianta léčby cyklosporin a jako další linie biologická léčba infliximabem, adalimumabem či golimumabem.
Podávání azathioprinu v případě tzv. steroid‑dependentního pacienta zvyšuje při souběhu s kortikoterapií odpověď na léčbu a snižuje riziko relapsu onemocnění. Z klinické praxe je opět dokumentován malý podíl takto léčených pacientů, dominantně byli léčeni aminosalicyláty. Dle doporučených postupů ale kyselina salicylová navodí slizniční hojení jen u malé části pacientů s kolitidou a nemá dlouhodobě prokazatelný klinický účinek.
V dlouhodobém horizontu dochází u pacientů k nevratným strukturálním změnám a k po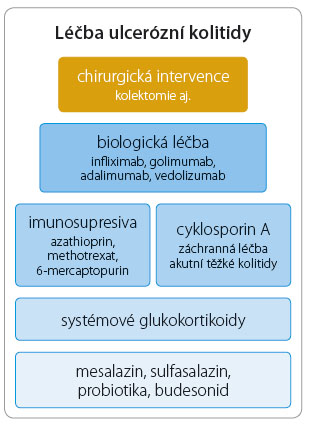 škození trávicího traktu. Slizniční hojení má prognostický význam pro kolektomii v budoucnosti; v případě odkládání intenzifikace léčby tak zvyšujeme její pravděpodobnost.
škození trávicího traktu. Slizniční hojení má prognostický význam pro kolektomii v budoucnosti; v případě odkládání intenzifikace léčby tak zvyšujeme její pravděpodobnost.
Optimální pacient pro léčbu golimumabem
MUDr. Přemysl Falt, Ph.D., z Fakultní nemocnice Ostrava si dal za cíl charakterizovat optimálního pacienta pro léčbu golimumabem.
Biologická léčba je součástí tzv. terapeutické pyramidy (obr. 1).
Připomněl, že mezi základní indikace biologické léčby patří:
- perzistující střední a vysoká aktivita choroby (při selhání konvenční terapie kortikosteroidy a imunosupresivy),
- kortikodependentní průběh onemocnění (neúčinnost/intolerance imunosuprese),
- kortikorefrakterní průběh nemoci,
- extraintestinální manifestace,
- závažná akutní (fulminantně aktivní) kolitida refrakterní na intravenózně (i.v.) podávané glukokortikoidy,
- refrakterní pouchitida po ileo‑pouch‑anální anastomóze.
Mezi hlavní cíle biologické léčby patří rychlé klinické zmírnění symptomů a jejich dlouhodobá kontrola (setrvalá klinická remise), snížení aktivity zánětu (slizniční hojení) a zachování střevní funkce; dále snížení potřeby kortikosteroidů a s tím spojených nežádoucích účinků, snížení potřeby chirurgického řešení a celkové zlepšení kvality života.
Golimumab je plně humánní monoklonální anti‑TNF‑α protilátka IgG1, která byla doposud indikována v léčbě revmatoidní artritidy, ankylozující spondylitidy a psoriatické artritidy. Na základě klinických studií PURSUIT SC a Maintenance byl golimumab schválen také pro léčbu ulcerózní kolitidy. Díky výhodnějším farmakokinetickým vlastnostem je možná jeho subkutánní (s.c.) aplikace a nižší frekvence podávání. Zatím dostupná klinická data ukazují, že čím vyšší jsou sérové koncentrace golimumabu, tím vyšší je účinnost léčby jak v indukční, tak v udržovací fázi.
Doktor Falt se zamýšlel nad postavením golimumabu mezi ostatními přípravky v dané indikaci: „Klinické zkušenosti s golimumabem jsou zatím omezené, přímé srovnání biologik není a pravděpodobně ani v dohledné době nebude k dispozici. Výhodou oproti dal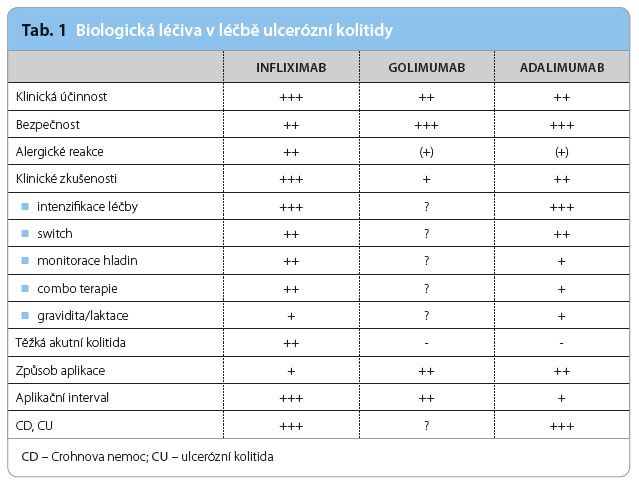 ším biologikům v této indikaci je zcela humánní struktura protilátky, tedy bezpečnost zejména z hlediska nízkého rizika vzniku alergických reakcí, dále způsob aplikace, tedy subkutánní podání, a aplikační interval 4 týdny. Nevýhodou jsou naopak doposud malé klinické zkušenosti týkající se i změny léčby (switch), její intenzifikace a využití v graviditě a laktaci. Golimumab pravděpodobně není vhodný k záchranné léčbě pacientů s vysoce aktivní ulcerózní kolitidou.“ Charakteristiky jednotlivých přípravků srovnává tab. 1.
ším biologikům v této indikaci je zcela humánní struktura protilátky, tedy bezpečnost zejména z hlediska nízkého rizika vzniku alergických reakcí, dále způsob aplikace, tedy subkutánní podání, a aplikační interval 4 týdny. Nevýhodou jsou naopak doposud malé klinické zkušenosti týkající se i změny léčby (switch), její intenzifikace a využití v graviditě a laktaci. Golimumab pravděpodobně není vhodný k záchranné léčbě pacientů s vysoce aktivní ulcerózní kolitidou.“ Charakteristiky jednotlivých přípravků srovnává tab. 1.
Optimální pacient pro podávání golimumabu tedy musí primárně splňovat jasná indikační kritéria k biologické léčbě a neměl by mít kontraindikace k této léčbě ani známky akutní těžké kolitidy. Významné jsou i preference z pohledu režimu aplikace samotného pacienta, popř. fakt, že nemocný má problematické žilní vstupy. Golimumab je také možné zvážit u pacientů rizikových pro podání infliximabu. Ideálně by se mělo jednat o mladšího pacienta (ve věku do 50 let), u starších je systémová léčba biologiky spojena obecně s výrazně vyšším rizikem vzniku oportunních infekcí. Otázkou je tzv. switch z jiného biologika při alergické reakci nebo při selhání léčby a nesnášenlivost thiopurinů. Vzhledem k revmatologickým indikacím se nabízí také otázka využití golimumabu u pacientů s mimostřevními (kloubními) obtížemi, jako je např. sakroiliitida či enteropatická artritida.