Současný pohled na léčbu ADHD
Porucha pozornosti s hyperaktivitou (ADHD – Attention deficit hyperactivity disorder) je nejčastějším psychiatrickým onemocněním dětského věku, postihuje 6–8 % školních dětí. Je zatížena až 60% psychiatrickou komorbiditou, dědičnost ADHD je 75%. U většiny pacientů přetrvávají příznaky poruch pozornosti a organizace aktivit do dospělého věku. ADHD představuje dispoziční faktor pro riskantní chování a abúzus návykových látek. Léčebným přístupem volby je kombinace farmakoterapie a behaviorální terapie spolu s dalšími psychosociálními intervencemi. V prvním kroku farmakoterapie se uplatňují psychostimulancia (methylfenidát) a atomoxetin. V případě přidružené poruchy chování je při selhání farmakoterapie první volby doporučena podpůrná terapie risperidonem. První doporučené postupy terapie ADHD byly vytvořeny v roce 2006. Léčbou ADHD se má zabývat dětský psychiatr.
Úvod
Poruchou pozornosti s hyperaktivitou (ADHD – Attention deficit hyperactivity disorder) trpí 6–8 % školních dětí. Typické jsou potíže se zaměřením a udržením pozornosti, hyperaktivitou a impulzivitou. Podle dosud převažujících údajů jsou chlapci postiženi 2,5krát častěji než dívky [1]. Diagnostická kritéria pro ADHD uvádí tab. 1. Některé příznaky nebo plný syndrom přetrvají do dospělosti až u 60 % pacientů. Hyperaktivita a impulzivita se zmírňují s věkem, poruchy pozornosti a zhoršená schopnost organizace 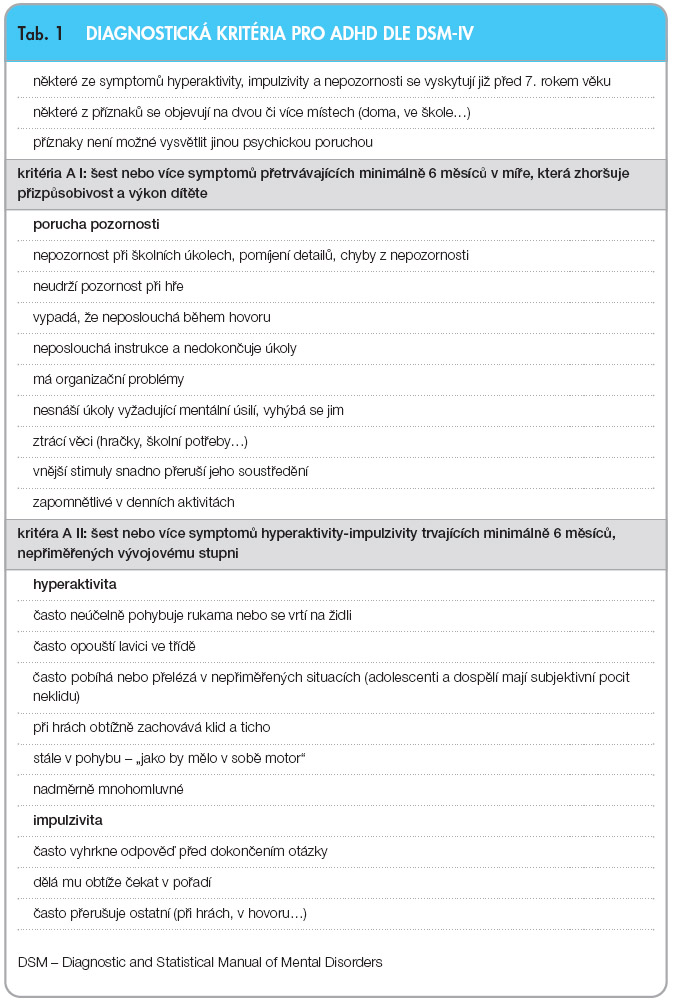 aktivit naopak přetrvávají [2, 3]. Velmi častá (60 % pacientů) je psychiatrická komorbidita. Nejčastěji se spolu s ADHD vyskytují úzkostné poruchy, porucha opozičního vzdoru a poruchy chování, tiky, specifické poruchy školních dovedností a deprese [4]. ADHD způsobuje horší výkon ve škole, obtíže se zařazením do kolektivu a později komplikuje navázání a udržení pevnějších vztahů, uplatnění v profesním a rodinném životě. Zhoršení kvality života je u ADHD větší než např. u asthma bronchiale. Dalšími riziky jsou abúzus návykových látek, riskantní řízení auta a další neuvážené chování, např. promiskuita apod. [1, 5]. Podklad ADHD je u dvou třetin pacientů genetický, uplatňuje se více genů s malým efektem (hlavními kandidátními geny jsou geny pro dopaminové receptory a dopaminergní, noradrenergní transportér a dopamin betahydroxylázu) [6]. U třetiny postižených se uplatňují vnější faktory, nejvýznamnější je hypoxická zátěž plodu během gravidity a při porodu [1]. Patofyziologickým mechanismem ADHD je dysfunkce kortikosubkortikálních cerebelárních katecholaminergních okruhů [7].
aktivit naopak přetrvávají [2, 3]. Velmi častá (60 % pacientů) je psychiatrická komorbidita. Nejčastěji se spolu s ADHD vyskytují úzkostné poruchy, porucha opozičního vzdoru a poruchy chování, tiky, specifické poruchy školních dovedností a deprese [4]. ADHD způsobuje horší výkon ve škole, obtíže se zařazením do kolektivu a později komplikuje navázání a udržení pevnějších vztahů, uplatnění v profesním a rodinném životě. Zhoršení kvality života je u ADHD větší než např. u asthma bronchiale. Dalšími riziky jsou abúzus návykových látek, riskantní řízení auta a další neuvážené chování, např. promiskuita apod. [1, 5]. Podklad ADHD je u dvou třetin pacientů genetický, uplatňuje se více genů s malým efektem (hlavními kandidátními geny jsou geny pro dopaminové receptory a dopaminergní, noradrenergní transportér a dopamin betahydroxylázu) [6]. U třetiny postižených se uplatňují vnější faktory, nejvýznamnější je hypoxická zátěž plodu během gravidity a při porodu [1]. Patofyziologickým mechanismem ADHD je dysfunkce kortikosubkortikálních cerebelárních katecholaminergních okruhů [7].
Základní léčebné přístupy
Léčebný přístup k ADHD je excelentním příkladem komplexní práce pedopsychiatra. Terapeutický čas dělíme mezi pacienta a jeho rodinu, spolupracujeme se školou a všemi, kteří se o dítě starají. Komplexní bio-psycho-sociální přístup nachází u ADHD oporu nejen z pohledu zdravého rozumu, ale jako optimální je ověřen i v klinických studiích. V roce 2006 byly vytvořeny první české doporučené postupy pro léčbu hyperkinetické poruchy. Vycházejí z analýzy dostupných světových klinických guidelines pro léčbu ADHD a z reálných možností ve zdravotnickém systému ČR [8]. Česká doporučení byla rozdělena na dvě skupiny: postupy léčby Poruchy aktivity a pozornosti F 90.0 a postupy léčby Hyperkinetické poruchy chování F 90.1 [9]. Tato doporučení předkládají ucelený algoritmus postupu a jsou nadějí pro standardizaci péče o děti s ADHD v ČR, resp. s hyperkinetickými poruchami.
Vztah farmakologické léčby a psychoterapie
V roce 1999 proběhla ve Spojených státech amerických rozsáhlá studie nazvaná Multimodal Treatment Study of Children with ADHD (MTA) s unikátním designem, zaměřená na srovnání efektivity různých léčebných postupů [10]. Studie se zúčastnilo 579 dětí, jednalo se o žáky 1.–4. třídy (ve věku 7–10 let) s diagnózou ADHD kombinovaného subtypu, stanovenou na základě klinického vyšetření a škál pro rodiče a učitele. Kromě ADHD trpělo 40 % dětí zároveň poruchou opozičního vzdoru, 14 % poruchami chování, 38 % úzkostnými poruchami a 14 % tiky. Pacienti byli náhodně rozděleni do čtyř skupin podle terapeutického přístupu: medikace (Med), behaviorální léčba (Beh), kombinovaná léčba (Comb), komunitní léčba (Com). Studie trvala 14 měsíců. Behaviorální léčba (Beh) sestávala z tréninku rodičů (skupinová a individuální sezení) a práce s dětmi (intenzivní letní výcvikový program v rozsahu 8 týdnů a školní konzultace). Farmakoterapie (Med) probíhala za daleko většího dohledu, než je obvyklé v běžné klinické praxi. Pacienti byli léčeni methylfenidátem podávaným třikrát denně, vstupní dávka do studie byla stanovena až po 28denní titraci a po zhodnocení grafických záznamů efektivity několika zkušenými kliniky ve spolupráci s rodiči. U 68 % pacientů byla úvodní vstupní dávka dosažená touto metodou 30,5 mg methylfenidátu/den. I pacienti v komunitní léčbě (Com) ve dvou třetinách dostávali farmakoterapii (stimulancia), ale k jejímu řízení nebyl vytvořen tak efektivní aparát jako ve skupině Med. Čtvrtým léčebným přístupem byla kombinovaná léčba (Comb) zahrnující behaviorální přístup a intenzivní farmakoterapii, stejně pečlivě vedenou jako u skupiny léčené pouze touto metodou (Med).
Ve všech skupinách došlo v průběhu studie k redukci symptomů ADHD. Skupiny léčené intenzivní medikací (Med a Comb) dosáhly největší redukce symptomatiky a statisticky signifikantně se tento efekt lišil od skupin léčených pouze behaviorálně nebo komunitně [11]. V následném 24měsíčním sledování se ukázalo, že od 14. měsíce léčby je ve skupině s kombinovanou léčbou potřeba nižších dávek stimulancií než u skupiny s pouhou medikací [12]. To je velmi významné zjištění, protože řada nežádoucích účinků stimulancií, jako je např. zpomalení růstu, je závislá na dávce [13]. Při posuzování efektivity terapeutických přístupů je třeba se zajímat i o účinek na symptomy přidružených psychiatrických poruch. V MTA z 19 hodnocených domén (jako jsou např. opoziční/agresivní příznaky, úzkostné příznaky, sociální dovednosti, vztah dítě – rodič a úspěch ve škole) byla kombinovaná léčba nejúspěšnější ve 12 případech, samotná farmakoterapie ve čtyřech, behaviorální léčba ve dvou a komunitní léčba v jednom případě. Tyto další domény mají zásadní vliv na kvalitu života dětí s ADHD a jejich blízkých, kteří se podílejí na výchově a vzdělávání. Dalším významným údajem byla spokojenost rodičů s léčbou. Ukázalo se, že kombinovaná léčba byla signifikantně více pozitivně hodnocena než pouze farmakologický přístup [11].
Současné možnosti farmakoterapie ADHD v České republice
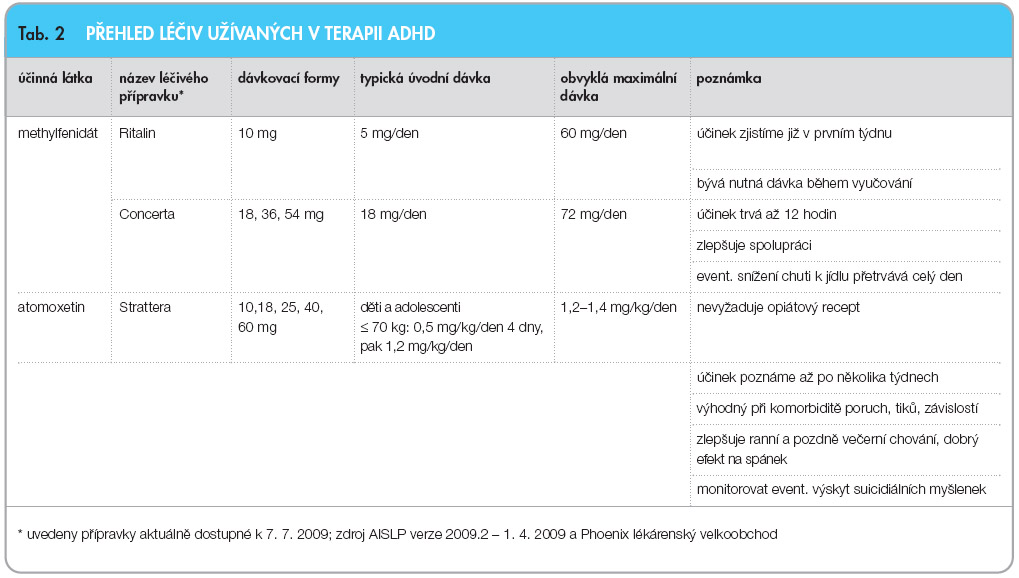 Pro léčbu ADHD, resp. pro léčbu hyperkinetické poruchy, jsou v současné době v ČR registrovány pouze tři preparáty. Ze stimulancií je to methylfenidát ve dvou lékových formách, dále máme k dispozici nestimulační lék atomoxetin. V případě selhání těchto léků první a druhé volby mohou být použita antidepresiva s noradrenergním a dopaminergním účinkem, ale jejich efekt není tak spolehlivě prokázán jako u stimulancií a atomoxetinu, navíc je tato léčba zatížena vyšší mírou nežádoucích účinků. V případě závažnější poruchy chování bývá vedle základní léčby použit ještě risperidon [9]. Přehled nejčastěji užívaných léčiv v terapii ADHD přináší tab. 2.
Pro léčbu ADHD, resp. pro léčbu hyperkinetické poruchy, jsou v současné době v ČR registrovány pouze tři preparáty. Ze stimulancií je to methylfenidát ve dvou lékových formách, dále máme k dispozici nestimulační lék atomoxetin. V případě selhání těchto léků první a druhé volby mohou být použita antidepresiva s noradrenergním a dopaminergním účinkem, ale jejich efekt není tak spolehlivě prokázán jako u stimulancií a atomoxetinu, navíc je tato léčba zatížena vyšší mírou nežádoucích účinků. V případě závažnější poruchy chování bývá vedle základní léčby použit ještě risperidon [9]. Přehled nejčastěji užívaných léčiv v terapii ADHD přináší tab. 2.
Stimulancia
Stimulancia jsou nejdéle používanými léky v dětské psychiatrii. V placebem kontrolovaných dvojitě slepých studiích u dětí, adolescentů a dospělých s ADHD nalézáme 65–75 % respondérů, oproti 4–30 % ve skupinách s placebem [13]. Při hodnocení účinku pomocí škál vychází velikost efektu průměrně okolo 1,0, což stimulancia řadí mezi nejúčinnější psychofarmaka vůbec [14]. Účinek stimulancií je patrný již v prvním týdnu léčby [15]. V České republice máme v současné době k dispozici jediného zástupce této skupiny, methylfenidát. Krátkodobě působící forma methylfenidátu (Ritalin) má biologický poločas 2,5 hodiny, klinický účinek trvá 2,5–4 hodiny, což pro kontrolu symptomů vyžaduje podávání 3krát denně. Zejména dávka během dopoledního vyučování je problematická. Proto bylo věnováno velké úsilí vývoji lékových forem s prodlouženým účinkem (až 12 hodin). Dlouhodobě působící lékové formy prokazatelně zlepšují spolupráci [16] a usnadňují dětem i rodičům situaci zejména v českých podmínkách, kdy nemáme školní zdravotníky. Nicméně nepokrývají některé klíčové části dne ráno a večer. Dvojitě slepé studie prokázaly stejnou účinnost dlouhodobě působících lékových forem v léčbě ADHD, jako mají krátkodobě působící stimulancia.
V květnu 2009 byly naše léčebné možnosti rozšířeny o methylfenidát s dlouhodobým účinkem (Concerta). Funguje na principu pomalého osmotického uvolňování účinné látky ze speciální tablety, kterou pacient užívá jednou denně (ráno). Účinek nastupuje podobně jako u lékových forem s okamžitým uvolňováním do jedné hodiny od užití a při mírném kolísání hladin přetrvává, nezávisle na jídle, 10–12 hodin. Léčba methylfenidátem je zahajována krátkodobě působící lékovou formou v dávce 5 mg/den podané ráno. Po týdnu při dobré toleranci lze dávku zvýšit na 10 mg/ den. Další dávky léku rozdělujeme do zbytku dne tak, aby pokryly alespoň nejkritičtější úseky (dopolední a odpolední vyučování, domácí příprava, kroužky). Stimulancia vykazují lineární závislost účinku na dávce a není žádné oficiálně stanovené terapeutické okno, proto pro každého pacienta hledáme optimální schéma titrace se zvyšováním dávky jednou týdně a pečlivým vyhodnocováním efektu léčby doma a ve škole. Zhruba jedna třetina školních dětí bude mít iniciální odpověď při nízké dávce (≤ 15 mg methylfenidátu/den), střední odpověď při dávce 16–34 mg/den a vysokou odpověď při dávce ≥ 34 mg/den [17]. Připomeňme, že v MTA studii byla ve farmakoterapeutické skupině, která byla spolu se skupinou s kombinovanou léčbou vyhodnocena jako nejúspěšnější, vstupní dávka 30,5 mg/den u 68 % dětí ve věku 7–10 let [12]. V případě osvědčeného efektu a dobré snášenlivosti krátkodobé lékové formy methylfenidátu můžeme přejít na podávání methylfenidátu s prodlouženým účinkem jednou denně. Krátkodobé lékové formě methylfenidátu dáváme přednost tam, kde ADHD narušuje významně školní vyučování, ale mimo vyučování rodiče ani pacienti léčbu nepožadují. Preskripce methylfenidátu v jakékoliv formě podléhá opatřením pro skupinu omamných a psychotropních látek skupiny II. Při léčbě methylfenidátem je třeba upozornit rodiče na možné zhoršení příznaků onemocnění nastávající po odeznění účinku léku, jež obvykle trvá několik desítek minut. Nejčastějšími nežádoucími účinky jsou snížená chuť k jídlu, bolesti břicha, nauzea, bolesti hlavy, nervozita, nespavost. Některé z těchto symptomů mohou časem vymizet, jiným, jako je např. nespavost, lze čelit úpravou dávkovacího schématu. Léčba stimulancii může zpomalit růst a přírůstek hmotnosti dítěte, a proto tyto parametry během léčby monitorujeme [12]. Zvýšená opatrnost je nutná u pacientů s tiky, epilepsií, výraznou depresí a úzkostí, anorexií a lékovou závislostí. U pacienta s kardiovaskulárními obtížemi a anamnézou náhlých úmrtí v rodině je nutné vyšetření kardiologem a jeho souhlas s léčbou.
Předškoláci a stimulancia
Stimulancia jsou předepisována i dětem v předškolním věku, a to zejména tam, kde je hyperaktivita tak výrazná, že ohrožuje dítě na zdraví [18]. V této věkové skupině bylo pochopitelně provedeno mnohem méně klinických studií než u dětí starších. Connor (2002) [19] shrnul devět malých studií s methylfenidátem u dětí mladších 6 let, většinou s dvojitě slepým designem nebo aspoň se srovnávacím souborem. Celkově zahrnují 206 dětí, dávky methylfenidátu se pohybovaly v rozmezí 2,5–30 mg/ den nebo 0,15–1,0 mg/kg/den. Osm z těchto studií potvrdilo účinnost methylfenidátu při dávkování 1 mg/kg/den, a dávky tak byly srovnatelné se školními dětmi. U dětí s významným vývojovým opožděním byl pozorován vyšší výskyt nežádoucích účinků, jako je podrážděnost, sociální izolace a plačtivost [20], proto je doporučována velmi opatrná titrace dávky methylfenidátu. Ve studii PATS (Preschool ADHD Treatment Study) řízené NIMH (National Institute of Mental Health) [21, 22] bylo v otevřeném designu léčeno methylfenidátem 183 dětí ve věku 3–5 let. Z nich 165 následně pokračovalo ve dvojitě slepé placebem kontrolované fázi trvající 6 týdnů. V této studii se ukázalo jako optimální dávkování methylfenidátu 0,7 mg/kg/den, pro nežádoucí účinky farmakologickou léčbu předčasně ukončilo 18 % dětí [23]. Ve srovnání se studií MTA (školní děti) byl ve studii PATS zjištěn vyšší výskyt emočních nežádoucích účinků, jako je podrážděnost a plačtivost [24]. U předškoláků ve studii PATS byl parametr effect size (míra účinnosti) nižší, pouze 0,4–0,8, oproti 0,5–1,3 u školních dětí [25]. Farmakogenetická studie provedená jako součást studie PATS ukázala, že předškolní děti metabolizují methylfenidát v průměru pomaleji než děti školního věku [26]. Závěrečné doporučení pro léčbu takto malých dětí tedy zní: titrovat dávku velmi opatrně, protože i nižší dávky mohou přinést klinický efekt, a cíleně sledovat dynamiku emočních symptomů, které by mohly být nežádoucími účinky léčby. Pokud je léčba methylfenidátem účinná, je doporučeno pokračovat 6 měsíců a pak znovu vyhodnotit psychopatologický stav. V této věkové skupině může dojít u určité části dětí k vymizení příznaků, a další léčba již není nutná [27]. Přístupem první volby by u předškolních dětí s ADHD měla být edukace rodičů a zlepšování rodičovských dovedností [28].
Atomoxetin
Od roku 2007 je v České republice k dispozici nový preparát pro léčbu ADHD atomoxetin, který nepatří mezi stimulancia. Jedná se o centrální sympatomimetikum působící s vysokou afinitou a selektivitou inhibici zpětného vychytávání noradrenalinu blokádou presynaptického noradrenalinového transportéru [29]. Jeho působení je tedy v souladu s katecholaminergní hypotézou ADHD. Zvyšuje koncentraci noradrenalinu a nepřímým efektem i koncentraci dopaminu v prefrontálním kortexu, ale nikoliv ve striatu a v nucleus accumbens. Tento mechanismus účinku zřejmě podmiňuje fakt, že terapie atomoxetinem nepůsobí psychostimulačně, nepodporuje vznik syndromu závislosti ani tiků [8].
Trvání účinku atomoxetinu je až 24 hodin při jednodenním dávkování, u většiny pacientů je podáván ráno. Michelson a kol. [30] zjistili, že atomoxetin je účinnější než placebo od prvního týdne léčby, ale nejvyšší efekt je pozorován od šestého týdne léčby. S atomoxetinem jsou dnes již velké klinické zkušenosti a jeho účinek byl testován v řadě klinických studií. Míra účinnosti (effect size, ES) je u atomoxetinu vypočítávána na 0,7; NNT je 4,2 (number needed to treat – počet pacientů, které je třeba léčit, aby právě jeden z nich dosáhl remise). Tyto výsledky jsou srovnatelné s methylfenidátem, kde je NNT 4,8. Pro ilustraci uveďme, že ES u antidepresiv je 0,5 a NNT 9 [31]. Unikátní profil účinku atomoxetinu (nepodporuje vznik závislosti, nezhoršuje úzkost ani tiky) vedl k testování jeho účinnosti u komplikované ADHD. Jednou z nejčastějších komorbidit ADHD jsou úzkostné poruchy, nalézáme je až u 35 % dětí. Geller [32] ve dvojitě slepé studii u 176 pacientů ve věku 8–17 let s ADHD a komorbidní úzkostnou poruchou zjistili, že po 12 týdnech léčby atomoxetinem došlo k signifikantnímu zlepšení symptomů ADHD (ES = 1,0) a zmírnily se i symptomy úzkostné poruchy (ES = 0,5). U jedné třetiny dětí s ADHD se setkáváme s tiky. Allen a kol. se zabývali účinkem a snášenlivostí atomoxetinu u 7–17letých pacientů s ADHD a tikovou poruchou. Byla prokázána účinnost atomoxetinu na příznaky ADHD, nedošlo ke zhoršení tiků a v některých subškálách pro hodnocení tiků bylo zjištěno signifikantní zlepšení [33]. Stejně dobré výsledky zjistil Spencer a kol. u pacientů s Touretteovým syndromem a ADHD. Komorbidní tiková porucha nesnižovala účinek léčby na příznaky ADHD a ve dvou ze tří použitých škál pro hodnocení tiků bylo patrné signifikantní zlepšení [34].
S ohledem na dobré zkušenosti s nor-adrenergními antidepresivy podávanými večer pacientům s noční enurézou byl v této indikaci testován také atomoxetin. Sumner a kol. prokázali ve dvojitě slepé placebem kontrolované studii u celkového souboru 87 dětí signifikantní zvýšení frekvence suchých nocí u skupiny léčené atomoxetinem ve srovnání s placebem [35]. Několik studií se zabývalo účinkem atomoxetinu u pacientů s ADHD a poruchou opozičního vzdoru (Oppositional defiant disorder, ODD) jakožto nejčastějším komorbidním psychiatrickým onemocněním [36–39]. Ukazuje se, že u těchto pacientů lze očekávat signifikantně vyšší účinek atomoxetinu než placeba na příznaky ADHD, srovnatelný se skupinou bez této komorbidity. Výsledky v ovlivění příznaků poruchy opozičního vzdoru jsou nejednoznačné. V rozsáhlé 9měsíční studii u 416 dětí a adolescentů s ADHD a ODD, kterou provedl Hazel a kol. [38], se ukázalo, že přítomnost komorbidní ODD neměla vliv na dobrý účinek atomoxetinu v prevenci relapsu příznaků ADHD. Léčbu atomoxetinem zahajujeme dávkou 0,5 mg/kg/den a po 7 dnech se zvyšuje na doporučené cílové dávkování 1,2 mg/kg/den [40]. Nejčastějšími nežádoucími účinky, které mohou v průběhu prvních dnů léčby vymizet, jsou nechutenství, bolest hlavy, bolest břicha, zvracení. V některých zemích byl atomoxetin spolu s antidepresivy zařazen mezi léky s tzv. black box warning a je doporučeno monitorování eventuálního výskytu suicidiálních myšlenek, představ a tendencí [41]. Většina pacientů užívá atomoxetin ráno, v případě výskytu sedace po ranní dávce lze přesunout užití léku na večer. Podání s jídlem snižuje pravděpodobnost gastrointestinálních nežádoucích účinků.
Farmakologická léčba ADHD a kardiovaskulární rizika
V březnu 2006 vydala americká Pediatric Advisory Commitee varování před rizikem náhlých úmrtí při léčbě farmaky doporučenými u ADHD. Americký úřad FDA shrnul 20 dostupných případů při léčbě amfetaminem a dextroamfetaminem (14 dětí a 6 dospělých) a 14 případů úmrtí u dětí a 4 dospělých při léčbě methylfenidátem. Je třeba připomenout, že frekvence náhlých úmrtí v dětské populaci je celkově odhadována na 1,3–8,5/100 000 pacientů za rok [42]. Villalaba shrnul, že frekvence náhlých úmrtí u pacientů s ADHD ve sledovaném období od ledna 1996 do prosince 2004 byla 0,2/100 000/rok při léčbě methylfenidátem, 0,3/100 000/rok u amfetaminu a 0,5/100 000/rok u atomoxetinu. Frekvence náhlých úmrtí u dětí léčených pro ADHD tedy nepřekračuje celkovou frekvenci v populaci [43]. Původně uvažované „black box“ varování tedy nakonec nebylo doporučeno. V současné době není považováno za nezbytné provádět rutinní kardiologické vyšetření před zahájením léčby ADHD u jinak zdravých dětí [44]. Platí ovšem doporučení spíše nezahajovat léčbu stimulancii u pacientů s již existujícím kardiovaskulárním onemocněním nebo s příznaky takového onemocnění, stejně jako u jedince, který má náhlá úmrtí v rodinné anamnéze. Pokud by přece jen byla farmakologická léčba ADHD i v takovémto případě nezastupitelná, je nezbytné vyšetření u kardiologa, jeho souhlas se zahájením léčby a následné sledování v kardiologické ambulanci po dobu trvání farmakologické terapie [45].
Risperidon
Risperidon řadíme mezi atypická neuroleptika. Ve dvojitě slepých studiích prokázal schopnost snižovat agresivitu, dráždivost a hyperaktivitu. Jako jediný zástupce své skupiny získal registraci pro léčbu poruch chování u dětí od pěti let.
Aman a kol. zjistili ve dvojitě slepé placebem kontrolované studii signifikantně vyšší účinek risperidonu než placeba na příznaky poruch chování u dětí s ADHD. Přidání risperidonu k léčbě methylfenidátem vedlo k významnému ústupu hyperaktivity. Kombinace methylfenidátu a risperidonu nezvýšila frekvenci nežádoucích účinků [46]. Ve dvojitě slepé placebem kontrolované studii u 25 dětí ve věku 7–12 let léčených stimulancii s diagnózou ADHD a výrazné agrese zjistili Armenteros a kol. zmírnění agrese dle hodnocení rodičů, ale ne dle hodnocení učitelů [47]. Dobrý efekt prokázal risperidon u pacientů s ADHD, s poruchami chování a se sníženým intelektem [48]. Ve studii Gunthera a kol. u 23 dětí ve věku 6–15 let s ADHD a poruchami chování nebylo zjištěno zpomalení kognitivního tempa a zhoršení pozornosti, pokud byl vedle methylfenidátu užíván i risperidon. Zmírnily se příznaky poruch chování [49].
České doporučené postupy léčby uvádějí jako první krok v léčbě ADHD a poruch chování (resp. hyperkinetické poruchy chování) methylfenidát [9]. Pokus o samostatnou léčbu methylfenidátem je v souladu s výsledky metaanalýzy studií s celkovým souborem 844 dětí, kdy methylfenidát u dětí s ADHD a komorbidní agresí vykazoval tzv. effect size 0,9 [50]. Ve druhém kroku je doporučena augmentace risperidonem. U dětí s hmotností nižší než 50 kg je doporučeno začínat s dávkou 0,25 mg/den a obden tuto dávku zvyšovat o 0,25 mg. Obvyklé dávky u dětí s ADHD a poruchami chování a s hyperkinetickými poruchami chování se pohybují v rozmezí 1–2 mg/den. Ve třetím kroku je alternativou methylfenidátu atomoxetin [9].
Dlouhodobá farmakologická léčba ADHD
ADHD byla dlouho považována za onemocnění spíše dětské populace, které z větší části spontánně remituje během adolescence. Tento názor do značné míry souvisel s důrazem na hyperaktivitu jako hlavní skupinu symptomů ADHD, která se skutečně s věkem zmírňuje. Rostoucí zájem o poruchy pozornosti a další kognitivní deficity ukázal, že jde o symptomy většinou perzistující do dospělého věku a z hlediska funkčnosti závažnější, než je hyperaktivita [51]. Poruchy pracovní paměti a z toho vyplývající obtíže s plánováním a organizací aktivit, zhoršená schopnost odložit odměnu, to vše jsou charakteristiky, které jsou protikladné k vlastnostem nezbytným ke stabilnímu a úspěšnému životu. S posunem v konceptu ADHD směrem k poruchám pozornosti a organizace aktivit přichází zájem o dlouhodobou léčbu dětí, adolescentů a dospělých.
Proběhla řada studií sledujících efektivitu dlouhodobé farmakologické léčby ADHD. Abikoff a kol. [52] neprokázali během dvouletého sledování u 103 dětí ve věku 7–9 let pokles efektu léčby methylfenidátem. Charach a kol. sledovali po dobu 5 let 79 z 91 účastníků předcházející klinické studie s methylfenidátem. Z nich 69 setrvalo v léčbě po dobu 5 let. Kritériem pro adherenci bylo užívání methylfenidátu alespoň 5 dní v týdnu a nepřítomnost lékových prázdnin delších než 14 dní. Ukázalo se, že pacienti splňující kritéria pro adherenci byli v průběhu studie lépe hodnoceni učiteli než pacienti neadherentní [53]. Willens a kol. ve studii u 407 dětí s ADHD ve věku 6–13 let léčených methylfenidátem s prodlouženým účinkem zjistili, že po dobu dvou let sledování setrvalo ve farmakologické léčbě 229 dětí a 85 % rodičů těchto dětí hodnotilo efekt léčby jako dobrý nebo vynikající. Průměrná dávka methylfenidátu stoupla během dvou let o jednu pětinu [54]. Dlouhodobý účinek atomoxetinu byl sledován u 416 dětí ve věku 6–15 let. Oproti placebu byl atomoxetin po 9 měsících léčby signifikantně úspěšnější v prevenci relapsu příznaků (návrat k závažnosti na začátku) [55]. Willens dlouhodobě sledoval 601 adolescentů s ADHD léčených atomoxetinem, z nichž 219 dokončilo dvouletou léčbu. Průměrná dávka atomoxetinu byla 1,4 mg/kg/den. Pro nedostatečný účinek odstoupilo ze studie 16,5 % adolescentů. U respondérů došlo podle hodnocení rodičů škálou ADHD RS-IV k úpravě stavu k normě od třetího měsíce léčby a tento efekt vydržel do konce dvouletého sledování [56].
Podnětné poznatky o dynamice efektu medikace při dlouhodobé léčbě vzešly i z následného, dnes již devítiletého, sledování pacientů z MTA studie [57, 58]. Od 22. měsíce přestávaly být rozdíly ve výsledcích léčby mezi skupinami (medikovaní vs. nemedikovaní; kombinovaná léčba vs. samotná medikace) signifikantní. Největší zlepšení bylo pozorováno v průběhu prvních 14 měsíců léčby a pak již bylo pozvolnější. Přetrvávající postižení bylo spojeno s přítomností komorbidní poruchy opozičního vzdoru a poruch chování vyskytujících se již při vstupu do studie.
Podle dlouhodobého vývoje bylo možné pacienty rozdělit do tří skupin:
- 1. děti s malým úvodním zlepšením a následným postupným zlepšováním;
- 2. děti s výrazným úvodním zlepšením, které vydrželo i po 36 měsících;
- 3. děti, které se zlepšily na začátku, ale pak se zhoršily.
Posledně jmenovaná skupina pacientů měla celkově vyšší skóre agresivity a průměrně nižší IQ než předchozí dvě skupiny. Zajímavé je, že dynamika zlepšení zdaleka nebyla u všech pacientů ve shodě s aktuální medikací. Zlepšení v první skupině bylo na aktuální medikaci vázáno, ale ve druhé skupině už najdeme pacienty, kteří během prvních 14 měsíců studie sice byli intenzivně farmakologicky léčeni, ale zlepšení během následného dvouletého sledování pokračovalo i bez farmakologické léčby.
V klinické praxi musíme tedy být připraveni na to, že stav pacienta se může při dobré complianci postupně zhoršit navzdory několikaměsíčnímu dobrému efektu léčby. Taková situace může nastat zejména v přítomnosti komorbidních poruch, ale můžeme počítat také s možností remise již bez nutnosti medikace. Za odpověď na léčbu je považována redukce příznaků o 50 % [59]. Jestliže je tedy pacient léčený pro ADHD alespoň jeden rok kompenzován, nevyskytují se příznaky ADHD, je potřeba zamyslet se nad pokračováním medikace.
- 1. není třeba úměrně zvyšovat dávku léku, přestože se zvyšuje hmotnost a výška dítěte;
- 2. stav pacienta se nezhorší, pokud opomene užít dávku stimulancia;
- 3. chování i koncentrace jsou na dobré úrovni i během delších lékových prázdnin.
Období, kdy je menší zátěž a rodiče mohou chování dítěte celodenně hodnotit, jsou ideální pro to, aby farmakologická léčba byla zkusmo ukončena. K přesnějšímu zhodnocení schopnosti koncentrace a výdrže u náročnějších činností mohou rodiče během prázdnin vyzkoušet občasnou domácí výuku.
Psychosociální léčba ADHD
Behaviorálně orientovaná psychosociální léčba je spolu s farmakoterapií základním terapeutickým přístupem k ADHD [60]. Děti s ADHD čelí v denním životě řadě problémů, které překračují rámec jádrových symptomů. Mívají problémy ve vztazích s vrstevníky, s dodržením nároků, které na ně kladou dospělí, mají horší vztahy s rodiči. Kontrola jádrových příznaků farmakologickou léčbou tedy neznamená, že dítě s ADHD je zcela v pořádku [61]. Například to, že dítě, které je díky farmakologické léčbě méně hyperaktivní a impulzivní, a není proto odmítáno kamarády, ještě neznamená, že se umí mezi děti šikovně začlenit, apod. Vyřešení těchto problematických oblastí je však důležité pro dlouhodobý vývoj.
- 1. zda jeho rodiče zvládnou efektivní výchovné postupy;
- 2. jak dítě vyjde se svými vrstevníky;
- 3. jak je úspěšné ve škole.
V behaviorální léčbě jde o vytvoření dovedností kompenzujících deficity vyplývající z poruchy. Protože je ADHD chronicky probíhající onemocnění, budou rodičům i dětem naučené techniky prospěšné velmi dlouho a začátek léčby by se neměl odkládat [63]. Behaviorální přístup chápe chování jako kaskádu relativně ohraničených aktivit, které jsou určitým podnětem spouštěny a vedou k zákonitým důsledkům. Na základě analýzy chování v tomto smyslu, resp. systému ABC (Antecendens – to, co předchází určitému chování čili spouštěč; Behavior – chování, které děti, rodiče a učitelé chtějí změnit; Consequence – co následuje po určitém chování), lze postupně fixovat aktivity žádoucí a eliminovat aktivity škodlivé. Právě zde se ukazuje, že léčba ADHD nemůže být zaměřena jen na dítě. K úspěchu je nutné, aby na svém chování byli ochotni pracovat i rodiče [64]. Psychosociální léčba v širším smyslu zahrnuje spolupráci dětského psychiatra se školou dítěte. Jejím cílem je výměna informací o pokrocích v úpravě chování a výkonu ve škole a edukace učitelů o problematice ADHD. Obeznámenost s moderními poznatky o léčbě ADHD a přístupech k dětem s touto poruchou zatím nelze na českých školách automaticky předpokládat. Učitel je přitom v prvních ročnících základní školy jednou z nejdůležitějších osob, s níž se dítě v tomto věku setkává.
Seznam použité literatury
- [1] Biederman J, Faraone SV. Attention-deficit hyperactivity disorder. Lancet 2005; 16–22; 366: 237–248.
- [2] Willoughby MT. Developmental course of ADHD symptomatology during the transition from childhood to adolescence: a review with recommendations. J Child Psychol Psychiatry 2003; 44: 88–106.
- [3] Mannuzza S, Klein RG, Moulton JL 3rd. Persistence of Attention-Deficit/Hyperactivity Disorder into adulthood: what have we learned from the prospective follow-up studies? J Atten Disord 2003; 7: 93–100.
- [4] Spencer TJ. ADHD and comorbidity in childhood. J Clin Psychiatry 2006; 67 (Suppl. 8): 27–31.
- [5] Wilens TE. The nature of the relationship between attention-deficit/hyperactivity disorder and substance use. J Clin Psychiatry 2007; 68 (Suppl. 11): 4–8.
- [6] Faraone SV, Perlis RH, Doyle AE, et al. Molecular genetics of attention-deficit/hyperactivity disorder. Biol Psychiatry 2005; 57: 1313–1323.
- [7] Biederman J, Faraone SV. Current concepts on the neurobiology of Attention-Deficit/Hyperactivity Disorder. J Atten Disord 2002; 6 (Suppl. 1): S7–16.
- [8] Hrdlička M. Postavení atomoxetinu v léčbě hyperkinetické poruchy u dětí a adolescentů. Čes slov psychiatr 2007; 103: 230–239.
- [9] Drtílková I, Hrdlička M, Paclt I. Hyperkinetické poruchy u dětí. In: Raboch J, Anders M, Praško J, Hellerová P (eds). Psychiatrie: Doporučené postupy psychiatrické péče II. 1. vyd. Praha, Psychiatrická společnost ČLS JEP, 2006, s. 141–149.
- [10] MTA Cooperative Group. 14-month randomized clinical trial of treatment strategies for attention-deficit/hyperactivity disorder. The MTA Cooperative Group. Multimodal Treatment Study of Children with ADHD. Arch Gen Psychiatry 1999; 56: 1073–1086.
- [11] MTA Cooperative Group. Moderators and mediators of treatment response for children with attention-deficit/hyperactivity disorder: the Multimodal Treatment Study of children with Attention-deficit/hyperactivity disorder. Arch Gen Psychiatry 1999; 56: 1088–1096.
- [12] Faraone SV, Biederman J, Morley CP, Spencer TJ. Effect of stimulants on height and weight: a review of the literature. J Am Acad Child Adolesc Psychiatry 2008; 47: 994–1009.
- [13] Greenhill LL, Pliszka S, Dulcan MK, Bernet W, et al. American Academy of Child and Adolescent Psychiatry. Practice parameter for the use of stimulant medications in the treatment of children, adolescents, and adults. J Am Acad Child Adolesc Psychiatry 2002; 41(Suppl. 2): 26S–49S.
- [14] Conners CK. Forty years of methylphenidate treatment in Attention-Deficit/Hyperactivity Disorder. J Atten Disord 2002; 6 (Suppl. 1): S17–30.
- [15] Greenhill L, Beyer DH, Finkleson J, et al. Guidelines and algorithms for the use of methylphenidate in children with Attention-Deficit/Hyperactivity Disorder. J Atten Disord 2002; 6 (Suppl. 1): S89–S100.
- [16] Wilens TE, McBurnett K, Bukstein O, et al. Multisite controlled study of OROS methylphenidate in the treatment of adolescents with attention-deficit/hyperactivity disorder. Arch Pediatr Adolesc Med 2006; 160: 82–90.
- [17] Vitiello B, Severe JB, Greenhill LL, et al. Methylphenidate dosage for children with ADHD over time under controlled conditions: lessons from the MTA. J Am Acad Child Adolesc Psychiatry 2001; 40: 188–196.
- [18] Greenhill LL. The use of psychotropic medication in preschoolers: indications, safety and efficacy. Can J Psychiatry 1998; 3: 576–581.
- [19] Connor DF. Preschool attention deficit hyperactivity disorder: a review of prevalence, diagnosis, neurobiology, and stimulant treatment. J Dev Behav Pediatr 2002; 23 (Suppl. 1): S1–S9.
- [20] Handen BL, Feldman HM, Lurier A, et al. Efficacy of methylphenidate among preschool children with developmental disabilities and ADHD. J Am Acad Child Adolesc Psychiatry 1999; 38: 805–812.
- [21] Kollins S, Greenhill L, Swanson J, et al. Rationale, design, and methods of the Preschool ADHD Treatment Study (PATS). J Am Acad Child Adolesc Psychiatry 2006; 45: 1275–1283.
- [22] Posner K, Melvin GA, Murray DW, et al. Clinical presentation of attention-deficit/hyperactivity disorder in preschool children: the Preschoolers with Attention-Deficit/Hyperactivity Disorder Treatment Study (PATS). J Child Adolesc Psycho-pharmacol 2007; 17: 547–562.
- [23] Abikoff HB, Vitiello B, Riddle MA, et al. Methylphenidate effects on functional outcomes in the Preschoolers with Attention-Deficit/Hyperactivity Disorder Treatment Study (PATS). J Child Adolesc Psychopharmacol 2007; 17: 581–592.
- [24] Wigal T, Greenhill L, Chuang S, et al. Safety and tolerability of methylphenidate in preschool children with ADHD. J Am Acad Child Adolesc Psychiatry 2006; 45: 1294–1303.
- [25] Vitiello B, Abikoff HB, Chuang SZ, et al. Effectiveness of methylphenidate in the 10-month continuation phase of the Preschoolers with Attention-Deficit/Hyperactivity Disorder Treatment Study (PATS). J Child Adolesc Psychopharmacol 2007; 17: 593–604.
- [26] McGough J, McCracken J, Swanson J, et al. Pharmacogenetics of methylphenidate response in preschoolers with ADHD. J Am Acad Child Adolesc Psychiatry 2006; 45: 1314–1322.
- [27] Lahey BB, Pelham WE, Loney J, et al. Three-year predictive validity of DSM-IV attention deficit hyperactivity disorder in children diagnosed at 4–6 years of age. Am J Psychiatry 2004; 161: 2014–2020.
- [28] Kratochvil CJ, Egger H, Greenhill LL, McGough JJ. Pharmacological management of preschool ADHD. J Am Acad Child Adolesc Psychiatry 2006; 45: 115–118.
- [29] Malá E, Kučera Z. Atomoxetin. Remedia 2007; 17: 542–550.
- [30] Michelson D, Allen AJ, Busner J, et al. Once-daily atomoxetine treatment for children and adolescents with attention deficit hyperactivity disorder: a randomized, placebo-controlled study. Am J Psychiatry 2002; 159: 1896–1901.
- [31] Banaschewski T, Coghill D, Santosh P, et al. Long-acting medications for the hyperkinetic disorders. A systematic review and European treatment guideline. Eur Child Adolesc Psychiatry 2006; 15: 476–495.
- [32] Geller D, Donnelly C, Lopez F, et al. Atomoxetine treatment for pediatric patients with attention-deficit/hyperactivity disorder with comorbid anxiety disorder. J Am Acad Child Adolesc Psychiatry 2007; 46: 1119–1127.
- [33] Allen AJ, Kurlan RM, Gilbert DL, et al. Atomoxetine treatment in children and adolescents with ADHD and comorbid tic disorders. Neurology 2005; 65: 1941–1949.
- [34] Spencer TJ, Sallee FR, Gilbert DL, et al. Atomoxetine treatment of ADHD in children with comorbid Tourette syndrome. J Atten Disord 2008; 11: 470–481.
- [35] Sumner CR, Schuh KJ, Sutton VK, et al. Placebo-controlled study of the effects of atomoxetine on bladder control in children with nocturnal enuresis. J Child Adolesc Psychopharmacol 2006; 16: 699–711.
- [36] Bangs ME, Hazell P, Danckaerts M, et al. Atomoxetine ADHD/ODD Study Group. Atomoxetine for the treatment of attention-deficit/hyperactivity disorder and oppositional defiant disorder. Pediatrics 2008; 121: e314–e320.
- [37] Kaplan S, Heiligenstein J, West S, et al. Efficacy and safety of atomoxetine in childhood attention-deficit/hyperactivity disorder with comorbid oppositional defiant disorder. J Atten Disord 2004; 8: 45–52.
- [38] Hazell P, Zhang S, WolanĘczyk T, et al. Comorbid oppositional defiant disorder and the risk of relapse during 9 months of atomoxetine treatment for attention-deficit/hyperactivity disorder. Eur Child Adolesc Psychiatry 2006; 15: 105–110.
- [39] Newcorn JH, Spencer TJ, Biederman J, et al. Atomoxetine treatment in children and adolescents with attention-deficit/hyperactivity disorder and comorbid oppositional defiant disorder. J Am Acad Child Adolesc Psychiatry 2005; 44: 240–248.
- [40] Michelson D, Faries D, Wernicke J, et al. Atomoxetine ADHD Study Group. Atomoxetine in the treatment of children and adolescents with attention-deficit/hyperactivity disorder: a randomized, placebo-controlled, dose-response study. Pediatrics 2001; 108: E83.
- [41] Bangs ME, Tauscher-Wisniewski S, Polzer J, et al. Meta-analysis of suicide-related behavior events in patients treated with atomoxetine. J Am Acad Child Adolesc Psychiatry 2008; 47: 209–218.
- [42] Liberthson RR. Sudden death from cardiac causes in children and young adults. N Engl J Med 1996; 334: 1039–1044.
- [43] Villalaba L. Follow up review of AERS search identifying CASE of sudden death occuring with drugs used for the treatment of attention deficit hyperactivity disorder (ADHD). http://www.fda.gov/ ohrms/dockets/ac/06/briefing-4210B-Index.htm/ 2006
- [44] Biederman J, Spencer TJ, Wilens TE, et al. Treatment of ADHD with stimulant medications: response to Nissen perspective in the New England Journal of Medicine. J Am Acad Child Adolesc Psychiatry 2006; 45: 1147–1150.
- [45] Wilens TE, Prince JB, Spencer TJ, et al. Stimulants and sudden death: what is a physician to do? Pediatrics 2006; 118: 1215–1219.
- [46] Aman MG, Binder C, Turgay A. Risperidone effects in the presence/absence of psychostimulant medicine in children with ADHD, other disruptive behavior disorders, and subaverage IQ. J Child Adolesc Psychopharmacol 2004; 14: 243–254.
- [47] Armenteros JL, Lewis JE, Davalos M. Risperidone augmentation for treatment-resistant aggression in attention-deficit/hyperactivity disorder: a placebo-controlled pilot study. J Am Acad Child Adolesc Psychiatry 2007; 46: 558–565.
- [48] Correia Filho AG, Bodanese R, Silva TL, et al. Comparison of risperidone and methylphenidate for reducing ADHD symptoms in children and adolescents with moderate mental retardation. J Am Acad Child Adolesc Psychiatry 2005; 44: 748–755.
- [49] Günther T, Herpertz-Dahlmann B, Jolles J, et al. The influence of risperidone on attentional functions in children and adolescents with attention-deficit/hyperactivity disorder and comorbid disruptive behavior disorder. J Child Adolesc Psychopharmacol 2006; 16: 725–735.
- [50] Pappadopulos E, Woolston S, Chait A, et al. Pharmacotherapy of aggression in children and adolescents: efficacy and effect size. J Can Acad Child Adolesc Psychiatry 2006; 15: 27–39.
- [51] Nigg JT, Willcutt EG, Doyle AE, Sonuga-Barke EJ. Causal heterogeneity in attention-deficit/hyperactivity disorder: do we need neuropsychologically impaired subtypes? Biol Psychiatry 2005; 57: 1224–1230.
- [52] Abikoff H, Hechtman L, Klein RG, et al. Social functioning in children with ADHD treated with long-term methylphenidate and multimodal psychosocial treatment. J Am Acad Child Adolesc Psychiatry 2004; 43: 820–829.
- [53] Charach A, Ickowicz A, Schachar R. Stimulant treatment over five years: adherence, effectiveness, and adverse effects. J Am Acad Child Adolesc Psychiatry 2004; 43: 559–567.
- [54] Wilens T, McBurnett K, Stein M, et al. ADHD treatment with once-daily OROS methylphenidate: final results from a long-term open-label study. J Am Acad Child Adolesc Psychiatry 2005; 44: 1015–1023. Erratum in: J Am Acad Child Adolesc Psychiatry 2006; 45: 632.
- [55] Michelson D, Buitelaar JK, Danckaerts M, et al. Relapse prevention in pediatric patients with ADHD treated with atomoxetine: a randomized, double-blind, placebo-controlled study. J Am Acad Child Adolesc Psychiatry 2004; 43: 896–904.
- [56] Willens T, Gao H, Thomason C, et al. Longer term treatment with atomoxetine in adolescents with ADHD. Scientific Proceedings of the American Psychiatric Association (Nr 578) 2004, New York City.
- [57] Swanson J, Arnold LE, Kraemer H, et al. MTA Cooperative Group. Evidence, interpretation, and qualification from multiple reports of long-term outcomes in the Multimodal Treatment study of Children With ADHD (MTA): part I: executive summary. J Atten Disord 2008; 12: 4–14.
- [58] Swanson J, Arnold LE, Kraemer H, et al. MTA Cooperative Group. Evidence, interpretation, and qualification from multiple reports of long-term outcomes in the Multimodal Treatment Study of children with ADHD (MTA): Part II: supporting details. J Atten Disord 2008; 12: 15–43.
- [59] Kutcher S, Aman M, Brooks S, et al. International consensus statement on attention-deficit/hyperactivity disorder (ADHD) and disruptive behaviour disorders (DBDs): clinical implications and treatment practice suggestions. Eur Neuropsychopharmacol 2004; 14: 11–28.
- [60] Pelham WE Jr, Fabiano GA. Evidence-based psychosocial treatments for attention-deficit/hyperactivity disorder. J Clin Child Adolesc Psychol 2008; 37: 184–214.
- [61] Barkley RA. Psychosocial treatments for attention-deficit/hyperactivity disorder in children. J Clin Psychiatry 2002; 63 (Suppl. 12): 36–43.
- [62] Hinshaw SP. Moderators and mediators of treatment outcome for youth with ADHD: understanding for whom and how interventions work. Ambul Pediatr 2007; 7(Suppl. 1): 91–100.
- [63] Webster-Stratton C, Reid J, Hammond M. Social skills and problem-solving training for children with early-onset conduct problems: who benefits? J Child Psychol Psychiatry 2001; 42: 943–952.
- [64] Hinshaw SP, Owens EB, Wells KC, et al. Family processes and treatment outcome in the MTA: negative/ineffective parenting practices in relation to multimodal treatment. J Abnorm Child Psychol 2000; 28: 555–568.