Současný pohled na terapii neuroendokrinních nádorů
Neuroendokrinní nádory (NEN) představují heterogenní skupinu nádorů s velmi odlišnými vlastnostmi. Od správné diagnózy typu nádoru se odvíjí i specifická léčba. V současné době se v terapii těchto nádorů uplatňují nejen výkony chirurgické, lokální léčba jaterních metastáz a ve vybraných případech chemoterapie, ale zaznamenáváme výrazné pokroky i v cílené biologické léčbě včetně využití antiproliferativního účinku somatostatinových analog, tyrozinkinázových inhibitorů (TKI) a inhibitorů mTOR (mammalian target of rapamycin). Značný pokrok učinila i léčba otevřenými zářiči navázanými na analoga somatostatinu.
Úvod
U mnohobuněčných organismů, tedy i u člověka, je stálost vnitřního prostředí v odpovědi na změny vnější i vnitřní zajišťována třemi komunikačními mechanismy: nervovým, endokrinním a neuroendokrinním. Nervový přenos ovládá přímo výkonnou buňku, se kterou je nervové zakončení v kontaktu, příkladem jsou třeba kosterní svaly. Endokrinní přenos je založen na tom, že endokrinní buňky produkují hormony, působky, které jsou vyplavovány do krevního oběhu a ovlivňují tak i vzdálené buňky kdekoliv v organismu. Příkladem endokrinních žláz neboli žláz s vnitřní sekrecí je štítná žláza, vaječníky, varlata, kůra nadledvin. Neuroendokrinní přenos je založen na tom, že nervová zakončení stimulují specializované buňky k produkci působků, které pak při vyplavení do krevního oběhu ovlivňují funkci vzdálených buněk.
Neuroendokrinní tkáň je soustředěna jednak ve velkých žlázách, jako je např. zadní lalok hypofýzy, dřeň nadledvin a paraganglia, jednak je difuzní neuroendokrinní tkáň přítomna téměř ve všech orgánech. Nádory velkých neuroendokrinních žláz jsou velmi vzácné, daleko častěji se vyskytují nádory vycházející z difuzního neuroendokrinního systému, zejména v trávicím traktu, pankreatu, plicích, kůži, ale i v jiných systémech a orgánech (např. urogenitální trakt, prs aj.) [1].
Historicky se o neuroendokrinních nádorech (NEN) soudilo, že jsou vzácné a indolentní. Ve skutečnosti však NEN představují velmi nejednotnou skupinu nádorů lišících se projevy i prognózou. V této heterogenní skupině se jednotlivé typy nádorů mohou značně lišit jak svým biologickým chováním (od indolentního po velmi maligní), tak klinickými projevy, podle toho, zda jsou hormonálně funkční, či zda hormonální produkce zcela chybí. Incidence NEN v posledních třiceti letech roste rychleji než incidence ostatních solidních nádorů a za uvedené období se zvýšila pětinásobně. Jistě je to dáno nejen absolutním zvýšením jejich výskytu, který se přisuzuje změnám životního stylu, ale i kvalitnějšími diagnostickými metodami a zlepšeným povědomím o jejich existenci v odborné i laické veřejnosti.
Diagnostika
Diagnostika NEN může být pro nezkušeného klinika i patologa velmi obtížná a mnohdy je správná diagnóza stanovena až s odstupem mnoha měsíců. Občas se setkáváme se situací, že je nemocný s hormonálním syndromem léčen dokonce na psychiatrii pro domnělé psychosomatické onemocnění. Vzhledem k tomu, že NEN mohou být zachyceny napříč mnoha obory (gastroenterologie, chirurgie, plicní, endokrinologie…), je potřeba informovat o NEN širokou lékařskou veřejnost.Klinická symptomatologie může být různorodá. U funkčních nádorů je to nejčastěji karcinoidový syndrom s typickými četnými průjmy, návaly horka a s červenáním (flush), arteriální hypertenzí (AH) a bronchokonstrikcí. Při dlouhodobém průběhu může docházet k subendokardiál-
ní fibróze s chlopenní insuficiencí i k retroperitoneální fibróze. Dále to mohou být syndromy spojené s produkcí jiných specifických hormonů, např. hypoglykemické stavy u inzulinomu, Cushingův syndrom při produkci ACTH (fyziologicky hormon předního laloku hypofýzy ektopicky produkovaný nádorem) aj. v závislosti na působení produkovaného hormonu.
Do diagnostického algoritmu dále patří metody endoskopické včetně biopsie a zobrazovací metody všech typů. Dobře diferencované nádory mívají somatostatinové receptory, a proto jsou dobře zobrazitelné na somatostatinové receptorové scintigrafii (SRS) – octreoscanu, avšak vzhledem k nižší proliferační aktivitě nebývají průkazné klasickou FDG PET (fluo-rodeoxyglukózová pozitronová emisní tomografie). K jejich zobrazení lze využít speciální 68Ga-DOTATOC (DOTATATE; Ga-[1,4,7,10-tetraazacyclododecane-N,N′,N″,N′″-tetraacetic acid]-d-Phe1,Tyr3-octreotate) PET, toto vyšetření však v České republice zatím není dostupné. Naproti tomu špatně diferencované nádory nemají somatostatinové receptory, ale dobře kumulují radioaktivně značenou glukózu.
Klasifikace
Úl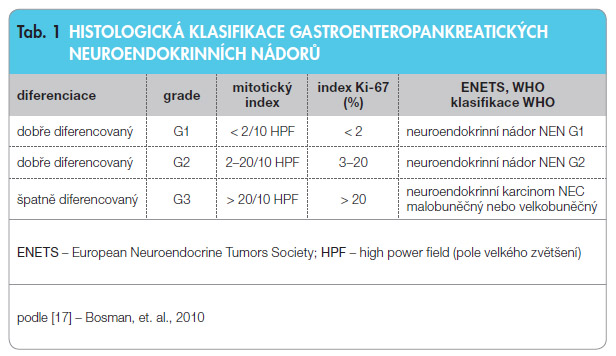 oha patologa v diagnostice NEN je zcela zásadní. Pokud jsou NEN odečítány na pracovištích, která s nimi nemají dostatečnou zkušenost, je vhodné provedení druhého čtení zkušeným specializovaným patologem.
oha patologa v diagnostice NEN je zcela zásadní. Pokud jsou NEN odečítány na pracovištích, která s nimi nemají dostatečnou zkušenost, je vhodné provedení druhého čtení zkušeným specializovaným patologem.
Při histopatologickém vyšetření je zásadní imunohistochemický průkaz synaptofyzinu (membránového glykoproteinu presynaptických vezikul) a/nebo CgA, eventuálně i hormonálního produktu v nádoru. Nezbytné je stanovení proliferačního indexu (tj. počtu buněk v buněčném cyklu), který se vyjadřuje procentuálně prostřednictvím Ki-67 (antigen vázaný na jádra buněk v buněčném cyklu) a je stanovován použitím MIB (monoklonální protilátka detekující Ki-67) v oblastech hot-spots nádoru, a stanovení počtu mitóz na 10 HPF (high power field – pole velkého zvětšení, tzn. počet mitóz na 10 zorných polí při velkém zvětšení). Podle těchto dvou kritérií se NEN gastroenteropankreatické (GEP) nově dělí na neuroendokrinní nádory dobře diferen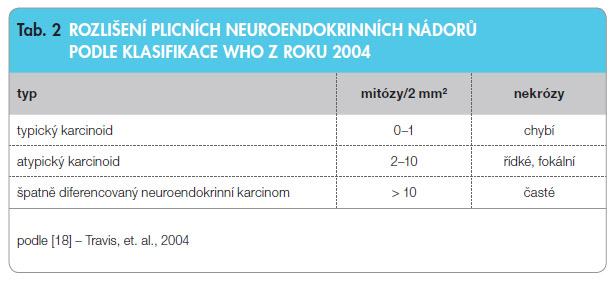 cované G1, neuroendokrinní nádory dobře diferencované G2 a neuroendokrinní karcinomy G3 malobuněčné nebo velkobuněčné, viz tab. 1.
cované G1, neuroendokrinní nádory dobře diferencované G2 a neuroendokrinní karcinomy G3 malobuněčné nebo velkobuněčné, viz tab. 1.
Plicní NEN se klasifikují jako typický karcinoid (G1), atypický karcinoid (G2) a velkobuněčný nebo malobuněčný neuroendokrinní karcinom (G3), viz tab. 2. Toto rozdělení není akademické, ale má i zásadní význam pro kliniky s ohledem na volbu následných vyšetřovacích a terapeutických postupů.
Terapie
Léčba špatně diferencovaných neuroendokrinních karcinomů malobuněčných a velkobuněčných, ať již jsou nalezeny v jakékoliv lokalizaci, má těžiště v chemoterapii, která je založena na platinových derivátech, analogicky s malobuněčným plicním karcinomem, jemuž se svým biologickým chováním často podobají. Proto je nutno je přísně odlišovat od dobře diferencovaných NEN. Následující text se bude týkat dobře diferencovaných NEN G1 a G2. NEN G1 a G2 v gastroenteropankreatické i plicní lokalizaci se léčí primárně chirurgickým odstraněním. Rozsah výkonu je určen rozsahem nádorového postižení a stupněm diferenciace nádoru. Dosud neexistují žádná data, která by podporovala po radikálním chirurgickém výkonu podávání adjuvantní terapie jakéhokoliv typu.
Pokročilé NEN G1 a G2 mohou být léčeny jedním z následujících způsobů. Není výjimkou, že v rámci několikaletého průběhu nádorového onemocnění je sekvenčně, někdy i konkomitantně, využito více léčebných modalit.
Lokální metody u nemocných s dominantním jaterním postižením
Ve vybraných situacích se doporučuje paliativní chirurgická resekce jaterních metastáz, která zmenší nádorovou nálož, a tím sníží i intenzitu symptomů vyvolávaných nádorem.U mladých nemocných s mnohočetnými jaterními metastázami bez extrahepatálního postižení lze uvažovat i o transplantaci jater [2].U nemocných s jaterními metastázami, které nejsou vhodné pro chirurgickou resekci, se častěji používá paliativní embolizace a. hepatica. Chemoembolizace s cytostatiky nepřináší oproti prosté embolizaci žádné další výhody. Při embolizaci funkčních nádorů je nutné preventivně zabránit akcentaci syndromů následkem vyplavování působků při rozpadu nádorových buněk. U karcinoidu by například mohla masivním vyplavením serotoninu vzniknout karcinoidová krize s orgánovým selháváním. Prevence spočívá v podávání krátkodobých analog somatostatinu. Krize se může rozvinout třeba až za týden po provedeném výkonu.V poslední době je u nemocných s pokročilými NEN dosahováno slibných výsledků radioembolizací yttriovými mikrosférami [3, 4].Randomizované studie porovnávající účinnost jednotlivých lokálních metod při terapii jaterního postižení NEN nebyly dosud provedeny.
Somatostatinová analoga
Somatostatin je endogenní inhibitor žlázové a endokrinní sekrece. Inhibuje uvolňování pituitárních hormonů a gastrointestinálních hormonů (např. inzulinu, gastrinu, serotoninu) a uvolňování amylázy z pankreatických acinárních buněk. Kromě antisekretorického účinku předpokládají preklinické studie u somatostatinu ještě působení antiproliferační, proapoptotické a antiangiogenní. Účinek somatostatinu je zprostředkován pomocí pěti typů somatostatinových receptorů (SSTR1–5), a je tedy tkáňově specifický. NEN mají většinou velmi dobře vyjádřené somatostatinové receptory, i když zastoupení jednotlivých subtypů může být různé. U funkčních nádorů je pro inhibici hormonální sekrece nejdůležitější zastoupení receptorů SSTR2 a SSTR5.
Somatostatinová analoga ve většině případů dobře kontrolují karcinoidový syndrom i jiné hormonální syndromy u funkčních NEN. Jde o cílenou léčbu, vazbou na SSTR snižují tyto látky uvolňování bioaktivních peptidů a aminů buňkou.
Somatostatinový analog oktreotid má delší biologický poločas eliminace než somatostatin, váže se na receptory SSTR2, 3, 5 a vyrábí se ve formě, která se uvolňuje bezprostředně po podání a v tzv. prodloužené (LAR, long-acting release) formě. Většinou se LAR forma podává 1krát za čtyři týdny, forma s bezprostředním uvolňováním slouží jako záchrana při nedostatečném působení LAR formy nebo při karcinoidové krizi [5].
Další analog somatostatinu lanreotid má podobný receptorový profil jako oktreotid a obvykle se rovněž podává 1krát za čtyři týdny. V komparativní studii prokázala obě analoga podobnou účinnost při kontrole symptomů [6].
Antiproliferační účinek oktreotidu u midgut (nádor středního střeva podle lokalizace vyplývající z embryonálních vztahů) nádorů funkčních i nefunkčních potvrdila v klinické studii fáze III PROMID v roce 2009 Rinke a kol. [7]. Nejlepší účinek oktreotidu byl zaznamenán u nádorů s metastatickou náloží v játrech postihující maximálně 10 % parenchymu. Otázkou zůstává, zda léčba oktreotidem má být zahájena hned po stanovení diagnózy, nebo až při progresi choroby. Antiproliferační působení této látky u nádorů v jiné lokalizaci (hrudník, pankreas, rektum) není dosud prokázáno.
Antiproliferační účinek lanreotidu u nefunkčních karcinoidů a pankreatických nádorů je nyní zkoumán v radomizované studii fáze III Clarinet. Výsledky této studie budou k dispozici příští rok.
Ve vývoji je několik nových somatostatinových analog, včetně subtypově specifických, bispecifických, panreceptorových agonistů, nepeptidových analog a hybridních sloučenin somatostatin/dopamin. Pasireotid (SOM 230) je panreceptorový agonista, který se váže na SSTR1–3 a na SSTR5. S pasireotidem probíhají studie hodnotící účinnost léčby u funkčních syndromů i antiproliferační účinnost pasireotidu.
Radioterapie cílená na peptidové receptory (PRRT)
Přítomnosti somatostatinových receptorů v NEN lze využít k cílené radioterapii. Otevřený zářič je navázán na analog somatostatinu, který po nitrožilním podání do organismu specificky ozáří pouze nádorovou tkáň. Nejčastěji se používá 90Y a 177Lu. Tento typ léčby u nás není dostupný, nejbližší pracoviště aplikující tuto léčbu jsou v Německu (Bad Berka) a v Nizozemsku. Radioizotopovou léčbou lze dosáhnout velmi pěkných paliativních účinků ve smyslu ústupu syndromů u funkčních nádorů i ve smyslu zmenšení nádorové nálože. Co se týká pozdních nežádoucích účinků PRRT, jsou zprávy o renální dysfunkci, pancytopenii a myelodysplazii [8, 9]. Tato metoda se jeví jako velmi slibná, bohužel však dosud nejsou k dispozici žádné prospektivní randomizované studie, které by zhodnotily protinádorovou aktivitu a dlouhodobé nežádoucí účinky PRRT.
Interferon alfa
Interferon alfa (IFN-α) se používá v léčbě NEN již několik dekád. IFN-α 2a a IFN-α 2b se vážou na specifické interferonové receptory buněk NEN a tím potenciálně mění genovou transkripci, inhibují syntézu proteinů a ovlivňují degradaci peptidových hormonů [10]. V Evropě je IFN-α registrován pro terapii karcinoidového syndromu u midgut nádorů, v USA registrován není. Monoterapií IFN-α je možné kontrolovat karcinoidový syndrom a vyvolat biochemickou odpověď (tj. snížení odpadu HIAA v moči a pokles sérové koncentrace CgA) u 30–35 % nemocných [10]. Vzhledem k toxickému profilu a dlouhodobému podávání v případě NEN není IFN-α vhodný pro první linii léčby.
Podobně jako u oktreotidu se i u IFN-α spekuluje o jeho antiproliferačním účinku. Postavení IFN-α v léčbě NEN je poněkud kontroverzní, většinou se podává až po selhání somatostatinových analog.V současné době probíhá v USA velká randomizovaná studie SWOG porovnávající účinnost IFN-α a bevacizumabu.
Cytotoxická léčba
Účinnost cytotoxické léčby závisí jednak na proliferační aktivitě nádoru, jednak na jeho lokalizaci. Chemoterapie má větší naději na odpověď u NEN s proliferačním indexem Ki-67 vyšším než 10 %, tedy spíše u středně diferencovaných G2 NEN. U midgut NEN a typického karcinoidu plicního je účinek chemoterapie minimální. Ve většině případů je v klinických studiích zkoušen streptozotocin (u nás nemá registraci), dakarbazin a temozolomid (pro tuto indikaci u nás není registrován).
Na rozdíl od NEN jiných lokalizací odpovídají pankreatické nádory většinou na chemoterapii na bázi streptozotocinu a temozolomidu. Kombinací streptozotocin, doxorubicin a fluorouracil bylo v retrospektivní analýze 84 nemocných dosaženo 39 % objektivních odpovědí. Režim je však náročný a je třeba brát v úvahu nefrotoxicitu streptozotocinu [12]. Z tohoto hlediska se jeví jako výhodnější kombinace s perorálním temozolomidem, jehož toxický profil je příznivější. Nejlepší výsledky byly pozorovány v kombinaci kapecitabin (750 mg/m2 2krát denně v den 1–14) a temozolomid (200 mg/m2 denně v den 10–14). V retrospektivním sledování 30 nemocných bylo popsáno 70 % objektivních odpovědí nádoru na léčbu touto kombinací [13]. Optimální dávkování temozolomidu u pankreatických NEN bude předmětem nových klinických studií.
Cílená molekulární léčba
Cílená terapie se zaměřuje hlavně na transdukční kaskádu, která spouští po vazbě VEGF (vascular endothelial growth factor, vaskulární endotelový růstový faktor) na receptor VEGF (VEGFR) a mTOR (mammalian target of rapamycin) metabolickou cestu. Stejně jako chemoterapie je i cílená molekulární léčba úspěšnější u pankreatických NEN. Neuroendokrinní nádory jsou velmi vaskularizované se zvýšenou regulací VEGF a VGFR (VEGFR-1). Exprese VEGF koreluje u tzv. low grade (nádory s nízkým stupněm malignity) NEN s angiogenezí, metastazováním a kratším intervalem do progrese onemocnění. K inhibici této metabolické cesty jsou zkoušeny tyrozinkinázové inhibitory (TKI), sorafenib, sunitinib a pazopanib, a monoklonální protilátka bevacizumab.
Důležitou křižovatkou metabolických cest několika proliferačních faktorů, která navíc ovlivňuje metabolismus a angi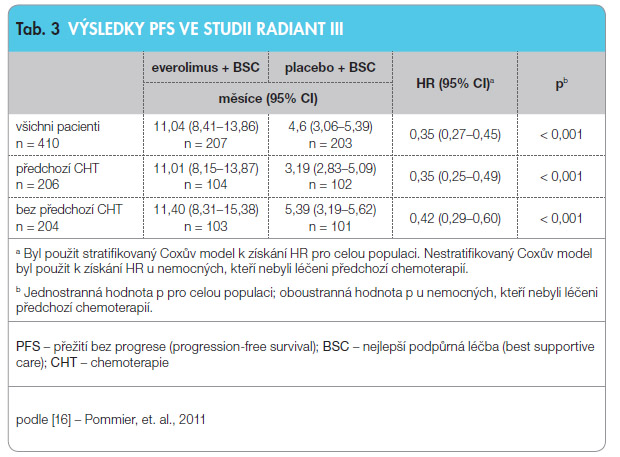 ogenezi, je mTOR. V této indikaci bylo provedeno několik studií všech fází s everolimem. Po slibných výsledcích studie fáze II Radiant I u pankreatických NEN byly zveřejněny výsledky studie Radiant III porovnávající účinnost everolimu a placeba u pacientů s progredujícím pankreatickým NEN, z nichž polovina již byla předléčena analogy somatostatinu, chemoterapií i jinými metodami. V obou ramenech studie bylo zařazeno celkem 410 nemocných. Bylo dosaženo času do progrese 11,4 měsíce vs. 5,4 měsíce ve prospěch everolimu dle investigátorů a 11,0 vs. 4,6 měsíce ve prospěch everolimu při centrálním hodnocení, viz tab. 3. Po 18 měsících bylo 34 % pacientů užívajících everolimus bez progrese onemocnění (vs. 9 % v placebové větvi). V době analýzy uskutečněné do února 2011 (tzv. cut-off) byl medián OS (celkové přežívání, overall survival) 36,6 měsíce v placebové větvi, ve větvi s everolimem mediánu nebylo dosaženo (HR = 0,89, 95% CI: 0,64–1,23) [14].
ogenezi, je mTOR. V této indikaci bylo provedeno několik studií všech fází s everolimem. Po slibných výsledcích studie fáze II Radiant I u pankreatických NEN byly zveřejněny výsledky studie Radiant III porovnávající účinnost everolimu a placeba u pacientů s progredujícím pankreatickým NEN, z nichž polovina již byla předléčena analogy somatostatinu, chemoterapií i jinými metodami. V obou ramenech studie bylo zařazeno celkem 410 nemocných. Bylo dosaženo času do progrese 11,4 měsíce vs. 5,4 měsíce ve prospěch everolimu dle investigátorů a 11,0 vs. 4,6 měsíce ve prospěch everolimu při centrálním hodnocení, viz tab. 3. Po 18 měsících bylo 34 % pacientů užívajících everolimus bez progrese onemocnění (vs. 9 % v placebové větvi). V době analýzy uskutečněné do února 2011 (tzv. cut-off) byl medián OS (celkové přežívání, overall survival) 36,6 měsíce v placebové větvi, ve větvi s everolimem mediánu nebylo dosaženo (HR = 0,89, 95% CI: 0,64–1,23) [14].
Everolimus je pro léčbu pankreatických NEN kategorizován i v České republice. Od 1. 2. 2013 mají úhradový dodatek čtyři onkologická pracoviště – VFN Praha, MOÚ Brno, FN Hradec Králové a FN Olomouc.
Aktuální indikační omezení úhrady SÚKL do 1. 11. 2014 určuje everolimus k léčbě neresekovatelných nebo metastazujících pankreatických neuroendokrinních tumorů s progresí během předchozích 12 měsíců v indikaci a) hormonálně nefunkčních dobře diferencovaných tumorů po selhání IFN-α; b) hormonálně nefunkčních středně diferencovaných tumorů. Pacienti musejí mít výkonnostní stav dle ECOG/WHO (the Eastern Cooperative Oncology Group/World Health Organization) nejvýše stupně 2; nesmějí prodělat arteriální embolizaci v játrech v předchozích šesti měsících, kryoablaci nebo radiofrekvenční ablaci hepatální metastázy v předchozích dvou měsících nebo být dlouhodobě léčeni kortikoidy či jinými imunosupresivy. Léčba je ukončena, pokud je radiologicky dokumentována další progrese cílových lézí podle kritérií RECIST (Response Evaluation Criteria In Solid Tumors).
Indikační omezení na nefunkční nádory G1 po selhání léčby IFN-α je přitom zjevným nesmyslem, protože IFN-α tuto indikaci vůbec nemá. Rovněž byl opakovaně popsán pozitivní vliv everolimu na protrahované hypoglykemické stavy u inzulinomů.
Na podkladě výsledků preklinického hodnocení a studií fáze I a II se sunitinibem byla provedena multinacionální randomizovaná dvojitě slepá studie kontrolovaná placebem fáze III, jejíž výsledky publikoval Raymond a kol. Do studie bylo zařazeno 171 nemocných s dobře diferencovanými maligními pankreatickými NEN progredujícími v posledních 12 měsících. Pacienti byli randomizováni k léčbě sunitinibem v dávce 37,5 mg denně (86 nemocných) a k podávání placeba [15]. Primární cíl studie – PFS (přežití bez progrese, progression-free survival) – byl signifikantně delší ve větvi se sunitinibem (11,4 měsíce) oproti placebu (5,5 měsíce). PFS byl navíc podobně prodloužen ve všech podskupinách, bez ohledu na předchozí léčbu somatostatinovými analogy nebo na podávání chemoterapie. Léčebná odpověď (ORR, objective response rate) byla 9 % vs. 0 %. Kvalita života hodnocená z dotazníků EORTC QLQ-30 neprokázala statisticky významný rozdíl mezi oběma skupinami. Prodloužení celkového přežití studie neprokázala [15].
K terapii pankreatických NEN byl již na podkladě výsledků této klinické studie fáze III registrován v USA i v Evropě také sunitinib. V České republice však dosud není kategorizován, nemocní k němu mají přístup pouze prostřednictvím klinické studie ve VFN v Praze a v MOÚ v Brně. Pro jiné než pankreatické lokalizace NEN je biologická léčba obecně doporučována pouze v rámci klinických studií.
Nové možnosti
Ve stadiu klinického hodnocení se nacházejí kombinace everolimus + bevacizumab, everolimus + temozolomid a everolimus + pasireotid. Probíhají i pilotní studie s inhibitory dalších cílových struktur, jako je PI3K (fosfatidylinositol 3-kináza), AKT (proteinkináza B) a TORC1 (target of rapamycin complex 1).
Závěr
Neuroendokrinní nádory jsou fascinující skupinou nádorů s velmi odlišnými vlastnostmi. Současné pokroky v terapii některých z nich nelze obecně přenášet na jiné skupiny NEN. Důležitá je proto co nejdokonalejší diagnostika, která umožní správnou indikaci určitého typu léčby. Nemalou roli hraje rovněž zkušenost lékaře. Kooperativní skupina pro NEN (www.neuroendokrinni-nadory.cz) je kdykoliv připravena přispět radou i pomocí.
Seznam použité literatury
- [1] Zamrazil V. Neuroendokrinní systém a jeho význam. Neuroendokrinní tumory. Postgraduální medicína 2010, 12: 620–626.
- [2] Le Treut YP, Delpero JR, Dousset B, et al. Results of liver transplantation in the treatment of metastatic neuroendocrine tumors. A 31-case French multicentric report. Ann Surg 1997; 225: 355–364.
- [3] Kennedy AS, Dezarn WA, McNeillie P, et al. Radioembolization for unresectable neuroendocrine hepatic metastases using resin 90Y-microspheres: early results in 148 patients. Am J Clin Oncol 2008; 31: 271–279.
- [4] King J, Quinn R, Glenn DM, et al. Radioembolization with selective internal radiation microspheres for neuroendocrine liver metastases. Cancer 2008; 113: 921–929.
- [5] Modlin IM, Pavel M, Kidd M, Gustafsson BI. Review article: somatostatin analogues in the treatment of gastroenteropancreatic neuroendocrine (carcinoid) tumours. Aliment Pharmacol Ther 2010; 31: 169–188.
- [6] O’Toole D, Ducreux M, Bommelaer G, et al. Treatment of carcinoid syndrome: a prospective crossover evaluation of lanreotide versus octreotide in terms of efficacy, patient acceptability, and tolerance. Cancer 2000; 88: 770–776.
- [7] Rinke A, Müller HH, Schade-Brittinger C, et al. Placebo-controlled, double blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors: a report from the PROMID Study Group. J Clin Oncol 2009; 27: 4656–4663.
- [8] Kwekkeboom DJ, de Herder WW, Kam BL, et al. Treatment with the radiolabeled somatostatin analog [177Lu-DOTA 0, Tyr3]octreotate: toxicity, efficacy, and survival. J Clin Oncol 2008; 26: 2124–2130.
- [9] Bushnell DL Jr, O’Dorisio TM, O’Dorisio MS, et al. 90Y-edotreotide for metastatic carcinoid refractory to octreotide. J Clin Oncol 2010; 28: 1652–1659.
- [10] Oberg K. The action of interferon alpha on human carcinoid tumours. Semin Cancer Biol 1992; 3: 35–41.
- [11] Boudreaux JP, Klimstra DS, Hassan MM, et al. The NANETS consensus guideline for the diagnosis and management of neuroendocrine tumors: well-differentiated neuroendocrine tumors of the Jejunum, Ileum, Appendix, and Cecum. Pancreas 2010; 39: 753–766.
- [12] Kouvaraki MA, Ajani JA, Hoff P, et al. Fluorouracil, doxorubicin, and streptozocin in the treatment of patients with locally advanced and metastatic pancreatic endocrine carcinomas. J Clin Oncol 2004; 22: 4762–4771.
- [13] Strosberg JR, Fine RL, Choi J, et al. First-line chemotherapy with capecitabine and temozolomide in patients with metastatic pancreatic endocrine carcinomas. Cancer 2010; 117: 268–275.
- [14] Yao JC, Shah MH, Ito T, et al. Everolimus for advanced pancreatic neuroendocrine tumors. N Engl J Med 2011; 364: 514–523.
- [15] Raymond E, Dahan L, Raoul JL, et al. Sunitinib malate for the treatment of pancreatic neuroendocrine tumors. N Engl J Med 2011; 364: 501–513.
- [16] Pommier R, Wolin E, Panneerselvam A, et al. ASCO 2011. Chicago, IL. Abstract 4103.
- [17] Bosman F, Carneiro FT, Hrubon RH, et al. World Health Organization Classification of Tumours, Pathology and Genetics of Tumours of the Digestive Systém. IARC Press. Lyon, France 2010.
- [18] Travis WD, Brambilla E, Muller-Hermelink HK, Harris CC. Pathology and Genetics of Tumours of the Lung, Pleura, Thymus and Heart. IARC Press. Lyon, France 2004. World Health Organization Classification of Tumours; vol 10.