Specifika farmakoterapie diabetu v dětském věku
Terapie diabetu u dětí a adolescentů vyžaduje specifické přístupy přizpůsobené potřebám rostoucího organismu. Dětský diabetes již dávno automaticky neznamená diabetes 1. typu (DM1). Ten sice stále představuje nejčastější typ (přibližně 95 % případů), nicméně přesnější genetická diagnostika potvrzuje výskyt monogenních forem u 3–4 % dětí mladších 18 let, což je rozhodně více, než bylo odhadováno před několika lety. Výskyt diabetu 2. typu (DM2) se liší mezi jednotlivými etniky a populacemi, u Evropanů kavkazského etnika je výskyt DM2 u dětí stále pouze okolo 1 %, u Asiatů či Afroameričanů jsou však tato čísla mnohonásobně vyšší, a to při stejném BMI. Proporce mezi jednotlivými typy se mění podle věku při manifestaci. Do věku šesti měsíců se prakticky vždy jedná o monogenní typ diabetu, poté již dominuje DM1. Pro terapii DM1 a monogenních forem využíváme všechny prostředky známé z farmakoterapie diabetu u dospělých, rozdíl je v dávkování a účinnosti jednotlivých typů léčby. V léčbě DM2 se jako nejefektivnější jeví vyšší dávky metforminu, v případě nedostatečné reakce přecházíme neprodleně na léčbu inzulinem.
Novorozenecký diabetes
Novorozenecký a časně kojenecký věk je z diabetologického hlediska naprosto unikátním obdobím charakterizovaným monogenní etiologií prakticky všech případů [1]. Proto byla pro manifestaci novorozeneckého diabetu stanovena věková hranice šesti měsíců, která přesahuje období klasicky označované jako novorozenecké (tedy 28 dní věku). Jedná se o vzácné onemocnění s incidencí přibližně 1 : 200 000 [2].
V současné době je známo více než 20 genů, jejichž mutace způsobují novorozenecký diabetes. Nejčastějšími z nich jsou geny KCNJ11 a ABCC8 kódující Kir6.2, respektive SUR1 podjednotky kaliového kanálu beta-buňky [1]. Před zahájením léčby je nezbytné prokázat molekulárněgenetickou podstatu diabetu a na základě toho rozhodnout o adekvátní terapii. V případě mutací v některé z podjednotek KATP kanálu jsou léčivy první volby antidiabetika ze skupiny derivátů sulfonylurey (nejvíce zkušeností je s glibenklamidem a gliklazidem), většina dětí na tuto terapii zareaguje vyplavením inzulinu s následnou korekcí hyperglykemie. Přechod z terapie inzulinem na léčbu deriváty sulfonylurey je možný v jakémkoli věku, citlivost beta-buněk na tuto léčbu přetrvává i po dlouhodobé inzulinoterapii. Děti s nejtěžšími mutacemi KATP kanálu na tuto terapii nereagují a je třeba u nich zahájit podávání inzulinu.
Část dětí s novorozeneckým diabetem má navíc závažné neurologické příznaky (opožďování psychomotorického vývoje, epilepsie). Tento stav označujeme jako DEND syndrom (z anglického Developmental Delay, Epilepsy, Neonatal Diabetes) [3]. Tyto děti většinou na léčbu perorálními antidiabetiky typicky nereagují, léčíme je proto inzulinem [4]. Několik kazuistik však doložilo parciální zlepšení psychomotorického vývoje u dětí s neurologickým deficitem, ale bez přítomnosti epilepsie [5]. Tento stav nazýváme i-DEND (intermediate DEND). V terapii využíváme kombinace inzulinu a vysokých dávek derivátů sulfonylurey. Efektivitu perorální terapie je třeba kriticky zhodnotit ve spolupráci s dětským neurologem v prvních letech života.
Pokud diagnostikujeme vzácnější mutace jiných genů způsobujících novorozenecký diabetes, například genu pro inzulin, zahajujeme okamžitě terapii inzulinem. Obecně pro novorozence platí, že nejčastěji využíváme depotní inzulinová analoga, po zvýšení množství sacharidů ve stravě přidáváme standardně rychlé inzuliny preprandiálně. Vhodnou alternativou je léčba inzulinovou pumpou, jejíž výhodou je možnost flexibilnější aplikace inzulinu podle množství a času přijatých sacharidů.
Období batolecí a předškolní věk
Pokud se diabetes manifestuje ve druhém půlroce života a později, jedná se nejčastěji o DM1. Jeho terapie může být poměrně svízelná vzhledem k tomu, že tyto děti mají velmi dobrou citlivost na inzulin, a tedy tendenci ke zvýšené labilitě glykemických profilů s obtížně predikovatelnými, ale o to výraznějšími výkyvy glykemií. Dalším komplikujícím faktorem pro dosažení uspokojivé kontroly diabetu u některých dětí je variabilita příjmu sacharidů v jednotlivých dnech. Zejména u dětí mladších tří let je skutečně velmi obtížné odhadnout množství sacharidů, které dítě opravdu zkonzumuje a které je třeba pokrýt inzulinem. Proto je někdy nutné inzulin aplikovat postprandiálně s vědomím rizika tranzientních hyperglykemií. U dětí s obtížně dosažitelnou pravidelností v jídle může někdy pomoci inzulinová pumpa; v některých zemích patří manifestace diabetu v předškolním věku mezi uznané indikace léčby pumpou [6].
Není bez zajímavosti, že v předškolním věku dochází nejčastěji k sérokonverzi protilátek specifických pro diabetes (podle nedávno publikované německé prospektivní studie je medián první detekce protilátek 2 roky) [7]. O tom, zda a v jakém věku dojde k manifestaci diabetu, rozhoduje genetické vybavení jedince, počet pozitivních autoprotilátek, jejich titr, a samozřejmě též dosud ne zcela uspokojivě probádané vlivy zevního prostředí.
Období pubertální
Puberta a adolescence jsou obdobími, kdy často dochází ke zhoršení kompenzace DM1 – často se zvyšuje hodnota glykovaného hemoglobinu (HbA1c), narůstá variabilita glykemií, objevují se první známky pozdních komplikací, současně roste riziko rozvoje diabetické ketoacidózy a těžkých hypoglykemií. Zatímco v předpubertálním věku je HbA1c relativně stabilní, u dívek okolo jedenáctého roku a u chlapců o něco později dochází ke vzestupu hladiny HbA1c nezřídka i o více než 10 mmol/mol, přibližně po šestnáctém roce věku začíná opětný pokles, viz [8]. Jde samozřejmě o průměrná čísla, řada dětí projde pubertou z diabetologického hlediska naprosto bez problémů. Mezi základní příčiny uvedeného nepříznivého jevu patří:
- fyziologické (hormonální) změny,
- zvýšená potřeba inzulinu (inzulinová rezistence),
- zvýšený příjem sacharidů (hyperfagie),
- psychické a sociální faktory.
V důsledku zvýšené inzulinové rezistence je puberta obdobím, kdy se mohou manifestovat monogenní typy diabetu, pro které je typická relativní inzulinopenie v důsledku dysfunkce beta-buněk (děti s absolutní inzulinopenií se zachytí již v novorozeneckém období). Jedná se nejčastěji o MODY3 a MODY1 (Maturity Onset Diabetes of the Young), které jsou způsobeny mutacemi genů HNF1A a HNF4A a někdy je označujeme jako tzv. diabety transkripčních faktorů [9].
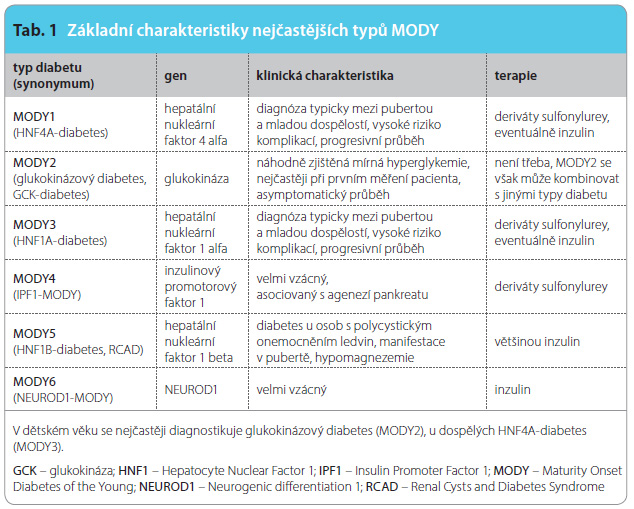
Na tyto formy diabetu bychom měli pomýšlet v případě pozitivní rodinné anamnézy (výskyt diabetu manifestovaného do věku 40 let alespoň ve třech generacích), nepřítomnosti autoprotilátek specifických pro DM1 a při absenci diabetické ketoacidózy při záchytu onemocnění. Správné stanovení etiologické diagnózy je důležité pro zahájení adekvátní terapie. Léčivem první volby pro pacienty s MODY3 a MODY1 jsou opět deriváty sulfonylurey, na které příznivě reaguje přibližně 80 % osob s těmito typy diabetu [10]. Není výjimkou, že diagnóza MODY u adolescenta umožní změnit terapii i u ostatních členů rodiny. Léčbu inzulinem je možné změnit na perorální i po desetiletích inzulinoterapie. Nejčastější formy monogenního diabetu shrnuje tab. 1.
Dávkování inzulinu u dětí
Denní potřeba inzulinu u dětí s DM1 se mění v závislosti na věku a délce trvání onemocnění. V období postiniciální remise a v prvních letech po manifestaci většinou stačí dávka 0,5 jednotky/kg/den, někdy i méně. V dalších letech se běžná denní potřeba inzulinu u prepubertálních dětí pohybuje okolo 0,7 jednotky/kg, v pubertě stoupá na 1,0–1,5 jednotky/kg, tedy na absolutně nejvyšší hodnoty, což se děje v důsledku snížené inzulinové senzitivity a typické pubertální hyperfagie [11]. Některé zdroje uvádějí potřebu inzulinu v pubertě až 2,0 jednotky/kg, tato dávka však jistě vede k neakceptovatelnému riziku zvyšování hmotnosti. Vyšší dávky inzulinu bývají nezbytné pro udržení adekvátní kontroly DM1 u pubertálních dívek, u chlapců jsou v průměru lehce nižší.
Přínos moderních technologií pro terapii DM1 u dětí
Prudký rozvoj moderních technologií v terapii diabetu začal koncem minulého století rutinním využíváním inzulinových pump, na které v posledních deseti letech navázaly kontinuální monitory glykemie; je pravděpodobné, že započatý vývoj bude pokračovat postupným spojováním těchto dvou modalit do uzavřeného okruhu kontinuální monitor glykemie – inzulinová pumpa. Pokud by se taková technologie ukázala jako funkční, spolehlivá a bezpečná, způsobilo by to naprostý převrat v léčbě diabetu nejen u dětí, protože by odpadla nutnost striktního dodržování diabetické diety a režimu, ale stačilo by (zjednodušeně) nastavit glykemii, na které chceme pacienta udržovat. V současné době se poměrně úspěšně testuje tento systém již mimo zdravotnická zařízení, nicméně stále v rámci klinických studií.
Obliba inzulinových pump v posledním desetiletí výrazně stoupla u lékařů i pacientů. Například recentní data z Dánska ukazují zvýšení podílu dětí využívajících inzulinovou pumpu z 5 % na 50 % za posledních deset let [12]. Efektivita této léčby je u dětí o něco nižší než u dospělých, což je dáno zejména užším výběrem vhodných kandidátů v období puberty, kdy je obtížné tyto děti motivovat k aktivnímu přístupu k terapii. Výsledky studií zacílených na účinnost inzulinových pump v pediatrii se liší podle designu. Zatímco observační studie ve své většině popisují zlepšení parametrů kompenzace po zahájení terapie inzulinovou pumpou (snížení hodnoty HbA1c, snížení incidence těžkých hypoglykemií) [12, 13], randomizované prospektivní studie jsou ve svých výsledcích nejednoznačné [14]. Zdá se, že klíčový je výběr vhodných pacientů pro tuto terapii, která pro dosažení maximálního efektu vyžaduje aktivní přístup dětí či rodičů. Zásadní roli zde hraje poučení o správných postupech při úpravách dávkování inzulinu.
Nejvýraznější technologickou změnou v diabetologii posledních let jsou bezesporu kontinuální monitory glykemie, které umožňují detekovat koncentrace glukózy v mezibuněčné tekutině v reálném čase. Jejich používání u diabetických dětí i dospělých vede ke zlepšení kompenzace diabetu, snížení hladin HbA1c, ke zlepšení detekce hypoglykemií (zejména nočních) doprovázenému snížením frekvence těžkých hypoglykemií a ke stabilizaci glykemických profilů (zkrácení doby v hyperglykemii i hypoglykemii) [15, 16]. Nejvyššího efektu je dosaženo při frekventním používání senzorů a za využití inzulinových pump vyšší kategorie umožňujících automatické vypnutí dodávky inzulinu (low-glucose suspend) v případě detekce nerozpoznané hypoglykemie [17].
Diabetes 2. typu u dětí
Terapeutická doporučení vycházejí ze současných doporučení Mezinárodní společnosti pro dětskou a adolescentní diabetologii (International Society for Pediatric and Adolescent Diabetes, ISPAD) [18]. Při zahájení terapie je nezbytné provést správnou diferenciální diagnostiku mezi jinými typy diabetu, tedy zejména rozlišit mezi DM1 a monogenním diabetem, což nemusí být vždy jednoduché. Pro rozlišení mezi DM1 a DM2 je nejdůležitější vyšetření autoprotilátek specifických pro diabetes, např. anti-GAD (protilátky proti dekarboxyláze glutamové kyseliny), anti-IA2 (protilátky proti tyrozinfosfatáze), protilátky proti inzulinu. Jejich negativní nález zvyšuje pravděpodobnost, že se skutečně jedná o DM2. Jsou-li protilátky pozitivní, jde nejspíše o DM1, nicméně je dobré mít na paměti, že existují přechodné typy, někdy označované též jako „double diabetes“ či „diabetes 1,5“, které sdružují základní klinické znaky obou nejčastějších typů diabetu [19]. Pro monogenní diabetes svědčí kromě absence autoprotilátek též pozitivní rodinná anamnéza diabetu alespoň ve třech generacích, i zde je však třeba zohlednit možnost mutace de novo [20]. Metodou volby při terapii DM2 u adolescentů je metformin v dávce postupně stoupající až na 2–2,5 g denně. Pokud nedojde ke zlepšení kontroly diabetu na doporučené hodnoty (HbA1c < 53 mmol/mol), zahajujeme terapii inzulinem, nejčastěji pomocí intenzifikovaného inzulinového režimu [18, 21].
Kritéria kompenzace diabetu u dětí
Cíle léčby a kritéria kompenzace jsou součástí standardů péče o pacienty s DM1 České diabetologické společnosti a vycházejí z posledního doporučení ISPAD, viz tab. 2 [22, 23]. Ve srovnání s cíli a kritérii používanými u dospělých vidíme některé rozdíly ve výši glykemií i v hodnotě HbA1c. Obecně jsou kritéria u dětí o něco mírnější. K tomu bylo přistoupeno jednak k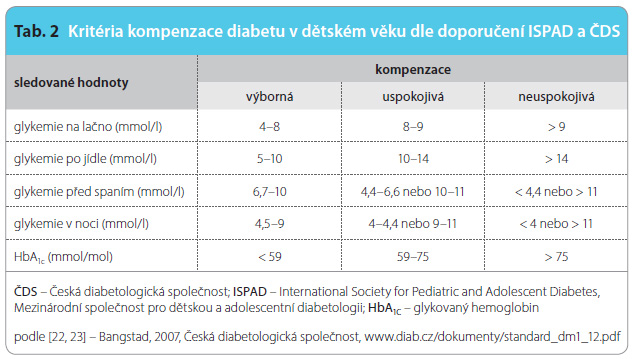 vůli zvýšenému riziku těžkých hypoglykemií, které mají závažnější důsledky pro vyvíjející se mozkové funkce a struktury [24], jednak proto, že vliv hyperglykemií na riziko pozdních komplikací je před pubertou přibližně poloviční v porovnání s následujícími lety. Novější studie však ukazují, že pro zdravý vývoj mozkových funkcí je velmi rizikové jednak kolísání glykemií z hypo- do hyperglykemických hodnot a jednak též dlouhodobá hyperglykemie [25]. V tomto smyslu by měli být edukováni adolescenti i rodiče diabetických dětí, snaha o co nejstabilnější a přitom co nejnižší glykemie patří k obecným zásadám terapie diabetu bez ohledu na věk.
vůli zvýšenému riziku těžkých hypoglykemií, které mají závažnější důsledky pro vyvíjející se mozkové funkce a struktury [24], jednak proto, že vliv hyperglykemií na riziko pozdních komplikací je před pubertou přibližně poloviční v porovnání s následujícími lety. Novější studie však ukazují, že pro zdravý vývoj mozkových funkcí je velmi rizikové jednak kolísání glykemií z hypo- do hyperglykemických hodnot a jednak též dlouhodobá hyperglykemie [25]. V tomto smyslu by měli být edukováni adolescenti i rodiče diabetických dětí, snaha o co nejstabilnější a přitom co nejnižší glykemie patří k obecným zásadám terapie diabetu bez ohledu na věk.
Optimální kritéria kompenzace d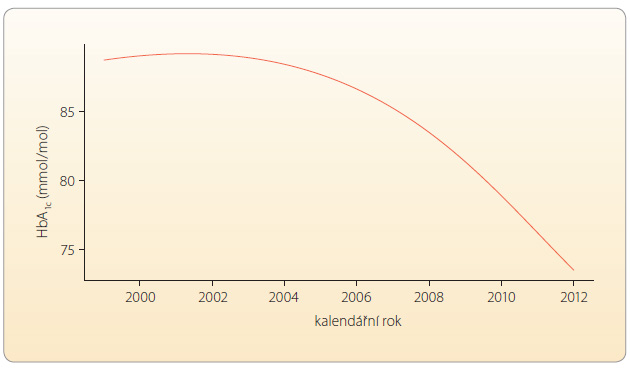 iabetu dlouhodobě splňuje pouze menšina dětí; ve většině center se jedná o čtvrtinu až třetinu dětí [11]. Paradoxně nejlépe se daří naplňovat tato kritéria u
iabetu dlouhodobě splňuje pouze menšina dětí; ve většině center se jedná o čtvrtinu až třetinu dětí [11]. Paradoxně nejlépe se daří naplňovat tato kritéria u ![Graf 1 Změny hodnot HbA1c podle věku dle údajů z německého registru DPV; podle [8] – Gerstl, et al., 2008. DCCT – The Diabetes Control and Complications Trial; HbA1c – glykovaný hemoglobin Graf](https://www.remedia.cz/photo-a-29996---.jpg) předškolních dětí, jistě proto, že jsou celodenně v péči rodičů. Nejobtížnějším obdobím je adolescence, kdy HbA1c výrazně stoupá u obou pohlaví, o něco více u dívek, viz graf 1. Pozitivní trend, k němuž jistě přispívá mj. častější využívání technologií, vidíme v posledních dekádách v postupném zlepšování kontroly diabetu u dětí, viz graf 2 [12]. Prognóza dnešních diabetických dětí je tak pravděpodobně příznivější, než tomu bylo kdykoli dříve.
předškolních dětí, jistě proto, že jsou celodenně v péči rodičů. Nejobtížnějším obdobím je adolescence, kdy HbA1c výrazně stoupá u obou pohlaví, o něco více u dívek, viz graf 1. Pozitivní trend, k němuž jistě přispívá mj. častější využívání technologií, vidíme v posledních dekádách v postupném zlepšování kontroly diabetu u dětí, viz graf 2 [12]. Prognóza dnešních diabetických dětí je tak pravděpodobně příznivější, než tomu bylo kdykoli dříve.
Období přechodu do péče diabetologa pro dospělé
Diabetické dítě je v péči dětského diabetologa většinou do devatenácti let, poté přechází do péče diabetologa pro dospělé. Toto období, které se v anglické literatuře nazývá „transition period“, je do značné míry obtížné, podle některých, zejména amerických studií vede k zásadnímu zhoršení kontroly diabetu v letech následujících po předání [26]. Přesná data o osudu těchto „bývalých“ diabetických dětí u nás prozatím chybějí.
Mezi úskalí tohoto období jistě patří odlišná edukační doporučení používaná u dětí a u dospělých, a to včetně selfmonitoringu (počet testovacích proužků do glukometru se po osmnáctém roce věku snižuje z 1800 na 1000), úprav dávkování inzulinu, dietních opatření apod. Navíc devatenáctiletý jedinec ještě povětšinou není psychicky zralý na samostatný život s diabetem, je třeba, aby mu diabetolog po předání pomáhal o něco intenzivněji, než je běžné u dospělých. Proto je třeba si pro tyto osoby s diabetem vyhradit zejména zpočátku více času, provést novou intenzivní reedukaci, aby se jednoznačně stanovila pravidla a požadavky, které se jistě mohou lišit od těch, jež jsou běžné v pediatrii. Je důležité nepromarnit toto období, kdy jsou mladí dospělí připraveni naslouchat, získávat nové informace a začít tak trochu znovu.
Závěr
Farmakologická i nefarmakologická léčba diabetu v dětství a dospělosti se spíše než výběrem terapeutických možností liší dávkováním léčiv a jejich efektivitou. Zásadně rozdílné je zastoupení jednotlivých typů diabetu. Období přechodu z péče dětského diabetologa do ošetřování specialistou pro dospělé je současně rizikem i šancí. Porozumění období, na které navazujeme, je důležitým předpokladem úspěšného zvládnutí této změny.
Práce vznikla s přispěním koncepční podpory výzkumné organizace MZ ČR č. 000064203, FN v Motole.
Seznam použité literatury
- [1] Ashcroft FM, Rorsman P. K(ATP) channels and islet hormone secretion: new insights and controversies. Nat Rev Endocrinol 2013; 9: 660–669.
- [2] Stanik J, Gasperikova D, Paskova M, et al. Prevalence of permanent neonatal diabetes in Slovakia and successful replacement of insulin with sulfonylurea therapy in KCNJ11 and ABCC8 mutation carriers. J Clin Endocrinol Metab 2007; 92: 1276–1282.
- [3] Gloyn AL, Pearson ER, Antcliff JF, et al. Activating mutations in the gene encoding the ATP-sensitive potassium-channel subunit Kir6.2 and permanent neonatal diabetes. N Engl J Med 2004; 350: 1838–1849.
- [4] Sumnik Z, Kolouskova S, Wales JK, et al. Sulphonylurea treatment does not improve psychomotor development in children with KCNJ11 mutations causing permanent neonatal diabetes mellitus accompanied by developmental delay and epilepsy (DEND syndrome). Diabet Med 2007; 24: 1176–1178.
- [5] Fendler W, Pietrzak I, Brereton MF, et al. Switching to sulphonylureas in children with iDEND syndrome caused by KCNJ11 mutations results in improved cerebellar perfusion. Diabetes Care 2013; 36: 2311–2316.
- [6] Cinek O, Sumnik Z, de Beaufort C, et al. Heterogeneity in the systems of pediatric diabetes care across the European Union. Pediatr Diabetes 2012; 13 (Suppl 16): 5–14.
- [7] Ziegler AG, Rewers M, Simell O, et al. Seroconversion to multiple islet autoantibodies and risk of progression to diabetes in children. JAMA 2013; 309: 2473–2479.
- [8] Gerstl EM, Rabl W, Rosenbauer J, et al. Metabolic control as reflected by HbA1c in children, adolescents and young adults with type-1 diabetes mellitus: combined longitudinal analysis including 27,035 patients from 207 centers in Germany and Austria during the last decade. Eur J Pediatr 2008; 167: 447–453.
- [9] Pruhova S, Ek J, Lebl J, et al. Genetic epidemiology of MODY in the Czech Republic: new mutations in the MODY genes HNF-4alpha, GCK and HNF-1alpha. Diabetologia 2003; 46: 291–295.
- [10] Shepherd M, Shields B, Ellard S, et al. A genetic diagnosis of HNF1A diabetes alters treatment and improves glycaemic control in the majority of insulin-treated patients. Diabet Med 2009; 26: 437–441.
- [11] Holl RW, Swift PG, Mortensen HB, et al. Insulin injection regimens and metabolic control in an international survey of adolescents with type 1 diabetes over 3 years: results from the Hvidore study group. Eur J Pediatr 2003; 162: 22–29.
- [12] Bangstad HJ, Danne T, Deeb LC, et al. Insulin pump treatment; increasing prevalence, and predictors for better metabolic outcome in Danish children and adolescents with type 1 diabetes. Pediatr Diabetes 2014; Jul 31. doi: 10.1111/pedi.12164.
- [13] Blackman SM, Raghinaru D, Adi S, et al. Insulin pump use in young children in the T1D Exchange clinic registry is associated with lower hemoglobin A1c levels than injection therapy. Pediatr Diabetes 2014; Feb 4: doi: 10.1111/pedi.12121.
- [14] Shalitin S, Phillip M. The use of insulin pump therapy in the pediatric age group. Horm Res 2008; 70: 14–21.
- [15] Battelino T, Conget I, Olsen B, et al. The use and efficacy of continuous glucose monitoring in type 1 diabetes treated with insulin pump therapy: a randomised controlled trial. Diabetologia 2012; 55: 3155–3162.
- [16] Szypowska A, Ramotowska A, Dzygalo K, Golicki D. Beneficial effect of real-time continuous glucose monitoring system on glycemic control in type 1 diabetic patients: systematic review and meta-analysis of randomised trials. Eur J Endocrinol 2012; 166: 567–574.
- [17] Bergenstal R, Welsh JB, Shin JJ. Threshold-based insulin-pump interruption for reduction of hypoglycemia. N Engl J Med 2013; 369: 224–232.
- [18] Rosenbloom AL, Silverstein JH, Amemiya S, et al.; International Society for Pediatric and Adolescent Diabetes. ISPAD Clinical Practice Consensus Guidelines 2006-2007. Type 2 diabetes mellitus in the child and adolescent. Pediatr Diabetes 2008; 9: 512–526.
- [19] Pozzilli P, Guglielmi C. Double diabetes: a mixture of type 1 and type 2 diabetes in youth. Endocr Dev 2009; 14: 151–166.
- [20] Stanik J, Dusatkova P, Cinek O, et al. De novo mutations of GCK, HNF1A and HNF4A may be more frequent in MODY than previously assumed. Diabetologia 2014; 57: 480–484.
- [21] Zeitler P. Approach to the obese adolescent with new-onset diabetes. J Clin Endocrinol Metab 2010; 95: 5163–5170.
- [22] Bangstad HJ, Danne T, Deeb LC, et al. ISPAD Clinical Practice Consensus Guidelines 2006-2007. Insulin treatment. Pediatr Diabetes 2007; 8: 88–102.
- [23] Česká diabetologická společnost ČLS JEP. Standardy péče o diabetes mellitus 1. typu. www.diab.cz navštíveno 1. 8. 2014.
- [24] Perantie DC, Koller JM, Weaver PM, et al. Prospectively determined impact of type 1 diabetes on brain volume during development. Diabetes 2011; 60: 3006–3014.
- [25] Arbelaez AM, Semenkovich K, Hershey T. Glycemic extremes in youth with T1DM: the structural and functional integrity of the developing brain. Pediatr Diabetes 2013; 14: 541–553.
- [26] Rausch JR, Hood KK, Delamater A, et al. Changes in treatment adherence and glycemic control during the transition to adolescence in type 1 diabetes. Diabetes Care 2012; 35: 1219–1224.