Stimulátory kostní novotvorby
V terapii osteoporózy lze použít léčiva snižující kostní resorpci nebo stimulátory kostní novotvorby. V léčbě osteoporózy dosud převažují antiresorptiva. Mezi stimulátory kostní novotvorby patří léčiva odvozená od parathormonu (PTH), vyvíjejí se rovněž látky ovlivňující sekreci PTH. Zvláštní postavení zaujímá stroncium, které má duální účinek – současně tlumí osteoresorpci a stimuluje osteoformaci. Vynikající účinek byl prokázán u teriparatidu (PTH 1-34), jehož parenterální podávání v dávce 20 mg denně vede k signifikantnímu poklesu rizika vzniku nových obratlových a mimoobratlových zlomenin a k výraznému nárůstu denzity kostního minerálu. Doporučená délka terapie činí 18 měsíců a tato léčba je určena především pro pacienty v těžkém stavu, s vícečetnými frakturami a bez odpovědi na běžnou antiresorpční léčbu. Rovněž podávání PTH 1-84 má pozitivní účinek na skelet. Po jednoroční léčbě PTH 1-84 dochází k nárůstu BMD v oblasti páteře a kyčle, který je zachován nebo zvýšen jen při současném či následném podávání alendronátu. Nenavazuje-li na roční léčbu PTH 1-84 terapie antiresorptivem, není možné získaný nárůst udržet. Stroncium ranelát představuje díky svému duálnímu účinku důležitý pokrok v léčbě osteoporózy. Tříleté podávání stroncium ranelátu v dávce 2 g denně vede k signifikatnímu nárůstu denzity kostního minerálu, hlavně však dochází k významnému poklesu rizika zlomenin v oblasti osového i periferního skeletu. Stimulátory kostní novotvorby představují další pokrok v léčbě osteoporózy.
Úvod
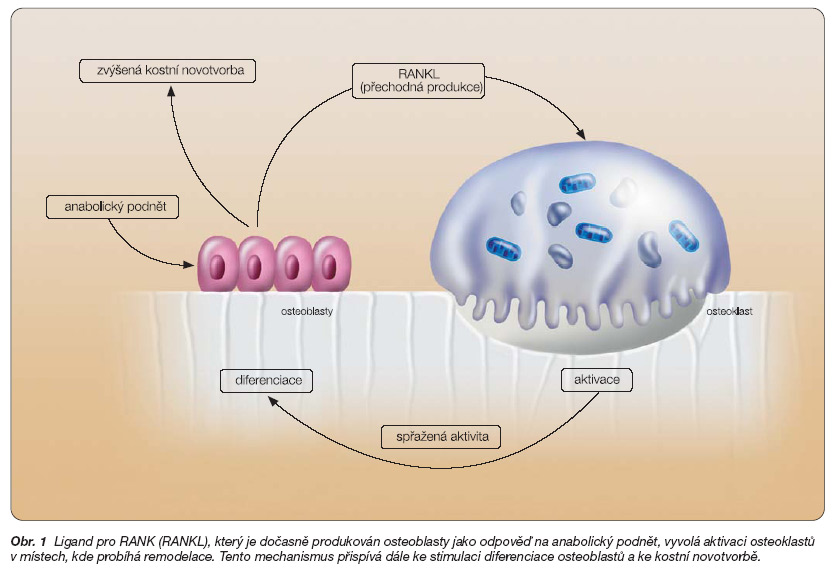
Osteoporóza postihuje 7–8 % obyvatelstva, což představuje významný problém medicínský, sociální, lidský a ekonomický. Předpokládá se, že v současné době zůstávají až tři čtvrtiny z celkového počtu pacientek nediagnostikovány a neléčeny, nebo jsou léčeny špatně a nedostatečně. Z tohoto důvodu lze očekávat systematický nárůst komplikací, především fraktur v oblasti proximálního femuru. V současné době je celoživotní riziko osteoporotické fraktury pro ženy 40% a riziko fraktury krčku femuru 18%. Předpokládaný nárůst rizika bude způsoben jednak prodlužováním průměrné délky života, ale též špatným životním stylem, negativními vlivy životního prostředí, nesprávnou životosprávou a mnoha dalšími rizikovými faktory [1]. V současné době je k dispozici široké spektrum velmi účinných léčiv, které se neustále rozšiřuje. Základem terapie osteoporózy je aktivní spolupráce pacienta, přiměřený pohyb se zátěží skeletu, zdravá životospráva. Nezbytná je dostatečná saturace vápníkem (včetně obvyklé suplementace 500 mg kalcia medikamentózně) a vitaminem D [1, 2]. Léčba osteoporózy je dlouhodobá (minimálně 2 roky). Hlavním cílem léčby je zabránit zlomeninám, mezi další cíle patří zachování množství a kvality kostní hmoty nebo dosažení jejich úpravy. Dalším cílem je zmírnit klinické důsledky fraktur a deformit skeletu a zachovat tělesnou zdatnost. Farmakologická léčba postmenopauzální osteoporózy je určena pro ženy s denzitometricky dokumentovanou osteoporózou (denzita kostního minerálu – BMD, T-skóre -2,5 a nižší), pro ženy se sníženou denzitou kostního minerálu, které utrpěly osteoporotickou zlomeninu, a měla by být zvážena u žen se sníženou denzitou kostního minerálu a současně přítomnými hlavními rizikovými faktory osteoporózy. Dostupná léčiva se obvykle dělí podle mechanismu jejich účinku na látky tlumící kostní resorpci a inhibující aktivitu osteoklastů a na látky stimulující kostní novotvorbu a působící primárně na osteoblasty. Uvedené dělení je značně schematické, neboť působení osteoklastů a osteoblastů je velmi úzce propojeno (obr. 1), přesto má svou logiku [2]. V dosavadní praxi moderní léčby osteoporózy jednoznačně převládají látky antiresorpční. Mechanismus jejich účinku spočívá v potlačení diferenciace preosteoklastů, potlačení vzniku osteoklastů a jejich aktivity, zásahu do intracelulárních metabolických procesů v osteoklastech a zvýšení jejich apoptózy. To vede ke zpomalení remodelačního cyklu a zvýšené mineralizaci kostí a zřejmě též ke zlepšení mikroarchitektury kostních trabekul [1–3]. V současné době se rovněž začínají prosazovat léčivé přípravky, které výrazně stimulují aktivitu osteoblastů, a tím zvyšují kostní formaci bez zásahu do kostní resorpce. Patří sem přípravky odvozené od parathormonu (PTH), vyvíjejí se rovněž látky ovlivňující sekreci PTH. Zvláštní postavení zaujímá stroncium, které má duální účinek – současně tlumí osteoresorpci a stimuluje osteoformaci [1–3].
Parathormon
Teriparatid (PTH 1-34)
Teriparatid je rekombinantní lidský parathormon obsahující aminokyseliny 1-34, a je tudíž identický s 34-N terminální sekvencí aminokyselin endogenního humánního parathormonu. Teriparatid je produkován E. coli za použití rekombinantní DNA technologie. PTH 1-34 má velmi výrazný osteoanabolický efekt, na rozdíl od kontinuálně produkovaného fyziologického PTH, který obsahuje 84 aminokyselin a je hlavním regulátorem metabolismu kalcia a fosforu, především zásahem do metabolismu ledvin a kostí. Rekombinantní fragment 1-34 vykazuje při intermitentním podávání unikátní mechanismus, neboť primárně stimuluje kostní novotvorbu a následně celou kostní remodelaci. Teriparatid zvyšuje tvorbu osteoblastů a současně snižuje jejich apoptózu. To vede ke vzestupu absolutního množství osteoblastů v kosti a zvýšené kostní formaci. Zlepšuje se však i kostní mikroarchitektura, počet a pevnost trabekul trámčité kosti, kortikální geometrie a síla kosti.
U myší byl v preklinických studiích zjištěn vyšší osteoanabolický účinek sekvence PTH 1-34 oproti PTH 1-31 či PTH 2-34 [4]. Intermitentní podávání PTH 1-34 opicím Cynomolgus vedlo ke zvýšení remodelace v kortikální kosti s následnou vyšší porozitou, mechanická odolnost kostní tkáně ovšem nebyla porušena [5].
Denní podávání PTH 1-34 po dobu 12 měsíců vedlo u postmenopauzálních žen k významnému nárůstu ukazatelů kostní formace (osteokalcinu o 150 % po 3 měsících podávání a kostní izoformy alkalické fosfatázy – bALP – o 80 % po 3 měsících), významný byl rovněž vzestup fibroblastového růstového faktoru (bFGF) o 45 % po 3 měsících a až o 90 % v 12. měsíci. Uvedené výsledky podporují hypotézu, že bFGF má významnou úlohu v osteoformačním procesu vyvolaném PTH [6].
Zásadním předělem byly výsledky studie Fracture Prevention Trial, která zahrnovala 1637 postmenopauzálních žen s 1–2 prevalentními frakturami, kterým bylo randomizovaně přiděleno k subkutánní autoaplikaci placebo (n = 544), nebo teriparatid v dávce 20 mg denně (n = 541), nebo teriparatid v denní dávce 40 mg (n = 552). Všechny ženy ve studii užívaly vitamin D (400–1200 IU denně) a kalcium (1000 mg denně). Průměrná doba léčby trvala v jednotlivých skupinách 18 6 5, 18 6 6 a 17 6 6 měsíců [7]. Studii dokončilo 1326 žen (81 %). V porovnání s placebem vedlo podávání 20 mg a 40 mg teriparatidu k poklesu rizika vzniku nové vertebrální zlomeniny o 65 % a 69 %, zatímco riziko 2 a více nových zlomenin bylo sníženo o 77 % a 86 %. Rovněž tak došlo u pacientek, které užívaly teriparatid, k signifikantně nižšímu výskytu bolesti zad (p = 0,007) a k méně významnému poklesu tělesné výšky (p = 0,002). Podávání teriparatidu vedlo též k významné redukci vzniku nových mimoobratlových zlomenin (o 35 a 40 %), u patologických zlomenin byl rozdíl ještě významnější (o 53 a 54 %). První pozitivní účinky léčby teriparatidem byly patrné po 9 až 12 měsících léčby. Výrazné byly též změny BMD, jejíž počáteční hodnoty byly u všech tří skupin shodné. Podávání 20 mg teriparatidu vedlo v porovnání s placebem k vzestupu BMD v oblasti bederní páteře o 9,7 6 7,4 %, v oblasti krčku femuru o 2,8 6 5,7 %, v celé kyčli o 2,6 6 4,9 %, dávka 40 mg denně vedla ve stejných místech k vzestupu BMD o 13,7 6 9,7 %, 5,1 6 6,7 % a 3,6 6 5,4 %. V oblasti radia došlo k poklesu BMD, který dosáhl statistické významnosti u dávky 40 mg [7]. Z nežádoucích účinků je nutno zmínit výskyt nádorových onemocnění, který byl ovšem nejvyšší v placebové skupině (4 % oproti 2 % pacientů léčených teriparatidem). Osteosarkom se nevyskytl u žádné pacientky. Pro nežádoucí příhody (nauzea, bolesti hlavy) odstoupilo celkem 126 žen, nebyl zaznamenán významný rozdíl ve výskytu nežádoucích příhod mezi placebovou větví a pacientkami užívajícími 20 mg teriparatidu denně. Mezi další nežádoucí účinky patřil výskyt mírné asymptomatické hyperkalcémie (S-Ca > 2,6 mmol/l) u 11 % žen užívajících 20 mg teriparatidu denně a u 28 % žen léčených denní dávkou 40 mg. Nebyla zjištěna hyperkalciurie. Protilátky proti PTH byly detekovány u méně než 1 % žen užívajících placebo, u 3 % užívajících dávku 20 mg a u 8 % žen užívajících 40 mg teriparatidu. Výskyt protilátek byl zcela asymptomatický [7]. Klinické hodnocení bylo z bezpečnostních důvodů zadavatelem ukončeno po 18 měsících, neboť v průběhu dlouhodobé (2leté) toxikologické studie s vysokými dávkami teriparatidu byl u krys zjištěn výskyt osteosarkomu [7]. Výskyt osteosarkomu u krys byl závislý na dávce teriparatidu, která mnohonásobně (10x) převyšovala dávku podávanou lidem a jejíž podávání trvalo po celou dobu života hlodavců. Nálezu nádoru předcházel rozvoj osteosklerózy. U opic nebyl výskyt osteosarkomu po dlouhodobé aplikaci PTH 1-34 zaznamenán. Neexistují rovněž důkazy o mutagenitě či genotoxicitě teriparatidu [7, 8]. Při dalším prospektivním sledování (v průměru 43 měsíců) 848 žen z výše uvedené studie s teriparatidem nebyl zjištěn žádný výskyt kostních nádorů [8]. V následující analýze studie Fracture Prevention Trial byl hodnocen vliv teriparatidu na výskyt nových zlomenin u 931 postmenopauzálních pacientek s prevalentními frakturami [9]. U žen, které užívaly placebo a měly prevalentní fraktury, byl zaznamenán další výskyt nových vertebrálních i mimoobratlových zlomenin (p < 0,001). U pacientek, které užívaly teriparatid, nebyla tato souvislost zjištěna [9].
V další studii byla porovnána účinnost teriparatidu a alendronátu [10]. Celkem 146 postmenopauzálních žen s osteoporózou bylo randomizovaně rozděleno do dvou skupin: injekce 40 mg teriparatidu jednou denně plus perorálně podávané placebo (n = 73), nebo alendronát per os plus injekčně podávané placebo (n = 73). Všechny ženy ve studii užívaly vitamin D (400–1200 IU denně) a kalcium (1000 mg denně). Průměrná doba léčby trvala 14 měsíců. U pacientek, kterým byl podáván teriparatid, došlo po třech měsících léčby k významnému nárůstu BMD v bederní páteři v porovnání s pacientkami, kterým byl po stejně dlouhou dobu podáván alendronát (+2,7 %; p < 0,001). Tento rozdíl se dále zvýraznil v 6. a 12. měsíci (+5,4 a + 8,3 %; p < 0,001). V oblasti krčku stehenní kosti a v celé kyčli byl rovněž výraznější nárůst BMD po léčbě teriparatidem [10]. V oblasti distálního radia vedlo podávání teriparatidu k poklesu BMD v porovnání s výchozími hodnotami či s podáváním alendronátu. Uvedený nález lze vysvětlit zvýšenou kortikální porozitou vřetenní kosti po podávání teriparatidu, což ovšem nevede ke zhoršení mechanické odolnosti kostní tkáně [5, 10]. Výskyt mimoobratlových zlomenin byl nižší u pacientek léčených teriparatidem (p = 0,042). Zatímco podávání alendronátu významně snížilo hodnoty ukazatelů kostní resorpce a formace již po jednom, resp. třech měsících podávání, aplikace teriparatidu vedla k signifikantnímu zvýšení obou ukazatelů [9]. Léčba teriparatidem v porovnání s alendronátem tedy vedla k výraznějšímu nárůstu BMD a významnějšímu poklesu výskytu mimoobratlových zlomenin [10].
Vyšetření vřetenní kosti periferní komputerovou tomografií (pQCT) u 101 postmenopauzálních žen prokázalo, že podávání teriparatidu po dobu 18 měsíců (20 či 40 mg s.c. denně oproti placebu) prokazatelně zvyšuje BMD, plochu kortikální kosti, periostální a endokortikální obvod [11–13]. Zlepšení strukturální geometrie proximálního femuru bylo pozorováno po 20měsíční léčbě teriparatidem u postmenopauzálních žen (teriparatid 20 mg denně, n = 186; 40 mg denně, n = 183; placebo, n = 189). V proximálním femuru zlepšuje podávání teriparatidu axiální pevnost a zvyšuje kortikální tloušťku i stabilitu v krčku femuru a intertrochanterické oblasti [14]. Histomorfometrická vyšetření bioptických vzorků kostní tkáně prokázala, že podávání teriparatidu zvyšuje kostní objem, vede k nárůstu počtu kostních trámců a zlepšuje jejich konektivitu, zvyšuje tloušťku kortikální kosti bez poruchy kostní mineralizace [15–17]. Změny v kostních markerech (vzestup ukazatelů formace – aktivity alkalické fosfatázy a prekurzorů kolagenu I. typu – PICP, PINP) jsou významné již po 1 měsíci léčby, stejně jako změny ukazatelů resorpce. Hodnoty ukazatelů formace (PICP a PINP) 1 a 3 měsíce po zahájení léčby vysoce a významně korelovaly se vzestupem BMD v bederní páteři po 18 měsících léčby, obdobně aktivita bALP a hodnota PICP po 1 měsíci léčby korelovaly s nárůstem kortikální tloušťky po 22 měsících od zahájení terapie [18, 19]. Tyto časné změny markerů kostní formace tedy predikují nárůst kostní hmoty po léčbě teriparatidem [18, 19]. Jak již bylo uvedeno, podávání teriparatidu vede k významnému poklesu výskytu bolesti zad, což je připisováno snížení počtu fraktur a jejich závažnosti [20, 21]. Tato skutečnost velmi pozitivně ovlivňuje kvalitu života [22]. Po ukončení léčby PTH 1-34 přetrvává snížené riziko mimoobratlových zlomenin po dobu 30 měsíců [23, 24]. Dalším důležitým údajem je zjištění, že účinky teriparatidu na skelet nejsou závislé na věku dospělé pacientky, ani na BMD na počátku léčby, ani na počtu prevalentních vertebrálních fraktur [25]. Účinnost PTH 1-34 byla též zkoumána u mužů s nízkou BMD. 437 mužů (průměrný věk 59 6 13 let) s BMD -2 SD (T-skóre) v oblasti bederní páteře či kyčle bylo na základě randomizace léčeno teriparatidem (20 mg nebo 40 mg), nebo jim bylo podáváno placebo po dobu 11 měsíců. Všichni užívali vitamin D (400–1200 IU denně) a kalcium (1000 mg denně). Studii dokončilo 356 mužů. Léčba teriparatidem vedla ve srovnání s užíváním placeba u mužů k významnému nárůstu BMD v závislosti na dávce. Byl též zaznamenán nárůst ukazatelů kostního obratu, zvláště kostní formace. Nejčastějšími nežádoucími příhodami byly nauzea a bolesti hlavy (do 18 %, nejvíce ve skupině s 40 mg teriparatidu denně). Rovněž tato studie byla předčasně ukončena ze stejného důvodu jako Fracture Prevention Trial [26]. V průběhu následujících 30 měsíců byly sledovány BMD a výskyt fraktur osového i periferního skeletu [27]. U mužů léčených PTH 1-34 došlo k mírnému poklesu BMD v oblasti bederní páteře a kyčle, ale tyto hodnoty byly stále vyšší v porovnání s hodnotami před zahájením léčby (p ≤ 0,001). U těchto pacientů bylo rovněž sníženo riziko středně těžkých a těžkých zlomenin [27]. PTH 1-34 byl rovněž hodnocen v léčbě glukokortikoidy indukované osteoporózy u postmenopauzálních žen (průměrný věk 63 let), které užívaly 5–20 mg prednisonu denně a hormonální substituční léčbu (HRT) [28, 29]. 12měsíční podávání PTH 1-34 signifikantně zvýšilo BMD v oblasti bederní páteře v porovnání s ženami, které užívaly pouze HRT (p < 0,001) [28, 30]. V průběhu prvních tří měsíců léčby došlo k výraznějšímu vzestupu ukazatelů kostní formace v porovnání s markery resorpce (150 % v. 100 %) [28]. Teriparatid představuje zajímavou a perspektivní alternativu v léčbě glukokortikoidy indukované osteoporózy.
Otázkou zůstává užití teriparatidu v kombinaci s jinými léčivy užívanými v terapii osteoporózy. Experimentálně byl u krys zjištěn komplementární účinek teriparatidu a antiresorpčního přípravku raloxifenu podáváných souběžně nebo sekvenčně v pořadí teriparatid-raloxifen [31]. Účinek se vysvětluje kombinací antiresorpčního efektu raloxifenu a zvýšenou kostní formací navozenou teriparatidem [32]. Uvedená kombinace byla použita v dvojitě zaslepené randomizované placebem kontrolované 6měsíční studii, kdy 68 postmenopauzálních žen užívalo teriparatid a placebo, zatímco 69 žen užívalo teriparatid s raloxifenem [32]. Kombinační léčba vedla k poklesu kostní resorpce, zatímco vzestup kostní formace nebyl kombinací obou látek významně ovlivněn. Byl zjištěn významný vzestup BMD v oblasti kyčle po léčbě kombinací raloxifenu a teriparatidu [32]. Studie porovnávající účinek alendronátu a teriparatidu již byla zmíněna [10]. Další komparativní randomizovaná dvojitě zaslepená studie zabývající se účinky alendronátu (10 mg denně per os; n = 101) a teriparatidu (20 mg denně s.c.; n = 102) zahrnovala 203 postmenopauzálních žen s osteoporózou, které byly léčeny po dobu 18 měsíců [33]. Od 3. měsíce byl výraznější vzestup BMD v oblasti bederní páteře u pacientek léčených teriparatidem, po 18 měsících léčby byl zaznamenán 19% nárůst BMD po léčbě teriparatidem, zatímco po léčbě alendronátem představoval nárůst 3,8 % (p < 0,01). Signifikantní změny byly rovněž zaznamenány v krčku femuru. Ukazatele kostního obratu byly po léčbě teriparatidem významně zvýšeny, podávání alendronátu vedlo k supresi kostní remodelace [33]. Histomorfometrické vyšetření 32 bioptických vzorků z uvedené studie prokázalo zvýšenou formaci i resorpci kostní tkáně po léčbě teriparatidem oproti významnému poklesu kostní remodelace po léčbě alendronátem. Nebyly zaznamenány rozdíly v mineralizaci. Uvedené nálezy podtrhují rozdílný mechanismus účinku obou léčiv [34]. Byla nastolena otázka, zda léčba kombinací alendronátu a teriparatidu povede ke zvýšení BMD. 83 mužům ve věku 46–85 let s BMD v oblasti páteře či kyčle < -2 SD (T-skóre) byl randomizovaně podáván alendronát (10 mg denně; n = 28), PTH 1-34 (40 mg s.c. denně; n = 27), nebo kombinace obou přípravků (n = 28). Alendronát byl užíván po dobu 30 měsíců, PTH 1-34 byl nasazen po 6 měsících. Všichni účastníci užívali denně kalcium (1000–1200 mg p.o.) a vitamin D (400 IU p.o.) [35]. Studii ukončilo 73 mužů. Nárůst BMD v oblasti bederní páteře a krčku femuru byl největší u pacientů užívajících PTH 1-34, nejnižší byl u pacientů užívajících samotný alendronát. Stejný trend byl patrný při vyhodnocení aktivity bALP [35]. Kombinace alendronátu a teriparatidu tedy není optimální možností léčby osteoporózy, neboť alendronát suprimuje stimulaci kostní formace vyvolanou PTH 1-34 [35]. Toto bylo potvrzeno další studií, která prokázala, že léčba alendronátem (1krát týdně p.o.) vedla k signifikantně menšímu nárůstu BMD v porovnání s léčbou kombinací alendronátu ve stejném dávkovacím režimu a trvalou denní aplikací PTH 1-34 či s kombinací alendronátu a denní aplikací PTH 1-34 vždy v alternujících 3měsíčních cyklech [36].
U 59 postmenopauzálních osteoporotických pacientek, které původně užívaly alendronát (10 mg denně p.o.) nebo raloxifen (60 mg denně p.o.) po dobu 18–36 měsíců, byla po vysazení léčby alendronátem či raloxifenem zahájena léčba PTH 1-34 (20 mg denně s.c.) společně s denním přísunem vápníku (1000 mg) a vitaminu D (400 IU). Léčba teriparatidem trvala celkem 18 měsíců. U pacientek, které v minulosti užívaly raloxifen, došlo k významnějšímu nárůstu ukazatelů kostní formace v porovnání s ženami, které předtím užívaly alendronát. Obdobný trend byl zaznamenán při vyšetření BMD v oblasti bederní páteře či kyčle [37]. Dle výsledků uvedené studie snižuje předchozí užívání alendronátu osteoanabolický účinek teriparatidu [37].
Ve srovnávací dvojitě zaslepené placebem kontrolované studii hodnotící účinnost léčby teriparatidem a kalcitoninem u 63 postmenopauzálních osteoporotických žen byl po 6 měsících zjištěn signifikantní nárůst BMD v oblasti bederní páteře u pacientů užívajících PTH 1-34, ale změny v oblasti kyčle a krčku femuru nebyly významné. Teriparatid vedl též k signifikantnímu nárůstu ukazatelů kostní formace [38]. PTH 1-34 tedy ovlivňuje nárůst kostní hmoty výrazněji než kalcitonin.
Experimentální práce prokázaly u krys pozitivní vliv teriparatidu na hojení zlomenin [39, 40], což může mít v budoucnosti klinický význam [41, 42]. Mezi dalšími terapeutickými možnostmi se rýsuje využití teriparatidu při transplantacích kostní dřeně, neboť PTH 1-34 usnadnil v experimentu u myší rychlejší proliferaci kmenových buněk a rychlejší přijetí transplantátu [42].
V současné době je teriparatid registrován pro léčbu prokázané osteoporózy u postmenopauzálních žen. Obvyklá denní dávka – 20 mg – musí být podávánaparenterálně, dávkovacím perem. Doporučená délka terapie činí 18 měsíců a tato léčba je určena především pro pacienty v těžkém stavu, s vícečetnými frakturami a bez odpovědi na běžnou antiresorpční léčbu. Léčba teriparatidem je finančně náročná a je určena pacientkám s těžkou osteoporózou. Podávání teriparatidu tudíž přísluší vybraným pracovištím.
Do budoucna se uvažuje o možnosti aplikace PTH 1-34 do dýchacích cest pomocí inhalátoru [43].
PTH 1-84
PTH 1-84 je kompletní molekula parathormonu obsahující všech 84 aminokyselin, u níž nebyl popsán karcinogenní efekt při podávání krysám [44]. PTH 1-84 byl použit v klinické studii zahrnující 238 postmenopauzálních žen s osteoporózou, které byly randomizovaně rozděleny do 4 skupin: PTH 1-84 (100 mg denně s.c.) po dobu 1 roku s následným podáváním alendronátu (10 mg p.o. 1x denně) po dobu druhého roku (skupina PTH-alendronát, n = 59); PTH 1-84 po dobu 1 roku s následným podáváním placeba po dobu druhého roku (skupina PTH-placebo, n = 60); PTH 1-84 plus alendronát po dobu 1 roku s následným podáváním alendronátu po dobu druhého roku (kombinovaná skupina, n = 59) a skupina užívající alendronát po dobu 2 let (alendronátová skupina, n = 60) [45]. Po dvou letech došlo k významnému nárůstu BMD ve všech skupinách. Nejvyšší vzestup BMD v oblasti bederní páteře byl patrný ve skupině PTH-alendronát a nejmenší ve skupině PTH-placebo [45]. V oblasti kyčle a krčku femuru došlo k významnému nárůstu BMD u všech skupin s výjimkou skupiny PTH-placebo. Nejvyšší úbytek BMD v oblasti distálního radia byl patrný ve skupině PTH-placebo. Po jednoroční léčbě PTH 1-84 tedy dochází k nárůstu BMD v oblasti páteře a kyčle, který je zachován nebo zvýšen jen při současném či následném podávání alendronátu. Nenavazuje-li na roční léčbu PTH 1-84 terapie antiresorpčním léčivem, není možné získaný nárůst udržet [45].
Látky ovlivňující sekreci PTH – kalcilytika
Kalcilytika jsou látky, které modulují citlivost calcium-sensing receptoru (CaSR), a tím ovlivňují sekreci PTH [46]. Za fyziologických podmínek reaguje CaSR na koncentrace Ca2+: při vzestupu S-Ca2+ snižuje sekreci PTH a při poklesu S-Ca2+ zvyšuje sekreci PTH. Kalcilytika jsou látky, které snižují citlivost CaSR na S-Ca2+, čímž dochází ke zvýšení sekrece PTH. Kalcilytika (NPS 2143 a Calhex 231) mají potenciál krátkodobě zvyšovat sekreci endogenního PTH s následným osteoanabolickým efektem [46, 47]. Za výhodu by bylo možné považovat perorální podávání [46]. Problematika kalcilytik se v současnosti týká oblasti základního výzkumu.
Stroncium ranelát
Stroncium představuje látku s duálním účinkem na kostní metabolismus. V letech 1950 až 1959 bylo zjištěno, že podávání malého množství solí stroncia osteoporotickým pacientům vedlo k nárůstu kostní hmoty v oblasti páteře [48–50]. U myší a krys bylo v 80. letech 20. století zjištěno, že podávání stroncium chloridu vede k zvýšení kostní formace a k poklesu počtu osteoklastů [48–50]. V 90. letech byla vyvinuta látka S-12911 – stroncium ranelát, který je složen ze 2 atomů stabilního stroncia a 1 molekuly kyseliny ranelové. Preklinické studie prokázaly, že stroncium ranelát zvyšuje novotvorbu kosti a zároveň snižuje její odbourávání [48–56]. Stroncium ranelát zvyšuje kostní formaci v kulturách kostní tkáně a jeho podání vede k replikaci prekurzorů osteoblastů a zvýšené syntéze kolagenu v kulturách kostních buněk hlodavců [51, 52]. Stroncium ranelát zvyšuje expresi osteoprotegerinu, čímž je snižována tvorba osteoklastů [53]. Stroncium ranelát tímto snižuje diferenciaci osteoklastů a navozuje jejich apoptózu, čímž dochází k poklesu osteoresorpční aktivity [54–56]. Uvedeným mechanismem dochází k obnovení rovnováhy kostního obratu ve prospěch kostní formace. Byl prokázán agonistický vliv stroncia na CaSR. Stroncium stimuluje CaSR obdobným způsobem jako ionty vápníku, ale s nižší afinitou k receptoru při stejné koncentraci uvedených iontů [57, 58]. U hlodavců dochází po podávání stroncium ranelátu k nárůstu hmoty trámčité kosti, ke zvýšení počtu trámců a k jejich zesílení [59, 60]. Zároveň je zachována normální mineralizace kostní tkáně bez porušení struktury krystalů hydroxyapatitu [52]. Stroncium ranelát též stimuluje in vitro formaci lidské chrupavčité tkáně, což může mít význam pro budoucí léčbu osteoartrózy [61]. Podávání stroncium ranelátu opicím Cynomolgus v dávkách od 100 po 1250 mg/kg/den po dobu 13 až 52 týdnů vedlo k ukládání stroncia v novotvořené kosti bez jakéhokoliv porušení mineralizace kostní tkáně [62]. Po perorálním podání se v zažívacím traktu vstřebává u člověka zhruba 25–30 % stroncia. Po perorálním podání 2 g stroncium ranelátu je u člověka absolutní biologická dostupnost stroncia přibližně 25 % (rozmezí 19–27 %), zatímco biologická dostupnost kyseliny ranelové je 2,5 % [48]. Vzestup plazmatických koncentrací stroncia je závislý na velikosti jeho perorální dávky, přitom však není ovlivněna extracelulární koncentrace kalcia [48]. Absorbované stroncium je distribuováno do 3 kompartmentů: extracelulární tekutiny, měkkých tkání a do kostí. Stroncium má obdobné fyzikálně-chemické vlastnosti jako kalcium, a tudíž disponuje vysokou afinitou ke kostní tkáni [48, 50]. Ukládání stroncia v kostech je přímo závislé na jeho plazmatické koncentraci a na úhrnné době podávání. Stroncium je do kostní tkáně inkorporováno nerovnoměrně, jeho větší obsah byl zjištěn v trámčité a nově formované kosti. V nově formované kostní tkáni je stroncium zabudováno do krystalické struktury, avšak méně než každý desátý atom kalcia je nahrazen atomem stroncia [48–50].
Eliminace stroncia je nezávislá na čase a dávce. Poločas stroncia je u postmenopauzálních žen 6,3 6 2,7 dní, poločas kyseliny ranelové 3,3 6 2,3 dní [48]. K vylučování stroncia dochází ledvinami a gastrointestinálním traktem. Celková clearance je přibližně 12 ml/min a jeho renální clearance je přibližně 7 ml/min. U kyseliny ranelové jsou tyto hodnoty 78 ml/min a 62 ml/min. Clearance stroncia se snižuje v závislosti na clearance kreatininu [48].
Léčebné užití stroncium ranelátu bylo prověřeno v klinických hodnoceních II. a III. fáze [63–67], z nichž zvláštní pozornost zasluhují studie III. fáze. Pilotní studie FIRST (Fracture International Run-in for Strontium ranelate Trial) měla za úkol normalizovat u populace pacientek hladiny vápníku a vitaminu D a vybrat vhodné pacientky pro zařazení do studií SOTI (Spinal Osteoporosis Therapeutic Intervention) a TROPOS (TReatment Of Periferal Osteoporosis). Pacientky ze studie FIRST byly osteoporotické samostatně pohyblivé ženy s vysokým rizikem zlomenin, u kterých se předpokládala schopnost porozumět plánu a cílům studie a rovněž se předpokládalo nejméně 4leté přežití. Do studie FIRST bylo zařazeno 9196 pacientek (průměrný věk 74 let). Byla vyšetřena hladina vitaminu D v séru, vyhodnocen denní příjem kalcia pomocí dotazníku a pacientky byly v indikovaných případech suplementovány denní dávkou 500 či 1000 mg vápníku, všem bylo podáváno 400 nebo 800 IU vitaminu D denně. V této suplementaci se pokračovalo v průběhu následujících studií SOTI a TROPOS [63]. Uvedená dvě klinická hodnocení představovala multicentrické, randomizované, dvojitě zaslepené placebem kontrolované 5leté studie III. fáze s hlavní analýzou po 3 letech [63–65].
Studie SOTI byla zaměřena na účinnost a snášenlivost stroncium ranelátu a jeho vliv na redukci vertebrálníchzlomenin [63, 64]. Primárním cílem bylo vyhodnocení incidence fraktur obratlů. Sekundárním cílem bylo vyhodnocení incidence mimoobratlových zlomenin, změny ukazatelů kostního obratu, změny tělesné výšky a vyhodnocení kvality života. Studie byla provedena u 1649 (placebo, n = 821; stroncium ranelát, n = 828) postmenopauzálních žen kavkazské rasy starších 50 let (průměrný věk 69,7 let) s nízkými hodnotami denzity kostního minerálu v bederní páteři (T-skóre < -2,4 SD), které v minulosti prodělaly alespoň jednu osteoporotickou frakturu obratle. Při zahájení studie neexistovaly významné vzájemné rozdíly mezi jednotlivými skupinami týkající se demografické situace, biochemických změn, BMD nebo morbidity. Denní dávka zkoušeného přípravku byla 2000 mg stroncium ranelátu podávaná po dobu 3 let. Po 4 letech léčby byla polovina pacientek, které původně užívaly stroncium ranelát, převedena na placebo, zatímco pacientky, které až dosud užívaly placebo, dostaly účinnou látku (stroncium ranelát). Rentgenogram hrudní a bederní páteře byl proveden před zahájením léčby a každých 12 měsíců. BMD byla měřena metodou DXA v oblasti bederní páteře a proximálního femuru před zahájením léčby a poté každých 6 měsíců, poslední BMD byla měřena v měsíci 51. Při hodnocení výsledků BMD bederní páteře byla provedena korekce s ohledem na přítomnost stroncia v kostní tkáni. Základní biochemické ukazatele, S-PTH, 25-hydroxyvitamin D, S-bALP, C-terminální telopeptid kolagenu typu I byly vyšetřeny v krevních vzorcích získaných před zahájením léčby, po 3 a 6 měsících, a dále každých 6 měsíců léčby. U 20 pacientek byly provedeny kostní biopsie po 24, 36 a 48 měsících. Studii dokončilo 1442 pacientek (placebo, n = 723; stroncium ranelát, n = 719) [46]. Po prvních 12 měsících léčby došlo u pacientek léčených stroncium ranelátem k poklesu rizika zlomeniny obratle o 49 % ve srovnání s placebovou skupinou. Po 3 letech léčby bylo riziko zlomeniny obratle nižší u skupiny léčené stronciem o 41 %. Na základě těchto údajů by 9 pacientek muselo být léčeno stroncium ranelátem po dobu 3 let, aby se zabránilo vertebrální fraktuře u 1 pacientky. Novou zlomeninu obratle mělo po 3 letech 17,7 % pacientek léčených stroncium ranelátem a 28,4 % pacientek užívajících placebo (p < 0,001). Více než jednu novou zlomeninu obratle mělo po 3 letech 6,4 % pacientek léčených stronciem a 9,8 % pacientek užívajících placebo (p = 0,02). Podávání stroncium ranelátu rovněž vedlo v porovnání s podáváním placeba k menšímu poklesu tělesné výšky [64]. Ve skupině léčené stronciem došlo k výraznému nárůstu BMD v oblasti bederní páteře (+12,7 %), krčku femuru (+7,2 %) a kyčle (+8,6 %), což představovalo oproti placebu nárůst +14,4 % , +8,3 % a +9,8 % (p < 0,001). Po 3 měsících léčby došlo u pacientek léčených stronciem k významnému vzestupu S-bALP a poklesu C-terminálního telopeptidu v séru (p < 0,001). Tyto změny přetrvávaly po celou dobu léčby [46, 47]. Histomorfometrické vyšetření kostní tkáně neprokázalo poruchy mineralizace. Léčba byla velmi dobře tolerována, u pacientek léčených stronciem byl pouze v průběhu prvních tří měsíců oproti těm, kterým bylo podáváno placebo, zaznamenán vyšší výskyt průjmovitých stolic. Studie SOTI prokázala, že stroncium ranelát v dávce 2000 mg denně významně snižuje riziko obratlových zlomenin [64].
Studie TROPOS byla zaměřena na vyhodnocení účinnosti a snášenlivosti stroncium ranelátu při současné redukci incidence mimoobratlových zlomenin. Primárním cílem byl pokles incidence mimoobratlových zlomenin, sekundárními cíli bylo vyhodnocení incidence zlomenin obratlů, změny ukazatelů kostního obratu, změny tělesné výšky a vyhodnocení kvality života [63, 65]. Uvedená studie zahrnovala 5091 žen kavkazské rasy starších 70 let (průměrný věk 76,8 roku) s nízkými hodnotami BMD v oblasti krčku stehenní kosti (T-skóre < -2,5 SD, průměrná hodnota -3,1 SD) a s prevalentní mimoobratlovou frakturou u 38,6 % hodnocených pacientek. Při zahájení studie neexistovaly významné vzájemné rozdíly mezi jednotlivými skupinami týkající se demografické situace, biochemických změn, BMD nebo morbidity. Pacientkám bylo randomizovaně přiděleno placebo, nebo stroncium ranelát. Denní dávka zkoušeného léčiva byla 2000 mg stroncium ranelátu podávaného po dobu 3 let (stroncium ranelát, n = 2554; placebo, n = 2537). Rentgenové snímky páteře nebyly nutností, ale byly prováděny u maximálního možného množství pacientek. Všechny mimoobratlové zlomeniny v průběhu studie byly dokumentovány rentgenologicky a/nebo lékařskou zprávou. BMD byla měřena metodou DXA v oblasti bederní páteře a proximálního femuru před zahájením léčby a poté každých 6 měsíců. Základní biochemické ukazatele, S-PTH, 25-hydroxyvitamin D, S-bALP a N-terminální telopeptid kolagenu typu I v moči byly vyšetřeny ve vzorcích krve a moče získaných před zahájením léčby, po 3 a 6 měsících, a dále každých 6 měsíců léčby. Studii dokončilo celkem 3320 pacientek, z toho 1687 dostávalo stroncium ranelát a 1633 dostávalo placebo. Po 3 letech léčby bylo riziko všech mimoobratlových zlomenin o 16 % nižší u skupiny léčené stronciem oproti skupině užívající placebo (p = 0,04). Riziko hlavních mimoobratlových osteoporotických zlomenin (kyčel, zápěstí, pánev, křížová kost, žebra, sternum, klíček, pažní kost) bylo po léčbě stroncium ranelátem sníženo oproti placebu o 19 % (p < 0,03). V souboru 1977 žen starších 74 let s BMD v oblasti kyčle < -3 SD (T-skóre) došlo po 3 letech léčby u pacientek užívajících stroncium (n = 982) k poklesu rizika zlomeniny kyčle o 36 % (p = 0,046) oproti pacientkám v placebové skupině (n = 995) [65]. Po 3leté léčbě stroncium ranelátem došlo k signifikantnímu nárůstu BMD v krčku femuru (+ 8,2%) a v kyčli (+ 9,8%) v porovnání se skupinou, jíž bylo podáváno placebo (p < 0,001). Rovněž byl pozorován pokles rizika zlomeniny obratle o 45 % u pacientek bez prevalentní zlomeniny obratle. Snášenlivost přípravku byla velmi dobrá, nebyl zaznamenán rozdíl ve výskytu nežádoucích příhod mezi skupinou léčenou stroncium ranelátem a skupinou užívající placebo. Nejčastěji se vyskytly nauzea a průjmovité stolice [65]. Metaanalytické zhodnocení studií SOTI a TROPOS prokázalo u pacientek léčených stronciem pokles rizika zlomeniny obratle o 48 % [66]. Riziko fraktury bylo signifikantně sníženo u pacientek osteopenických i osteoporotických [66]. U pacientek léčených stronciem bylo po 3 letech popsáno výrazné zlepšení kvality života oproti pacientkám užívajícím placebo (p = 0,03). Zlepšení kvality života lze přičíst poklesu incidence zlomenin, ústupu bolestí zad a dobré snášenlivosti užívaného přípravku [48]. Stroncium ranelát představuje díky svému duálnímu účinku důležitý pokrok v léčbě osteoporózy [67, 68].
Závěr
Látky podporující kostní formaci jsou významným obohacením současného arzenálu léčiv užívaných v léčbě osteoporózy. Hlavním cílem léčby osteoporózy nesmí být prostý nárůst denzity kostního minerálu, nýbrž snížení rizika zlomeniny, zvláště pak periferního skeletu, čímž lze zásadně ovlivnit kvalitu života pacientů. Léčiva stimulující kostní formaci též prokazatelně snižují riziko vzniku nových zlomenin, včetně rizika fraktur periferního skeletu.
Obr. 1 Ligand pro RANK (RANKL), který je dočasně produkován osteoblasty jako odpověď na anabolický podnět, vyvolá aktivaci osteoklastů v místech, kde probíhá remodelace. Tento mechanismus přispívá dále ke stimulaci diferenciace osteoblastů a ke kostní novotvorbě.
Seznam použité literatury
- [1] Rosen CJ. Postmenopausal osteoporosis. N Engl J Med 2005; 353: 595–603.
- [2] Riggs BL, Parfitt AM. Drugs used to treat osteoporosis: The critical need for a uniform nomenclature based on their action on bone remodeling. J Bone Miner Res 2005; 20: 177–184.
- [3] Compston JE. Current and emerging therapies for the treatment of post-menopausal osteoporosis. European Pharmacotherapy 2006; 73–76. www.touchbriefings.com
- [4] Mohan S, Kutílek Š, Zhang C, et al. Comparison of bone formation responses to parathyroid hormone (1-34), (1-31) and (2-34) in mice. Bone 2000; 27: 471–478.
- [5] Burr DB, Hirano T, Turner CH, et al. Intermittently administered human parathyroid horomone (1-34) treatment increases intracortical bone turn-over and porosity without reducing bone strength in the humerus of ovariectomized Cynomolgus monkeys. J Bone Miner Res 2001; 16: 157–165.
- [6] Hurley M, Yao W, Lane NE. Changes in serum fibroblast growth factor 2 in patients with glucocorticoid-induced osteoporosis treated with human parathyroid hormone (1-34). Osteoporos Int 2005; 16: 2080–2084.
- [7] Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001; 344: 1434–1441.
- [8] Tashjian AH, Chabner BA. Commentary on clinical safety of recombinant human parathyroid hormone in the treatment of osteoporosis in men and postmenopausal women. J Bone Miner Res 2002; 17: 1151–1161.
- [9] Gallagher JC, Genant HG, Crans GG, et al. Teriparatide reduces the fracture risk associated with increasing number and severity of osteoporotic fractures. J Clin Endocrinol Metab 2005; 90: 1583–1587.
- [10] Body JJ, Gaich GA, Scheele WH, et al. A randomized double-blind trial to compare the efficacy of teriparatide with alendronate in postmenopausal women with osteoporosis. J Clin Endocrinol Metab 2002; 87: 4528–4535.
- [11] Zanchetta JR, Bogado CE, Ferretti JL, et al. Effects of teriparatide on cortical bone in postmenopausal women with osteoporosis. J Bone Miner Res 2003; 18: 539–543.
- [12] Eriksen EF, Robins DA. Teriparatide: A bone formation treatment of osteoporosis. Drugs Today 2004; 40: 935–948.
- [13] Dobnig H. A review of teriparatide and its clinical efficacy in the treatment of osteoporosis. Expert Opin Pharmacother 2004; 5: 1153–1162.
- [14] Uusi-Rasi K, Semanick LM, Zanchetta JR, et al. Effects of teriparatide [rhPTH (1-34)] treatment on structural geometry of the proximal femur in elderly osteoporotic women. Bone 2005; 36: 948–958.
- [15] Jiang Y, Zhao JJ, Mitlak BH, et al. Recombinant human parathyroid hormone (1-34) [teriparatide] improves both cortical and cancellous bone structure. J Bone Miner Res 2003; 18: 1932–1941.
- [16] Miki T, Nakatsuka K, Naka H, et al. Effect and safety of intermittent weekly administration of human parathyroid hormone 1-34 in patients with primary osteoporosis evaluated by histomorphometry and microstructural analysis of iliac trabecular bone before and after 1 year of treatment. J Bone Miner Res 2004; 22: 569–576.
- [17] Paschalis EP, Glass EV, Donley DW, Eriksen EF. Bone mineral and collagen quality in iliac crest biopsies of patients given teriparatide: new results from the fracture intervention trial. J Clin Endo-crinol Metab 2005; 90: 4644–4649.
- [18] Chen P, Satterwhite JH, Licata AA, et al. Early changes in biochemical markers of bone formation predict BMD response to teriparatide in postmenopausal women with osteoporosis. J Bone Miner Res 2005; 20: 962–970.
- [19] Dobnig H, Sipos A, Jiang Y, et al. Early changes in biochemical markers of bone formation correlate with improvements in bone structure during teriparatide therapy. J Clin Endocrinol Metab 2005; 90: 3970–3977.
- [20] Genant HK, Halse J, Briney WG, et al. The effects of teriparatide on the incidence of back pain in postmenopausal women with osteoporosis. Curr Med Res Opin 2005; 21: 1027–1034.
- [21] Nevitt MC, Chen P, Dore RK, et al. Reduced risk of back pain following teriparatide treatment: a meta-analysis. Osteoporosis Int 2006; 17: 273–280.
- [22] Crans GG, Silverman SL, Genant HK, et al. Association of severe vertebral fractures with reduced quality of life. Reduction in the incidence of severe vertebral fractures by teriparatide. Arthritis and Rheumatism 2004; 50: 4028–4034.
- [23] Lindsay R, Scheele WH, Neer R, et al. Sustained vertebral fracture risk reduction after withdrawal of teriparatide in postmenopausal women with osteoporosis. Arch Intern Med 2004; 164: 2024–2030.
- [24] Prince R, Sipos A, Hossain A, et al. Sustained nonvertebral fragility fracture risk reduction after discontinuation of teriparatide treatment. J Bone Miner Res 2005; 20: 1507–1513.
- [25] Marcus R, Wang O, Satterwhite J, et al. The skeletal response to teriparatide is largely independent of age, initial bone mineral density, and prevalent vertebral fractures in postmenopausal women with osteoporosis. J Bone Miner Res 2003; 18: 18–23.
- [26] Orwoll ES, Scheele WH, Paul S, et al. The effect of teriparatide therapy on bone density in men with osteoporosis. J Bone Miner Res 2003; 18: 9–17.
- [27] Kaufman JM, Orwoll E, Goemaere S, et al. Teriparatide effects on vertebral fractures and bone mineral density in men with osteoporosis: Treatment and discontinuation of therapy. Osteoporos Int 2004; 15: 1–7.
- [28] Lane NE, Sanchez S, Modin GW, et al. Parathyroid hormone treatment can reverse corticosteroid-induced osteoporosis. Results of a randomized comntrolled clinical trial. J Clin Invest 1998; 102: 1627–1633.
- [29] Lane NE, Sanchez S, Modin GW, et al. Bone mass continues to increase at the hip after parathyroid hormone treatment is discontinued in glucocorticoid-induced osteoporosis. Results of a randomized controlled clinical trial. J Bone Miner Res 2000; 15: 944–951.
- [30] Rehman Q, Lang TF, Arnaud CD, et al. Daily treatment with parathyroid hormone is associated with an increase in vertebral cross-sectional area in postmenopausal women with glucocorticoid-induced osteoporosis. Osteoporos Int 2003; 14: 77–81.
- [31] Ma YL, Bryant HU, Zeng Q, et al. Raloxifene and teriparatide (hPTH 1-34) have complementary effects on the osteopenic skeleton of ovariectomized rats. J Bone Miner Res 2005; 20 (Suppl): 62–68.
- [32] Deal C, Omizo M, Schwartz EN, et al. Combination teriparatide and raloxifene therapy for postmenopausal osteoporosis: Results from a 6-month double-blind placebo-controlled trial. J Bone Miner Res 2005; 20: 1905–1911.
- [33] McClung MR, San Martin J, Miller PD, et al. Opposite bone remodeling effects of teriparatide and alendronate in increasing bone mass. Arch Intern Med 2005; 165: 1762–1768.
- [34] Arlot M, Meunier PJ, Boivin G, et al. Differential effects of teriparatide and alendronate on bone remodeling in postmenopausal women assessed by histomorphometric parameters. J Bone Miner Res 2005; 20: 1244–1253.
- [35] Finkelstein JS, Hayes A, Hunzelman JL, et al. The effects of parathyroid hormone, alendronate, or both in men with osteoporosis. N Engl J Med 2003; 349: 1216–1226.
- [36] Cosman F, Nieves J, Zion M, et al. Daily and cyclic parathyroid hormone in women receiving alendronate. N Engl J Med 2005; 353: 566–576.
- [37] Ettinger B, San Martin J, Crans G, Pavo I. Differential effects of teriparatide on BMD after treatment with raloxifene or alendronate. J Bone Miner Res 2004; 19: 745–751.
- [38] Hwang JS, Tu ST, Yang TS, et al. Teriparatide vs. Calcitonin in the treatment of Asian postmenopausal women with established osteoporosis. Osteoporos Int 2006; 17: 373–378.
- [39] Holzer G, Majeska RJ, Lundy MW, et al. Parathyroid hormone enhances fracture healing. A preliminary report. Clin Orthop Relat Res 1999; 366: 258–263.
- [40] Alkhiary YM, Gerstenfeld LC, Krall E, et al. Enhancement of experimental fracture-healing by systemic administration of recombinant human parathyroid hormone (PTH 1-34). J Bone Joint Surg Am 2005; 87: 731–741.
- [41] Hodsman AB, Bauer DC, Dempster DW, et al. Pathyroid hormone and teriparatide for the treatment of osteoporosis: a review of the evidence and suggested guidelines for its use. Endocr Rev 2005; 26: 688–703.
- [42] Tashjian AH, Gagel RF. Teriparatide [human PTH (1-34)]: 2.5 years of experience on the use and safety of the drug for the treatment of osteoporosis. J Bone Miner Res 2005; 20: 354–365.
- [43] Codrons V, Vanderbist F, Verbeeck RK, et al. Systemic delivery of parathyroid hormone (1-34) using inhalation dry powders in rats. J Pharm Sci 2003; 92: 938–950.
- [44] Fox J, Smith S, Jolette J, et al. A no observable carcinogenic effect dose level identified in Fischer 344 rats following daily treatment with PTH (1-84) for 2 years: Role of the C-terminal PTH receptor. Calcified Tissue Int 2006; 78 (Suppl 1): S105 (P263).
- [45] Black DM, Bilezikian JP, Ensrud KE, et al. One year of alendronate after one year of parathyroid hormone (1-84) for osteoporosis. N Engl J Med 2005; 353: 555–565.
- [46] Nemeth EF. The search for calcium receptor antagonists (calcilytics). J Molecul Endocrinol 2002; 29: 15–21.
- [47] Petrel C, Kessler A, Maslah F, et al. Modeling and mutagenesis of the binding site of Calhex 231, a novel negative allosteric modulator of the extracellular Ca2+-sensing receptor. J Biol Chem 2003; 278: 487–494.
- [48] Reginster JV, Deroisy R, Jupsin I. Strontium ranelate: a new paradigm in the treatment of osteoporosis. Drugs Today 2003; 39: 89–101.
- [49] Pors Nielsen S. The biological role of strontium. Bone 2004; 35: 583–588.
- [50] Marie PJ, Ammann P, Boivin G, et al. Mechanisms of action and therapeutic potential of strontium in bone. Calcif Tissue Int 2001; 69: 121–129.
- [51] Canalis E, Hott M, Deloffre P, et al. The divalent strontium salt S12911 enhances bone cell replication and bone formation in vitro. Bone 1996; 18: 517–523.
- [52] Barbara A, Delannoy P, Denis BG, Marie PJ. Normal matrix mineralization induced by strontium ranelate in MC3T3-E1 osteogenic cells. Metabolism 2004; 53: 532–537.
- [53] Brennan T, Rybchyn MS, Conigrave AD, et al. Strontium ranelate effect on proliferation and OPG expression in osteoblasts. Calcified Tissue Int 2006; 78 (Suppl 1): S129.
- [54] Baron R, Tsouderos Y. In vitro effects of S12911-2 on osteoclast function and bone marrow macrophage differentiation. Eur J Pharmacol 2002; 450: 11–17.
- [55] Takahashi N, Sasaki T, Tsouderos Y, Suda T. S12911-2 inhibits osteoclastic bone resorption in vitro. J Bone Miner Res 2003; 18 (6): 1082–1087.
- [56] Mentaverri R, Hurtel AS, Kamel S, et al. Strontium directly stimulates osteoclast apoptosis. Osteoporos Int 2004; 15: S92 (P345).
- [57] Quinn SJ, Kifor O, Chattopadhyay N, et al. Strontium is a full agonist of the extracellular calcium-sensing receptor (CaR) transfected in human embryonic kidney cells. Osteoporos Int 2004; 15: S107 (P392).
- [58] Pi M, Quarles LD. A novel cation-sensing mechanism in osteoblasts is a molecular target for strontium. J Bone Miner Res 2004; 19: 862–869.
- [59] Delannoy P, Bazot D, Marie PJ. Long-term treatment with strontium ranelate increases vertebral bone mass without deleterious effect in mice. Metabolism 2002; 51: 906–911.
- [60] Hott M, Deloffre P, Tsouderos Y, Marie PJ. S12911-2 reduces bone loss induced by short-term immobilization in rats. Bone 2003; 33: 115–123.
- [61] Henrotin Y, Labasse A, Zheng SX, et al. Strontium ranelate increases cartilage matrix formation. J Bone Miner Res 2001; 16: 299–308.
- [62] Boivin G, Farlay D, Panczer G, et al. Long-term strontium ranelate administration in monkeys: effects on mineral crystals and on the degree of mineralisation of bone. J Bone Miner Res 2001;16 (Suppl 1): SA401.
- [63] Meunier PJ, Reginster JY. Design and methodology of the phase 3 trials for the clinical development of strontium ranelate in the treatment of women with postmenopausal osteoporosis. Osteoporos Int 2003; 14 (Suppl 3): S66–S76.
- [64] Meunier PJ, Roux C, Seeman E, et al. The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. N Engl J Med 2004; 350:459–468.
- [65] Reginster JY, Seeman E, De Vernejoul MC, et al. Strontium Ranelate Reduces the Risk of Nonvertebral Fractures in Postmenopausal Women with Osteoporosis: Treatment of Peripheral Osteoporosis (TROPOS) Study. J Clin Endocrinol Metab 2005; 90: 2816–2822.
- [66] Roux C, Reginster JY, Fechtenbaum J, et al. Vertebral fracture risk reduction with strontium ranelate in women with postmenopausal osteoporosis is independent of baseline risk factors. J Bone Miner Res 2006; 21: 536–542.
- [67] Kendler DL. Strontium ranelate – data on vertebral and nonvertebral fracture efficacy and safety: mechanism of action. Curr Osteoporos Rep 2006; 4: 34–39.
- [68] Burlet N, Reginster JY. Strontium ranelate: the first dual acting treatment for postmenopausal osteoporosis. Clin Orthop Relat Res 2006; 443: 55–60.