Syndrom porušeného vnímání hypoglykemie a možnosti jeho léčby
Cílem moderní léčby diabetu je přiblížit se co nejvíce normálním hodnotám glykemie. Limitem současné farmakologické léčby však jsou hypoglykemické epizody, jež mohou narušovat každodenní život a v extrémním případě vést i ke smrti. Rizikovým faktorem pro vznik hypoglykemie je tzv. syndrom porušeného vnímání hypoglykemie, který komplikuje 5–10 % případů dlouhotrvajícího diabetu 1. typu a vyskytuje se i u diabetu 2. typu závislého na léčbě inzulinem. Nadměrná dávka inzulinu není vyrovnána včasnou kontraregulační sekrecí glukagonu v A buňkách pankreatu a zároveň je porušena centrální aktivace sympatoadrenálního systému. V důsledku toho nejenže nedochází k dostatečné novotvorbě glukózy v játrech, ale chybějí také varovné stresové příznaky, které pacienta upozorňují na nutnost perorálního příjmu cukru. Opakované hypoglykemie vedou k tomu, že se dále snižuje nastavení centrálních receptorů glykemie a porucha se prohlubuje. Ke zlepšení tohoto stavu může vést důsledné předcházení rekurentním poklesům hladiny glukózy, jež se ovšem musí opírat o intenzivní monitorování glykemie. Reálnou možnost pro léčbu syndromu porušeného vnímání hypoglykemie představuje obnova endogenní sekrece inzulinu transplantací celého pankreatu nebo izolovaných Langerhansových ostrůvků.
Úvod
Zvýšená hladina krevního cukru je hlavním diagnostickým kritériem diabetu. Typické klinické symptomy vznikají až při vysokých hodnotách glykemie, ale z dlouhodobého hlediska se může i malá odchylka podílet na vzniku charakteristických pozdních orgánových komplikací. V rámci komplexní léčby, která mimo jiné zahrnuje kontrolu tělesné hmotnosti, krevního tlaku a hladin cholesterolu, zaujímá udržování hodnot glykemie blízko normě ústřední postavení.
Prevence pozdních komplikací versus hypoglykemie
Těsná kontrola diabetu prokazatelně snižuje riziko vzniku a rozvoje diabetické retinopatie, nefropatie a polyneuropatie, a to jak u pacientů s diabetem 1. typu, tak i u diabetiků 2. typu [1, 2]. Včasná dlouhodobá kontrola snižuje také riziko postižení velkých cév se všemi jeho důsledky [3]. Jinými slovy, hlavním cílem dlouhodobé léčby diabetu by mělo být udržování hladiny glykemie co nejblíže fyziologickému rozmezí. Regulace hladiny krevního cukru je však porušena oběma směry, a naše úsilí tak naráží na další nebezpečí, kterým je naopak hypoglykemie.
Při regulaci glykemie se uplatňuje řada neurálních, hormonálních a metabolických faktorů. Nejdůležitější pozici však zaujímá inzulin. Sekrece inzulinu klesá nebo zcela zaniká u všech onemocnění, která postihují B-buňky pankreatu. Tak je tomu typicky u diabetu 1. typu, ale také v mnoha případech u diabetu 2. typu, kdy jsou tyto buňky vystaveny metabolickému stresu a postupně zanikají. Jsou-li B-buňky zachovány, je ještě možné jejich endogenní sekreci stimulovat inzulinovými sekretagogy. Dnes mezi ně patří zejména deriváty sulfonylmočoviny, glinidy a do určité míry analoga GLP-1 (glukagon-like peptide-1, glukagonu podobného peptidu 1) a inhibitory DPP-4 (dipeptidylpeptidázy-4). U diabetu 1. typu je nutné inzulin farmakologicky substituovat vždy a podobně tomu tak je i v pokročilejším stadiu diabetu 2. typu, přičemž včasné zahájení léčby inzulinem, ať již v kombinaci s perorálními antidiabetiky, či samostatně, je i v tomto případě doporučováno stále častěji [4].
Iatrogenní hypoglykemie
Poločas inzulinu v krvi je v řádu minut, a jakmile glykemie začne klesat zhruba pod 4,8 mmol/l, jeho sekrece se velmi rychle snižuje a při hodnotách okolo 4 mmol/lpadá téměř k nule. Tak tomu ale není u inzulinu, který se do těla dostává ve formě léku, typicky aplikovaného podkožně. Jeho vstřebávání do periferní krve nadále pokračuje v závislosti na dávce a typu přípravku bez ohledu na aktuální hladinu glykemie, přičemž podobná situace může nastat i v případě endogenního inzulinu, pokud je jeho sekrece stimulována léky. Zabránit nežádoucímu poklesu glykemie pak mohou pouze kontraregulační mechanismy nebo pacient sám, pokud si klesající hodnotu zjistí nebo včas rozpozná příznaky nastupující hypoglykemie. Tu pak koriguje příjmem sacharidů.
Symptomatické hypoglykemie jsou u diabetiků 1. typu běžnou součástí života. V průměru se udávají asi dvě epizody týdně, tedy i tisíce příhod v průběhu života, z nichž alespoň jedna ročně bývá tak závažná, že vyžaduje hospitalizaci či pomoc další osoby [5]. Těžká hypoglykemie vede k poruše funkce mozku, která se typicky upravuje po podání glukózy. Může ale také vést k náhlé srdeční arytmii, náhlé smrti či k poškození mozku [6].
Úmrtí v důsledku hypoglykemie je pravděpodobně mnohem častější, než se dříve předpokládalo. Nové studie ukazují, že 6–10 % úmrtí pacientů s diabetem 1. typu souvisí s hypoglykemií [7–9]. Podobné případy jsou u diabetiků 2. typu sice vzácnější, ale novější studie naznačují, že i zde může být snaha o těsnou metabolickou kompenzaci paradoxně spjata s vyšší mortalitou [10, 11]. Vzácně tomu tak je při užití látek, které pouze zlepšují tkáňovou citlivost vůči inzulinu (zejména metformin a thiazolidindiony), ale i ty se mohou podílet na vzniku hypoglykemie, pokud jsou kombinovány s inzulinovými sekretagogy či se samotným inzulinem.
Fyziologická reakce na hypoglykemii
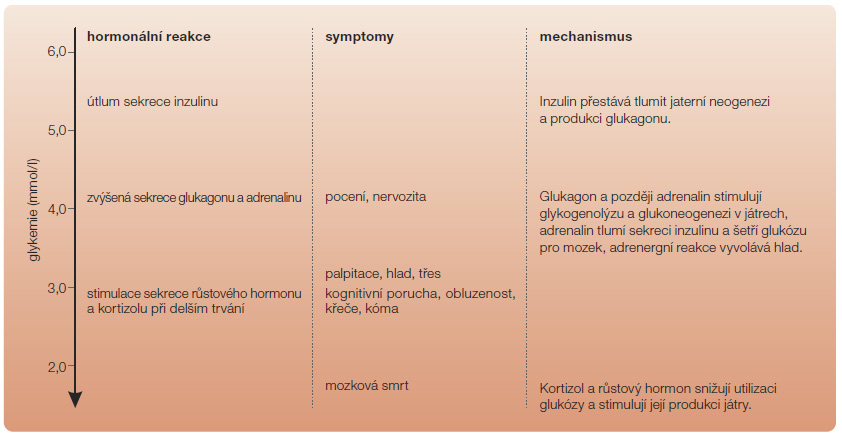 Obrázky 1 a 2 porovnávají reakce organismu na hypoglykemii za normálních okolností a při diabetu. Vedle zastavení produkce inzulinu je druhým důležitým mechanismem uvolňování glukagonu A-buňkami Langerhansových ostrůvků. A-buňky jsou sice u nemocných s oběma typy diabetu zachovány, nicméně postrádají trvalou parakrinní stimulaci B-buňkami, a zejména při diabetu 1. typu typicky reagují málo a opožděně [12]. Klíčovou úlohu tak přebírá třetí mechanismus, kterým je aktivace sympatoadrenální osy. Její primární úlohou j
Obrázky 1 a 2 porovnávají reakce organismu na hypoglykemii za normálních okolností a při diabetu. Vedle zastavení produkce inzulinu je druhým důležitým mechanismem uvolňování glukagonu A-buňkami Langerhansových ostrůvků. A-buňky jsou sice u nemocných s oběma typy diabetu zachovány, nicméně postrádají trvalou parakrinní stimulaci B-buňkami, a zejména při diabetu 1. typu typicky reagují málo a opožděně [12]. Klíčovou úlohu tak přebírá třetí mechanismus, kterým je aktivace sympatoadrenální osy. Její primární úlohou j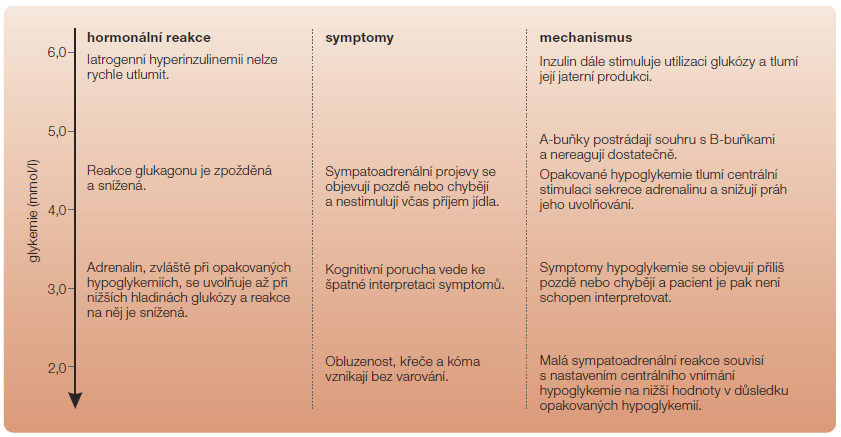 e zajistit dostatek glukózy pro mozek. Pomocí periferně i centrálně lokalizovaných senzorů glykemie se aktivuje autonomní periferní i centrální nervstvo a důsledkem je jak uvolňování noradrenalinu v nervových spojeních, tak i stimulace dřeně nadledvin, kde se uvolňuje adrenalin. Uvolňování adrenalinu je rovněž zprostředkováno autonomními nervy. Oba hormony vyvolávají klinické příznaky hypoglykemie. Adrenalin navíc několika
e zajistit dostatek glukózy pro mozek. Pomocí periferně i centrálně lokalizovaných senzorů glykemie se aktivuje autonomní periferní i centrální nervstvo a důsledkem je jak uvolňování noradrenalinu v nervových spojeních, tak i stimulace dřeně nadledvin, kde se uvolňuje adrenalin. Uvolňování adrenalinu je rovněž zprostředkováno autonomními nervy. Oba hormony vyvolávají klinické příznaky hypoglykemie. Adrenalin navíc několika 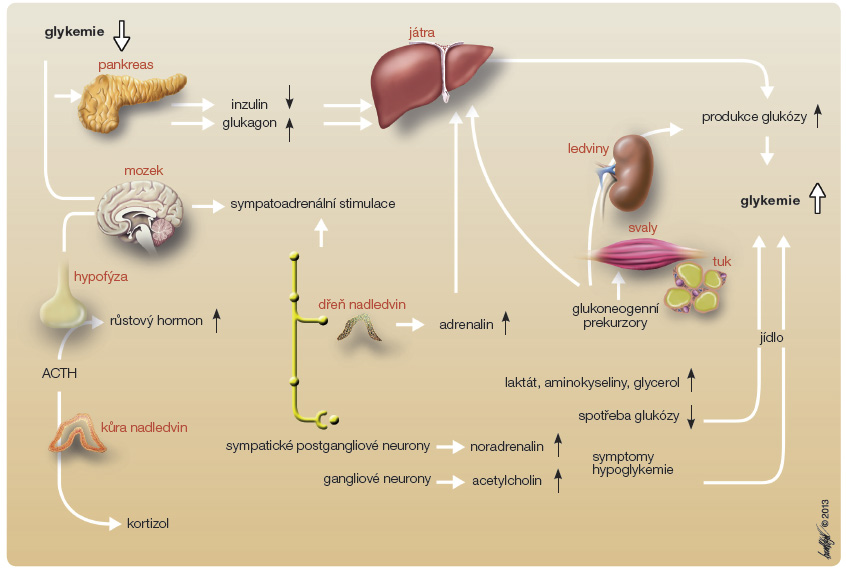 mechanismy zvyšuje hladinu glukózy: tlumí sekreci inzulinu, stimuluje A-buňky, zvyšuje jaterní a svalovou produkci glukózy, stimuluje syntézu glukózy v játrech a tlumí její periferní využití ve prospěch mozku. Mechanismus přirozené komplexní reakce organismu na hypoglykemii znázorňuje obr. 3.
mechanismy zvyšuje hladinu glukózy: tlumí sekreci inzulinu, stimuluje A-buňky, zvyšuje jaterní a svalovou produkci glukózy, stimuluje syntézu glukózy v játrech a tlumí její periferní využití ve prospěch mozku. Mechanismus přirozené komplexní reakce organismu na hypoglykemii znázorňuje obr. 3.
Syndrom porušeného vnímání hypoglykemie
Postižení autonomního nervového systému patří mezi typické orgánové poruchy dlouhotrvajícího diabetu a projevuje se v různých oblastech. U diabetu však nedochází pouze k narušení neurálního přenosu kontraregulačních reakcí. V důsledku opakovaných, často i mírných hypoglykemií dochází k zatím ne zcela objasněné adaptaci centrálních nervových senzorů na hypoglykemii, což vede k postupnému posunu glykemického prahu pro kontraregulační stimulaci. Tento jev se podařilo experimentálně potvrdit také u zdravých osob, u nichž uměle vyvolaná hypoglykemie den před testem vedla k utlumení kontraregulační sympatoadrenální reakce při hypoglykemii vzniklé následujícího dne [13].
Závažnost poruchy vzrůstá s frekvencí hypoglykemií, jejich stupněm a také v souvislosti s rozvojem dalších mikroangiopatických komplikací diabetu. Porucha u některých osob dosahuje takové míry, že zásadně narušuje kvalitu života nebo vede přímo k jeho ohrožení. Malá odpověď sympatického nervstva spolu s opožděnou a nízkou produkcí adrenalinu má za následek absenci varovných příznaků hypoglykemie, mezi něž patří zejména pocení, bušení srdce, třes, pocity brnění a nervozita. Nízká hladina glukózy vede také ke kognitivní poruše, takže pacienti nemusí být schopni svoji situaci interpretovat, nebo se dokonce brání cizí pomoci. I když se potom glykemie spontánně upraví (příjmem potravy či podáním glukózy nebo glukagonu), následuje zpravidla hyperglykemie, vegetativní dysbalance a nevolnost. Nastupující hyperglykemie pak vyžaduje další korekci.
![Obr. 4 Schéma „začarovaného kruhu“ při syndromu autonomního selhání spojeného s hypo- glykemií; podle [14] – Cryer, 2008.](https://www.remedia.cz/photo-a-29153---.jpg) Tak se nakonec uzavře opakující se kruh, který se v popsané formě označuje jako „hypoglycemia-associated autonomic failure“ (HAAF), viz obr. 4 [14, 15]. V širším smyslu se tato porucha označuje také jako „syndrom porušeného vnímání hypoglykemie“, který zejména naznačuje, že pacient kvůli chybějícím varovným příznakům včas nerozpoznává nastupující hypoglykemii a není schopen adekvátně reagovat. Důsledky takto probíhající hypoglykemie mohou být velmi závažné a pacienti se tak často pohybují v pásmu nebezpečných hodnot, které dále posilují labilitu diabetu a urychlují rozvoj mikroangiopatických komplikací. U některých pacientů vznikají nerozpoznané hypoglykemie typicky v noci [16] nebo v průběhu fyzické zátěže či i několik hodin po ní [17], často opět v noci [18]. Opakované těžké hypoglykemie také mohou vést postupně k demenci, která pacientovu ochranu vůči iatrogenní hypoglykemii definitivně podlomí.
Tak se nakonec uzavře opakující se kruh, který se v popsané formě označuje jako „hypoglycemia-associated autonomic failure“ (HAAF), viz obr. 4 [14, 15]. V širším smyslu se tato porucha označuje také jako „syndrom porušeného vnímání hypoglykemie“, který zejména naznačuje, že pacient kvůli chybějícím varovným příznakům včas nerozpoznává nastupující hypoglykemii a není schopen adekvátně reagovat. Důsledky takto probíhající hypoglykemie mohou být velmi závažné a pacienti se tak často pohybují v pásmu nebezpečných hodnot, které dále posilují labilitu diabetu a urychlují rozvoj mikroangiopatických komplikací. U některých pacientů vznikají nerozpoznané hypoglykemie typicky v noci [16] nebo v průběhu fyzické zátěže či i několik hodin po ní [17], často opět v noci [18]. Opakované těžké hypoglykemie také mohou vést postupně k demenci, která pacientovu ochranu vůči iatrogenní hypoglykemii definitivně podlomí.
Rizikové faktory
Hlavním rizikovým faktorem pro vznik hypoglykemie u pacientů s diabetem je pochopitelně absolutně nebo relativně vysoká dávka inzulinu nebo hypoglykemizujícího léku, který stimuluje produkci inzulinu (u pacientů s diabetem 2. typu). Tyto faktory jsou přehledně shrnuty v tab. 1. Je možné je rozdělit na typické a dále na ty, které se uplatňují 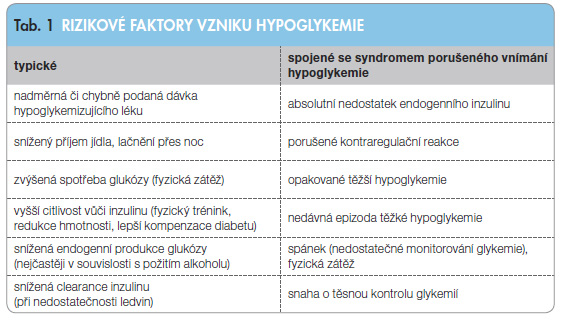 zejména u pacientů se syndromem autonomního selhání vyvolaného předchozími hypoglykemiemi (HAAF). Klíčovou úlohu hraje stupeň deficience endogenního inzulinu, neboť i jeho malá reziduální sekrece podléhá v případě hypoglykemie regulaci a frekvence hypoglykemií je prokazatelně nižší u osob, u kterých je sekrece endogenního inzulinu stále ještě přítomna [5].
zejména u pacientů se syndromem autonomního selhání vyvolaného předchozími hypoglykemiemi (HAAF). Klíčovou úlohu hraje stupeň deficience endogenního inzulinu, neboť i jeho malá reziduální sekrece podléhá v případě hypoglykemie regulaci a frekvence hypoglykemií je prokazatelně nižší u osob, u kterých je sekrece endogenního inzulinu stále ještě přítomna [5].
Důležité je také stanovit, o jak těsnou kontrolu glykemií budeme u konkrétního pacienta usilovat. Mezi rizikovými faktory se někdy uvádí léčba β-adrenergními blokátory, jež by mohly tlumit jaterní produkci glukózy a maskovat symptomy hypoglykemie. Tyto efekty se však (zvláště u kardioselektivních přípravků) v klinické studii prakticky nepodařilo spolehlivě prokázat [19].
Diagnostika
Diagnostika syndromu porušeného vnímání hypoglykemie se opírá především o anamnestické údaje. Pojem hypoglykemie přitom nemusí odpovídat dolní hranici normy udávané u zdravých osob a je do určité míry subjektivní. Americká diabetologická asociace (ADA) definuje hypoglykemii u pacientů s diabetem jako jakoukoliv epizodu nízké hladiny glukózy, která vystavuje pacienta potenciálnímu riziku. ADA doporučuje, aby za varovnou hodnotu byla považována již samostatně zjištěná plazmatická koncentrace hladiny glukózy ≤ 3,9 mmo/l [20].
Rozpoznávání hypoglykemie lze objektivizovat sledováním různých autonomních symptomů. V praxi lze nejlépe využít jednoduchý dotazník [15] a případně jej kombinovat se sledováním těchto subjektivních údajů, které pacient udává v průběhu kontinuálního monitorování glykemií prováděného pomocí podkožního senzoru při nízkých hladinách glykemie [21]. Plně vyjádřený syndrom HAAF zahrnuje kromě samotného porušeného subjektivního rozpoznávání hypoglykemie také poruchu kontraregulačních hormonálních reakcí. Její průkaz, např. v průběhu hypoglykemického clampu, je však náročný a v praxi se nepoužívá.
Prevence a léčba
Preventivní a léčebná opatření u pacientů, kteří často mívají symptomatické hypoglykemie nebo kteří přímo trpí syndromem porušeného vnímání hypoglykemie, vyžadují především rozpoznání vyvolávajících faktorů. Frekvenci a závažnost hypoglykemických epizod je nutné zjišťovat u každého pacienta léčeného hypoglykemizujícími léky. Je nutné hledat souvislosti a zjevné chyby a zjišťovat, zda obava pacienta z hypoglykemií není příčinou nedostatečného léčebného efektu. U každého pacienta je nutné individuálně posoudit známé rizikové faktory progrese komplikací diabetu a stanovit cílové hodnoty glykemií a glykovaného hemoglobinu. Při tom je třeba vzít v úvahu také pacientovy schopnosti a riziko, jež pro něho může znamenat výskyt případné hypoglykemie.
Vyjdeme-li z premisy, že každá další hypoglykemie vede ke zhoršení kontraregulačních reakcí a schopnosti hypoglykemii rozpoznávat, je především nutné stabilizovat glykemie na přijatelných hodnotách a vyvarovat se nežádoucího poklesu pod varovné hodnoty. V několika pracích bylo nezávisle potvrzeno, že úspěšná stabilizace na dobu 2–3 týdnů zvrátila poruchu rozpoznávání hypoglykemií a u většiny pacientů zlepšila kontraregulační reakce [22–24]. Stabilizování glykemie u pacientů s diabetem 1. typu zahrnuje podávání inzulinu ve 3–4denních dávkách (či inzulinovou pumpou), a to tak, aby se předpokládané hladiny inzulinu i glukózy co nejvíce blížily stanovenému limitu. K tomu je zapotřebí nejen trvale monitorovat glykemie (správně 4krát i vícekrát denně), ale také pacienta náležitě motivovat a vyškolit, aby samostatně dokázal svůj léčebný režim přizpůsobit aktuálním podmínkám. Režim by měl být flexibilní, cíle terapie by měly být zvoleny individuálně a pacient by měl mít k dispozici nejen potřebné technické vybavení, ale také zázemí kvalifikovaného týmu.
Obecně lze pacientům doporučit následující opatření:
- Dávat přednost krátce působícím inzulinovým analogům před lidským inzulinem, protože mají menší variabilitu účinku. Nižší počet nočních hypoglykemií byl také zaznamenán při náhradě inzulinů NPH analogy s prodlouženým účinkem (glargin).
- Ověřit přítomnost varovných příznaků při hodnotách glykemie okolo 3,9–3,5 mmol/l. Jejich chybění naznačuje poruchu rozpoznávání hypoglykemie.
- Pro pacienty s touto poruchou volit vyšší hodnoty cílových glykemií a hodnotu glykovaného hemoglobinu převyšující 5 %. Teprve pokud se po dobu alespoň 14 dní hypoglykemie nevyskytují a rozpoznávání hypoglykemie se zlepší, je možné cílové hodnoty snížit.
- U pacientů s diabetickou gastroparézou je vhodná inzulinová pumpa, a to s volbou spíše rozložených než okamžitých bolusových dávek.
- Vyhnout se ukvapené korekci hyperglykemie opakovaným podáním bolusových dávek inzulinu. Vstřebávání i rychle působících inzulinů z podkoží není úplné ani po třech hodinách a inzulin se může v těle kumulovat.
- Před fyzickou zátěží by glykemie měla být vyšší než 5 mmol/l a v průběhu zátěže je vhodné požití malé dávky sacharidů.
- Je nutné ověřit vhodný poměr bolusového inzulinu a postprandiální glykemie. Ta by za dvě hodiny po jídle rozhodně neměla klesat pod výchozí hodnotu.
- Pro pacienty s přetrvávající poruchou rozpoznání glykemií a HAAF by alespoň přechodně mělo být použito kontinuální monitorování pomocí podkožního senzoru s možností alarmu při klesajících hodnotách.
Moderní léčebné přístupy a výhled do budoucna
Praktická léčba diabetu je plně založena na empirickém přístupu. Pokud selhává endogenní sekrece inzulinu, je nutné jej nahradit farmakologicky a jeho dávky volit podle zkušenosti s přihlédnutím k naměřeným hodnotám glykemie. Velký pokrok pro řízení inzulinové léčby znamenají kontinuální podkožní senzory koncentrace glukózy, které jsou však pro svoji cenu jen omezeně dostupné pro dlouhodobé použití. Ve spojení s náležitou edukací jsou však zatím nejvhodnějším prostředkem pro zlepšení léčby pacientů se syndromem porušeného vnímání hypoglykemie. Přispívají ke stabilizaci diabetu a snižují výskyt závažných hypoglykemických epizod [25]. Výhodné je jejich použití v kombinaci se zevní inzulinovou pumpou [26], která by v krátké budoucnosti mohla být alespoň v průběhu kritického nočního období zpětnovazebně regulována, aby se předešlo nočním hypoglykemiím [27].
Při vývoji zpětnovazebné regulace by se také v prevenci hypoglykemie mohlo uplatnit řízené podávání glukagonu jako součást bioarteficiálního pankreatu [28]. V prevenci nočních hypoglykemií prokázal očekávaný účinek β2-adrenergní agonista terbutalin [29], ale nevýhodou je, že nepůsobí v závislosti na aktuální glykemii. Relevantní pro některé pacienty by mohlo být užívání adenosinového antagonisty kofeinu, který stimuluje uvolňování katecholaminů a reakci na hypoglykemii [30].
Podobně i fluoxetin (selektivní inhibitor zpětného vychytávání serotoninu) zvyšuje hladinu adrenalinu a nervovou sympatickou odpověď při hypoglykemii [31]. Protože se při hypoglykemii stejně jako při cvičení uvolňuje β-endorfin, který moduluje centrální autonomní systém, mohla by inhibice jeho receptorů vést ke zmírnění projevů HAAF v průběhu fyzické zátěže [32] a zlepšit u diabetiků odpověď adrenalinu na opakovanou hypoglykemii, jak se to nedávnou podařilo ukázat s použitím naloxonu [33].
Hypoglykemie by pochopitelně eliminovaly postupy, které by vedly k obnovení glukózou regulované inzulinové sekrece. To je zatím možné jen u vybrané skupiny pacientů, kteří podstupují orgánovou transplantaci pankreatu nebo izolovaných Langerhansových ostrůvků [34]. Protože je tento způsob léčby závislý na dostupnosti vhodných pankreatů od zemřelých dárců a také proto, že vyžaduje trvalé podávání imunosupresivní léčby, používá se zatím zejména u pacientů s diabetem 1. typu a chronickou nedostatečností ledvin, kteří současně podstupují transplantaci ledviny.
Pro pacienty, kteří trpí závažnou formou syndromu porušeného vnímání hypoglykemie a u nichž konvenční postupy nejsou účinné, však transplantace představuje někdy jedinou možnost, jak lze zásadním způsobem zlepšit kvalitu života. Po úspěšné transplantaci pankreatu pacient nepotřebuje exogenní inzulin a prakticky se u něj nevyskytují závažnější hypoglykemie. Navíc se ukazuje, že postupem času dochází ke zlepšení subjektivního vnímání uměle navozených nízkých hodnot glykemie. Do určité míry se také zlepšuje i dříve porušená sekrece glukagonu a adrenalinu při hypoglykemii [34]. Transplantace ostrůvků sice zatím nenavodí u většiny příjemců úplnou nezávislost na zevním inzulinu, ale spolehlivě eliminuje hypoglykemické epizody při inzulinové léčbě [35]. Po transplantaci se zlepšuje rozpoznávání hypoglykemie, zvyšuje se práh kontraregulačních reakcí při hypoglykemii a zlepšuje se endogenní produkce adrenalinu i glukagonu u pacientů, kteří předtím trpěli závažnou poruchou [36–38].
Indikace pro ostrůvkovou transplantaci však musí být pečlivě zvážena zejména s ohledem na vedlejší účinky terapie imunosupresivními léky. Je pravděpodobné, že nové poznatky v buněčné terapii umožní připravit in vitro dostatečné množství inzulin produkující tkáně, která je schopna regulované kontroly glykemie. Právě dostupnost takovéto tkáně pro větší počet pacientů bude znamenat zásadní zvrat v terapeutickém přístupu k těm nemocným, kteří jsou při současném způsobu léčby diabetu hypoglykemiemi ohroženi.
Seznam použité literatury
- [1] The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. The Diabetes Control and Complications Trial Research Group. N Engl J Med 1993; 329: 977–986.
- [2] Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group. Lancet 1998; 352: 837–853.
- [3] Holman RR, Paul SK, Bethel MA, et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008; 359: 1577–1589.
- [4] Gerstein HC, Bosch J, Dagenais GR, et al. Basal insulin and cardiovascular and other outcomes in dysglycemia. N Engl J Med; 367: 319–328.
- [5] Risk of hypoglycaemia in types 1 and 2 diabetes: effects of treatment modalities and their duration. Diabetologia 2007; 50: 1140–1147.
- [6] Cryer PE. Death during intensive glycemic therapy of diabetes: mechanisms and implications. Am J Med 2011; 124: 993–996.
- [7] Feltbower RG, Bodansky HJ, Patterson CC, et al. Acute complications and drug misuse are important causes of death for children and young adults with type 1 diabetes: results from the Yorkshire Register of diabetes in children and young adults. Diabetes Care 2008; 31: 922–926.
- [8] Jacobson AM, Musen G, Ryan CM, et al. Long-term effect of diabetes and its treatment on cognitive function. N Engl J Med 2007; 356: 1842–1852.
- [9] Skrivarhaug T, Bangstad HJ, Stene LC, et al. Long-term mortality in a nationwide cohort of childhood-onset type 1 diabetic patients in Norway. Diabetologia 2006; 49: 298–305.
- [10] Currie CJ, Peters JR, Tynan A, et al. Survival as a function of HbA(1c) in people with type 2 diabetes: a retrospective cohort study. Lancet 2010; 375: 481–489.
- [11] Gerstein HC, Miller ME, Byington RP, et al. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med 2008; 358: 2545–2559.
- [12] Gerich JE, Langlois M, Noacco C, et al. Lack of glucagon response to hypoglycemia in diabetes: evidence for an intrinsic pancreatic alpha cell defect. Science 1973; 182: 171–173.
- [13] Heller SR, Cryer PE. Reduced neuroendocrine and symptomatic responses to subsequent hypoglycemia after 1 episode of hypoglycemia in nondiabetic humans. Diabetes 1991; 40: 223–226.
- [14] Cryer PE. The barrier of hypoglycemia in diabetes. Diabetes 2008; 57: 3169–3176.
- [15] Mindlová M, Saudek F. Autonomní selhání způsobené recidivujícími hypoglykemiemi, jeho klinické hodnocení a terapie. Prakt Lék 2007; 87: 52–57.
- [16] Banarer S, Cryer PE. Sleep-related hypoglycemia-associated autonomic failure in type 1 diabetes: reduced awakening from sleep during hypoglycemia. Diabetes 2003; 52: 1195–1203.
- [17] Ertl AC, Davis SN. Evidence for a vicious cycle of exercise and hypoglycemia in type 1 diabetes mellitus. Diabetes Metab Res Rev 2004; 20: 124–130.
- [18] MacDonald MJ. Postexercise late-onset hypoglycemia in insulin-dependent diabetic patients. Diabetes Care 1987; 10: 584–588.
- [19] Shorr RI, Ray WA, Daugherty JR, Griffin MR. Antihypertensives and the risk of serious hypoglycemia in older persons using insulin or sulfonylureas. JAMA 1997; 278: 40–43.
- [20] Cryer PE. Preventing hypoglycaemia: what is the appropriate glucose alert value? Diabetologia 2009; 52: 35–37.
- [21] Streja D. Can continuous glucose monitoring provide objective documentation of hypoglycemia unawareness? Endocr Pract 2005; 11: 83–90.
- [22] Fanelli C, Pampanelli S, Epifano L, et al. Long-term recovery from unawareness, deficient counterregulation and lack of cognitive dysfunction during hypoglycaemia, following institution of rational, intensive insulin therapy in IDDM. Diabetologia 1994; 37: 1265–1276.
- [23] Cranston I, Lomas J, Maran A, et al. Restoration of hypoglycaemia awareness in patients with long-duration insulin-dependent diabetes. Lancet 1994; 344: 283–287.
- [24] Dagogo-Jack S, Rattarasarn C, Cryer PE. Reversal of hypoglycemia unawareness, but not defective glucose counterregulation, in IDDM. Diabetes 1994; 43: 1426–1434.
- [25] Unger J, Parkin C. Recognition, prevention, and proactive management of hypoglycemia in patients with type 1 diabetes mellitus. Postgrad Med 2011; 123: 71–80.
- [26] Bergenstal RM, Tamborlane WV, Ahmann A, et al. Effectiveness of sensor-augmented insulin-pump therapy in type 1 diabetes. N Engl J Med 2010; 363: 311–320.
- [27] Elleri D, Dunger DB, Hovorka R. Closed-loop insulin delivery for treatment of type 1 diabetes. BMC Med 2011; 9: 120.
- [28] El-Khatib FH, Russell SJ, Nathan DM, et al. A bihormonal closed-loop artificial pancreas for type 1 diabetes. Sci Transl Med 2010; 2: 27ra.
- [29] Cooperberg BA, Breckenridge SM, Arbelaez AM, Cryer PE. Terbutaline and the prevention of nocturnal hypoglycemia in type 1 diabetes. Diabetes Care 2008; 31: 2271–2272.
- [30] Richardson T, Thomas P, Ryder J, Kerr D. Influence of caffeine on frequency of hypoglycemia detected by continuous interstitial glucose monitoring system in patients with long-standing type 1 diabetes. Diabetes Care 2005; 28: 1316–1320.
- [31] Briscoe VJ, Ertl AC, Tate DB, Davis SN. Effects of the selective serotonin reuptake inhibitor fluoxetine on counterregulatory responses to hypoglycemia in individuals with type 1 diabetes. Diabetes 2008; 57: 3315–3322.
- [32] Milman S, Leu J, Shamoon H, et al. Opioid receptor blockade prevents exercise-associated autonomic failure in humans. Diabetes 2012; 61: 1609–1615.
- [33] Vele S, Milman S, Shamoon H, Gabriely I. Opioid receptor blockade improves hypoglycemia-associated autonomic failure in type 1 diabetes mellitus. J Clin Endocrinol Metab 2011; 96: 3424–3431.
- [34] Rickels MR. Recovery of endocrine function after islet and pancreas transplantation. Curr Diab Rep 2012; 12: 587–596.
- [35] Saudek F, Girman P, Kriz J, et al. Islet transplantation for treatment of type-1 diabetes mellitus. Cas Lek Cesk 2011; 150: 49–55.
- [36] Leitao CB, Tharavanij T, Cure P, et al. Restoration of hypoglycemia awareness after islet transplantation. Diabetes Care 2008; 31: 2113–2115.
- [37] Rickels MR, Schutta MH, Mueller R, et al. Islet cell hormonal responses to hypoglycemia after human islet transplantation for type 1 diabetes. Diabetes 2005; 54: 3205–3211.
- [38] Rickels MR, Schutta MH, Mueller R, et al. Glycemic thresholds for activation of counterregulatory hormone and symptom responses in islet transplant recipients. J Clin Endocrinol Metab 2007; 92: 873–879.