Taxany v léčbě karcinomu prsu
Karcinom prsu patří mezi nejčastější zhoubná onemocnění žen. V systémové léčbě prokázalo účinnost mnoho různých cytostatik. Mezi nejúčinnější cytostatika řadíme taxany, kam patří paklitaxel a docetaxel. Proběhla řada klinických studií hodnotících jejich účinnost jednak v léčbě časného, jednak v léčbě pokročilého karcinomu prsu. Přehledový článek přináší současné poznatky o užití taxanů v léčbě karcinomu prsu právě na podkladě randomizovaných klinických studií. V článku jsou zmíněny i rozdíly mezi paklitaxelem a docetaxelem.
Úvod
Karcinom prsu představuje jedno z nejčastějších zhoubných onemocnění žen. V roce 2010 činila incidence karcinomu prsu 121,14/100 000 žen a mortalita 34,25/100 000 žen [1]. Léčba karcinomu prsu je komplexní. Chemoterapie je nepostradatelnou součástí terapie tohoto zhoubného onemocnění. Mnoho cytostatik prokázalo účinnost v léčbě jak časného karcinomu prsu, tak i pokročilých stadií onemocnění. Mezi nejúčinnější a nejvíce používaná cytostatika v léčbě karcinomu prsu patří docetaxel a paklitaxel. Nejvíce klinických studií hodnotilo postavení taxanů v paliativní a adjuvantní léčbě. Cílem sdělení je poskytnout přehled o účinnosti taxanů právě ve výše zmíněných indikacích. Článek je zaměřen hlavně na porovnání taxanů s jinými cytostatiky, na vzájemné kombinace taxanů a jiných skupin cytostatik, léčebná schémata, a konečně i na vzájemné porovnání paklitaxelu a docetaxelu.
Obecná charakteristika taxanů
Taxany patří mezi cytostatika, která zabraňují depolymerizaci mikrotubulů, což vede k jejich stabilizaci. Následně je narušen průběh mitózy, podobně jako i jiné buněčné funkce, jejichž průběh je vázán na funkční mikrotubuly. Mitóza se může prodloužit až na 15 hodin. Taxany blokují také přechod G2-M buněčného cyklu. Paklitaxel byl izolován z kůry pacifického tisu (Taxus brevifolia) a z endofytické houby (Taxomyces andreanae). Postupně se zdařila i jeho úplná syntéza. Docetaxel byl připraven polysynteticky z přírodního produktu získaného z tisu (Taxus baccata). Při srovnání se zdá, že docetaxel prokazuje vyšší afinitu k vazbě na mikrotubuly, delší čas intracelulární retence, vyšší koncentraci v buňkách, vyšší procento exprese thymidinfosforylázy, vyšší indukci apoptózy a interakci s genem bcl2 v modelech in vivo a in vitro. Docetaxel charakterizuje lineární farmakokinetika a menší dávková závislost ve sr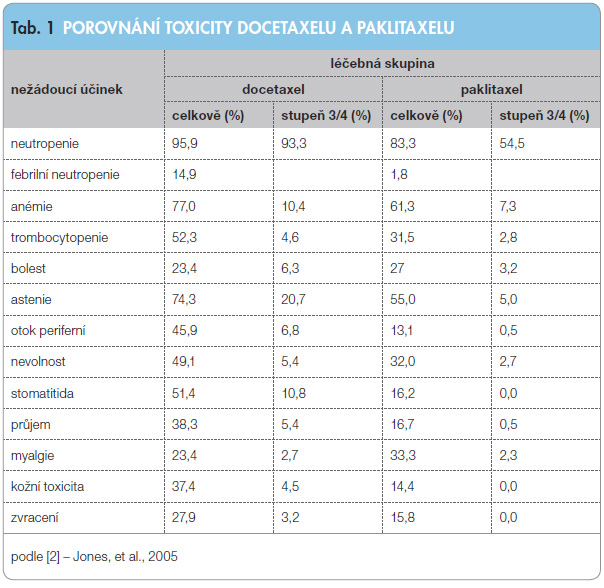 ovnání s paklitaxelem. Mezi nejčastější nežádoucí účinky taxanů patří myelotoxicita (hlavně granulocytopenie), hypersenzitivní reakce, gastrointestinální toxicita (nevolnost, zvracení, průjem, stomatitida), artralgie, myalgie, alopecie, lokální reakce. Typickým nežádoucím účinkem léčby paklitaxelem je periferní neurotoxicita, zatímco léčbu docetaxelem provázejí typické retence tekutin, únava, onycholýza. Přehled nežádoucích účinků v rámci klinické studie hodnotící třítýdenní podání paklitaxelu a docetaxelu v léčbě metastatického karcinomu prsu je prezentován v tab. 1 [2]. Spektrum nežádoucích účinků a jejich vyjádření se liší v závislosti na způsobu podání cytostatik (třítýdenní nebo týdenní aplikace, kontinuální aplikace), jak bude zmíněno níže.
ovnání s paklitaxelem. Mezi nejčastější nežádoucí účinky taxanů patří myelotoxicita (hlavně granulocytopenie), hypersenzitivní reakce, gastrointestinální toxicita (nevolnost, zvracení, průjem, stomatitida), artralgie, myalgie, alopecie, lokální reakce. Typickým nežádoucím účinkem léčby paklitaxelem je periferní neurotoxicita, zatímco léčbu docetaxelem provázejí typické retence tekutin, únava, onycholýza. Přehled nežádoucích účinků v rámci klinické studie hodnotící třítýdenní podání paklitaxelu a docetaxelu v léčbě metastatického karcinomu prsu je prezentován v tab. 1 [2]. Spektrum nežádoucích účinků a jejich vyjádření se liší v závislosti na způsobu podání cytostatik (třítýdenní nebo týdenní aplikace, kontinuální aplikace), jak bude zmíněno níže.
Taxany v léčbě metastatického karcinomu prsu
V paliativní léčbě metastatického karcinomu prsu proběhlo mnoho klinických studií, které hodnotily účinnost paklitaxelu i docetaxelu v monoterapii nebo v kombinaci s jinými cytostatiky. Paklitaxel v monoterapii prokázal účinnost jednak u pacientek nepředléčených antracykliny (celková léčebná odpověď, ORR, 35–55 %) [3–5], jednak u pacientek s onemocněním rezistentním k léčbě
antracykliny (ORR > 20 %) [6–8]. Standardní dávka paklitaxelu je 175 mg/m2 ve 3hodinovém infuzním podání každé 3 týdny. Dávka nižší než 135 mg/m2 má nižší účinnost [9]. Dávka 210 mg/m2 a 250 mg/m2 nezlepšuje ORR, přežití ani kvalitu života [10]. Kontinuální 24hodinová infuze prokázala významně vyšší ORR než 3hodinová aplikace; čas do progrese (TTP) nebo celkové přežití (OS) ale nebyly významně prodlouženy. Byla pozorována vyšší hematologická toxicita a nižší neurotoxicita [3]. Podávání paklitaxelu jednou týdně v dávce 80 mg/m2 v porovnání s aplikací výše uvedené dávky v třítýdenním intervalu prokázalo významně vyšší ORR (40 % vs. 28 %) a medián TTP (9 vs. 5 měsíců). OS bylo bez významného rozdílu. Týdenní aplikace byla provázena horší neurotoxicitou [11]. Docetaxel podobně jako paklitaxel prokázal léčebnou účinnost u předléčených pacientek s metastatickým karcinomem prsu (ORR přibližně 60 %) [12]. Standardní dávka je 100 mg/m2 podávaných v 3týdenních intervalech v monoterapii. Klinická studie hodnotila dávky 60 mg/m2, 75 mg/m2 a 100 mg/m2 v monoterapii. Byla prokázána významně vyšší závislost mezi dávkou, četností ORR (20 %, 22 %, 30 %) a mediány TTP (13, 15, 17 týdnů). OS nebylo významně prodlouženo (10,6, 10,3, 12,3 měsíce) [13]. Docetaxel podobně jako i paklitaxel lze podávat i v týdenním režimu v dávce 30–40 mg/m2 s léčebnou odpovědí dosahující 40–50 % [14]. Podávání jednou týdně je spojeno s nižším výskytem myelosuprese [15, 16], ale s vyšším výskytem kožní toxicity [17]. Taxany v léčbě metastatického karcinomu prsu lze hodnotit jednak u pacientek, které nebyly předléčeny antracykliny, jednak u pacientek s onemocněním rezistentním k léčbě antracykliny. U nemocných žen nepředléčených antracyklinem prokázal paklitaxel horší léčebné výsledky než doxorubicin [4], jiná klinická studie neprokázala rozdíly mezi oběma cytostatiky [5]. Paklitaxel také prokázal ekvivalentní účinnost s režimem CMFP (cyklofosfamid/methotrexát/ 5-fluorouracil/prednison) v první linii léčby metastatického karcinom prsu [18]. ORR (27 % vs. 35 %; p = 0,37) a medián přežití bez známek progrese (PFS; 5,3 vs. 6,4 měsíce; p = 0,25) byly podobné v obou ramenech. Docetaxel byl hodnocen v klinické studii TAX 303 s doxorubicinem. ORR byla významně vyšší u docetaxelu, podobně byl delší i TTP [19]. U pacientek předléčených antracykliny byl paklitaxel hodnocen se salvage režimem cisplatina/etoposid, kde prokázal horší výsledky ve smyslu ORR a TTP [20]. Docetaxel byl také hodnocen v monoterapii u pacientek, které byly před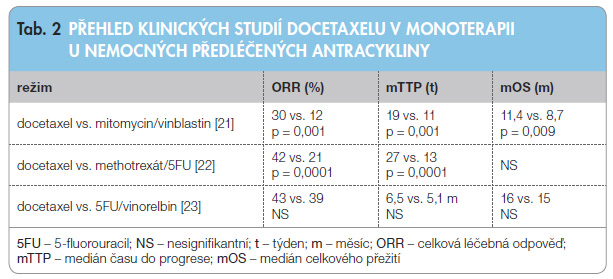 léčeny antracykliny. Dvě klinické studie prokázaly lepší výsledky docetaxelu v porovnání s kombinací mitomycin C a vinblastin nebo s kombinací methotrexát a 5-fluorouracil. Docetaxel neprokázal lepší výsledky než kombinace 5-fluorouracilu s vinorelbinem (tab. 2) [21–23].
léčeny antracykliny. Dvě klinické studie prokázaly lepší výsledky docetaxelu v porovnání s kombinací mitomycin C a vinblastin nebo s kombinací methotrexát a 5-fluorouracil. Docetaxel neprokázal lepší výsledky než kombinace 5-fluorouracilu s vinorelbinem (tab. 2) [21–23].
Na podkladě výše uvedených prací se zdá, že v monoterapii dosahuje docetaxel o něco lepších léčebných výsledků než paklitaxel. Na podobnou otázku se snažila odpovědět práce, která přímo porovnávala monoterapii paklitaxelem a docetaxelem. Klinická studie hodnotila 449 pa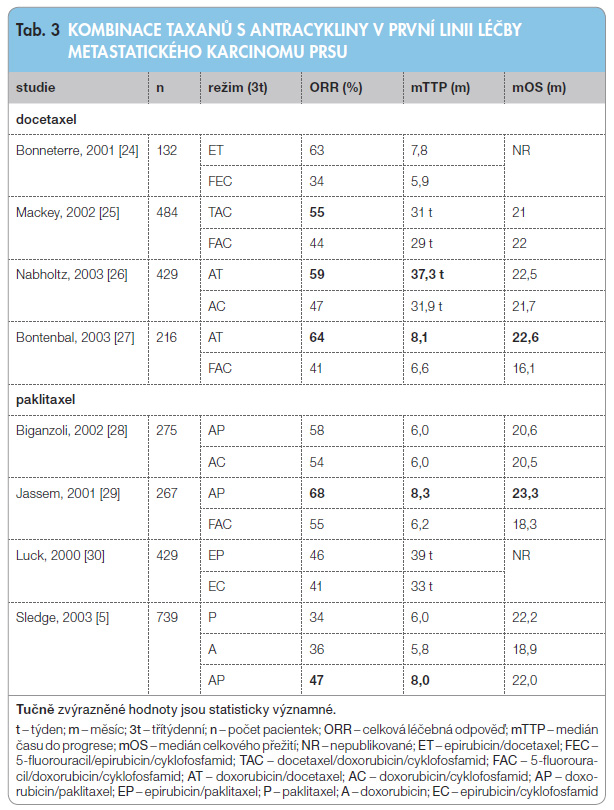 cientek, které byly předléčeny antracykliny pro metastatický karcinom prsu. Paklitaxel byl podáván v dávce 175 mg/m2, docetaxel v dávce 100 mg/m2, obě ramena ve 3týdenním režimu. ORR byla nesignifikantně vyšší v rameni s docetaxelem (32 % vs. 25 %; p = 0,1). Medián TTP byl významně delší u pacientek užívajících docetaxel (5,7 vs. 3,6 měsíce; p = 0,001), podobně i medián OS (15,4 vs. 12,7 měsíce; p = 0,03; HR 1,41; 95% CI: 1,15–1,73). Toxicita je uvedena v tab. 1 [2].
cientek, které byly předléčeny antracykliny pro metastatický karcinom prsu. Paklitaxel byl podáván v dávce 175 mg/m2, docetaxel v dávce 100 mg/m2, obě ramena ve 3týdenním režimu. ORR byla nesignifikantně vyšší v rameni s docetaxelem (32 % vs. 25 %; p = 0,1). Medián TTP byl významně delší u pacientek užívajících docetaxel (5,7 vs. 3,6 měsíce; p = 0,001), podobně i medián OS (15,4 vs. 12,7 měsíce; p = 0,03; HR 1,41; 95% CI: 1,15–1,73). Toxicita je uvedena v tab. 1 [2].
Paklitaxel a docetaxel byly hodnoceny také v kombinační léčbě metastatického karcinomu prsu. Uskutečnilo se více klinických studií, které hodnotily účinnost taxanů s antracyklinem ve srovnání se staršími antracyklinovými režimy v první linii léčby. Přehled klinických studií uvádí tab. 3.
Paklitaxel v kombinaci s doxorubicinem může zvyšovat kardiotoxicitu nejspíše na podkladě farmakokinetické interakce, která vede ke zvýšené koncentraci doxorubicinolu, což je kardiotoxický metabolit doxorubicinu [31]. Možnost obejít interakci představuje aplikace paklitaxelu den před podáním doxorubicinu nebo využití kontinuálního podání paklitaxelu po dobu 24 hodin. V roce 2008 byla publikována metaanalýza hodnotící postavení taxanů v první linii léčby metastatického karcinomu prsu. Nebyl prokázán vliv taxanů na OS pacientek ani v monoterapii, ani v kombinaci ve srovnání s antracyklinovým režimem bez taxanů. Kombinace taxanů s antracykliny v první linii byla spojena s významně delším časem do progrese, monoterapie taxany prokázala kratší TTP než režim bez taxanů. Taxany v první linii léčby metastatického karcinomu prsu by se měly indikovat v kombinaci s antracyk-
linem u nemocných s rychle progredujícím onemocněním a vyhovujícím klinickým stavem [32].
Další klinické práce hodnotily účinnost taxanů u nemocných předléčených antracykliny. Dvě klinické studie prokázaly lepší léčebné výsledky při podávání taxanů v kombinaci ve srovnání s monoterapií. První klinická studie hodnotila kombinaci docetaxel a kapecitabin proti monoterapii docetaxelem. Celkem bylo hodnoceno 511 pacientek. Kombinace prokázala významně vyšší ORR (42 % vs. 30 %), medián TTP (6,1 vs. 4,2 měsíce) i medián OS (14,5 vs. 11,5 měsíce). Toxické projevy léčby byly častější v rameni s kombinací [33]. Druhá klinická studie hodnotila kombinaci paklitaxelu s gemcitabinem proti paklitaxelu v monoterapii. Kombinace prokázala významně vyšší ORR (40,8 % vs. 22,1 %) i medián OS (18,5 vs. 15,8 měsíce) [34]. Další klinická studie nenalezla rozdíl v odpovědi na léčbu kombinací docetaxel a kapecitabin v porovnání s léčbou kombinací docetaxel a gemcitabin [35].
Taxany v adjuvantní léčbě časného karcinomu prsu Taxany prokázaly účinnost v léčbě metastatického karcinomu prsu, kde patří mezi základní cytostatika. Od poloviny devadesátých let minulého století začaly klinické studie hodnotit taxany v adjuvantní léčbě. První generace klinických studií hodnotily taxany v porovnání s režimy založenými na antracyklinech nebo v porovnání s neantracyklinovými režimy (např. režim CMF – cyklofosfamid/methotrexát/5-fluorouracil). Druhá generace klinických studií vzájemně posuzovala různé režimy taxanů, dávková schémata, kombinace, eventuálně sekvenční podání s antracykliny. Třetí generace klinických studií hodnotila kombinaci taxanů s novými látkami, hlavně s cílenou léčbou. Celkově proběhlo mnoho klinických studií, které hodnotily heterogenní populaci pacientek, různé léčebné kombinace, dávková schémata atd. Nezastupitelnou roli proto mají rozsáhlé metaanalýzy. Jedna z časných metaanalýz hodnotila 5 klinických studií, všechny prokázaly prodloužení přežití bez známek nemoci (DFS) a tři studie i prodloužení OS [36]. Další byla metaanalýza devíti klinických studií s 15 500 pacientkami. Taxany prokázaly významn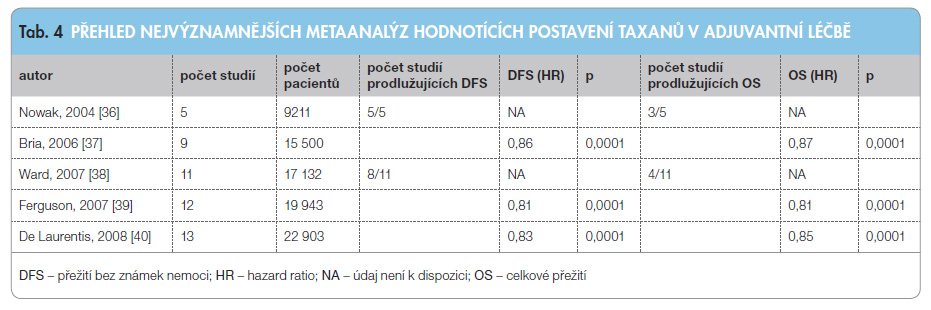 é prodloužení OS i DFS. Absolutní přínos v DFS dosahoval 3,3–4,6 % a v OS 2,0–2,8 % [37]. Jiná metaanalýza hodnotila jedenáct klinických studií, osm z nich prokázalo prodloužení DFS [38]. Následující metaanalýza prokázala význam taxanů u více než 18 000 pacientek v OS i v DFS [39]. Největší metaanalýza hodnotící téměř 23 000 pacientek ve třinácti klinických studiích také potvrdila významné zlepšení DFS i OS při zařazení taxanů do adjuvantní léčby časného karcinomu prsu. Taxany prokázaly absolutní pokles 5letého rizika o 5 % pro DFS a o 3 % pro OS [40]. V tab. 4 je uveden přehled pěti největších metaanalýz.
é prodloužení OS i DFS. Absolutní přínos v DFS dosahoval 3,3–4,6 % a v OS 2,0–2,8 % [37]. Jiná metaanalýza hodnotila jedenáct klinických studií, osm z nich prokázalo prodloužení DFS [38]. Následující metaanalýza prokázala význam taxanů u více než 18 000 pacientek v OS i v DFS [39]. Největší metaanalýza hodnotící téměř 23 000 pacientek ve třinácti klinických studiích také potvrdila významné zlepšení DFS i OS při zařazení taxanů do adjuvantní léčby časného karcinomu prsu. Taxany prokázaly absolutní pokles 5letého rizika o 5 % pro DFS a o 3 % pro OS [40]. V tab. 4 je uveden přehled pěti největších metaanalýz.
Sekvenční strategie
Účinnost taxanů byla hodnocena v kombinaci se standardní chemoterapií jednak sekvenčně, jednak konkomitantně. Jedna z prvních klinických studií (MDACC2002) [41] randomizovala 524 pacientek s postižením lymfatických uzlin nebo vysoce rizikové nemocné bez postižení lymfatických uzlin do dvou léčebných ramen. V prvním rameni bylo podáno 8 cyklů režimu FAC (5-fluorouracil/doxorubicin/cyklofosfamid), ve druhém rameni 4 cykly paklitaxelu následované 4 cykly režimu FAC. Jedná se o jednu z mála klinických studií, kde byly taxany podány před antracykliny. Léčebné výsledky nezaznamenaly významný rozdíl, nicméně byl zjištěn trend favorizující rameno s použitím paklitaxelu pro DFS (HR 0,7; p = 0,09). Klinická studie CALGB 9344 [42] ověřovala přínos přidání čtyř cyklů paklitaxelu podaných po aplikaci čtyř cyklů režimu AC (doxorubicin/cyklofosfamid) u pacientek s pozitivitou lymfatických uzlin. Celkem bylo hodnoceno 3121 nemocných žen. Přidání paklitaxelu významně prodloužilo DFS (HR 0,83; p = 0,013) i OS (HR 0,82; p = 0,0061). Součástí studie bylo i hodnocení různých dávek doxorubicinu (60, 75 a 90 mg/m2). Elevace dávky doxorubicinu neměla vliv na léčebné výsledky, byla zjištěna pouze nepatrně vyšší kardiotoxicita. Paklitaxel byl aplikován v 3týdenním intervalu ve standardní dávce 175 mg/m2. Podobný design měla i klinická studie NSABP-B28 [43], která hodnotila přínos podání čtyř cyklů paklitaxelu (225 mg/m2) po aplikaci čtyř cyklů režimu AC (doxorubicin v dávce 60 mg/m2). Celkem bylo hodnoceno 3060 pacientek s pozitivními lymfatickými uzlinami. OS nebylo významně prodlouženo (HR 0,93; p = 0,46), DFS byl významně prodloužen (HR 0,83; p = 0,006). Další klinická studie hodnotila účinnost sekvence epirubicinu a paklitaxelu [44]. Celkem bylo do studie zahrnuto 1246 nemocných žen s pozitivitou lymfatických uzlin, které byly léčeny šesti cykly režimu FEC (5-fluoro-
uracil/epirubicin/cyklofosfamid) nebo čtyřmi cykly FEC a osmi týdenními aplikacemi paklitaxelu v dávce 100 mg/m2. DFS byl významně prodloužen v sekvenci s režimem FEC a paklitaxel (HR 0,63; p = 0,01), OS nebylo významně prodlouženo (HR 0,74; p = 0,46). Podobně i docetaxel byl hodnocen v sekvenci s režimem FEC. Klinická studie PACS01 [45] hodnotila 1999 nemocných žen s pozitivitou lymfatických uzlin. Bylo srovnáváno šest cyklů režimu FEC100 se třemi cykly režimu FEC100 a následným podáním tří dávek docetaxelu 100 mg/m2 ve 3týdenním intervalu. Zařazení docetaxelu se projevilo významným prodloužením DFS (HR 0,82; p = 0,034) i OS (HR 0,73; p = 0,014). Adjuvantní účinek docetaxelu hodnotila i klinická studie TACT [46], ve které bylo zařazeno celkem 4162 pacientek s postižením lymfatických uzlin nebo s negativními lymfatickými uzlinami s vysokým rizikem (stupeň III, negativní estrogenové receptory, lymfovaskulární invaze). Bylo srovnáváno osm cyklů režimu FEC se čtyřmi cykly FEC a čtyřmi cykly docetaxelu, který byl podáván v dávce 100 mg/m2 ve 3týdenním intervalu. Součástí klinické studie bylo i třetí rameno: čtyři cykly monoterapie epirubicinem se sekvenčním podáním čtyř cyklů režimu CMF. Rameno s docetaxelem neprokázalo prodloužení DFS (HR 0,95; p = 0,44) ani OS (HR 0,99; p = 0,91) ve srovnání s ostatními dvěma větvemi studie. Zajímavý design měla i klinická studie NSABP-B27 [47]. Neoadjuvantně byl ve všech třech ramenech podán 4krát režim AC. V prvním rameni byla provedena operace, ve druhém byl podán sekvenčně neoadjuvantně 4krát docetaxel v dávce 100 mg/m2 po třech týdnech, v posledním rameni byla po podání čtyř cyklů režimu AC provedena operace a následně byly čtyři cykly docetaxelu aplikovány adjuvantně. Přidání docetaxelu neoadjuvantně zdvojnásobilo patologickou kompletní remisi (pCR; 26,1 % vs. 13,7 %; p = 0,001). Nemocné s pCR měly významně delší DFS i OS. Na podkladě výše zmíněných klinických studií, které hodnotily podávání paklitaxelu jednou týdně a jednou za tři týdny [11] nebo podávání paklitaxelu s docetaxelem v třítýdenním intervalu [2], byla provedena klinická studie ECOG 1199, která posuzovala paklitaxel s docetaxelem i v adjuvantním podání [48]. Bylo hodnoceno téměř 5000 nemocných žen s pozitivními lymfatickými uzlinami nebo vysoce rizikové nemocné s negativními lymfatickými uzlinami. Všechny nemocné byly léčeny čtyřmi cykly adjuvantní chemoterapie AC. Následovala randomizace pacientek do čtyř větví: 4krát 3týdenní paklitaxel v dávce 175 mg/m2, 12krát týdenní paklitaxel v dávce 80 mg/m2, 4krát 3týdenní docetaxel v dávce 100 mg/m2 a 12krát týdenní docetaxel v dávce 35 mg/m2. Úvodní analýza 2 × 2 nepotvrdila léčebné rozdíly v rámci typu cytostatika a dávkovaní. Při mediánu follow-up 64 měsíců bylo 5leté DFS významně vyšší ve skupině s týdenním paklitaxelem (HR 1,27; p = 0,006) a ve skupině s 3týdenním docetaxelem (HR 1,23; p = 0,02) v porovnání s 3týdenním podáním paklitaxelu. Týdenní docetaxel neprokázal lepší výsledky než třítýdenní paklitaxel. Při hodnocení OS prokázalo podávání paklitaxelu jednou týdně významné prodloužení OS v porovnání s podáváním paklitaxelu jednou za tři týdny (HR 1,32; p = 0,01). V dalších kohortách nebyl zaznamenán významný rozdíl v OS.
Konkomitantní podání antracyklinů a taxanů
Bylo uskutečněno několik klinických studií, které hodnotily i konkomitantní podání antracyklinů a taxanů v adjuvantní léčbě časného karcinomu prsu. Více klinických studií proběhlo s docetaxelem, i vzhledem k vyššímu riziku kardiotoxicity při kombinaci paklitaxelu a doxorubicinu v léčbě metastatického karcinomu prsu [31]. Docetaxel byl hodnocen v kombinaci s doxorubicinem v klinické studii BCIRG 001 [49], kam bylo zařazeno 1491 pacientek s pozitivními lymfatickými uzlinami. Nemocné byly léčeny šesti cykly režimu FAC nebo šesti cykly režimu TAC (docetaxel/doxorubicin/cyklofosfamid). Při mediánu follow-up 55 měsíců prokázal režim TAC významně delší DFS (HR 0,72; p = 0,01) i OS (HR 1,03; p = 0,008). Režim TAC byl ale provázen významně častějším výskytem závažných nežádoucích účinků (36 % vs. 27 %; p = 0,001). Febrilní neutropenie se vyskytla až desetkrát častěji (25 % vs. 2,5 %). Tato skutečnost podporuje indikaci profylaktického užití růstových faktorů pro bílou řadu (pegfilgrastim). Klinická studie ECOG 2197 srovnávala účinnost čtyř cyklů AC se čtyřmi cykly režimu AT (doxorubicin/docetaxel) [50]. Studie hodnotila 2882 pacientek s pozitivními lymfatickými uzlinami nebo nemocné bez postižení lymfatických uzlin s vysokým rizikem. Dávka docetaxelu byla 60 mg/m2.
Nebyl prokázán vliv režimu AT na DFS (HR 1,02; p = 0,78) a OS (HR 1,06; p = 0,62). Paklitaxel byl hodnocen ve studii ECTO [51], kde 1355 pacientek s pozitivitou lymfatických uzlin nebo pacientky s negativními lymfatickými uzlinami, ale s vysokým rizikem byly léčeny čtyřmi cykly kombinace AP (doxorubicin/paklitaxel) proti monoterapii doxorubicinem, následně byly nemocné v obou ramenech ještě léčeny čtyřmi cykly režimu CMF. DFS byl významně delší v rameni s paklitaxelem (HR 0,65; p = 0,01), OS zůstalo bez prodloužení (HR 0,71; p = 0,16). Další typ klinických studií přímo hodnotil sekvenční i konkomitantní kombinaci antracyklinů s taxany. Klinická studie BCIRG 005 [52] randomizovala 3298 pacientek s postižením lymfatických uzlin s HER2-negativním tumorem. Byla srovnávána sekvence AC-T (doxorubicin/cyklofosfamid → docetaxel) v osmi cyklech se šesti cykly režimu TAC; DFS (HR 1,002; p = 0,98) a OS (HR 0,91; p = 0,37) byly bez rozdílů. Režim TAC prokázal vyšší procento výskytu febrilní neu-
tropenie (18 % vs. 8 %), ale nižší výskyt neuropatie (28 % vs. 43 %). Rozsáhlejší klinická studie NSABP B-30 randomizovala 5351 pacientek [53] s pozitivními lymfatickými uzlinami. Pacientky byly léčeny čtyřmi cykly režimu TAC, čtyřmi cykly režimu AT a sekvencí 4krát AC-4krát T. Poslední zmíněný režim přinesl významné prodloužení DFS (HR 0,83; p = 0,06), ale neprokázal prodloužení OS (HR 0,86; p = 0,086) při srovnání s režimem TAC. Při srovnání prokázala sekvence AC-T významně delší DFS (HR 0,08; p = 0,001) i delší OS (HR 0,83; p = 0,034) v porovnání s režimem AT. Režim AT neprokázal horší výsledky než režim TAC.
Dávkově denzní režimy s taxany
Účinnost adjuvantní chemoterapie se po zavedení antracyklinů a taxanů do klinického užívání výrazně zlepšila. Nicméně snahy o další zlepšování léčebných výsledků pokračují. Možností je vývoj nových cytostatik a cílené léčby. Další možnosti otevírala hypotéza, která předpokládala, že podávání vyšších dávek cytostatik vyústí ve vyšší eradikaci nádorových klonů [54].
Teoretické předpoklady se ale v klinické praxi nepotvrdily. Příkladem může být klinická studie CALGB 9344 [42], kde byly srovnávány různé dávky doxorubicinu. Podávání dávek vyšších než 60 mg/m2 zlepšení léčebných výsledků neprokázalo, došlo pouze ke zvýšení toxicity léčby. Další možnost nabízí předpoklad, že zkrácení intervalu mezi jednotlivými cykly může přinést lepší protinádorový účinek. Do praxe byl zaveden pojem relativní dávková intenzita (RDI), který vyjadřuje dávkovou intenzitu konkrétního cytostatika jako procento dávkové intenzity cytostatika ve standardním režimu. Bylo prokázáno, že pokles RDI v adjuvantní chemoterapii časného karcinomu prsu pod 85 % je spojen s horšími léčebnými výsledky [55]. Nejvýznamnější klinickou studií hodnotící taxany v dávkově denzním režimu v adjuvantní léčbě karcinomu prsu byla CALGB 9741 [56]. Studie randomizovala 1892 pacientek s postižením lymfatických uzlin. Nemocné byly léčeny sekvenčním podáním čtyř cyklů doxorubicinu, čtyř cyklů paklitaxelu a čtyř cyklů cyklofosfamidu nebo sekvencí kombinace čtyř cyklů doxorubicinu a cyklofosfamidu následovanou čtyřmi cykly paklitaxelu. Obě léčebná schémata byla aplikována jednak ve 2týdenním nebo standardním 3týdenním režimu. Celkem tedy byla hodnocena čtyři léčebná ramena. Dávky cytostatik byly stejné ve všech větvích (doxorubicin 60 mg/m2 , paklitaxel 175 mg/m2, cyklofosfamid 600 mg/m2). Filgrastim byl podáván u všech nemocných v dávkově denzním režimu. Přestože při hodnocení nebyla prokázána výhoda konkomitantního podání doxorubicinu a cyklofosfamidu proti sekvenci (HR 1,04; p = 0,65), pacientky léčené dávkově denzním režimem měly významně delší DFS (HR 1,25; p = 0,012) i OS (HR neudán; p = 0,0496). Na podkladě této klinické studie lze podávání dávkově denzního režimu zvážit v praxi u nemocných pacientek s vysokým proliferačním indexem. Problémem některých klinických studií s použitím dávkově denzního režimu může být nevyrovnanost léčebných schémat ve srovnávaných větvích. Kupříkladu klinická studie AGO hodnotila podání různého počtu cyklů v obou ramenech [57].
Diskuse
Metastatický karcinom prsu je nevyléčitelné onemocnění. Chemoterapie představuje důležitou součást léčebné strategie a dříve nebo později bude indikovaná v podstatě u všech nemocných schopných chemoterapii podstoupit. V léčbě metastatického karcinomu prsu prokázalo účinnost mnoho cytostatik. Lze zvážit jednak monoterapii, jednak kombinaci cytostatik. Uskutečnily se dvě metaanalýzy, které prokázaly, že kombinovaná chemoterapie dosahuje lepších léčebných výsledků (přináší vyšší ORR, delší interval do progrese, hraničně lepší OS) než monoterapie, i za cenu vyšší toxicity [58, 59]. Taxany patří mezi skupinu cytostatik s nejvíce vyjádřenou účinností v léčbě metastatického karcinomu prsu. Proběhlo mnoho výše zmíněných klinických studií, které hodnotily taxany právě v této indikaci. V roce 2008 byla publikována metaanalýza hodnotící postavení taxanů v první linii léčby metastatického karcinomu prsu ve srovnání s režimy obsahujícími antracyklin. Nebyl prokázán účinek taxanů na OS pacientek v monoterapii ani v kombinaci. Kombinace taxanů s antracykliny v první linii prokázala významně delší TTP, při monoterapii taxany byl zaznamenán kratší TTP než při podávání režimu bez taxanů. Taxany v první linii léčby karcinomu prsu by se měly indikovat v kombinaci s antracyklinem u nemocných s rychle progredujícím onemocněním a s vyhovujícím klinickým stavem [32]. V současné době máme běžně k dispozici dva taxany – paklitaxel a docetaxel. Častou diskutovanou otázkou je srovnání obou taxanů. Z většiny klinických studií lze usuzovat jenom nepřímým srovnáním, kde se zdá, že docetaxel je mírně účinnější než paklitaxel. Problémem ale zůstává definice ekvitoxických dávek obou taxanů. Jediná klinická studie, která hodnotila přímé srovnání docetaxelu s paklitaxelem, prokázala, že medián TTP i medián OS byl významně delší při užití docetaxelu [2]. Nutno dodat, že se jednalo o monoterapii a obě cytostatika byla podávána ve třítýdenním režimu. Na podkladě klinické studie CALGB 9840 [11] bylo prokázáno, že aplikace paklitaxelu jedenkrát týdně dosahuje delšího mediánu TTP i vyššího procenta ORR než aplikace jednou za tři týdny. Nelze tedy jednoznačně určit, který z obou taxanů je lepší. Vždy je nutno zvážit i profil toxicity obou cytostatik jak ve vztahu k dávce, tak ve vztahu k frekvenci podání. Důležitým faktorem je i preference nemocné, její ochota častěji docházet na ambulanci onkologického pracoviště. Klinická studie ECOG 1199 srovnávala paklitaxel s docetaxelem i v adjuvantním podání [48]. Výsledkem bylo významně delší DFS při podávání paklitaxelu jednou týdně nebo při podávání docetaxelu v třítýdenním intervalu ve srovnání s podáváním paklitaxelu v třítýdenním intervalu. Při hodnocení OS prokázala významné prodloužení přežití pouze aplikace paklitaxelu v týdenním intervalu ve srovnání s aplikací paklitaxelu v třítýdenním rozpětí. Aplikace docetaxelu jednou týdně a jednou za tři týdny OS významně neprodloužily ve srovnání s podáváním paklitaxelu v třítýdenním intervalu. Léčebná schémata adjuvantní, respektive neoadjuvantní chemoterapie vycházejí z léčebných schémat používaných v léčbě metastatického karcinomu prsu. Vývoj adjuvantní léčby sleduje vývoj paliativní chemoterapie, je však zpravidla opožděn o řadu let. V případě hodnocení léčebných výsledků adjuvantní léčby je nutno zmínit skutečnost, že adjuvantní klinické studie trvají mnohem delší dobu než klinické studie paliativní léčby. Klinické studie hodnotící taxany v adjuvantní léčbě začaly probíhat před více než patnácti lety. Klinické studie postupně poskytovaly data, která potvrzují význam taxanů v adjuvantní léčbě. Vzhledem k heterogenitě hodnocených pacientek, různých režimů chemoterapie či dávkování bylo nezbytné provedení rozsáhlých metaanalýz. Ta nejrozsáhlejší hodnotila téměř 23 000 nemocných žen v 13 klinických studiích. Metaanalýza prokázala významné zlepšení DFS i OS při zařazení taxanů do adjuvantní léčby časného karcinomu prsu. Taxany prokázaly absolutní pokles 5letého rizika o 5 % pro DFS a o 3 % pro OS [40].
V dnešní éře onkologické léčby „šité na míru“ je důležité určit, které nemocné budou mít přínos z adjuvantní léčby taxany a u kterých by podání taxanů mohlo být vynecháno. Vzhledem ke skutečnosti, že mnoho metod molekulární biologie je dostupných až v dnešní době, většina klinických prediktivních faktorů byla hodnocena retrospektivně. Mezi nejvýznamnější hodnocené možné prediktivní klinické markery patří exprese estrogenových receptorů (ER) a exprese HER2 receptoru, v dnešní době již obligátně vyšetřované. Mnoho klinických studií hodnotilo význam exprese ER pro účinnost taxanů v adjuvantní léčbě. Klinická studie CALGB 9344 [42] prokázala přínos paklitaxelu jenom u ER-negativních (ER−) pacientek (p = 0,0006) vzhledem k DFS. Podobně i klinická studie CALGB 9741 [56] hodnotící dávkově denzní chemoterapii prokázala efekt na OS pouze u skupiny nemocných žen s ER− (p = 0,014). Naopak další klinické studie (BCIRG 001, ECOG 1199, PACS 01, TACT, NSABP B-28) neprokázaly účinek taxanů pouze u skupiny pacientek s ER−, ale i ve skupině ER-pozitivních žen (ER+), i když byl zaznamenán v některých klinických studiích nesignifikantní pokles rizika rekurence u pacientek s ER− [49]. Také metaanalýzy se zabývaly otázkou prediktivního významu exprese ER na účinnost taxanu v adjuvanci. Dvě největší metaanalýzy prokázaly významný efekt na OS u nemocných s pozitivními i negativními receptory [39, 40]. Zajímavou skutečností je, že klinické studie s paklitaxelem prokázaly nižší efektivitu u pacientek s ER+, zatímco klinické studie hodnotící docetaxel prokázaly přínos u pacientek s ER+ i ER−. Nutno dodat, že nemocné s ER+ patří do prognosticky příznivější skupiny než nemocné s ER−. Dalším faktorem, který ovlivňuje léčebné výsledky, je také indikace dlouhodobé adjuvantní hormonální léčby u pacientek s ER+. Proto lze usuzovat na mírně vyšší přínos taxanů v adjuvanci právě u skupiny s ER−.
Mnoho klinických studií bylo prováděno v době, kdy stanovení exprese HER2 genu nepatřilo ještě mezi rutinní vyšetřovací metody. Proto byl prediktivní význam exprese HER2 na účinnost taxanů zkoumán jenom u menšího počtu nemocných žen retrospektivně. Vyšetření se provádělo imunohistochemicky, hybridizací in situ nebo pomocí technik mikroarray. Při retrospektivním zhodnocení byla také zajímavá skutečnost vzájemného vztahu exprese ER a HER2. Klinická studie CALGB 9344 [42] prokázala přínos podávání taxanu u subpopulace s overexpresí HER2 (HER2+) bez ohledu na stav exprese ER (HR 0,59; p = 0,01). Paklitaxel neprokázal přínos u skupiny pacientek HER2-negativních (HER2−) a současně ER+, které tvořily více než 50 % kohorty. Exprese HER2 byla hodnocena i v klinické studii BCIRG 001 [49], kde se prokázal přínos docetaxelu bez ohledu na stav exprese HER2. Metaanalýza šesti klinických studií [40] prokázala přínos taxanů u pacientek s onemocněním HER2+ i HER2−. Pacientky s HER2+ karcinomem prsu se řadí do skupiny vysokého rizika rekurence onemocnění. Proto se u těchto nemocných zvažovaly intenzivnější chemoterapeutické režimy, nejčastěji kombinace antracyklinu a taxanů. Později byla zjištěna skutečnost, že zvýšená exprese HER2 je spojena s koamplifikací genu pro topoizomerázu 2ɑ, která je cílovým místem účinku antracyklinů. Přibližně 30 % pacientek se zvýšenou expresí HER2 má současně koamplifikaci topoizomerázy 2ɑ, tedy jedná se asi o 8% podíl ze všech nemocných s karcinomem prsu. Pro tyto nemocné je přínosná jednak léčba antracykliny, jednak anti-HER2 cílená terapie, např. trastuzumabem. Kombinace trastuzumabu s antracykliny se nedoporučuje pro vyšší riziko kardiotoxicity. V případě generalizovaného karcinomu prsu je tendence indikovat v první linii cílenou léčbu proti HER2 spíše než léčbu antracykliny. Anti-HER2 léčba se nejčastěji kombinuje právě s taxany. V současnosti probíhají klinické studie, které by posoudily, zda koamplifikace genu pro topoizomerázu 2ɑ je významnějším prediktivním markerem než exprese HER2, dle výsledků pak bude zváženo zařazení antracyklinů do první linie léčby.
Zajímavou otázku, zda lze antracykliny nahradit taxany v adjuvantní léčbě časného karcinomu prsu, se snažila vyřešit klinická studie USO 9735 [60]. Tato studie hodnotila 1016 pacientek s postižením lymfatických uzlin i nemocné s negativními lymfatickými uzlinami vysokého rizika. Pacientky byly léčeny kombinací AC nebo kombinací docetaxelu a cyklofosfamidu (TC). Při mediánu follow-up 7 let prokázal režim s docetaxelem významně delší DFS (HR 0,74; p = 0,03) i OS (HR 0,69; p = 0,03). Při hodnocení prospěchu vzhledem k expresi HER2 bylo zjištěno významné prodloužení DFS i OS u pacientek s HER2+ i HER2− karcinomem prsu. Klinická studie ECOG 2197 [50] neprokázala přínos režimu doxorubicin/docetaxel (AT) ve srovnání s režimem AC. Možným faktorem byl vyšší podíl pacientek s pozitivními lymfatickými uzlinami (52 % vs. 34 %) ve studii ECOG 2197, kde byla také použita nižší dávka docetaxelu, a to 60 mg/m2, v porovnání se studií USO 9735, kde byl docetaxel aplikován v dávce 75 mg/m2. Režim TC lze tedy zvážit hlavně u pacientek s negativními lymfatickými uzlinami, když je zvažována adjuvantní chemoterapie. Nebo v případě kardiální dysfunkce, kde by podání antracyklinů mohlo být rizikové. Při hodnocení výsledků klinických studií je nutno brát ohled i na složení kohorty pacientek. Příkladem může být klinická studie CALGB 9344, která prokázala účinnost paklitaxelu v DFS i OS, naproti tomu studie NSABP B-28 prokázala příznivý vliv paklitaxelu jenom na DFS, OS zůstalo bez významného rozdílu [42, 43]. Obě studie hodnotily nemocné s pozitivitou lymfatických uzlin. Většina nemocných žen ve studii NSABP B-28 měla pozitivní 1–3 lymfatické uzliny (70 % pacientek), naproti tomu ve studii CALGB 9344 mělo pouze 46 % nemocných pozitivní 1–3 lymfatické uzliny, u 12 % pacientek bylo přítomno dokonce 10 a více postižených lymfatických uzlin. Kohorta ve studii NSABP B-28 tedy byla prognosticky příznivější, proto mohl být příznivý vliv na OS touto skutečností ovlivněn. Dokazuje to procento 5letého OS pacientek v kontrolním rameni (režim AC), které bylo vyšší právě ve studii NSABP B-28 (85 % vs. 77 %). Další klinické prognostické faktory, jako je stav lymfatických uzlin, věk, stav menopauzy, hodnotily dvě největší metaanalýzy [39, 40]. DFS a OS pacientek bylo zařazením taxanů do adjuvantní léčby prodlouženo bez ohledu na výše zmíněné faktory. Z léčby taxany v adjuvanci mají tedy prospěch nemocné s negativními i pozitivními lymfatickými uzlinami, mladší i starší populace pacientek, podobně je tato léčba přínosná i pro premenopauzální, stejně jako pro postmenopauzální nemocné. Další otázkou je i kombinace antracyklinů s taxany. Lze hodnotit jednak sekvenční podání, jednak konkomitantní podání. Více klinických studií bylo uskutečněno s docetaxelem, i vzhledem k vyššímu riziku kardiotoxicity při kombinaci AP v léčbě metastatického karcinomu prsu [31]. Výsledky klinických studií byly zmíněny výše. Při přímém srovnání nebyl zjištěn vliv na OS obou léčebných strategií, s výjimkou klinické studie NSABP B-30 [53], a to jenom pro režim AT, nikoliv pro režim TAC. Důležitým faktorem při indikaci obou léčebných možností je zvážení možného rizika toxicity. V rámci klinické studie BCIRG 005 [52] prokázal režim TAC vyšší procento výskytu febrilní neutropenie (18 % vs. 8 %), ale menší výskyt neuropatie (28 % vs. 43 %) a myalgie (52 % vs. 37 %) než sekvenční rameno. Konkomitantní podání lze zvážit u nemocných pacientek s vysokým proliferačním indexem, nicméně tady se nabízí i možnost aplikace dávkově denzního režimu [61]. V posledních letech se hledají způsoby, jak snížit toxicitu stávajících cytostatik. Možností je jejich vazba na nosiče, které mění farmakokinetiku cytostatik. Příkladem je paklitaxel navázaný na albuminové nanočástice o velikosti 130 nm (nab-paklitaxel: nanoparticle albumin-bound paclitaxel). Vazba na albuminové receptory gp60 umožňuje lepší průnik paklitaxelu buněčnou membránou endotelových buněk. V nádorové tkáni dochází vzhledem k vyšší koncentraci albumin vázajícího proteinu SPARC (Secreted Protein Acidic Rich in Cysteine) k vyšší kumulaci nab-paklitaxelu [62]. Na základě toho lze navýšit dávku paklitaxelu s následným zvýšením protinádorové účinnosti. Klinická studie III. fáze srovnávala třítýdenní podání nab-paklitaxelu v dávce 260 mg/m2 ve srovnání s konvenčním třítýdenním podáním paklitaxelu v dávce 175 mg/m2 [63]. Významně vyšší byla ORR (33 % vs. 19 %; p = 0,001) i medián TTP (23 vs. 19,6 týdne; p = 0,006). Při subanalýze došlo i k významnému prodloužení mediánů OS, a to o 2,3 měsíce u pacientek léčených ve druhé linii léčby. Výskyt febrilní neutropenie byl v obou ramenech stejný, při užití nab-paklitaxelu byl významně vyšší výskyt periferní neuropatie (10 % vs. 2 %; p = 0,001), která však byla lépe léčitelná. Další klinická studie II. fáze prokázala lepší léčebné výsledky a nižší toxicitu týdenní aplikace nab-paklitaxelu než třítýdenního podání nab-paklitaxelu nebo docetaxelu [64]. Letos bylo publikováno retrospektivní hodnocení výše zmíněných dvou klinických studií, které hodnotily účinnost a bezpečnost nab-paklitaxelu u pacientek v první linii léčby metastatického karcinomu prsu se špatnými prognostickými faktory (viscerální metastatické postižení, recidiva onemocnění v době kratší než 2 roky od adjuvantní chemoterapie). Nemocné s viscerálními metastázami prokázaly při léčbě nab-paklitaxelem významně vyšší ORR v obou klinických studiích. ORR nebyla významně vyšší u pacientek s kratší dobou vzniku recidivy onemocnění. Medián PFS byl významně prodloužen jenom ve druhé klinické studii, a to při týdenní aplikaci nab-paklitaxelu v dávce 150 mg/m2 ve srovnání s týdenní aplikací nab-paklitaxelu v dávce 100 mg/m2 nebo s docetaxelem ve třítýdenním podání [65].
Závěr
Zařazení taxanů do paliativní léčby
Taxany patří mezi nejvíce účinné látky v léčbě karcinomu prsu. Na podkladě publikované metaanalýzy hodnotící postavení taxanů v první linii metastatického karcinomu prsu ve srovnání s antracyklinovými režimy bez taxanů nebyl prokázán vliv taxanů na OS pacientek ani v monoterapii, ani v kombinaci s antracykliny. Kombinace taxanů s antracykliny v první linii prokázala významně delší TTP než antracyklinový režim bez taxanů. Taxany v první linii metastatického karcinomu prsu by se měly indikovat v kombinaci s antracyklinem u nemocných s rychle progredujícím onemocněním a vyhovujícím klinickým stavem. U ostatních nemocných nepředléčených antracykliny (eventuálně více než 12 měsíců od ukončení adjuvance antracykliny) lze v první linii léčby karcinomu prsu zvážit použití antracyklinového režimu. Taxany lze následně indikovat v další linii léčby v kombinaci s dalšími cytostatiky, jako je gemcitabin, eventuálně kapecitabin. Monoterapii lze indikovat u nemocných v horším výkonnostním stavu, v závislosti na charakteru onemocnění apod. U HER2+ nemocných je od první linie paliativní léčby indikovaná cílená léčba proti HER2 s možnou kombinací s taxany. Paklitaxel lze indikovat také v kombinaci s bevacizumabem v první linii metastatického karcinomu prsu. Možností, jak snížit toxicitu a zlepšit léčebné výsledky taxanů, jsou nové lékové formy (např. nab-paklitaxel).
Zařazení taxanů do adjuvantní léčby
V adjuvantní léčbě prokázaly nejvýznamnější metaanalýzy přínos taxanů k OS a k DFS, a to bez ohledu na stav ER, expresi HER2, věk, stav lymfatických uzlin, stav menopauzy. Dle doporučení České onkologické společnosti se taxany v adjuvanci indikují u nemocných žen středního a vysokého rizika, kdy nelze přepokládat odezvu na hormonální léčbu. Upřednostňují se sekvenční režimy antracyklinů a taxanů. Preferovaná aplikace u docetaxelu je ve třítýdenních intervalech, u paklitaxelu lépe v týdenním intervalu. Konkomitantní podání antracyklinů a taxanů (lépe docetaxelu) lze zvážit u nemocných pacientek s vysokým proliferačním indexem, nicméně tady se nabízí i možnost aplikace dávkově denzního režimu. Při indikaci taxanů je nutno brát ohled i na profil toxicity léčby, preferenci nemocné a zkušenosti onkologického pracoviště.
Seznam použité literatury
- [1] Dušek L, Mužík J, Kubásek M, et al. Epidemiologie zhoubných nádorů v České republice (on-line). Masarykova univerzita 2005. www.svod.cz
- [2] Jones SE, Erban J, Overmoyer B, et al. Randomized phase III study of docetaxel compared with paclitaxel in metastatic breast cancer. J Clin Oncol 2005; 23: 5542–5551.
- [3] Smith RE, Brown AM, Mamounas EP, et al. Randomized trial 3-hour versus 24-hour infusion of high-dose paclitaxel in patients with metastatic or locally advanced breast cancer: NSABP B-26. J Clin Oncol 1999; 17: 3403–3411.
- [4] Parideans R, Biganzoli L, Bruning P, et al. Paclitaxel versus doxorubicin as first-line single-agent chemotherapy fo metastatic breast cancer. EORTC. J Clin Oncol 2000; 18: 724–733.
- [5] Sledge GW, Neuberg D, Bernardo P, et al. Phase III trial of doxorubicin, paclitaxel, and the combination of doxorubicin and paclitaxel as front-line chemotherapy for metastatic breast cancer: an intergroup trial (E1193). J Clin Oncol 2003; 2: 588–592.
- [6] Holmes FA, Walters RS, Theriault RL, et al. Phase II trial of taxol, an active drug in the treatment of metastatic breast cancer. J Natl Cancer Inst 1991; 83: 1797–1805.
- [7] Geyer CE, Green SJ, Moinpour CM, et al. Expanded phase II trial of paclitaxel in metastatic breast cancer: SWOG. Breast Cancer Res Treat 1998; 51: 169–181.
- [8] Vermorken JB, ten Bokkel Huinink WW, Mandjes IA, et al. High-dose paclitaxel with granulocyte colony-stimulating factor in patients with advanced breast cancer refractory to antracyklin therapy. Semin Oncol 1995; 22 (4 Suppl. 8): 16–22.
- [9] Nabholtz JM, Gelmon K, Bontenbal M, et al. Multicenter, randomized comparative study of two doses of paclitaxel in patients with metastatic breast cancer. J Clin Oncol 1996, 14: 1858–1867.
- [10] Winer EP, Berry DA, Wool S, et al. Failure of higher-dose paclitaxel to improve outcome in patients with metastatic breast cancer: CALGB 9342. J Clin Oncol 2004; 22: 2061–2068.
- [11] Seidman A, Berry D, Cirrincione C, et al. CALGB 9840: Randomized phase III trial of weekly compared with every 3 weeks paclitaxel for metastatic breast cancer, with trastuzumab for all HER2 overexpressors and random assignment to trastuzumab or in HER2 nonoverexpressors. CALGB 9840. J Clin Oncol 2008; 26: 1642–1649.
- [12] Ravdin PM, Burris HA, Cook G, et al. Phase II trial of docetaxel in advanced antracykline-resistant or antracenedione-resistant breast cancer. J Clin Oncol 1995; 13: 2879–2885.
- [13] Harvey V, Mourdisen H, Semiglazov V, et al. Phase III trial comparing three doses of docetaxel for second line treatment of advanced breast cancer. J Clin Oncol 2006; 24: 4963–4970.
- [14] Burstein HJ, Manola J, Younger J, et al. Docetaxel administered on a weekly basis for metastatic breast cancer. J Clin Oncol 2000; 18: 1212–1219.
- [15] Löffler TM. Is there a place for dose-dense weekly shedules of the taxoids? Semin Oncol 1998; 25 (Suppl 12): 32–34.
- [16] Tomiak E, Piccart MJ, Kerger J, et al. Phase I study of docetaxel administered as 1-hour intravenous infusion on a weekly basis. J Clin Oncol 1994; 12: 1458–1467.
- [17] Engels FK, Verweij J. Docetaxel administered schedule: from fever to tears? A review of randomised studies. Eur J Cancer 2005; 41: 1117–1126.
- [18] Bishop JF, Dewar J, Toner GC, et al. Initial paclitaxel improves outcome compared with CMFP combination chemotherapy as front.-line therapy in untreated metastatic breast cancer. J Clin Oncol 1999; 17: 2355–2364.
- [19] Chan S, Friedrichs K, Noel D, et al. Prospective randomized trial of docetaxel versus doxorubicin in patients with metastatic breast cancer. The 303 Study Group. J Clin Oncol 1999; 17: 2341–2354.
- [20] Icli E, Akbulut H, Uner A, et al. Paclitaxel (T) vs cisplatin + VP16 (EP) in metastatic breast cancer patients treated with anthracyclines. Ann Oncol 2002; 13 (Suppl 5): 47.
- [21] Nabholtz JM, Senn HJ, Bezwoda WR, et al. Prospective randomized trial of docetaxel versus mitomycin plus vinblastine in patients with metastatic breast cancer progressing despote previous anthracycline-containing chemotherapy. 304 Study Group. J Clin Oncol 1999; 17: 1413–1424.
- [22] Sjöström J, Blomqvist C, Mouridsen H, et al. Docetaxel compared with sequential methotrexate and 5-fluorouracil in patients with advanced breast cancer after anthracycline failure. Eur J Cancer 1999; 35: 1194–1201.
- [23] Bonneterre J, Roche H, Monnier A, et al. Docetaxel vs 5-fluorouracil plus vinorelbine in metastatic breast cancer after anthracycline therapy failure. Br J Cancer 2002; 87: 1210–1215.
- [24] Bonneterre J, Dieras V, Tubiana-Hulin M, et al. Epirubicin/docetaxel (ET) versus 5FU/epirubicin/cyclophosphamide (FEC) combination as first line chemotherapy in patients with metastatic breast cancer. Breast Cancer Res Treat 2001; 69: 215.
- [25] Mackey J, Paterson A, Dirix L, et al. Final results of the phase III randomized trial comparing docetaxel (T), doxorubicin (A) and cyclophosphamide (C) to FAC as first line chemotherapy for patients with metastatic breast cancer. Proc Am Soc Clin Oncol 2002; 21: 25a
- [26] Nabholtz JM, Falkson C, Campos D, et al. Docetaxel and doxorubicin compared with doxorubicin and cyclophosphamide as first line chemotherapy for metastatic breast cancer. J Clin Oncol 2003; 21: 968–975.
- [27] Bontenbal M, Braun JJ, Creemers GJ, et al. Phase III study comparing AT to FAC as first-line chemotherapy in patients with metastatic breast cancer. Eur J Cancer 2003; 1: 5201–5202.
- [28] Biganzoli L, Cufer T, Bruning P, et al. Doxorubicin and paclitaxel versus doxorubicin and cyclophosphamide as first-line chemotherapy in metastatic breast cancer. EORTC 10961. J Clin Oncol 2002: 20: 3114–3121.
- [29] Jassem J, Pienkowski T, Pluzanka A, et al. Doxorubicin and paclitaxel versus 5FU, doxorubicin and cyclophosphamide as first-line therapy for women with metastatic breast cancer. J Clin Oncol 2001; 19: 1707–1715.
- [30] Luck HJ, Thomssen C, Untch M, et al. Multicentric phase III study in first line treatment of advanced breast cancer. Epirubicin/paclitaxel vs epirubicin/cyclophosphamide. Proc Am Soc Clin Oncol 2000; 19: 73a.
- [31] Gehl J, Boesgaard M, Paaske T, et al. Combined doxorubicin and paclitaxel in advanced breast cancer: effective and cardiotoxic. Ann Oncol 1996; 7: 687–693.
- [32] Piccart-Gebhart MJ, Burzykowski T, Buyse M, et al. Taxanes alone or in combination with anthracyclines as first-line therapy of patients with metastatic breast cancer. JCO 2008; 26: 1980–1986.
- [33] O´Shaughnessy J, Miles D, Vukelja S, et al. Superior survival with capecitabine plus docetaxel combination therapy in anthracyclin-pretreated patients with advanced breast cancer. J Clin Oncol 2002; 20: 2812c0150–2823.
- [34] Albain K, Nag S, Cardelillo-Ruiz G, et al. Global phase III study of gemcitabine plus paclitaxel (GT) vs paclitaxel (T) as frontone therapy for metastatic breast cancer. J Clin Oncol 2004; 22: 510.
- [35] Chan S, Romieau G, Hober J, et al. Gemcitabine plus docetaxel versus capecitabine plus docetaxel for antracyclin-pretreated metastatic breast cancer patients. J Clin Oncol 2005; 23: 581.
- [36] Nowak AK, Wilcken NR, Stocker MR, et al. Systematic review of taxane-containing versus nontaxane-containing regiment for adjuvant and neoadjuvant treatment of early breast cancer. Lancet 2004; 5: 372–380.
- [37] Bria E, Nistico C, Cuppone F, et al. Benefit of taxanes as adjuvant chemotherapy for early breast cancer: pooled analysis of 15 500 patients. Cancer 2006; 106: 2337–2344.
- [38] Ward S, Simpson E, Davis S, et al. Taxanes for the adjuvant treatment of early breast cancer: systematic review and economic evaluation. Health Technol Assess 2007; 11: 1–144.
- [39] Ferguson T, Wilcken N, Vagg R, et al. Taxanes for adjuvant treatment of early breast cancer. Cochrane Database of systemic reviews 2007.
- [40] De Laurentiis M, Giuseppe C, D´Agostino D, et al. Taxane-based combinations as adjuvant chemotherapy of early breast cancer: a meta-analysis of randomized trials. J Clin Oncol 2008, 1: 44–52.
- [41] Buzdar AU, Singletary SE, Valero V, et al. Evaluation of paclitaxel in adjuvant chemotherapy for patients with operable breast cancer: preliminary data of prospective randomized trial. Clin Cancer Res 2000, 8: 1073–1107.
- [42] Henderson IC, Berry DA, Demetri DG, et al. Improved outcomes from adding sequential paclitaxel but not form escalating doxorubicin dose in an adjuvant chemotherapy regimen for patients with node-positive primary breast cancer. J Clin Oncol 2003; 21: 976–983.
- [43] Mamounas EP, Bryant J, Lembersky B, et al. Paclitaxel after doxorubicin plus cyclophosphamide as adjuvant chemotherapy for node positive breast cancer. J Clin Oncol 2005; 23: 3686–3696.
- [44] Martin M, Rodrigez-Lescure A, Ruiz A, et al. Multicenter, randomized phase III study of adjuvant chemotherapy for node positive breast cancer comparing 6 cycles of FEC90 versus 4 cycles of FEC90 followed by weekly paclitaxel administrations: GEICAM 9906. Breast Cancer Res Treat 2005; 94: 39.
- [45] Roche H, Fumoleau P, Spielmann M, et al. Sequnetial adjuvant epirubicin-based and docetaxel chemotherapy for node positive breast cancer patients. J Clin Oncol 2006; 24: 5664–5671.
- [46] Ellis P, Barret-Lee P, Johnson L, et al. Sequential docetaxel as adjuvant chemotherapy for early breast cancer (TACT). Lancet 2009; 373: 1681–1692.
- [47] Bear HD, Anderson S, Brown A, et al. The effect on tumour response of adding sequential preoperative docetaxel to preoperative doxorubicin and cyclophosphamide. J Clin Oncol 2003; 21: 4165–4174.
- [48] Saprano JA, Wang M, Martino S, et al. Weekly paclitaxel in the adjuvant treatment of breast cancer. N Engl J Med 2008; 358: 1663–1671.
- [49] Martin M, Pienkowski T, Mackey J, et al. Adjuvant docetaxel for node positive breast cancer. N Engl J Med 2005; 352: 2303–2313.
- [50] Goldstein LJ, O´Neill, Sparano J. Phase III AT v AC in the adjuvant treatment of node positive and high risk node negative breast cancer. J Clin Oncol 2005; 23: 16.
- [51] Gianni L, Baselga J, Eiermann W. European Cooperative Trial in Operable Breast Cancer (ECTO): Improved freedom from progression from adding paclitaxel to doxorubicin followed by cyclophosphamide methothrexate and fluorouracil. J Clin Oncol 2005; 23: 16.
- [52] Eiermann W, Pienkowski T, Crown J, et al. Phase III randomized trial comparing docetaxel in combination with doxorubicin and cyclophosphamide followed by docetaxel in her2 negative early breast cancer patients with positive axillary lymph nodes. Breast Cancer Res Treat 2005; 94 (Suppl, abstr 1069).
- [53] Swain S, Jeong J, Geyer C, et al. NSABP B-30: definitive analysis of patient outcome from randomized trial evaluating different schedules and combinations of adjuvant therapy containing doxorubicin, docetaxel and cyclophosphamide in women with operable, node-positive breast cancer. Cancer Res 2009; 69: 75.
- [54] Coldman AJ, Goldie JH. Impact of dose-dense chemotherapy on the development of permanent drug resistance. Semin Oncol 1987; 14: 29–33.
- [55] Bonadonna G, Valagussa P, Molitrni A, et al. Adjuvant cyclophosphamide, methotrexate and fluorouracil in node positive breast cancer. N Engl J Med 1995; 332: 901–906.
- [56] Hudis C, Citron M, Berry D, et al. Five year follow-up if INT C9741: dose-dense chemotherapy in safe and effective. Breast Cancer Res Treat 2005; 94: 39 (Suppl, abstract 41).
- [57] Moebus VJ, Lueck HJ, Thomssen C, et al. Dose-dense sequential chemotherapy with epirubicin, paclitaxel, and cyclophosphamide in comparison to conventional schedule chemotherapy in high-risk breast cancer patients. Mature results of an AGO trial. Breast Cancer Res Treat 2006; 100 (Suppl 1, abstract 53).
- [58] Carrick S, Parker S, Wilcken N, et al. Single agent versus combination chemotherapy for metastatic breast cancer. Cochrane Database Syst Rev 2005, Issue 2, Art No. CD003372, DOI 10.1002/14651858.
- [59] Bruzzi P, Del Mastro L, Formani MP, et al. Objective response to chemotherapy as a potential surrogate and point of survival in metastatic breast cancer patients. J Clin Oncol 2005; 23: 5117–5125.
- [60] Jones S, Holmes F, O´Shaughnessy J, et al. Extended follow-up and analysis by age of the US oncology adjuvant trial 9735: docetaxel/cyclophosphamide is associated with an overall survival benefit compared to doxorubicin/cyclophosphamide and is well-tolerated in woman 65 or older. Breast Cancer Res Treat 2007; 106: (Suppl, abstract 12).
- [61] Hudis C, Citron M, Berry D, et al. Five year follow-up if INT C9741: dose-dense chemotherapy in safe and effective. Breast Cancer Res Treat 2005, 94: 39 (Suppl, abstract 41).
- [62] Desai N. Nab technology: a drug delivery platform utilizing endothelial gp60 receptor-based transport and tumour-derived SPARC for targeting. Drug delivery report 16th edition 2007, 37–41.
- [63] Gradishar NJ, Tjulandin S, Davidson N, et al. Phase III trial of nanoparticle albumin-bound paclitaxel compared with poly-ethylated castor oil-based paclitaxel in women breast cancer. J Clin Oncol 2005; 23: 7794–7803.
- [64] Gradishar WJ, Krasnojon D, Cheporov S, et al. Phase II trial of nab-paclitaxel compared with docetaxel as first-line chemotherapy in patients with metastatic breast cancer: final analysis of overall survival. Clin Breast Cancer 2012; 12: 313–321.
- [65] O‘Shaughnessy J, Gradishar WJ, Bhar P, et al. Nab-paclitaxel for first-line treatment of patients with metastatic breast cancer and poor prognostic factors: a retrospective analysis. Breast Cancer Res Treat 2013; 138: 829–837.