Terapie idiopatických střevních zánětů u dětí
Idiopatické střevní záněty (IBD), ke kterým řadíme Crohnovu nemoc a ulcerózní kolitidu, představují skupinu imunitně podmíněných a chronicky relabujících onemocnění trávicí trubice. Incidence IBD celosvětově neustále narůstá a až 25 % nově diagnostikovaných případů se manifestuje u jedinců mladších 20 let. Právě tato věková skupina si zasluhuje speciální přístup, neboť nízký věk v době diagnózy je spojen se závažnějším průběhem nemoci a s vyšším rizikem chirurgického výkonu. Jak diagnóza samotná, tak i nesprávně vedená terapie mohou zásadním způsobem ovlivnit další život pacienta. Pro dětský věk je typická vysoká míra kortikodependence a kortikorezistence, navíc se řada pacientů stává v průběhu let refrakterní na konvenční terapii. Namístě je proto časná a často agresivní terapie zahájená co nejdříve po stanovení diagnózy, jejímž cílem je zajistit optimální růst a vývoj mladého jedince.
Úvod
Idiopatické střevní záněty (IBD), k nimž patří Crohnova choroba (CD) a ulcerózní kolitida (UC), patří mezi chronická zánětlivá onemocnění trávicí trubice neznámé etiologie a jen částečně poznané patogeneze. Výskyt obou onemocnění v naší populaci stoupá, podle aktuálních údajů dosahuje jejich incidence v dospělé populaci hodnot kolem 6 případů na 100 000 obyvatel za rok [1]. V roce 2001 představovala incidence CD v dětské populaci 1,25/100000/rok, přičemž byl pozorován přibližně pětinásobný vzestup mezi roky 1990 a 2001 [2].
CD je charakterizována segmentálním, granulomatózním a transmurálním zánětem, který může postihnout kteroukoli část trávicí trubice od dutiny ústní až po rektum. Zánět prostupující celou stěnou střeva je často příčinou stenóz, píštělí nebo abscesů [3, 4]. Projevy nemoci závisí především na lokalizaci zánětu. Typickými symptomy jsou bolesti břicha lokalizované do pravého podbřišku, úbytek tělesné hmotnosti, anémie, únava, průjmy. Při postižení proximální části trávicí trubice (nejčastěji duodenum a jejunum) se onemocnění manifestuje jako malabsorpční syndrom, je-li přítomna stenóza, objevuje se také časná postprandiální bolest a zvracení. Specifickým projevem CD v dětském věku je porucha růstu – projevuje se u 30–35 % nemocných. Navzdory léčbě nedojde až u třetiny takto postižených dětí k naplnění jejich růstového potenciálu.
Pro UC je typický hemoragicko-katarální zánět sliznice tlustého střeva, který u dospělých pacientů nejčastěji zasahuje rektum a šíří se kontinuálně proximálním směrem. V dětském věku převažuje extenzivní postižení tlustého střeva, při němž je zánětem zasaženo celé tlusté střevo (80 % případů) [3–5]. Rektum bývá naopak ušetřeno – tato situace někdy ztěžuje správnou diagnostiku onemocnění. K typickým příznakům patří četné průjmovité stolice s příměsí krve či hlenu, defekace je doprovázena tenesmy. Porucha růstu není u dětí s UC tak častá jako při onemocnění CD, nicméně je popisována v 10 % případů.
Zvláštní jednotku, u dětí častější než u dospělých, představuje tzv. indeterminovaná kolitida, nově označovaná jako neklasifikovaný střevní zánět (IBD unclasified, IBD-U), která nenaplňuje jednoznačně kritéria CD ani UC. Postupem času však může dojít k rozvoji změn typických pro CD či UC a definitivní diagnóza tak může být stanovena i s několikaletým odstupem.
Diagnostika
Základní principy diagnostiky IBD jsou u dětí shodné s postupy v dospělé populaci. V praxi je doporučeno používat tzv. Portská kritéria [5], díky nimž lze diagnostický proces u dětí sjednotit a minimalizovat riziko opomenutí důležitých procedur. Typickým příkladem je nutnost endoskopického vyšetření nejen tlustého střeva, ale i horní části trávicí trubice s odběrem bioptických vzorků u dětí s podezřením na CD. Důležitou a pro dětský věk specifickou metodou je zhodnocení růstové aktivity pomocí tzv. percentilových grafů.
Na rozdíl od dospělých pacientů s IBD využíváme u dětí i v klinické praxi validované indexy aktivity střevního zánětu. Aktivitu CD hodnotíme pomocí indexu PCDAI (Pediatric Crohn´s Disease Activity Index), který zohledňuje jak klinické symptomy (bolesti břicha, počet a charakter stolic, celkovou aktivitu onemocnění v uplynulém týdnu), tak i laboratorní parametry (hematokrit, sedimentace, albumin), antropometrická data (vývoj hmotnosti, růst), fyzikální nález na břiše, perianální nález a přítomnost extraintestinálních projevů [6]. Velkou výhodou použití tohoto indexu je zohlednění růstových parametrů dítěte. Obdobou tohoto indexu u dětí s UC je PUCAI (Pediatric Ulcerative Colitis Activity Index) [7]. Tyto indexy slouží také k hodnocení odpovědi na zahájenou terapii a pomáhají při rozhodování o dalším terapeutickém postupu.
Farmakoterapie IBD u dětí
Léčba IBD u dětí využívá v naprosté většině léků a postupů shodných s těmi, které používáme u dospělých. Mezi hlavní odlišnosti patří dávkování, které je u většiny léků, včetně aminosalicylátů, kalkulováno podle tělesné hmotnosti pacienta, důraz na nutriční stav nemocného a zejména na růstovou aktivitu a také využití příznivého působení enterální výživy u nemocných s CD.
Enterální výživa
U dětí s aktivní CD je při navození remise metodou volby exkluzivní enterální výživa (EEV) [4, 8, 9]. EEV podávaná po dobu 6–8 týdnů je totiž u dětí stejně účinná jako terapie kortikosteroidy (KS) [9, 10]. Na rozdíl od nich však postrádá závažné nežádoucí účinky a má anabolický efekt (potlačení proteolýzy, stimulace proteosyntézy). Pozitivně ovlivňuje lineární růst, kostní hmotu a může vést i ke zhojení zánětlivých změn v trávicí trubici. Mechanismus účinku EEV nebyl dosud plně objasněn, pravděpodobně však hlavní roli hraje eliminace antigenů ze stravy, úprava střevní permeability a mikroflóry a následné snížení produkce zánětlivých mediátorů. Z hlediska účinnosti terapie není rozdíl mezi polymerní, oligomerní či elementární dietou [11]. Nicméně polymerní přípravky mají lepší chuťové vlastnosti a z toho vyplývající možnost perorálního podání. Dětskými pacienty jsou lépe tolerovány a jsou také levnější.
V přípa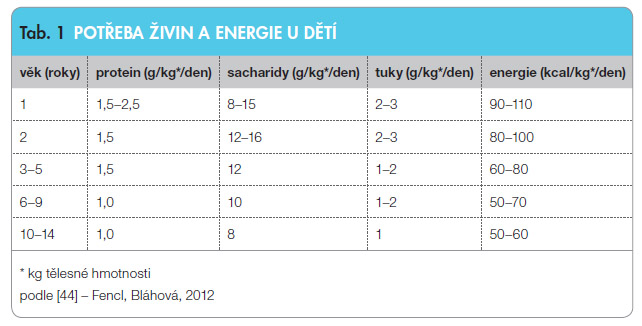 dě, že pacient netoleruje EEV formou sippingu, je možná aplikace pomocí nazoenterální sondy. EEV lze podávat kontinuálně i bolusově. Při kontinuálním podávání do žaludku, duodena nebo jejuna (optimálně pomocí nutriční pumpy) odpovídá počáteční dávka 50 % vypočteného objemu, plné dávky dosahujeme dle tolerance druhý až třetí den podávání. Při bolusovém podání (pouze do žaludku) je zpočátku vhodná kontrola rezidua, interval a velikost bolusu pak závisí na toleranci pacienta a celkové potřebné dávce EEV (tab. 1).
dě, že pacient netoleruje EEV formou sippingu, je možná aplikace pomocí nazoenterální sondy. EEV lze podávat kontinuálně i bolusově. Při kontinuálním podávání do žaludku, duodena nebo jejuna (optimálně pomocí nutriční pumpy) odpovídá počáteční dávka 50 % vypočteného objemu, plné dávky dosahujeme dle tolerance druhý až třetí den podávání. Při bolusovém podání (pouze do žaludku) je zpočátku vhodná kontrola rezidua, interval a velikost bolusu pak závisí na toleranci pacienta a celkové potřebné dávce EEV (tab. 1).
Enterální výživa by měla pokrýt 120 % kalorické potřeby vypočtené na ideální hmotnost pacienta v poměru k výšce, s cílem zajistit jeho růst a potřebné hmotnostní přírůstky. V případě, že po 2–3 týdnech nedojde k odpovědi na terapii (tj. k poklesu PCDAI alespoň o 15 bodů nebo k dosažení hodnoty PCDAI pod 30 bodů), je potřeba zvážit jinou léčbu (KS nebo biologická léčba). Po celou dobu aplikace EEV je nutno zajistit dostatečný příjem tekutin, nejvhodnější je popíjení nesycené vody bez příchuti. Na konci indukčního režimu přecházíme na běžnou stravu v průběhu 2–3 dnů, doporučována je bezezbytková dieta. Za účelem zlepšení stavu výživy a snížení rizika relapsu je často využívána i parciální enterální výživa jako doplňková terapie. V léčbě UC má enterální výživa pouze podpůrný charakter, EEV nemá vliv na potlačení aktivity UC.
Kortikosteroidy
Postavení KS v léčbě dětských pacientů s CD a UC se rovněž liší; KS nejsou lékem první volby pro navození remise u CD. K této terapii přistupujeme v případě, že EEV není tolerována nebo je neefektivní a jestliže není indikována biologická terapie.
Naproti tomu jsou KS účinné v terapii středně a vysoce aktivní UC. Potřeba kortikoterapie je v dětské populaci vyšší než u dospělých pacientů s UC – až 80 % nemocných vyžaduje podání KS do tří měsíců od stanovení diagnózy.
Lékem volby je prednison podávaný v dávce 1–2 mg/kg/den jednou denně (maximálně však 60 mg denně) [4], alternativou je podání methylprednisolonu p.o. v ekvivalentní dávce v poměru 0,8 : 1,0. Při vysoké aktivitě onemocnění a nutnosti hospitalizace je vhodné aplikovat KS parenterálně. V takovém případě lze použít methylprednisolon i.v.
1,5 mg/kg/den v jedné denní dávce (opět nepřekračujeme dávku 60 mg) nebo hydrokortison i.v. v dávce 2 mg/kg/den (maximálně však 4 × 100 mg) [12].
Stejně jako u dospělých pacientů nejsou ani v dětské populaci KS vhodné pro udržovací terapii IBD [4]. Důvodem jsou především nežádoucí účinky – vedle těch, které se vyskytují běžně u dospělých pacientů (osteoporóza, katarakta, diabetes mellitus, kožní strie, akné), mohou způsobit u dětí i závažnou poruchu růstu. Kortikodependenci, která je u dětí relativně častá, řešíme zpravidla časným zahájením imunosupresivní terapie (nejčastěji thiopuriny) [13]. Topické KS (budesonid) jsou u dětí (na rozdíl od dospělých pacientů) podstatně méně účinné a jejich použití v indukční terapii CD u dětí není paušálně doporučováno. Při léčbě KS je nutno zajistit adekvátní příjem kalcia a vitaminu D formou suplementace kombinovanými přípravky; inhibitory protonové pumpy snižují výskyt dyspeptických obtíží zejména při vyšších dávkách KS.
Aminosalicyláty
Účinnou látkou této skupiny léků je 5-aminosalicylová kyselina (5-ASA, mesalazin). Přesný mechanismus účinku 5-ASA není znám, předpokládá se, že protizánětlivé působení je závislé na koncentraci léčiva ve střevní sliznici. Aminosalicyláty mají výborný bezpečnostní profil, nicméně jejich účinnost v terapii IBD u dětí je omezená. V léčbě CD u dětí nehrají aminosalicyláty významnou roli.
V monoterapii je lze použít u mírné formy UC, u středně těžké formy pak v kombinaci s KS. Přípravky s 5-ASA jsou dětem podávány v dávce 60–80 mg/kg/den (maximálně 4,8 g/den), rozděleně ve dvou denních dávkách. U dětí, které nejsou schopny lék spolknout, lze mesalazin ve formě granulí vysypat a přidat do jídla. Oproti léčbě dospělých pacientů u dětí obvykle nesnižujeme dávku mesalazinu v udržovací terapii UC; důvodem je zpravidla větší rozsah a celkově těžší dlouhodobý průběh onemocnění v dětské populaci.
Lokální terapie je vhodná u mírné a středně těžké proktitidy, která je však u dětí vzácná (méně než 5 %). Další možností je použití lokálních forem v kombinaci s perorálními formami 5-ASA u pacientů s levostrannou nebo extenzivní kolitidou, stejně jako v dospělé populaci [14]. Tato kombinace zvyšuje účinnost terapie ve srovnání s monoterapií. Dávka se pohybuje kolem 25 mg/kg až do 1 g/den. Vzhledem k tomu, že lokální terapie 5-ASA je účinnější než lokální kortikoterapie, měla by být upřednostněna [15]. Tolerance lokálně aplikovaných léků je individuální, případné odmítnutí lokální terapie pacientem musí být respektováno.
U pacientů s kloubní symptomatologií lze použít i sulfasalazin v dávce 40–60 mg/kg/den rozděleně ve dvou denních dávkách, maximálně však 4 g denně [4]. V tomto případě je však vzhledem k častějším nežádoucím účinkům doporučováno začínat léčbu dávkou 25 mg/kg/den a tu postupně zvyšovat. Intolerance aminosalicylátů je výjimečným jevem, klinický obraz může připomínat akutní relaps nemoci. Pokud dojde k vymizení obtíží po vysazení terapie 5-ASA a k jejich opakovanému výskytu opět se zahájením terapie, je diagnóza intolerance potvrzena a další použití 5-ASA vyloučeno.
Thiopuriny
Thiopuriny představují jednu z nejdůležitějších terapeutických modalit v udržovací léčbě IBD u dětí [16]. Na základě více ne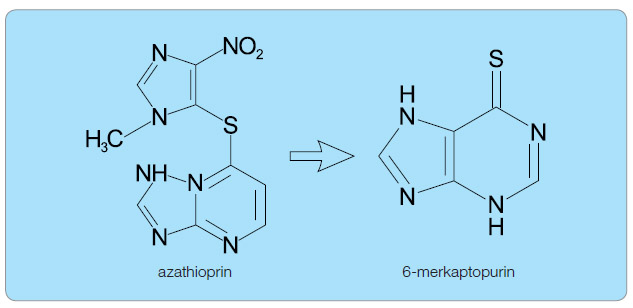 ž třicetileté zkušenosti lze říci, že se jedná o účinnou a bezpečnou terapii dětských pacientů s IBD [16, 17]. Mechanismus jejich účinku spočívá v inhibici tvorby nukleotidů a v potlačení imunitní odpovědi zprostředkovávané T lymfocyty [18]. Hlavními představiteli této skupiny léků jsou azathioprin (AZA) a 6-merkaptopurin (6-MP). Azathioprin je neúčinné proléčivo, ve střevě lépe vstřebatelné než 6-MP; ten vzniká z azathioprinu odštěpením nitroimidazolového jádra, viz obr. 1.
ž třicetileté zkušenosti lze říci, že se jedná o účinnou a bezpečnou terapii dětských pacientů s IBD [16, 17]. Mechanismus jejich účinku spočívá v inhibici tvorby nukleotidů a v potlačení imunitní odpovědi zprostředkovávané T lymfocyty [18]. Hlavními představiteli této skupiny léků jsou azathioprin (AZA) a 6-merkaptopurin (6-MP). Azathioprin je neúčinné proléčivo, ve střevě lépe vstřebatelné než 6-MP; ten vzniká z azathioprinu odštěpením nitroimidazolového jádra, viz obr. 1.
Dávky léku jsou stejné jako v dospělosti, tedy 2–2,5 mg/kg/den, lék je možno podat v jedné denní dávce [16, 19]. Léčbu většinou zahajujeme dávkou nižší a postupně ve 2–3 krocích zvyšujeme na finální hodnotu podle výsledků krevního obrazu (KO) a aktivity jaterních transamináz (ALT – alaninaminotransferáza, AST – spartátaminotransferáza). Spíše výjimečně (známe-li genotyp pro thiopurinmethyltransferázu – TPMT) podáváme plnou dávku od počátku léčby. Částečný pokles počtu leukocytů a zejména lymfocytů je žádoucí pro dosažení klinického efektu; absolutní počet lymfocytů 1000–1500 × 106/l je spojen s větší pravděpodobností udržení remise. U pacientů s velmi nízkou aktivitou TPMT je podání thiopurinů kontraindikováno.
Při intoleranci AZA lze v některých případech použít 6-MP, jeho doporučené dávkování je přibližně 1,5 mg/kg/den v jedné denní dávce. V průběhu dlouhodobé terapie je důležité upravovat dávku podle měnící se hmotnosti dítěte.
Terapii AZA mohou doprovázet některé nežádoucí účinky, a to jak dávkově závislé (myelotoxicita, hepatotoxicita), tak i dávkově nezávislé (pankreatitida) [18]. Po celou dobu léčby thiopuriny jsou proto nezbytné klinické kontroly a také laboratorní monitoring (KO + dif., AST, ALT). V případě leukopenie s hodnotami nižšími než 4 × 109/l je třeba zvážit redukci dávky v závislosti na klinické situaci (např. na rychlosti poklesu počtu leukocytů). Indikací k ukončení terapie je pokles počtu leukocytů pod hodnotu 3 × 109/l nebo vzestup aktivity jaterních transamináz nad trojnásobek normy. Pomocným kritériem je také počet lymfocytů; jejich pokles pod 1,0 × 109/l je rovněž důvodem ke zvýšené opatrnosti, popřípadě k redukci dávky léku. Dalším důvodem ke snížení dávky nebo k přerušení terapie thiopuriny může být výskyt opakovaných infekčních komplikací, nejčastěji respiračních nebo močových infekcí – v takovém případě je nutno reagovat bez ohledu na hodnotu leukocytů či lymfocytů.
Léčba thiopuriny je indikována u pacientů se středně a vysoce aktivním zánětem – v praxi je dnes u dětských pacientů zahájeno podávání thiopurinů současně s indukční léčbou (EEV/KS), aby jejich účinek nastoupil v době předpokládaného ukončení indukční terapie.
Methotrexát
Methotrexát (MTX) patří mezi tzv. antimetabolity. Je analogem kyseliny listové: ireverzibilně se váže na enzym dihydrofolátreduktázu, čímž brání vzniku aktivního tetrahydrofolátu z kyseliny listové. Indikací k podání MTX je především CD [20], pro jeho účinnost v léčbě UC není dostatek důkazů [21]. Terapii MTX volíme nejčastěji u dětí s chronicky aktivní kortikodependentní formou CD v případě, že léčba thiopuriny nebo biologiky není účinná nebo není pacientem tolerována. Protože vstřebávání methotrexátu v trávicí trubici je nepravidelné, je parenterální aplikace účinnější, navíc řeší i problém případné non-compliance pacienta [22]. U dětí je doporučena dávka 15 mg/m2 jednou týdně, den po aplikaci je vhodné podávat kyselinu listovou (10 mg p.o.) ke snížení toxicity léku. Léčba je většinou dobře snášena, vyžaduje nicméně pravidelný monitoring klinického stavu a laboratorních parametrů (KO, aktivita jaterních transamináz, v případě respiračních obtíží rtg nebo CT plic).
Účinek terapie by měl být patrný již v průběhu jednoho měsíce, nicméně další zlepšení lze očekávat ještě i po čtyřech měsících léčby. Pokud je terapie účinná, ponecháváme ji dlouhodobě, přičemž se nepředpokládá, že by při doporučeném dávkování došlo k překročení maximální povolené kumulativní dávky léčiva. V případě závažné leukopenie, neutropenie či trombocytopenie dávku redukujeme nebo terapii zcela ukončujeme. Použití MTX je jednoznačně kontraindikováno v období gravidity.
Cyklosporin
Cyklosporin A (CyA) patří do skupiny kalcineurinových inhibitorů. Jeho použití je omezeno na refrakterní a fulminantní
formu UC, která nereaguje na konvenční léčbu intravenózními KS [23, 24]. Své místo má ale pouze v indukční terapii, eventuálně do doby dosažení plného účinku thiopurinů či k překlenutí doby do chirurgického výkonu. Do dosažení remise činí dávka CyA 2 mg/kg/den kontinuálně i.v. (cílové plazmatické koncentrace se pohybují kolem 150–300 ng/ml), poté pokračujeme v léčbě perorálně dávkou 5–8 mg/kg/den rozdělenou do dvou denních podání (cílové plazmatické koncentrace 100–200 ng/ml). V průběhu terapie se doporučuje opět monitorování pacienta vzhledem k potenciální toxicitě CyA (nefrotoxicita, hepatotoxicita aj.). Nezbytností je i současná chemoprofylaxe infekce Pneumocystis jirovecii podáváním trimethoprim-sulfamethoxazolu [24].
Antibiotika
Antibiotika jsou v terapii IBD u dětí využívána pouze k řešení septických komplikací při bakteriálním přerůstání nebo při léčbě píštělí a abscesů [4, 16]. K nejčastěji používaným léčivům patří fluorochinolon ciprofloxacin, a to díky svému širokému antibiotickému spektru (včetně gramnegativních bakterií a Pseudomonas aeruginosa). Optimální dávkování představuje 5 mg/kg/12 hodin. Dalším často využívaným lékem je baktericidní nitroimidazolové antibiotikum metronidazol, s dobrou vstřebatelností a distribucí do tkání. Lze jej s výhodou využít v léčbě nitrobřišních infekcí, abscesů, infekcí malé pánve i postantibiotické klostridiové kolitidy. Aplikuje se dle tíže stavu jak parenterálně, tak i perorálně, a to v dávce 7,5 mg/kg každých 8 hodin. Při fistulující formě nemoci nebo perianálním postižení je doporučováno ponechat antibiotickou terapii alespoň po dobu 6 týdnů. Vzhledem k častému výskytu respiračních infekcí u dětí (vyžadujících ATB terapii) je důležité vyhýbat se používání potencovaných aminopenicilinů, které mohou vést následně k rozvoji klostridiové infekce.
Biologická léčba
S érou biologik došlo k zásadním změnám v přístupu k terapii IBD u dětí. Biologická terapie se stala nadějí pro pacienty nereagující na konvenční léčbu a pro děti se závažným a rozsáhlým onemocněním doprovázeným signifikantní poruchou růstu. Navíc bylo prokázáno, že účinnost biologické terapie je vyšší, pokud je zahájena do jednoho roku od stanovení diagnózy [25]. Optimální načasování je tedy naprosto zásadní a vyžaduje dohled dětského gastroenterologa zkušeného v dané oblasti.
V sou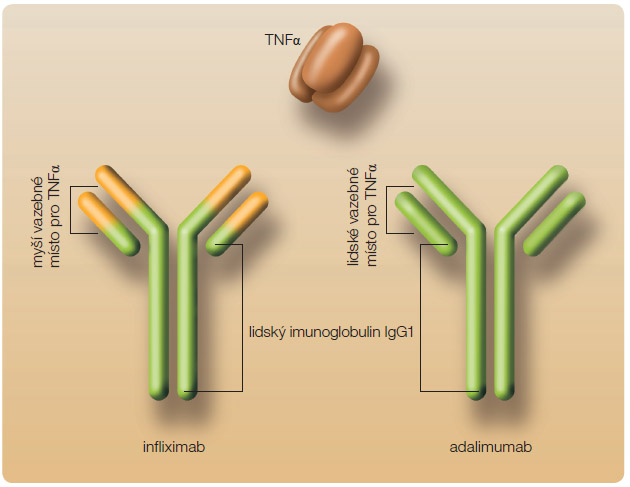 časné době jsou u dětí v klinické praxi využívány dva přípravky působící proti tumor nekrotizujícímu faktoru alfa (TNFα) – rekombinantní chimérická protilátka třídy IgG1 infliximab a plně humánní protilátka (rovněž IgG1) adalimumab, viz obr. 2.
časné době jsou u dětí v klinické praxi využívány dva přípravky působící proti tumor nekrotizujícímu faktoru alfa (TNFα) – rekombinantní chimérická protilátka třídy IgG1 infliximab a plně humánní protilátka (rovněž IgG1) adalimumab, viz obr. 2.
Před zahájením biologické terapie musí být vyloučena latentní forma TBC infekce, a to provedením intradermálního tuberkulinového testu, tzv. IGRA (Interferon Gamma Release Assay) testu a rtg plic. Aktivní TBC je jednoznačnou kontraindikací podání biologika. V případě latentní TBC je nejdříve indikováno zahájení terapie antituberkulotiky [26]. Další závažnou infekcí, kterou je třeba před zahájením léčby vyloučit, je HBV (hepatitis B virus) infekce, jelikož anti-TNF terapie byla u HBV-pozitivních jedinců spojena s vysokým rizikem reaktivace HBV a jaterního selhání.
Infliximab
Infliximab byl zaveden do léčby CD již v roce 1998, pro léčbu dětských pacientů je používán od roku 2007. Lék je podáván formou intravenózních infuzí v dávce 5 mg/kg v průběhu indukční fáze léčby v 0., 2. a 6. týdnu. V případě pozitivní odpovědi (hodnocené obvykle v 10. týdnu) pokračuje terapie udržovací, a to ve stejné dávce v intervalu 8 týdnů. Pokud dojde k sekundární ztrátě odpovědi, je možné terapii intenzifikovat, a sice jak zkrácením intervalu podávání na 6–4 týdny, tak i navýšením dávky až na 10 mg/kg.
Schéma léčby UC se v současnosti neliší od způsobu používaného u pacientů s CD [26].
Na účinnost biologické terapie u dětských pacientů s IBD upozornilo v minulosti několik menších studií [27–32]. Na tyto první úspěchy pak navázala velká multicentrická randomizovaná studie REACH [33], jejíž výsledky byly publikovány v roce 2007. Zmiňované studie se účastnily děti se středně a vysoce aktivní CD. Pacienti, kteří odpověděli na indukci třemi dávkami (došlo u nich k poklesu PCDAI alespoň o 15 bodů nebo k poklesu hodnoty indexu pod 30 bodů), pokračovali následně v léčbě udržovací v intervalu 8 nebo 12 týdnů. Při hodnocení v 10. týdnu byla odpověď na terapii přítomna u 88,4 % pacientů a 58,9 % dosáhlo klinické remise. Na konci sledování (54. týden) byla odpověď na terapii zaznamenána u 63,5 % a klinická remise u 55,8 % pacientů, lepšího účinku bylo dosaženo při osmitýdenním intervalu mezi dávkami.
Post-hoc analýza studie REACH pak prokázala účinnost infliximabu v terapii perianálních píštělí, kdy již 6týdenní terapie vedla k částečnému nebo úplnému zhojení píštělí u 72,7 % zúčastněných [34]. Po deseti letech od zveřejnění prvních výsledků studie byla publikována i data vycházející z dlouhodobého sledování [35]. Téměř u 80 % pacientů byla zaznamenána dlouhodobá remise nebo pouze mírná aktivita onemocnění. Řada studií, včetně studie REACH, prokázala také signifikantní vliv terapie infliximabem na zlepšení lineárního růstu [31, 32, 36] a snížení dávky KS [37].
Donedávna byla účinnost infliximabu v terapii UC popisována pouze jako série kazuistik či malých studií [16]. V roce 2010 publikovali Hyams a kol. výsledky první velké prospektivní multicentrické kohortové studie u dětských pacientů s UC [38]: 63 % z nich bylo kortikorefrakterních a 35 % kortikodependentních. Remise bez potřeby KS dosáhlo po 12 měsících 38 % jedinců.
V roce 2012 pak byly publikovány výsledky studie, jíž se účastnily děti se středně těžkou až těžkou formou UC nereagující na konvenční terapii. Pacienti dostali indukční terapii v klasickém dávkovacím schématu. Při hodnocení v 8. týdnu odpovědělo na terapii 73,3 % pacientů. V 54. týdnu pak dosáhlo remise při 8týdenním intervalu podávání 38,1 %, při 12týdenním však pouze u 18,2 % zúčastněných.Infliximab bývá také využíván v terapii steroid-refrakterní těžké akutní UC, a to na základě konsenzu odborníků skupiny ECCO (European Crohn´s and Colitis Organization) a Pracovní skupiny pro IBD při ESPGHAN (European Society for Paediatric Gastroenterology, Hepatology and Nutrition) [23]. Z dosud publikovaných dat se zdá být účinnost infliximabu vyšší v případě akutní těžké steroid-refrakterní UC než u chronické steroid-dependentní kolitidy [39].
Adalimumab
Adalimumab má podobu subkutánních injekcí. Indukční terapie spočívá v aplikaci léku v dávce 100 mg/m2 (až do dávky 160 mg) v 0. týdnu, s odstupem dvou týdnů je následována dávkou 50 mg/m2 (do 80 mg) a poté dávkou 25 mg/m2 (do 40 mg) každé dva týdny. Při pozitivní odpovědi na terapii (hodnoceno s odstupem 6–12 týdnů od zahájení terapie) lze pokračovat v terapii udržovací [26].
Účinnost adalimumabu v léčbě CD u dětí prokázalo nejdříve několik retrospektivních studií. Jednou z nich byla studie RESEAT, která hodnotila účinnost adalimumabu u pacientů s CD, z nichž 95 % užívalo v minulosti infliximab a 65 % mělo konkomitantní imunosupresi. Po třech měsících byla klinická odpověď zachycena v 65 %, po roce pak v 70 % případů. Britská společnost pro dětskou gastroenterologii, hepatologii a výživu publikovala v roce 2011 práci popisující účinnost adalimumabu u 61 % léčených pacientů [41]. Koncem roku 2011 již ale byly publikovány výsledky první prospektivní, multicentrické, randomizované a dvojitě zaslepené studie [42]. Tato studie srovnávala dva různé dávkovací režimy u dětí se středně těžkou a těžkou formou CD, u kterých byla nemoc aktivní navzdory terapii imunosupresivy či KS nebo u kterých došlo k sekundární ztrátě odpovědi nebo k intoleranci infliximabu. Po podání indukční dávky 160/80 mg s.c. (u pacientů s hmotností vyšší než 40 kg) nebo dávky 80/40 mg s.c. (u pacientů s hmotností nižší než 40 kg) byli pacienti randomizováni k udržovací terapii ve vyšším (40 mg, resp. 20 mg á 2 týdny) nebo nižším dávkovacím režimu (20 mg, resp. 10 mg á 2 týdny). Po indukci byla zaznamenána klinická odpověď u 82 % pacientů ve skupině s vyšším a u 60 % ve skupině s nižším dávkováním. Ve 26. týdnu bylo klinické remise dosaženo u 39 % (resp. 28 %) léčených. U pacientů, kteří nebyli dříve léčeni infliximabem, byla míra dosažení remise vyšší (57 % a 35 %). V 52. týdnu se nacházelo v remisi 33 % (resp. 23 %) pacientů. U jedinců bez předchozí terapie infliximabem byly výsledky lepší, remise zde nastala v 45 % a 28 %.
Účinnost adalimumabu v terapii UC u dětí dosud nebyla ověřena žádnou randomizovanou kontrolovanou studií, nicméně použití adalimumabu u dětí s UC popisuje několik kazuistik [41, 43].
Strategie léčby IBD u dětí
Základní strategické cíle léčby IBD u dětí se neliší od cílů v dospělé populaci: dosažení kompletní remise (klinické, laboratorní, morfologické), úprava kvality života a zabránění chirurgickým výkonům, zejména pak opakovaným. Specifické rysy střevních zánětů u dětí, především vliv na růstovou aktivitu, častější výskyt extenzivních forem nemoci, horší odpověď na konvenční farmakoterapii spolu se skutečností, že samotný vznik IBD v dětském věku představuje významný rizikový faktor nepříznivého průběhu onemocnění, vyžadují ovšem některé odlišné postupy.Celkově je proto strategie farmakoterapie dětských pacientů s CD a UC charakterizována agresivnějším přístupem ve srovnání s pacienty dospělými. Tradiční model tzv. step-up léčby, který spočívá v postupném zavádění účinnějších léků při selhání méně účinné léčebné varianty, je právě u dětí stále častěji nahrazován postupy označovanými jako akcelerovaná step-up léčba, či se dokonce uplatňuje strategie tzv. top-down terapie. V prvním případě jde o urychlení postupného modelu v závislosti na individuálním posouzení rizika nepříznivého průběhu nemoci. V praxi to nejčastěji znamená, že nevyčkáváme dosažení účinku konvenčního imunosupresiva (obvykle thiopurinů), ale zahájíme léčbu protilátkami proti TNFα.
Stále častěji je u dětí aplikována biologická terapie na samém počátku léčby (top-down). Důvodem může být přítomnost závažných rizikových faktorů: extenzivní postižení tenkého střeva, signifikantní růstová retardace, perianální postižení nebo přítomnost závažných extraintestinálních projevů v případě CD, u nemocných s UC pak těžce probíhající extenzivní kolitida s vysokým rizikem kolektomie. I v dětském věku je vhodné v nejzávažnějších případech podávat od počátku léčbu kombinovanou, tedy biologikum spolu s thiopurinovým imunosupresivem, výjimečně s MTX.
Výhodou dětského věku je lepší tolerance agresivní terapie zejména z důvodu menší náchylnosti k infekčním komplikacím a také celkově vyšší účinnost léčby ve srovnání s dospělými; tento fakt se nejvýrazněji projevuje v oblasti biologické léčby. Současně si ovšem musíme být vědomi i některých rizik – mezi ně patří především riziko lymfoproliferativních onemocnění. Tzv. hepatosplenický T-lymfom byl popsán téměř výlučně u adolescentů či mladých dospělých (především mužů), kteří byli léčeni thiopuriny v kombinaci s protilátkami proti TNFα. Z tohoto důvodu je nutno pečlivě zvážit délku podávání kombinované terapie, a pokud to stav pacienta umožní, převést jej na monoterapii jedním či druhým lékem.
Je pochopitelné, že výše uvedené postupy v některých případech překračují omezení stanovená pro léčbu zejména ze strany zdravotních pojišťoven. Týká se to především časného zavedení biologické terapie. Jsme však přesvědčeni, že jednoznačný požadavek individualizovat léčbu pacientů v závislosti na konkrétní klinické situaci a snaha o minimalizaci dlouhodobých nepříznivých důsledků střevního zánětu pro mladého pacienta nás k takovému přístupu opravňuje.
Seznam použité literatury
- [1] Ďuricová D, Bortlík M, Benko P, et al. Incidence idiopatických střevních zánětů v ČR: prospektivní populační studie. Gastroent Hepatol 2012; 66 (Suppl. 2): S23.
- [2] Pozler O, Maly J, Bonova O, et al. Incidence of Crohn disease in the Czech Republic in the years 1990 to 2001 and assessment of pediatric population with inflammatory bowel disease. J Pediatr Gastroenterol Nut 2006; 42: 186–189.
- [3] Van Assche G, Dignass A, Panes J, et al. European Crohn‘s and Colitis Organisation (ECCO). The second European evidence – based Consensus on the diagnosis and management of Crohn‘s disease: Definitions and diagnosis. J Crohns Colitis 2010; 4: 7–27.
- [4] Sandhu BK, Fell JM, Beattie RM, et al.; on Behalf of the IBD Working Group of the British Society of Paediatric Gastroenterology, Hepatology, and Nutrition: Guidelines for the Management of Inflammatory Bowel Disease in Children in the United Kingdom. J Pediatr Gastroenterol Nutr 2010; 50: S1–S13.
- [5] IBD Working Group of the European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN). Inflammatory Bowel Disease in Children and Adolescents: Recommendations for Diagnosis-The Porto Criteria. J Pediatr Gastroenterol Nutr 2005; 41: 1–7.
- [6] Hyams JS, Ferry GD, Mandel FS, et al. Development and validation of a pediatric Crohn‘s disease activity index. J Pediatr Gastroenterol Nutr 1991; 12: 439–447.
- [7] Turner D, Otley AR, Mack D, et al. Development, validation, and evaluation of a pediatric ulcerative colitis activity index: a prospective multicenter study. Gastroenterology 2007; 133: 423–432.
- [8] Day AS, Burgess L. Exclusive enteral nutrition and induction of remission of active Crohn‘s disease in children. Expert Rev Clin Immunol 2013; 9: 375–383.
- [9] Critch J, Day AS, Otley A, et al., on behalf of the NASPGHAN IBD Committee. Use of Enteral Nutrition: for the control of intestinal inflammation in Peadiatric Crohn Disease: J Pediatr Gastroenterol Nutr 2012; 54: 298–305.
- [10] Soo J, Malik BA, Turner JM, et al. Use of Exclusive Enteral Nutrition Is Just as Effective as Corticosteroids in Newly Diagnosed Pediatric Crohn‘s Disease. Dig Dis Sci 2013 Sep 12 [Epub ahead of print].
- [11] Dziechciarz P, Horvath A, Shamir R, Szaiewska H. Meta-analysis: enteral nutrition in active Crohn‘s disease in children. Aliment Pharmacol Ther 2007; 15: 795–806.
- [12] Turner D, Levine A, Escher JC, et al. Management of pediatric ulcerative colitis: joint ECCO and ESPGHAN evidence-based consensus guidelines. J Pediatr Gastroenterol Nutr 2012; 55: 340–361.
- [13] Markowitz J, Grancher K, Kohn N, et al. A multicenter trial of 6-mercaptopurine and prednisone in children with newly diagnosed Crohn’s disease. Gastroenterology 2000; 119: 895–902.
- [14] Ford AC, Khan KJ, Achkar JP, et al. Efficacy of oral vs. topical, or combined oral and topical 5-aminosalicylates, in Ulcerative Colitis: systematic review and meta-analysis. Am J Gastroenterol 2012; 107: 167–176.
- [15] Marshall JK, Thabane M, Steinhart AH, et al. Rectal 5-aminosalicylic acid for induction of remission in ulcerative colitis. Cochrane Database Syst Rev 2010; 1: CD004115, doi: 10.1002/14651858.CD004115.pub2.
- [16] Wilson DC, Thomas AG, Croft NM, et al. Systematic review of the evidence base for the medical treatment of paediatric inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2010; 50 (Suppl. 1): S14–34.
- [17] Sandborn WJ. A review of immune modifier therapy for inflammatory bowel disease: azathioprine, 6-mercaptopurine, cyclosporine, and methotrexate. Am J Gastroenterol 1996; 91: 423–433.
- [18] Dubinsky MC. Azathioprine, 6-mercaptopurine in inflammatory bowel disease: pharmacology, efficacy, and safety. Clin Gastroenterol Hepatol 2004; 2: 731–743.
- [19] Candy S, Wright J, Gerber M, et al. A controlled double blind study of azathioprine in the management of Crohn’s disease. Gut 1995; 37: 674–678.
- [20] Feagan BG, Fedorak RN, Irvine EJ, et al. A comparison of methotrexate with placebo for the maintenance of remission in Crohn disease. North American Crohn study group investigators. N Engl J Med 2000; 342: 1627–1632.
- [21] Oren R, Arber N, Odes S, et al. Methotrexate in chronic active ulcerative colitis: a double-blind, randomized, Israeli multicenter trial. Gastroenterology 1996; 110: 1416–1421.
- [22] Turner D, Grossman AB, Rosh JR, et al. Methotrexate following unsuccessful thiopurine therapy in pediatric Crohn disease. Am J Gastroenterol 2007; 102: 2804–2812.
- [23] Turner D, Travis SP, Griffiths AM, et al. Consensus for managing acute severe ulcerative colitis in children: a systematic review and joint statement from ECCO, ESPGHAN, and the Porto IBD working group of ESPGHAN. Am J Gastroenterol 2011; 106; 574–588.
- [24] Turner D, Griffiths AM. Acute severe ulcerative colitis in children: a systematic review. Inflamm Bowel Dis 2011; 17: 440–449.
- [25] Lionetti P, Bronzini F, Salvestrini C, et al. Response to infliximab is related to disease duration in pediatric Crohn disease. Aliment Pharmacol Ther 2003; 18: 425–431.
- [26] Bortlík M, Ďuricová D, Kohout P, et al. Doporučení pro podávání biologické terapie u idiopatických střevních zánětů. Gastroent Hepatol 2012; 66: 12–22.
- [27] Baldassano R, Braegger CP, Escher JC, et al. Infliximab (REMICADE) therapy in the treatment of pediatric Crohn disease. Am J Gastroenterol 2003; 98: 833–838.
- [28] Lamireau T, Cezard JP, Dabadie A, French-Speaking Group for Pediatric Gastroenterology Nutrition, et al. Efficacy and tolerance of infliximab in children and adolescents with Crohn disease. Inflamm Bowel Dis 2004; 10: 745–750.
- [29] de Ridder L, Escher JC, Bouquet J, et al. Infliximab therapy in 30 patients with refractory pediatric Crohn disease with and without fistulas in the Netherlands. J Pediatr Gastroenterol Nutr 2004; 39: 46–52.
- [30] Borrelli O, Bascietto C, Viola F, et al. Infliximab heals intestinal inflammatory lesions and restores growth in children with Crohn disease. Dig Liver Dis 2004; 36: 342–347.
- [31] Cezard JP, Nouaili N, Talbotec C, et al. A prospective study of the efficacy and tolerance of a chimeric antibody to tumor necrosis factors (remicade) in severe pediatric Crohn disease. J Pediatr Gastroenterol Nutr 2003; 36: 632–636.
- [32] Wewer V, Riis L, Vind I, et al. Infliximab dependency in a national cohort of children with Crohn disease. J Pediatr Gastroenterol Nutr 2006; 42: 40–45.
- [33] Hyams J, Crandall W, Kugathasan S, et al. REACH Study group: Induction and maintenance infliximab therapy for the treatment of moderate to severe Crohn’s disease in children. Gastroenterology 2007; 132: 863–873.
- [34] Crandall W, Hyams J, Kugathasan S, et al. Infliximab therapy in children with concurrent perianal Crohn disease: observations from REACH. J Pediatr Gastroenterol Nutr 2009; 49: 183–190.
- [35] Hyams J, Walters TD, et al. Safety and efficacy of maintenance infliximab therapy for moderate to severe Crohn’s disease in children: REACH open-label extension. Curr Med Res Opin 2011; 27: 651–662.
- [36] Griffiths A, Hyams J, Crandall W, et al. Height and growth delayed children with active Crohn disease improves during treatment with infliximab. Gastroenterol 2009; 48: 168–174.
- [37] Hyams J, Lerer T, Griffiths A, et al. Long-term outcome of maintenace infliximab therapy in children with Crohn’s disease. Inflamm Bowel Dis 2009; 15: 816–822.
- [38] Hyams JS, Lerer T, Griffiths A, et al. Outcome following infliximab therapy in children with ulcerative colitis. Am J Gastroenterol 2010; 105: 1430–1436.
- [39] Russell GH, Katz AJ. Infliximab is effective in acute but not chronic childhood ulcerative colitis. J Pediatr Gastroenterol Nutr 2004; 39: 166–170.
- [40] Rosh JR, Lerer T, Markowitz J, et al. Retrospective evaluation of the safety and effect of adalimumab therapy (RESEAT) in pediatric Crohn’s disease. Am J Gastroenterol 2009; 104: 3042–3049.
- [41] Russell RK, Wilson ML, Loganathan S, et al. A BSPGHAN survey of the effectiveness and safety of adalimumab in children with inflammatory bowel disease. Alimentary Pharmacology and Therapeutics 2011; 33: 946–953.
- [42] Hyams JS, Griffiths AM, Markowitz J, et al. Safety and efficacy of adalimumab for moderate to severe Crohn‘s disease in children. Gastroenterology 2011; 143: 365–374.
- [43] Noe JD, Pfefferkorn M. Short-term response to adalimumab in childhood inflammatory bowel disease. Inflamm Bowel Dis 2008; 14: 1683–1687.
- [44] Fencl F, Bláhová K. Parenterální výživa. Čes-slov Pediat 2012; 67: 52–59.