Tiky a Touretteův syndrom – současné možnosti léčby
Tiky patří k nejčastějším dyskinetickým projevům. Jsou hlavními příznaky primárních tikových poruch, z nichž nejzávažnější je Touretteův syndrom, u kterého se kombinují tiky a poruchy chování. Základem léčby je edukace a úprava životního stylu. K zahájení farmakoterapie přistupujeme až při těžších projevech onemocnění. Pro zmírnění tiků nejčastěji volíme tiaprid, klonazepam nebo risperidon, v závažnějších případech aripiprazol. Klasická neuroleptika (např. haloperidol) ponecháváme kvůli častému rozvoji nežádoucích účinků v záloze jen pro nejtěžší případy. Pro léčbu hyperaktivity s poruchou pozornosti užíváme atomoxetin nebo methylfenidát. Ve farmakoterapii obsedantně-kompulzivní poruchy podáváme citalopram či fluoxetin, u dětí a adolescentů pak fluvoxamin, sertralin či klomipramin. Tato léčiva je možné využít také k ovlivnění nutkavé složky tiků.
Úvod
Pohybové a zvukové tiky patří k nejčastějším extrapyramidovým projevům a jsou hlavními příznaky primárních tikových poruch, mezi které řadíme přechodnou tikovou poruchu, chronickou motorickou nebo vokální tikovou poruchu a Touretteův syndrom (TS), označovaný též jako kombinovaná vokální a mnohočetná motorická tiková porucha. Objevují se zpravidla v dětství, v řadě případů přetrvávají i v dospělosti.
Tiky můžeme charakterizovat jako náhlé, nápadné, bezúčelně se opakující pohyby nebo zvuky rušící normální aktivitu. Četnost, závažnost i lokalizace tiků se může v čase měnit. Tiky se zmírňují v klidu a v psychické pohodě, naopak ve stresu a při duševním vypětí se zhoršují. Bývají spojeny s nutkáním k jejich provedení, které je po vykonání tiku následováno pocitem úlevy [1]. Důležitým diferenciálně diagnostickým rysem je dočasná potlačitelnost tiků vůlí. Při delším zadržování tiků však nutkání k jejich provedení zesílí natolik, že tiky nelze již déle zadržovat a dochází k jejich intenzivnímu vybíjení. Sémiologicky tiky dělíme na pohybové a zvukové, dle stupně komplexity pak na prosté a komplexní [2]. U jednoho pacienta se mohou postupně objevovat a současně kombinovat tiky různých modalit a komplexity.
Samostatně pak označujeme některé komplexní tikové projevy, např. koprolalii (vykřikování vulgarismů), echolalii (opakování slov či vět jiné osoby), echopraxii (napodobování pohybů jiné osoby) či palilalii (opakování vlastních slov nebo jejich částí, zejména poslední slabiky).
Přechodná tiková porucha je nejlehčí a nejběžnější tikovou poruchou v dětství, postihuje až 28 % školáků [3]. Obvykle se manifestuje prostým pohybovým nebo zvukovým tikem, někdy i více tiky najednou, včetně komplexních. Trvá maximálně jeden rok a je ukončena spontánní remisí. Většinou nevyžaduje farmakologickou léčbu.
Chronická motorická nebo vokální tiková porucha se objevuje v dětství, někdy i v dospělosti. Vyznačuje se jediným pohybovým nebo zvukovým tikem neměnné intenzity v trvání nejméně jednoho roku, případná remise nepřesáhne několik měsíců. V léčbě postupujeme podobně jako při terapii tiků u TS.
Touretteův syndrom je vrozené neurologicko-psychiatrické onemocnění, u kterého se kromě pohybových a zvukových tiků často objevují přidružené poruchy chování, zejména hyperaktivita s poruchou pozornosti (ADHD, attention deficit hyperactivity disorder) a obsedantně-kompulzivní porucha (OCD, obsessive-compulsive disorder), dále pak sebepoškozování, deprese, specifické poruchy učení a další [4]. Příznaky začínají v dětství, onemocnění se vyskytuje 3–4krát častěji u chlapců, prevalence se pohybuje v rozsahu 0,4–3,8 % [3]. Projevy TS se obvykle zhoršují během puberty, naopak v dospělosti je tendence ke zmírňování. Příčina onemocnění není přesně známa, předpokládá se multifaktoriální působení genetických [5] a epigenetických faktorů [6]. Za hlavní patogenetický mechanismus je považována funkční porucha bazálních ganglií s následnou dysregulací kortiko-striato-thalamo-kortikálního okruhu [7]. Podkladem této dysfunkce může být vývojová dopaminergní hyperinervace stria-
ta, zvýšená senzitivita dopaminových receptorů, ale i změny dalších neuromediá-
torových systémů [8].
Obecné zásady léčby tiků a Touretteova syndromu
Základem léčby tiků a přidružených poruch chování je správná a včasná diagnóza, kterou lze ve většině případů stanovit na podkladě prostého klinického vyšetření bez nutnosti dalších pomocných vyšetřovacích metod. Klademe důraz na to, aby pacient a jeho okolí byli o nemoci důkladně informováni, neboť již samotné pochopení příčiny obtíží má pro nemocného významný léčebný efekt. V terapii tikových poruch hrají klíčovo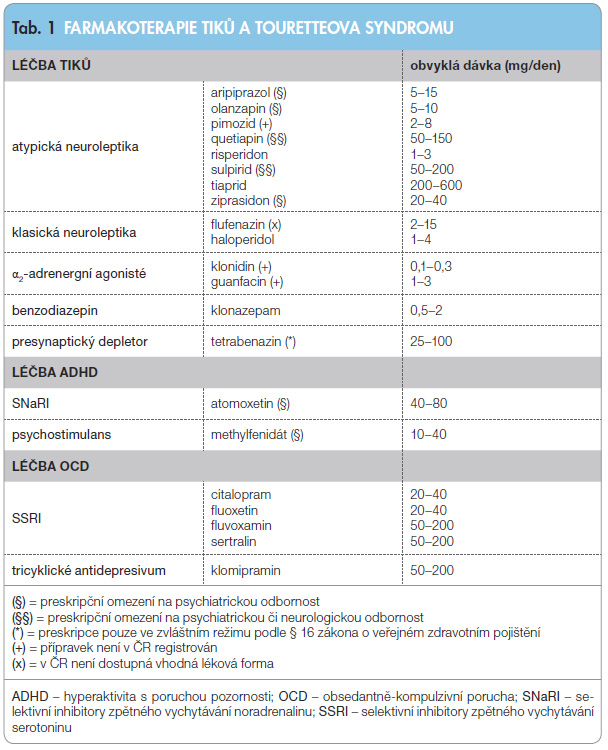 u roli režimová opatření, nemocný by se měl chránit před nadměrným stresem, u dětí je třeba uplatňovat speciální výchovné a edukační postupy. K farmakoterapii (tab. 1) přistupujeme tehdy, pokud i přes režimová opatření projevy nemoci významně narušují běžné aktivity pacienta. Terapii cílíme na nejvíce obtěžující příznak, strategií není potlačit všechny tiky a projevy poruch chování, ale zmírnit je na únosnou míru. Při zahájení léčby musíme zohlednit poměr očekávaného terapeutického přínosu vůči riziku možných nežádoucích účinků. Dávku zvoleného léčiva postupně titrujeme od nízké do adekvátních hodnot a vždy vyčkáme potřebné doby pro nástup účinku léčby (týdny až měsíce). U těžkých forem TS můžeme postupně podávat i kombinaci léčiv, jimiž se snažíme docílit jak zmírnění tiků, tak přidružených poruch chování. V terapii tiků se většina přípravků používá tzv. off-label, oficiálně schválenou indikaci pro léčbu TS má jen haloperidol a tiaprid.
u roli režimová opatření, nemocný by se měl chránit před nadměrným stresem, u dětí je třeba uplatňovat speciální výchovné a edukační postupy. K farmakoterapii (tab. 1) přistupujeme tehdy, pokud i přes režimová opatření projevy nemoci významně narušují běžné aktivity pacienta. Terapii cílíme na nejvíce obtěžující příznak, strategií není potlačit všechny tiky a projevy poruch chování, ale zmírnit je na únosnou míru. Při zahájení léčby musíme zohlednit poměr očekávaného terapeutického přínosu vůči riziku možných nežádoucích účinků. Dávku zvoleného léčiva postupně titrujeme od nízké do adekvátních hodnot a vždy vyčkáme potřebné doby pro nástup účinku léčby (týdny až měsíce). U těžkých forem TS můžeme postupně podávat i kombinaci léčiv, jimiž se snažíme docílit jak zmírnění tiků, tak přidružených poruch chování. V terapii tiků se většina přípravků používá tzv. off-label, oficiálně schválenou indikaci pro léčbu TS má jen haloperidol a tiaprid.
Léčiva užívaná v léčbě tiků
Klasická neuroleptika
Klasická neuroleptika působí jako antagonisté dopaminových receptorů v mozkové kůře, limbickém a nigrostriatálním systému. Jejich používání je spojeno s řadou nežádoucích vedlejších účinků, proto se je snažíme ponechat v záloze pro nejtěžší případy, kde méně rizikové přípravky nemají dostatečný efekt.
Haloperidol a pimozid jsou prvními farmaky, u kterých byla prokázána účinnost při léčbě tiků [9–11]. V ČR je k dispozici pouze haloperidol (běžné dávkování 1–4 mg/den), pimozid (běžné dávkování 2–8 mg/den) již registrován není. Ke klinicky významnému snížení tikových projevů dochází až u 80 % pacientů [12]. Obávanými komplikacemi jsou extrapyramidové nežádoucí účinky – akutní dystonie, akatizie, parkinsonský syndrom či tardivní dyskineze [13], při léčbě pimozidem dále hrozí prodloužení intervalu QT a srdeční arytmie [14]. Medikace, zvláště u dětí, může vyvolat sedaci, apatii, úzkost, depresi, kognitivní zpomalení. Objevuje se rovněž přírůstek tělesné hmotnosti, poruchy endokrinních funkcí, nepravidelnosti menses či provokace laktace [15]. Po vysazení se může vyskytnout podrážděnost, nespavost, napětí, zažívací obtíže a „syndrom z odnětí” se zhoršením tiků.
Flufenazin je v USA považován za nejúčinnější a nejméně sedativní klasické neuroleptikum. V ČR je dostupná bohužel pouze depotní forma, s níž nejsou v léčbě TS dostatečné zkušenosti. Dávkování se pohybuje v rozsahu 2–15 mg/den, nežádoucí účinky jsou podobné jako u haloperidolu, flufenazin však bývá lépe tolerován [16].
Atypická neuroleptika
Atypická neuroleptika účinkují antagonisticky zejména na dopaminergní systém mimo striatum, což snižuje riziko nežádoucích extrapyramidových účinků. Vyšší selektivita k jednotlivým podtypům receptorů však může snižovat účinek na tikové projevy.
Tiaprid, sulpirid a amisulprid jsou selektivní agonisté dopaminergních receptorů D2 ze skupiny substituovaných benzamidů. Nejčastěji bývá pro léčbu tiků využíván tia-
prid, jehož potenciál tlumit tikové projevy dokládá řada studií [17–19]. Běžná denní dávka se pohybuje mezi 200–600 mg, k častým vedlejším účinkům patří ospalost, sedace, zvýšení tělesné hmotnosti a hyperprolaktinemie. Ve Velké Británii je v léčbě dospělých hojně využíván také sulpirid (50–200 mg/den), při jehož podávání lze očekávat příznivý efekt zhruba v 60 % případů [20]. Nežádoucí účinky zahrnují kromě výše uvedených také depresi či poruchy spánku.
Risperidon působí jako antagonista s vysokou afinitou k receptorům D2 a 5-HT2. Je nejvíce prostudovaným atypickým neuroleptikem v terapii TS, jeho schopnost zmírňovat tiky byla opakovaně publikována [21, 22], proto je v řadě zemí (zejména ve Velké Británii) považován za lék první volby. Působí příznivě také na projevy OCD a na agresivitu [23]. Obvyklá denní dávka se pohybuje mezi 1–3 mg. K častým vedlejším účinkům patří únava a sedace, objevit se může emoční labilita, nauzea, zvyšování hmotnosti či poruchy spánku, extrapyramidové projevy se vyskytují vzácně.
Aripiprazol, označovaný jako dopaminový stabilizátor či parciální agonista, má jedinečný duální účinek na dopaminergních receptorech D2. Při nízké endogenní aktivitě dopaminu se chová jako agonista, naopak při vysoké aktivitě působí antagonisticky, čímž normalizuje úroveň dopaminergní neurotransmise. Účinkuje také na serotonergních receptorech 5-HT1A (parciální agonista) a 5-HT2A (antagonista). Poslední dobou přibývají kazuistiky a otevřené studie, které ukazují velmi dobrý účinek aripiprazolu u těžších forem TS, a to jak u dětí, tak u dospělých [24–26]. Běžnou terapeutickou dávku představuje 5–15 mg/den. Aripiprazol lze bezpečně kombinovat se selektivními inhibitory zpětného vychytávání serotoninu (SSRI) a dalšími psychofarmaky. Nežádoucí účinky bývají obvykle mírné a přechodné, zahrnují sedaci, nespavost, nauzeu, zvyšování hmotnosti, hyperprolaktinemii či iniciální dysforickou reakci [24].
Z dalších atypických neuroleptik, která jsou však pro léčbu tikových poruch využívána spíše okrajově, prokázal pozitivní účinek olanzapin (5–10 mg/den) [27], quetiapin (50–150 mg/den) [28] a ziprasidon (20–40 mg/den) [29]. K častým nežádoucím účinkům patří sedace a přibývání na váze. U nejnovějších neuroleptik, jimiž jsou paliperidon a sertindol, nebyla doposud publikována žádná práce zaměřená na léčbu tiků.
Klozapin se s ohledem na riziko závažných nežádoucích účinků (agranulocytóza) k léčbě TS v současné době prakticky nepoužívá. Účinnost klozapinu u tikových projevů je sporná [30, 31], navíc existují práce, které dokládají exacerbaci tiků po zahájení léčby klozapinem [32].
Další léčiva
Benzodiazepin klonazepam je v ČR (na rozdíl od zahraničí) využíván v léčbě tiků velmi hojně, a to jak v monoterapii, tak častěji v kombinaci s jinými léčivy. Příznivý efekt bývá zejména na klonické tiky, výhodou může být také anxiolytické působení [19]. Obvyklá denní dávka je v rozmezí 0,5–2 mg. Lék by se měl podávat jen krátkodobě a zvolna vysazovat. Při dlouhodobém užívání, podobně jako u ostatních benzodiazepinů, vzniká tolerance provázená snížením účinku. Nežádoucí příznaky zahrnují únavu a sedaci, paradoxní reakce se zmateností a agresivitou je u mladých pacientů velmi vzácná.
Agonisté presynaptických α2-adrenergních receptorů klonidin (0,1–0,3 mg/den) a guanfacin (1–3 mg/den) se v některých zemích (zejména v USA) považují u pacientů s TS za léky první volby [33]. Kromě tiků příznivě ovlivňují také projevy ADHD. K nežádoucím účinkům patří hypotenze, sedace, bolest hlavy, sucho v ústech či poruchy spánku. Při náhlém vysazení může dojít k hypertenzní krizi. Oba medikamenty nejsou bohužel v současné době v ČR registrovány.
Tetrabenazin je presynaptický depletor, který inhibuje transport dopaminu z cytoplazmy do presynaptických vezikul a tím se podílí na metabolické degradaci dopaminu a inhibici dopaminergní neurotransmise. V USA je některými autory (spolu s guanfacinem) pokládán za lék první volby [33]. Je velmi účinný jak v léčbě tiků, tak tardivních dyskinezí [34]. Dávkování se pohybuje od 25 mg do 100 mg denně. Vedlejší účinky zahrnují únavu, nauzeu, depresi či insomnii. Kontraindikací je současná terapie inhibitory monoaminooxidázy (IMAO), výskyt deprese či kojení. V ČR je tetrabenazin sice registrován, ale není kategorizován, lze ho proto předepsat jen ve zvláštním režimu podle § 16 zákona o veřejném zdravotním pojištění (zákon č. 48/1997 Sb.). Z tohoto důvodu ho ponecháváme v záloze pro nejtěžší formy tikových a dyskinetických projevů, kde předchozí léčba selhává.
Pozitivní efekt v léčbě tiků byl zaznamenán také u dalších farmak, uveďme již pouze výčtem: např. antikonvulziva topiramát [35] a levetiracetam [36]; dopaminergní agonisté apomorfin, buspiron, ropinirol či pergolid [37]; nikotin [38] či tetrahydrokannabinol (THC) [39].
Léčiva užívaná v léčbě přidružených poruch chování
Terapie poruch chování patří do rukou zkušeného odborníka, nejlépe psychiatra. Farmakologické léčbě ADHD, OCD či sebepoškozování je věnováno mnoho jiných, detailnějších textů [40–42], zde uvedeme jen stručný výčet léků s ohledem na indikační specifika u Touretteova syndromu.
Atomoxetin (40–80 mg/den), selektivní inhibitor zpětného vychytávání noradrenalinu (SNaRI), je indikován u těžších forem ADHD. Působí příznivě nejen na příznaky této poruchy, ale snižuje také výskyt tiků [43]. Nejčastějšími vedlejšími účinky jsou bolesti břicha, snížená chuť k jídlu, nauzea, zvýšení tepové frekvence a krevního tlaku. Mezi hlavní kontraindikace patří současné užívání IMAO a glaukom s úzkým úhlem. Lze kombinovat se SSRI i s tricyklickými antidepresivy.
Methylfenidát (10–40 mg/den) je psychostimulans, které je rovněž účinné v terapii ADHD. U pacientů s TS je jeho použití méně vhodné, neboť zvyšuje hladinu dopaminu v nucleus accumbens, což může vést nejen k návykovosti této látky, ale zejména ke zhoršení tikových projevů. Další vedlejší účinky představuje nespavost, nechutenství či zvýšená afektivní dráždivost. Ke kontraindikacím patří glaukom, léčba IMAO a tricyklickými antidepresivy.
U pacientů s projevy OCD nejčastěji volíme přípravky ze skupiny SSRI. Při zahájení léčby SSRI u dětí a adolescentů je třeba zvýšené opatrnosti pro možné riziko rozvoje suicidiálních tendencí [44]. K dalším nežádoucím účinkům patří gastrointestinální obtíže, agitovanost, insomnie, poruchy sexuálních funkcí a snížení příjmu potravy. U všech SSRI je kontraindikována kombinace s IMAO. Dospělým obvykle podáváme citalopram (20–40 mg/den) či fluoxetin (20–40 mg/den), u dětí volíme přednostně fluvoxamin (50–200 mg/den) nebo sertralin (50–200 mg/den). Dětmi bývá dobře tolerováno také tricyklické antidepresivum klomipramin (50–200 mg/den),
kontraidikována je současná terapie psychostimulancii a IMAO, s opatrností lze klomipramin kombinovat s atomoxetinem. Mezi nežádoucí účinky patří únava, sucho v ústech, zácpa, zvýšení chuti k jídlu, tachykardie či rozmazané vidění. Všechna výše uvedená antidepresiva je možné využít také k ovlivnění nutkavé složky tikových projevů.
Další léčebné postupy
Nezastupitelnou pozici v léčbě TS a přidružených poruch chování má psychologické poradenství a psychoterapie. V léčbě tiků mohou pomoci techniky habit reversal (HRT) a expozice a prevence kompulzivní odpovědi (ERP, exposure and response prevention) [45], u OCD pak bývá účinná kognitivně-behaviorální terapie (CBT). Vhodné je rovněž nemocné odkázat na svépomocnou pacientskou organizaci – občanské sdružení ATOS (www.atos-os.cz), které poskytuje informace a další podporu
nemocným.
Lokální aplikace botulotoxinu A je určena především pro pacienty, kteří mají menší počet pohybových tiků dlouhodobě na stejném místě [46]. U nejtěžších farmakorezistentních pacientů se v zahraničí výzkumně zkouší hluboká mozková stimulace (DBS, deep brain stimulation) cílená do thalamických jader, nucleus accumbens či do globus pallidus internus [47]. Existují také ojedinělé práce o účinku elektrokonvulzivní terapie (ECT) [48] a repetitivní transkraniální magnetické stimulace (rTMS) [49], význam těchto metod pro léčbu tiků je však spíše marginální.
Seznam použité literatury
- [1] Kwak C, Dat Vuong K, Jankovic J. Premonitory sensory phenomenon in Tourette’s syndrome. Mov Disord 2003; 18: 1530–1533.
- [2] Jankovic J, Růžička E. Tiky a Touretteův syndrom. Cas Lek Cesk 1997; 136: 399–404.
- [3] Robertson MM. The prevalence and epidemiology of Gilles de la Tourette syndrome. Part 1: the epidemiological and prevalence studies. J Psychosom Res 2008; 65: 461–472.
- [4] Cavanna AE, Servo S, Monaco F, Robertson MM. The behavioral spectrum of Gilles de la Tourette syndrome. J Neuropsychiatry Clin Neurosci 2009; 21: 13–23.
- [5] Deng H, Gao K, Jankovic J. The genetics of Tourette syndrome. Nat Rev Neurol 2012; 8: 203–213.
- [6] Hoekstra PJ, Dietrich A, Edwards MJ, et al. Environmental factors in Tourette syndrome. Neurosci Biobehav Rev 2013; 37: 1040–1049.
- [7] Ganos C, Roessner V, Münchau A. The functional anatomy of Gilles de la Tourette syndrome. Neurosci Biobehav Rev 2013; 37: 1050–1062.
- [8] Swain JE, Scahill L, Lombroso PJ, et al. Tourette syndrome and tic disorders: a decade of progress. J Am Acad Child Adolesc Psychiatry 2007; 46: 947–968.
- [9] Ross MS, Moldofsky H. A comparison of pimozide and haloperidol in the treatment of Gilles de la Tourette’s syndrome. Am J Psychiatry 1978; 135: 585–587.
- [10] Shapiro E, Shapiro AK, Fulop G, et al. Controlled study of haloperidol, pimozide and placebo for the treatment of Gilles de la Tourette’s syndrome. Arch Gen Psychiatry 1989; 46: 722–730.
- [11] Chapel JL, Brown N, Jenkins RL. Tourette’s Disease: Symptomatic Relief with Haloperidol. Am J Psychiatry 1964; 121: 608–610.
- [12] Shapiro AK, Shapiro E, Eisenkraft GJ. Treatment of Gilles de la Tourette’s syndrome with clonidine and neuroleptics. Arch Gen Psychiatry 1983; 40: 1235–1240.
- [13] Riddle MA, Hardin MT, Towbin KE, et al. Tardive dyskinesia following haloperidol treatment in Tourette’s syndrome. Arch Gen Psychiatry 1987; 44: 98–99.
- [14] Gulisano M, Cali PV, Cavanna AE, et al. Cardiovascular safety of aripiprazole and pimozide in young patients with Tourette syndrome. Neurol Sci 2011; 32: 1213–1217.
- [15] Roke Y, van Harten PN, Boot AM, Buitelaar JK. Antipsychotic medication in children and adolescents: a descriptive review of the effects on prolactin level and associated side effects. J Child Adolesc Psychopharmacol 2009; 19: 403–414.
- [16] Borison RL, Ang L, Chang S, et al. New pharmacological approaches in the treatment of Tourette syndrome. Adv Neurol 1982; 35: 377–382.
- [17] Eggers C, Rothenberger A, Berghaus U. Clinical and neurobiological findings in children suffer-ing from tic disease following treatment with tiapride. Eur Arch Psychiatry Neurol Sci 1988; 237: 223–229.
- [18] Klepel H, Gebelt H, Koch RD, Tzenow H. [Treatment of extrapyramidal hyperkineses in childhood with tiapride]. Psychiatr Neurol Med Psychol (Leipz) 1988; 40: 516–522.
- [19] Drtílková I, Balaštíková B, Lemanová H. Tiaprid, clonazepam a clonidin u dětí s tikovou a komorbidní hyperkinetickou poruchou. (Klinická a EEG studie). Čes a slov Psychiat 1997; 93: 54–78.
- [20] Robertson MM, Schnieden V, Lees AJ. Management of Gilles de la Tourette syndrome using sulpiride. Clin Neuropharmacol 1990; 13: 229–235.
- [21] Bruun RD, Budman CL. Risperidone as a treatment for Tourette’s syndrome. J Clin Psychiatry 1996; 57: 29–31.
- [22] Dion Y, Annable L, Sandor P, Chouinard G. Risperidone in the treatment of Tourette syndrome: a double-blind, placebo-controlled trial. J Clin Psychopharmacol 2002; 22: 31–39.
- [23] Sandor P, Stephens RJ. Risperidone treatment of aggressive behavior in children with Tourette syndrome. J Clin Psychopharmacol 2000; 20: 710–712.
- [24] Malá E. Léčba Touretteova syndromu aripiprazolem u dětí a adolescentů – observační studie. Čes a slov Psychiat 2011; 107: 321–323.
- [25] Drtílková I, Theiner P. Aripiprazol v off-label indikaci léčby Tourettova syndromu. Čes a slov Psychiat 2010; 106: 107–110.
- [26] Wenzel C, Kleimann A, Bokemeyer S, Muller-Vahl KR. Aripiprazole for the treatment of Tourette syndrome: a case series of 100 patients. J Clin Psychopharmacol 2012; 32: 548–550.
- [27] McCracken JT, Suddath R, Chang S, et al. Effectiveness and tolerability of open label olanzapine in children and adolescents with Tourette syndrome. J Child Adolesc Psychopharmacol 2008; 18: 501–508.
- [28] Copur M, Arpaci B, Demir T, Narin H. Clinical effectiveness of quetiapine in children and adolescents with Tourette’s syndrome: a retrospective case-note survey. Clin Drug Investig 2007; 27: 123–130.
- [29] Sallee FR, Kurlan R, Goetz CG, et al. Ziprasidone treatment of children and adolescents with Tourette’s syndrome: a pilot study. J Am Acad Child Adolesc Psychiatry 2000; 39: 292–299.
- [30] Jaffe E, Tremeau F, Sharif Z, Reider R. Clozapine in tardive Tourette syndrome. Biol Psychiatry 1995; 38: 196–197.
- [31] Caine ED, Polinsky RJ, Kartzinel R, Ebert MH. The trial use of clozapine for abnormal involuntary movement disorders. Am J Psychiatry 1979; 136: 317–320.
- [32] Bastiampillai T, Dhillon R, Mohindra R. Exacerbation of tics secondary to clozapine therapy. Aust N Z J Psychiatry 2008; 42: 1068–1070.
- [33] Jankovic J, Kurlan R. Tourette syndrome: evolving concepts. Mov Disord 2011; 26: 1149–1156.
- [34] Chen JJ, Ondo WG, Dashtipour K, Swope DM. Tetrabenazine for the treatment of hyperkinetic movement disorders: a review of the literature. Clin Ther 2012; 34: 1487–1504.
- [35] Jankovic J, Jiménez-Shahed J, Brown LW. A randomised, double-blind, placebo-controlled study of topiramate in the treatment of Tourette syndrome. J Neurol Neurosurg Psychiatry 2010; 81: 70–73.
- [36] Fernández-Jeán A, Fernández-Mayoralas DM, Muñoz-Jareño N, Calleja-Perez B. An open-label, prospective study of levetiracetam in children and adolescents with Tourette syndrome. Eur J Paediatr Neurol 2009; 13: 541–545.
- [37] Eddy CM, Rickards HE, Cavanna AE. Treatment strategies for tics in Tourette syndrome. Ther Adv Neurol Disord 2011; 4: 25–45.
- [38] Sanberg PR, Silver AA, Shytle RD, et al. Nicotine for the treatment of Tourette’s syndrome. Pharmacol Ther 1997; 74: 21–25.
- [39] Müller-Vahl KR. Treatment of Tourette syndrome with cannabinoids. Behav Neurol 2013; 27: 119–124.
- [40] Shier AC, Reichenbacher T, Ghuman HS, Ghuman JK. Pharmacological treatment of attention deficit hyperactivity disorder in children and adolescents: clinical strategies. J Cent Nerv Syst Dis 2013; 5: 1–17.
- [41] Praško J. Obsedantně-kompulzívní porucha a její léčba. Postgrad Med 2010; 12: 752–759.
- [42] Malá E. Sebepoškozování jako závažný symptom a nebezpečný společenský jev. Lékařské listy 2009; 58: 6–10.
- [43] Spencer TJ, Sallee FR, Gilbert DL, et al. Atomoxetine treatment of ADHD in children with comorbid Tourette syndrome. J Atten Disord 2008; 11: 470–481.
- [44] Barbui C, Esposito E, Cipriani A. Selective serotonin reuptake inhibitors and risk of suicide: a systematic review of observational studies. CMAJ 2009; 180: 291–297.
- [45] Wile DJ, Pringsheim TM. Behavior Therapy for Tourette Syndrome: A Systematic Review and Meta-analysis. Curr Treat Options Neurol 2013, May 14 [Epub ahead of print].
- [46] Aguirregomozcorta M, Pagonabarraga J, Diaz-Manera J, et al. Efficacy of botulinum toxin in severe Tourette syndrome with dystonic tics involving the neck. Parkinsonism Relat Disord 2008; 14: 443–445.
- [47] Müller-Vahl KR. Surgical treatment of Tourette syndrome. Neurosci Biobehav Rev 2013; 37: 1178–1185.
- [48] Dehning S, Feddersen B, Mehrkens JH, Müller N. Long-term results of electroconvulsive therapy in severe Gilles de la Tourette syndrome. J ECT 2011; 27: 145–147.
- [49] Le K, Liu L, Sun M, et al. Transcranial magnetic stimulation at 1 Hertz improves clinical symptoms in children with Tourette syndrome for at least 6 months. J Clin Neurosci 2013; 20: 257–262.