Transportní systémy pro mRNA vakcíny
Souhrn:
Franc A, Bíba V. Transportní systémy pro mRNA vakcíny. Remedia 2021; 31: 74–81.
Tato přehledová práce z pohledu biofarmacie pojednává o mRNA vakcínách, které patří mezi tzv. genové vakcíny a v současné době jim je věnována zvýšená pozornost. Článek se nezabývá srovnáním s dalšími typy vakcín ani jejich přísadami, což je možné i v češtině nalézt v řadě přehledových prací. Cílem tohoto přehledu je v krátkosti nastínit mechanismus účinku a zevrubně uvést systémy, které vedou k transfekci nukleových kyselin přes buněčnou membránu do buňky a jejích organel, dále stručně popsat technologii přípravy těchto systémů a rovněž zmínit bezpečnost a legislativní požadavky pro jejich registraci.
Summary:
Franc A, Biba V. Transport systems for mRNA vaccines. Remedia 2021; 31: 74–81.
In terms of biopharmacy, this work describes mRNA vaccines that are also called “gene vaccines” and that are now receiving increased attention. The article does not deal with a comparison with other types of vaccines (or their additives) that are also available in Czech in some review articles. The aim of this review is to briefly outline the mechanism of action and to describe systems that allow the transfection of nucleic acids across the cell membrane into the cell and its organelles, and to briefly describe the preparation technology and also to mention safety and registration requirements.
Key words: mRNA vaccines, translation, vectors, nanoparticles, production,safety
Princip genových vakcín
Genové vakcíny (DNA/mRNA) patří do tzv. třetí generace vakcín. Popis evoluce předchozích generací lze pak nalézt v dalších přehledových článcích [1,2]. Jejich podstata spočívá v tom, že tyto vakcíny pomocí vnesené nukleové kyseliny naučí část somatických buněk hostitelského organismu, resp. člověka, syntetizovat proteiny, které se pak buď jako protilátky, nebo jako povrchové epitopy účastní imunitní odpovědi proti patogenu. DNA vakcíny obsahují obvykle virový či nevirový vektor s plazmidem z cílového patogenu, který je po transportu do hostitelské buňky schopen vyvolat potřebnou buněčnou i humorální imunitu vůči danému patogenu. Plazmid nejprve vstupuje do eukaryotické buňky a následně do jejího jádra, kde se stává součástí DNA malé části somatických, obvykle svalových buněk hostitele. V jádře těchto buněk je pak příslušný gen pomocí RNA polymerázy přepisován do informační neboli mediátorové RNA (mRNA), která vzniká na principu komplementarity k vláknu DNA. Vzniklá mRNA pak přechází do cytoplazmy, resp. do ribozomů, kde tvoří předlohu k syntéze potřebného proteinu, který se dále podílí na imunitní reakci a za jehož syntézu odpovídá specifický gen. Proces, kdy v jádře podle předlohy DNA vzniká mRNA, se nazývá transkripce, a proces, kdy podle předlohy mRNA vzniká potřebný protein, se jmenuje translace. Samotný proces vstupu exogenní mRNA do hostitelské buňky je označován jako transfekce. Mediátorová RNA samotná nebo zabudovaná do vhodného vektoru pak bývá použita k vakcinaci, čímž se obejde celý proces transkripce a nedojde k modifikaci DNA buněčného jádra hostitelské buňky. I přes skutečnost, že principem DNA vakcín není změna zárodečných buněk, ale pouze omezeného množství buněk somatických, bývá zdůrazňováno, že u mRNA vakcíny ani teoreticky nehrozí riziko změny lidského genomu [3]. U DNA vakcín se uvádí, že jejich zkoušky byly prováděny pouze na zvířatech, a nelze proto ani prokázat, ani vyvrátit genetické ovlivnění lidských buněk [4]. Případnou analogickou interakci s DNA ve formě přirozeného vektoru způsobují například onkogenní viry [5]. Tento článek se proto dále zaměřuje výlučně na mRNA vakcíny, u kterých se toto podezření nepředpokládá.
Transkripce
Při procesu transkripce vzniká nejprve holé vlákno RNA (hnRNA), ke kterému je následně na jedné straně přidána tzv. guanosinová čepička, tvořící konec 5᾽, a na druhé straně je přidán tzv. poly(A) konec a celé vlákno prochází tzv. sestřihem (splicing). Konec 5᾽ je tvořen především 7 methylguanosinem, který je fosfátovou vazbou spojen s molekulou ribózy jednoho konce hnRNA. Poly(A) konec je tvořen řadou z adeninových nukleotidů a je poly(A) polymerázou připojen k druhému konci holého vlákna hnRNA. Poly(A) konec chrání mRNA během jejího transportu z jádra do ribozomů před enzymatickou degradací a rovněž pomáhá tento transport zajišťovat. Závěrečný sestřih zbavuje mRNA tzv. nekódujících částí (intronů). Pro translaci je pak podstatná tzv. oblast otevřeného čtecího rámce, kódující potřebný protein. Tak vzniká definitivní mRNA [6].
Translace
Definitivní mRNA je pomocí transportních proteinů přenesena z jádra do cytoplazmy a následně do ribozomu. Zde dochází k syntéze molekuly proteinu, která je sestavována z jednotlivých aminokyselin dle genetického kódu mRNA, obsaženého v oblasti otevřeného čtecího rámce. Translace se sestává ze tří následných fází: iniciace, elongace a terminace. V iniciační fázi dochází ke kontaktu tzv. startovního nukleotidového tripletu mRNA (tzv. startkodon AUG) s ribozomem. Pomocí řady iniciačních faktorů pak začíná proces skenování informace. Během fáze elongace je dle každého následného nukleotidového tripletu (kodonu) mRNA ke vznikajícímu peptidovému řetězci přidávána jedna z dvaceti aminokyselin, které jsou do ribozomu transportovány pomocí tRNA na základě jejího nukleotidového tripletu (antikodonu), jenž je komplementární k příslušnému načtenému kodonu mRNA. Poté, co dojde k načtení tzv. terminálního nukleotidového tripletu (stopkodonu UAA, UAG nebo UGA), je proteosyntéza ukončena [6].
Transfekce
Mediátorová RNA musí v rámci
vstupu do procesu proteosyntézy hostitelské buňky však
nejprve překonat řadu bariér. Pro dosažení očekáváného
účinku je proto třeba zvolit vhodný lékový transportní systém
(virový či nevirový vektor), který mRNA zprostředkuje
transfekci. Jejich volba se odvíjí od typu hostitelské buňky
a fyzikálně chemických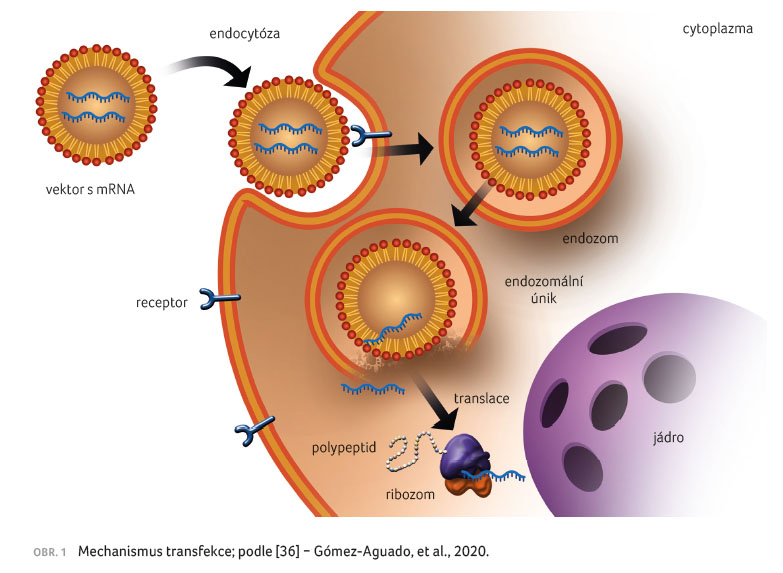 vlastností systému, do kterého
má být mRNA zapracována. V podstatě dnes existují dva
základní přístupy podání mRNA vakcíny do hostitelské
buňky. První z nich spočívá v primární transfekci
mRNA do dendritických buněk ex vivo, které pak samy
slouží k vakcinaci. Druhý přístup spočívá ve vakcinaci
samotnou mRNA, resp. v jejím zabudování do vektoru.
Na rozdíl od vakcinace, kdy je mRNA vpravena přímo
do cytoplazmy dendritických buněk ex vivo, při
vakcinaci holým vláknem mRNA nebo pomocí vektoru musí mRNA
překonat řadu bariér. První se vyskytují na cestě
z místa vpichu do požadované buněčné populace, kdy
musí překonat řadu extracelulárních bariér, dále jsou to
endocytické bariéry, skrze které molekula přechází během
procesu, kdy je aktivně vychytávána cílovou buňkou, a nakonec
intracelulární bariéry ovlivňující endozomální uvolňování
mRNA do cytoplazmy [7], viz obrázek 1.
vlastností systému, do kterého
má být mRNA zapracována. V podstatě dnes existují dva
základní přístupy podání mRNA vakcíny do hostitelské
buňky. První z nich spočívá v primární transfekci
mRNA do dendritických buněk ex vivo, které pak samy
slouží k vakcinaci. Druhý přístup spočívá ve vakcinaci
samotnou mRNA, resp. v jejím zabudování do vektoru.
Na rozdíl od vakcinace, kdy je mRNA vpravena přímo
do cytoplazmy dendritických buněk ex vivo, při
vakcinaci holým vláknem mRNA nebo pomocí vektoru musí mRNA
překonat řadu bariér. První se vyskytují na cestě
z místa vpichu do požadované buněčné populace, kdy
musí překonat řadu extracelulárních bariér, dále jsou to
endocytické bariéry, skrze které molekula přechází během
procesu, kdy je aktivně vychytávána cílovou buňkou, a nakonec
intracelulární bariéry ovlivňující endozomální uvolňování
mRNA do cytoplazmy [7], viz obrázek 1.
Vznik imunitní odpovědi
Jako hostitelské buňky se uplatňují především antigen prezentující buňky (APC), a to primárně dendritické buňky. Po jejich saturaci se vzhledem k místu aplikace mohou uplatnit např. i svalové nebo kožní buňky, fibroblasty apod. [8]. Protein, který je po transfekci exogenní mRNA v hostitelské buňce syntetizován, je následně štěpen proteazomy a vzniklé oligonukleotidy jsou transportovány do endoplazmatického retikula, kde se váží na molekuly MHC třídy I a II. Vzniklé komplexy jsou následně transportovány na buněčný povrch a v případě dendritických buněk dopraveny do lymfatických uzlin. U MHC I komplexu pak dochází k aktivaci cytotoxických CD8+ T lymfocytů, které ničí infikované buňky. U MHC II komplexu dochází ke stimulaci CD4+ T lymfocytů, které tvorbou cytokinů mj. aktivují B lymfocyty k tvorbě protilátek. Vedle exprese antigenů může mRNA kódovat i specifickou protilátku ve formě lidského imunoglobulinu G (IgG), který hostitelská buňka sama produkuje. Tyto protilátky jsou identické s protilátkami nalezenými u pacienta s anamnézou imunity vůči danému patogenu nebo jsou těmto protilátkám podobné. Lidská buňka se tak stává sama producentem specifických protilátek proti patogenu, jehož gen byl pomocí mRNA dopraven do ribozomů hostitelské buňky a vytvořil zde předlohu k jejich syntéze [9].
Výroba mRNA
Již od 90. let existuje snaha o vývoj mRNA vakcín, nicméně od počátku panovala skepse s ohledem na stabilitu této molekuly. Avšak ukázalo se, že mRNA je relativně stabilní, a navíc může být vyrobena zcela mimo tělní, resp. buněčný systém. Za tímto účelem byla in vitro vyvinuta linearizovaná šablona DNA, která se pomocí polymerázy T7 nebo SP6 RNA ex vivo přepisuje do molekuly mRNA. Kódování mRNA probíhá od konce 5᾽ až po poly(A) konec a obsahuje oblast otevřeného čtecího rámce, což simuluje strukturu mRNA, která se běžně nachází v cytoplazmě eukaryotických buněk. Uvádí se, že při zavedení průmyslové metody lze takto vyrábět až několikakilogramové šarže [10]. Exogenní mRNA je však v cytoplazmě hostitelské buňky rychle rozkládána ribonukleázami, a proto bývá zapouzdřena do vektoru, který usnadní její transport do dendritických buněk, případně přímo do cytoplazmy hostitelských buněk a dále do jejich organel, resp. do ribozomů. Mediátorová RNA je po předání informace nakonec degradována fyziologickými procesy, čímž se snižuje riziko toxicity [11].
Transportní systémy
K plnému využití mRNA je zapotřebí bezpečného a efektivního transportního prostředku, který by byl kompatibilní s tkáňovými tekutinami, zaručil by ochranu mRNA před ribonukleázami, zabránil buněčnému vychytávání ve formě endocytózy a díky schopnosti delšího přetrvávání v mezibuněčné tkáni by zabezpečil efektivní translaci. Vedle klasických virových vektorů ve formě adenovirů, alfavirů, flavivirů, rhabdovirů, viru spalniček apod. je možné využít tvorby virům podobných částic (virus like particles, VLP) a hlavně translačních systémů ve formě komplexů nebo nanočástic, jejichž přípravě se již řadu let věnuje farmaceutická technologie [12]. Těmito systémy se stručně zabývá i následující popis.
Holá mRNA
K transfekci do eukaryotické buňky je ovšem možné použít i holé vlákno mRNA. Poprvé byla transfekce prokázána v roce 1990 myšími svalovými buňkami po jednoduché intramuskulární injekci. V současných klinických studiích se s výhodou cílí na antigen prezentující buňky (APC) formou intradermálních a intranodálních injekcí. Některé studie prokázaly, že transfekce je pozitivně ovlivněna přítomností vápenatých iontů a závisí na teplotě a dávce. Při samotné transfekci se uplatňují dva mechanismy. Prvním je aktivní transport lipidovými kanály a ve druhém případě jde o mikropinocytózu, která se uplatňuje jen v menší míře. Nedávné studie prokázaly, že intranodální injekce holé mRNA může vzbudit silnou expresi T lymfocytů [6].
Elektroporace
Ke zvýšení účinnosti transfekce se mohou používat i fyzikální metody, z nich stěžejní úlohu hraje elektroporace a v menší míře sonoporace. Její princip spočívá v generaci impulzu intenzivního elektrického pole, které vede k dočasnému vzniku mikropórů v buněčné stěně, jimiž mohou procházet nukleové kyseliny do buňky. Póry se po transfekci rychle zacelí, aniž by došlo k denaturaci buněčné stěny či buněčných organel. Obvykle se používá opakovaného pulzu řádově v desítkách voltů po dobu desítek milisekund [13]. Výzkumy na dendritických buňkách prokázaly vysokou schopnost transfekce mRNA (89 % s 15% úmrtností), přičemž došlo k prezentaci funkčních antigenních peptidů na buněčném povrchu, což vedlo k aktivaci cytolytických T lymfocytů [14].
Protaminové komplexy
Protamin je jaderný kationický protein s vysokým obsahem argininu, ve kterém se při procesu spermatogeneze kondenzují hlavičky spermií s obsahem nukleových kyselin (v tomto případě DNA). Tato schopnost protaminu se proto využívá i při formulaci vakcíny s obsahem mRNA, kde protamin slouží k její ochraně před působením sérových ribonukleáz. Některé vakcíny však v pokusech in vivo neprokázaly dostatečnou expresi antigenu a protaminové komplexy tak zůstaly v používání jako imunoadjuvancia, přičemž od jejich použití jako vektorů se dnes spíše upouští. Protaminové komplexy byly využity například k výrobě vektorů pro klinické hodnocení vakcíny proti chřipce a vzteklině [7].
Kationické nanoemulze
Kationická nanoemulze typu olej ve vodě (O/V), kde je vnitřní fáze tvořena specifickými lipofilními látkami, může být s výhodou stabilizována komplexním emulgátorem a dá se využít jako vektor, pokud vnitřní fáze zároveň obsahuje nukleovou kyselinu. Příkladem kationické nanoemulze je systém tvořený emulgátorem MF59 (společnosti Novartis), který vytváří emulzi squalenu typu O/V a zároveň slouží jako účinné imunoadjuvans, jež má zavedený profil klinické bezpečnosti a je dobře snášeno dětmi i staršími osobami. V pokusu byla vytvořena kationická nanoemulze, jejíž olejovou fázi tvořil speciálně pro transfekci komerčně dostupný kationický lipid DOTAP (1,2 dioleoyl 3 trimethylammonium propan), který byl spolu s imunoadjuvans MF59 a SPAN 85 vemulgován do vodné fáze již obsahující Tween 80. Výsledná směs byla poté homogenizována pomocí mikrofluidizéru (vysokotlaký mísič kapalné fáze). Vznikla tak vnitřní, olejová fáze tvořená nanokapénkami. Do ní byla zároveň přidána mRNA, exprimující fúzní protein lidského respiračního syncytiálního viru (RSV F). Tato nanoemulze vyvolala u myší, potkanů, králíků a makaků silnou imunitní odpověď ve formě indukce buněčné i humorální imunity, která je srovnatelná s infekcí samotným virem [15].
Modifikované dendrimerické nanočástice
Dendrimery jsou polymerové trojrozměrné řetězce uspořádané do tzv. stromečků, které samotné neaktivují lidský imunitní systém a prakticky nevykazují toxicitu. Struktura je tvořena molekulami různých monomerů, většinou polyaminů. Dendrimery obsahují uvnitř řetězců velký sterický prostor, přičemž funkční skupiny směřují k povrchu. Tyto funkční skupiny navíc umožňují vazbu biologicky aktivních látek [16]. Příprava modifikovaných dendrimerických nanočástic (DMNP) není nikterak složitá, jelikož většina z nich má schopnost samonaskládání okolo mRNA. Principem přípravy vakcíny je kondenzace kationických polyethyleniminů (PEI) okolo anionických fosfátových řetězců dílčích nukleotidů, což vede ke vzniku kompaktních nanočástic, které po separaci poskytují určitou míru ochrany před ribonukleázami. Částice mohou být pegylovány pomocí polyethylenglykolu (PEG) [17]. Tento systém je schopen generovat ochrannou imunitu proti širokému spektru účinků patogenů díky mRNA, kódující například antigeny chřipky H1N1, Toxoplasma gondii nebo viru Ebola, přičemž vede ke vzniku buněčné i humorální imunity [18].
Lipozomy s protaminovými komplexy
Další možnost transfekce se zvýšenou stabilitou vlákna mRNA představuje kombinace protaminového komplexu zapouzdřeného do lipozomu. Lipozomy patří ke klasickým a osvědčeným systémům, které se používají k prostupu buněčnou membránou, a proto si našly své místo i ve formulaci mRNA vakcín. Jsou to měchýřkovité útvary z fosfolipidů, nejčastěji fosfatidylcholinu, cholesterolu a glykolipidů, které zde tvoří jednu či více vrstev, přičemž každá vrstva je složena z lipidové dvojvrstvy. Uvnitř lipozomu se nachází hydrofilní část, do které je možno inkorporovat mRNA. Příprava lipozomů je poměrně snadná, má nízkou variabilitu šarží s možností vzniku různé škály vlastností. K jejich výrobě lze použít například tvorbu suchého lipidického filmu, který vzniká na vnitřní stěně baňky po odstranění rozpouštědla. Po rehydrataci, sonifikaci, případné extruzi a vysušení je možné získat lipozomy o potřebné velikosti k zabudování nukleových kyselin. Příkladem je nazální vakcína, kdy mRNA v kationickém komplexu s protaminem byla inkorporována do kationických lipozomů, jejichž stěna byla tvořena z DOTAP, cholesterolu a z látky označované jako DSPE PEG (distearoyl glycero 3 fosfoethanolamin N methoxypolyethylenglykol). Tyto látky byly v molárním poměru smíseny ve směsi chloroformu a methanolu a směs byla vysušena v rotační odparce, rehydratována a mRNA kódující cytokeratin 19 ve směsi s protaminem byla do lipozomů inkorporována během krátké inkubace. Tato vakcína při intranazální aplikaci vyvolala silnou buněčnou imunitní odpověď a zpomalila růst Lewisova karcinomu plic na myším modelu [19].
Kationické polymery
Kationické polymery, jako je PEI, polyamidoamin (PAMAM) nebo chitosan, v přítomnosti negativně nabité molekuly mRNA kondenzují a po separaci vytvářejí vhodné transportní systémy umožňující transfekci. K formulaci vakcín se s výhodou používá metoda mikrofluidizace, kde se mísí vodné roztoky polysacharidu s roztokem RNA za vzniku nanokondenzátů. Například formulace založená na PEI s mRNA indukovala specifické reakce T lymfocytů proti infekcím HIV po intramuskulární vakcinaci na myším modelu. Stejně tak vakcíny na bázi směsi mRNA a PAMAM vytvořily na obdobném modelu imunitu proti viru Ebola, viru chřipky H1N1 nebo Toxoplasma gondii [20].
Kationické polymerové lipozomy
Jednou z prvních nukleových vakcín ve formě lipozomů byla enkapsulovaná mRNA kódující nukleoprotein chřipkového viru. Dipalmitoylfosfatidylcholin (DPPC), cholesterol a fosfatidylserin se zde společně vysuší na rotační odparce a směs se redisperguje v oktyl β D glukopyranosidu. Po inkorporaci mRNA se směs dialyzuje, extruduje a purifikuje gelovou permeací. Na myším modelu vedla vakcína k expresi cytolytických T lymfocytů [21]. Obecný popis přípravy samotných lipozomů je popsán výše. Ve formě lipozomů se ke klinickému hodnocení již vyrobily vakcíny proti HIV, RSV nebo chřipce [22].
Polysacharidové částice
Další možností ke zvýšení stability i transfekce je tvorba polysacharidových nanočástic obsahujících nukleové kyseliny. Při konstrukci mRNA vakcín lze s úspěchem využít např. systém na bázi směsi chitosanu s alginátem, vytvářejících společně gelovou strukturu. Tento systém je díky své struktuře rychle biodegradován. Nejprve se chitosan rozpustí v kyselém pufru s přídavkem kyseliny jantarové a po neutralizaci se vysráží N sukcinylchitosan, který se zlyofilizuje. Následně se připraví roztok alginátu, který se zoxiduje oxidačním činidlem. Po smísení obou roztoků v příhodném poměru vzniká chitosan-alginátový gel, kde jsou obě složky spojeny in situ vzniklou Schiffovou bází. Do gelové struktury vzniklé po lyofilizaci je možné zabudovat připravené lipidické částice mRNA (jejich příprava viz popis níže), které se po rehydrataci injikují do hostitelského organismu, čímž se pozitivně ovlivní rychlost uvolňování a sníží se rychlost degradace nukleové kyseliny. V pokusu byla použita mRNA kódující ovalbumin (OVA), což na myším modelu vedlo ke zvýšení proliferace T lymfocytů a sekrece interferonu gama [23].
Kationické lipidické nanočástice
Dalším z možných vektorových systémů jsou lipidické kationické nanočástice, které bývají tvořeny lipidickými či hybridními lipopolysacharidovými směsnými biopolymery se zabudovanou mRNA. Příkladem může být směs kationického lipidického polymeru DOTAP a anionického protamin sulfátu, v nichž je enkapsulována mRNA kódující enzym luciferázu. Připraví se zásobní roztoky pro mRNA a protaminu v neutrálním roztoku glukózy. Příprava nanočástic může probíhat metodou intenzivního mísení (např. již zmíněná mikrofluidizace) buď vytvořením jádra z mRNA a protaminu a následným přidáním DOTAP, nebo vytvořením jádra z DOTAP a mRNA s následným přidáním protaminu; případně smísením protaminu a DOTAP s následným přidáním mRNA. Principem tvorby nanočástic je elektrostatická interakce opačně nabitých polymerů vytvářejících agregující se obrácené micely ve formě mRNA obklopené kationtovými lipidy. Transfekce byla hodnocena na myším modelu metodou bioluminiscence po intramuskulární aplikaci. Výsledky prokázaly synergické působení hybridních polymerů v transfekci oproti samotným lipidickým částicím [24].
Kationické lipidické cholesterolové nanočástice
Tato modifikace vychází z předchozího s tím rozdílem, že do lipidů, které tvoří obal částic, je vmezeřen cholesterol, čímž může dojít k dalšímu zvýšení jeho mechanické stability; mRNA je zde enkapsulována do formy kationických nanočástic s asistencí lipidů (CLAN) s obsahem cholesterolu. Tyto částice se připravují vytvořením emulze typu O/V a následným odpařením vnější fáze. Například vodný roztok mRNA kódující OVA se emulguje v disperzi chloroformu s kopolymerem PEG s PLGA a s kationickým lipidem s vázaným cholesterolem BHEM Chol (N,N bis(2 hydroxyethyl) N methyl N (2 cholesteryloxykarbonylaminoethyl) ammonium bromid). Chloroform je následně odpařen za vzniku nanočástic. Takto zapracovaná vakcína ve formě mRNA kódující OVA po intravenózní aplikaci na myším modelu účinně stimulovala zrání dendritických buněk a podporovala aktivaci a proliferaci T lymfocytů. Následně došlo i ke zpomalení růstu lymfomu E.G7 OVA [25].
Kationické lipidické cholesterolové pegylované nanočástice
I v tomto případě se jedná
o rozvoj předchozího systému, kdy navíc dochází k pegylaci
lipidických nanočástic,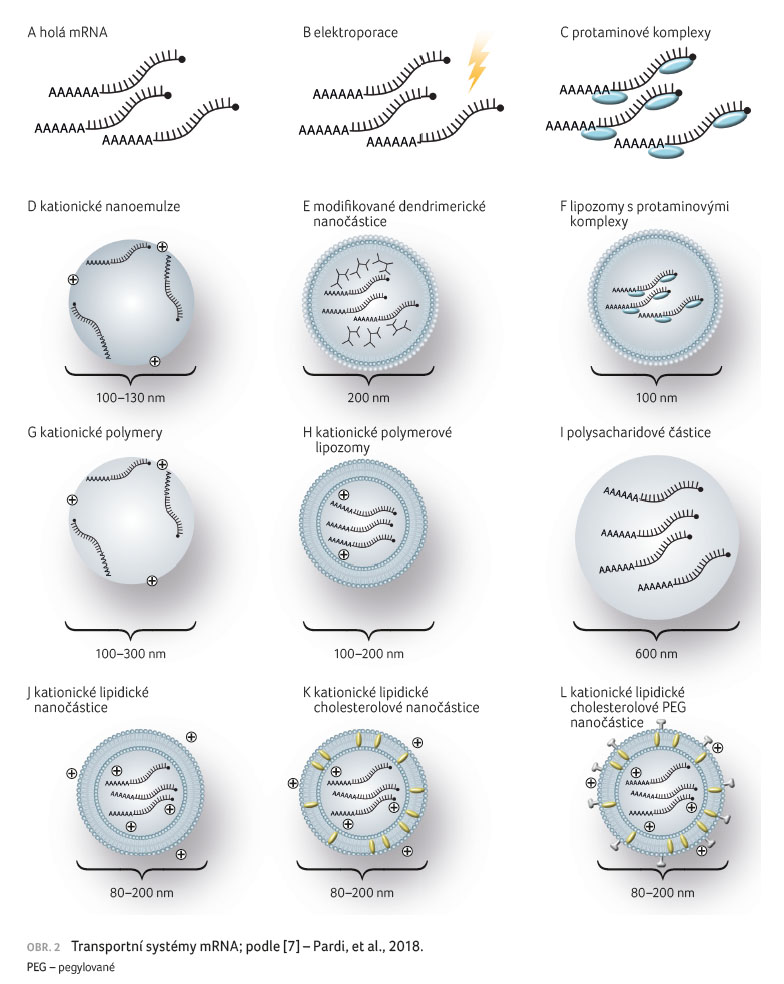 přičemž se PEG přednostně orientuje
na jejich vnější povrch. Oproti předešlému systému zde
PEG působí jako bariéra stericky stabilizující celý systém,
čímž snižuje nespecifickou vazbu na proteiny. Se zvyšujícím
se obsahem PEG se při intravenózní aplikaci prodlužuje doba
setrvávání v krevním oběhu při současném snížení
buněčného vychytávání a interakci s endozomální
membránou. Zároveň je potlačena účinnost ribonukleáz.
Příkladem je tvorba vakcíny s obsahem mRNA kódující
produkci alkalické fosfatázy (SEAP). Příprava spočívá v tom,
že se nejprve smísí lipidické složky DSPC
(1,2 distearoyl sn glycero 3 fosfocholin),
cholesterol a PEG DMG 2000
(1,2 dimyristoyl sn glycero 3 fosfoethanolamin N [methoxy(polyethylenglykol) 2000])
v etanolu. Následně se mRNA spolu s kationickým tenzidem
určeným pro dispergaci nukleových kyselin a označovaným
zkratkou
DLinDMA (N,N dimethyl 2,3 bis[(9Z,12Z) oktadeka 9,12 dienyloxy]propan 1 amin)
dispergují v citrátovém pufru o pH 6 a lipidická
i hydrofilní fáze se společně smísí. Později se přidá
další podíl pufru, čímž „vypadnou“ pegylované lipidické
částice, které se oddělí dialýzou. Po intramuskulární
aplikaci na myším modelu se ukázalo, že pouhá desetina
dávky vede k vyšší produkci SEAP s menší variabilitou
kolísání koncentrace oproti stejně aplikované nativní mRNA
[26].
přičemž se PEG přednostně orientuje
na jejich vnější povrch. Oproti předešlému systému zde
PEG působí jako bariéra stericky stabilizující celý systém,
čímž snižuje nespecifickou vazbu na proteiny. Se zvyšujícím
se obsahem PEG se při intravenózní aplikaci prodlužuje doba
setrvávání v krevním oběhu při současném snížení
buněčného vychytávání a interakci s endozomální
membránou. Zároveň je potlačena účinnost ribonukleáz.
Příkladem je tvorba vakcíny s obsahem mRNA kódující
produkci alkalické fosfatázy (SEAP). Příprava spočívá v tom,
že se nejprve smísí lipidické složky DSPC
(1,2 distearoyl sn glycero 3 fosfocholin),
cholesterol a PEG DMG 2000
(1,2 dimyristoyl sn glycero 3 fosfoethanolamin N [methoxy(polyethylenglykol) 2000])
v etanolu. Následně se mRNA spolu s kationickým tenzidem
určeným pro dispergaci nukleových kyselin a označovaným
zkratkou
DLinDMA (N,N dimethyl 2,3 bis[(9Z,12Z) oktadeka 9,12 dienyloxy]propan 1 amin)
dispergují v citrátovém pufru o pH 6 a lipidická
i hydrofilní fáze se společně smísí. Později se přidá
další podíl pufru, čímž „vypadnou“ pegylované lipidické
částice, které se oddělí dialýzou. Po intramuskulární
aplikaci na myším modelu se ukázalo, že pouhá desetina
dávky vede k vyšší produkci SEAP s menší variabilitou
kolísání koncentrace oproti stejně aplikované nativní mRNA
[26].
Jednotlivé transportní systémy
přehledně uvádí obrázek 2, nadějné transportní
systémy mRNA vakcín v klinickém hodnocení přibližuje
tabulka 1.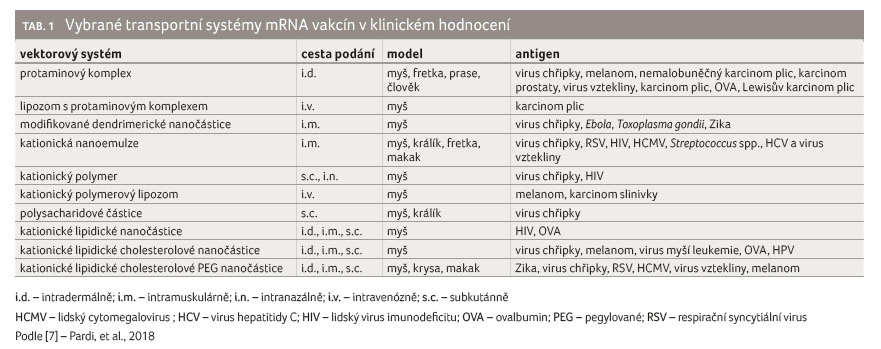
Způsoby aplikace
Způsobem aplikace se mRNA vakcíny
v podstatě neliší od jiných vakcín. Až do této
doby nebyly schváleny k humánní terapii a je možné
vycházet převážně ze zvířecích modelů. V případě
prevence infekčních chorob se podávají zejména ve formě
injekcí, a to intradermálně, subkutánně, intramuskulárně
a u onkologických vakcín intravenózně a intranodálně.
Vedle toho se využívá i intranazální aplikace. Mohou se též
podávat pomocí mikrojehel, ať už dutých [27], nebo připravených
z hydrofilního polymeru, jako je např. PVA [28] nebo
PVP [29], které se rozp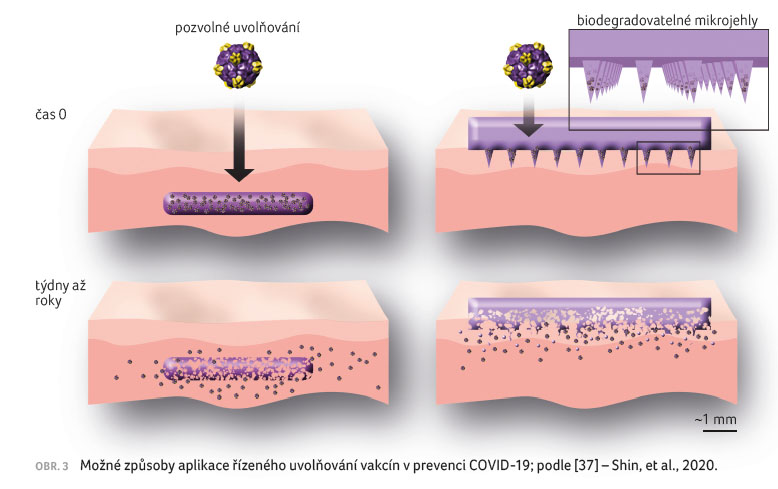 ouštějí až po aplikaci. Existují
i futuristické vize pro vakcíny ve formě VLP, které
ve formě implantátů a náplastí s mikrojehlami
umožní prodloužené uvolňování aktivní složky v závislosti
na použitém polymeru.
Implantáty mají být podávány subkutánně kvalifikovaným
personálem, zatímco náplasti s mikrojehlami lze intradermálně
bezbolestně aplikovat i neškoleným personálem. Systémy by
mohly omezit i nutnost intenzivního chlazení vakcín a počítá
se s nimi i v prevenci COVID 19 [30], obrázek 3. Uvažuje se, že náplasti s mikrojehlami by obecně
mohly být spojeny se zanesením identifikačních údajů,
které by po aplikaci byly zároveň in vivo nepřenosným
očkovacím průkazem [31].
ouštějí až po aplikaci. Existují
i futuristické vize pro vakcíny ve formě VLP, které
ve formě implantátů a náplastí s mikrojehlami
umožní prodloužené uvolňování aktivní složky v závislosti
na použitém polymeru.
Implantáty mají být podávány subkutánně kvalifikovaným
personálem, zatímco náplasti s mikrojehlami lze intradermálně
bezbolestně aplikovat i neškoleným personálem. Systémy by
mohly omezit i nutnost intenzivního chlazení vakcín a počítá
se s nimi i v prevenci COVID 19 [30], obrázek 3. Uvažuje se, že náplasti s mikrojehlami by obecně
mohly být spojeny se zanesením identifikačních údajů,
které by po aplikaci byly zároveň in vivo nepřenosným
očkovacím průkazem [31].
Účinnost a bezpečnost
Při zavedení mRNA vakcín do léčebné terapie lze ovšem očekávat, že při daném mechanismu mohou nastat problémy s účinností. Nemusí totiž dojít k transfekci dostatečného množství kopií mRNA do potřebného počtu hostitelských buněk a tím i k dostatečné exprimaci antigenu nebo dostatečně masivní tvorbě protilátek, což by nevedlo k požadované imunitní odpovědi [8]. Je třeba si rovněž uvědomit, že do současné doby neexistovaly žádné mRNA vakcíny, které by byly schváleny pro humánní terapii. Dosavadní klinická hodnocení ukazují, že k dosažení požadované imunogenity je třeba aplikace několika opakovaných dávek. Proto existují i snahy toto omezení překonat použitím adjuvantních systémů. Z hlediska posouzení toxicity se přepokládá zejména přítomnost lokálního a systémového zánětu, biodistribuce a perzistence exprimovaného imunogenu, stimulace autoreaktivních protilátek a potenciální toxicita nukleotidů. Možnou obavou je, že očkovací látky na bázi mRNA, vedoucí k interferonové odpovědi typu I, mohou vést k autoimunitě [7].
Legislativní požadavky
Aby bylo možno vakcíny, stejně jako
jiné léčivé přípravky, používat při poskytování
zdravotních služeb pacientům, je nutná (kromě zcela výjimečných
případů, které nejsou předmětem tohoto pojednání) jejich
registrace. Před zahájením procesu registrace je třeba provést
preklinické a klinické hodnocení, jež umožňuje zjistit,
zda je léčivo účinné, zda má přijatelný bezpečnostní
profil, zda jeho přínosy převažují nad riziky. U vakcín
toto hodnocení standardně trvá řadu let – obvyklá doba
preklinického testování a prvních tří fází klinického
hodnocení se uvádí 7–10 let, přičemž samotné fáze I−III
trvají u vakcín obvykle 6–8 let (obr. 4).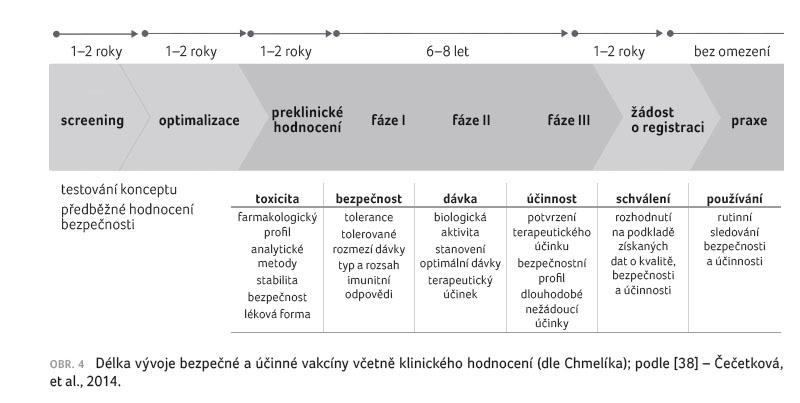
Teprve poté, co je na základě dat z těchto hodnocení prokázán příznivý poměr přínosu a rizik (včetně dostatečných dat o dlouhodobé bezpečnosti, přičemž právě hodnocení dlouhodobé bezpečnosti má zásadní význam), nastoupí další fáze – administrativní, tedy registrační řízení. Obecně se léčivé přípravky v zemích Evropské unie mohou registrovat buď postupem centralizovaným (rozhodnutí o registraci vydává Evropská komise), nebo čistě národním, nebo decentralizovaným (decentralized procedure, DCP), resp. systémem vzájemného uznávání registrací (mutual recognition procedure, MRP). U některých léčivých přípravků (těch, které jsou uvedeny v příloze Nařízení Evropského parlamentu a Rady [ES] č. 726/2004 ze dne 31. března 2004) je obligatorní centralizovaná registrace (při níž řízení provádí Evropská léková agentura a vlastní rozhodnutí vydává Evropská komise). To platí i pro vakcíny na bázi mRNA (a také na bázi DNA) [32].
Jak již bylo uvedeno, registrační řízení se provádí až poté, co jsou k dispozici data preklinického testování a prvních tří fází klinického hodnocení. Samotná registrační procedura trvá přibližně 270 dnů (přičemž stanovisko Výboru pro humánní léčivé přípravky, který provádí vlastní hodnocení, má být vydáno do 210 dnů po obdržení žádosti o registraci, pak může dojít k výzvě k doplnění údajů, popř. k přezkumu stanoviska atd.) [33]. Existuje také možnost tzv. podmíněné registrace, založené na neúplných datech (typicky např. tehdy, nejsou li dosud provedeny studie dlouhodobé bezpečnosti). Tuto podmíněnou registraci lze udělit za situace, kdy existují neuspokojené potřeby pacientů u závažných nebo život ohrožujících onemocnění. Takováto podmíněná registrace je udělena ještě před předložením úplných klinických údajů v případě, že výhody spojené s okamžitou dostupností takového léčivého přípravku na trhu vyváží rizika spojená s tím, že tyto údaje ještě nebyly předloženy. V naléhavých situacích může být udělena registrace takovým léčivým přípravkům rovněž v případě, že nebyly předloženy úplné preklinické nebo farmaceutické údaje. V době sepsání tohoto pojednání byla takováto podmíněná registrace udělena přípravku Comirnaty − mRNA vakcína proti onemocnění COVID 19 (modifikovaný nukleosid) [34].
Velmi zajímavou je otázka právního postavení vakcín na bázi mRNA (stejně jako i DNA) z hlediska jejich zařazení mezi genovou terapii. V části IV Přílohy I bodu 2.2 směrnice 2001/83/ES [35] je definován léčivý přípravek pro genovou terapii takto: „Léčivým přípravkem pro genovou terapii se rozumí biologický léčivý přípravek, který má následující vlastnosti: a) obsahuje účinnou látku, která obsahuje rekombinantní nukleovou kyselinu používanou u lidí nebo podávanou lidem k regulaci, reparaci, výměně, doplnění nebo odstranění genetické sekvence, nebo z takové rekombinantní nukleové kyseliny sestává; b) jeho terapeutický, profylaktický nebo diagnostický účinek se vztahuje přímo na sekvenci rekombinantní nukleové kyseliny, kterou obsahuje, nebo na produkt genetické exprese této sekvence. Léčivé přípravky pro genovou terapii nezahrnují vakcíny proti infekčním onemocněním.“ Z této definice vyplývá, že ačkoliv vakcíny na bázi mRNA i DNA naplňují znaky genové terapie (jejich účinek se vztahuje přímo na sekvenci rekombinantní nukleové kyseliny, kterou obsahují, nebo na produkt genetické exprese této sekvence), do kategorie léčivých přípravků pro genovou terapii nespadají, a to pouze proto, že jde o vakcíny proti infekčním onemocněním. Proto se na ně nevztahují ani speciální požadavky a výsledky hodnocení nutné pro schválení genové terapie. Přitom zcela obdobné vakcíny, určené k onkologickým aplikacím, by mezi přípravky pro genovou terapii spadaly, a tyto požadavky by se proto na ně vztahovaly.
Seznam použité literatury
- [1] Franc A. Vakcíny z pohledu farmaceuta. Čes slov Farm 2020; 69: 151–162.
- [2] Franc A. Jsou vakcíny bezpečné? Prakt lékáren 2020; 16: 204–207.
- [3] Brito LA, Chan M, Shaw CA, et al. A cationic nanoemulsion for the delivery of next‑generation RNA vaccines. Mol Ther 2014; 2: 2118−2129.
- [4] Petráš M. Internetové informační centrum správného očkování. Očkovací látky. Dostupné na: https://www.vakciny.net/principy_ockovani/pr_02.html#chapter5_public (30. 10. 2020)
- [5] Krump NA, You J. Molecular mechanisms of viral oncogenesis in humans. Nat Rev Microbiol 2018; 11: 684−698.
- [6] Schlake T, Thess A, Fotin‑Mleczek M, Kallen KJ. Developing mRNA‑vaccine technologies. RNA Biol 2012; 11: 1319−1330.
- [7] Pardi N, Hogan MJ, Porter FW, Weissman D. mRNA vaccines – a new era in vaccinology. Nat Rev Drug Discov 2018; 4: 261.
- [8] Schlake T, Thess A, Fotin‑Mleczek M, Kallen KJ. Developing mRNA‑vaccine technologies. RNA biology 2012; 9: 1319–1330.
- [9] Vajdy M, Srivastava I, Polo J, et al. Mucosal adjuvants and delivery systems for protein‐, DNA‐ and RNA‐based vaccines. Immunol Cell Biol 2004; 6: 617−627.
- [10] Versteeg L, Almutairi MM, Hotez PJ, Pollet J. Enlisting the mRNA vaccine platform to combat parasitic infections. Vaccines 2019; 4: 122.
- [11] Gurevich VV, Pokrovskaya ID, Obukhova TA, Zozulya SA. Preparative in vitro mRNA synthesis using SP6 and T7 RNA polymerases. Anal Biochem 1999; 2: 207−213.
- [12] Lundstrom K. Self‑replicating RNA viruses for RNA therapeutics. Molecules 2018; 12: 3310.
- [13] Cu Y, Broderick KE, Banerjee K, et al. Enhanced delivery and potency of self‑amplifying mRNA vaccines by electroporation in situ. Vaccines 2013; 3: 367−383.
- [14] Van Tendeloo VF, Ponsaerts P, Lardon F, et al. Highly efficient gene delivery by mRNA electroporation in human hematopoietic cells: superiority to lipofection and passive pulsing of mRNA and to electroporation of plasmid cDNA for tumor antigen loading of dendritic cells. Am J Hematol 2001; 1: 49−56.
- [15] Brito LA, Chan M, Shaw CA, et al. A cationic nanoemulsion for the delivery of next‑generation RNA vaccines. Mol Ther 2014; 12: 2118−2129.
- [16] Svobodova L, Snejdarkova M. Poly(amidoamine) dendrimers: synthesis, properties and self‑assembly. Chem listy 2004; 4: 161−165.
- [17] Torrice M. Dendrimer‑RNA particles offer fast, customizable vaccines. Chem Eng News 2016; 28: 8.
- [18] Chahal JS, Khan OF, Cooper CL, et al. Dendrimer‑RNA nanoparticles generate protective immunity against lethal Ebola, H1N1 influenza, and Toxoplasma gondii challenges with a single dose. PNAS USA 2016; 29: E4133−E4142.
- [19] Mai Y, Guo J, Zhao Y, et al. Intranasal delivery of cationic liposome‑protamine complex mRNA vaccine elicits effective anti‑tumor immunity. Cell Immunol 2020; 354: 104143.
- [20] Zeng C, Zhang C, Walker PG, et al. Formulation and delivery technologies for mRNA vaccines In: Current topics in microbiology and immunology. Berlin, Heidelberg: Springer 2020.
- [21] Martinon F, Krishnan S, Lenzen G, Magné P, et al. P. Induction of virus‐specific cytotoxic T lymphocytes in vivo by liposome‐entrapped mRNA. Eur J Immunol 1993; 7: 1719−1722.
- [22] Reichmuth AM, Oberli MA, Jaklenec A, et al. mRNA vaccine delivery using lipid nanoparticles. Ther Deliv 2016; 5: 319−334.
- [23] Yan J, Chen R, Zhang H, Bryers JD. Injectable biodegradable chitosan‐alginate 3D porous gel scaffold for mRNA vaccine delivery. Macromol Biosci 2019; 2: 1800242.
- [24] Siewert CD, Haas H, Cornet V, et.al. Hybrid biopolymer and lipid nanoparticles with improved transfection efficacy for mRNA. Cells 2020; 9: 2034.
- [25] Fan YN, Li M, Luo YL, et al. Cationic lipid‑assisted nanoparticles for delivery of mRNA cancer vaccine. Biomater Sci 2018; 11: 3009−3018.
- [26] Geall AJ, Verma A, Otten GR, et al. Nonviral delivery of self‑amplifying RNA vaccines. PNAS USA 2012; 36: 14604−14609
- [27] Golombek S, Pilz M, Steinle, H, et al. Intradermal delivery of synthetic mRNA using hollow microneedles for efficient and rapid production of exogenous proteins in skin. Mol Ther Nucleic Acids 2018; 11: 382−392.
- [28] Al‑Japairai KAS, Mahmood S, Almurisi SH, et al. Current trends in polymer microneedle for transdermal drug delivery. Int J Pharm 2020; 587: 119673.
- [29] Koh KJ, Liu Y, Lim SH, et al. Formulation, characterization and evaluation of mRNA‑loaded dissolvable polymeric microneedles (RNApatch). Sci Rep 2018; 8: 1–11.
- [30] Shin MD, Shukla S, Chung YH, et al. COVID‑19 vaccine development and a potential nanomaterial path forward. Nat Nanotech 2020; 8: 646−655.
- [31] Weintraub K. Invisible ink could reveal whether kids have been vaccinated. Dostupné na: https://www.scientificamerican.com/article/invisible‑ink‑could‑reveal‑whether‑kids‑have‑been‑vaccinated/ (18. 12. 2020).
- [32] Nařízení EP a Rady (ES) č. 726/2004 ze dne 31. března 2004, kterým se stanoví postupy Společenství pro registraci a dozor nad humánními a veterinárními léčivými přípravky a kterým se zakládá Evropská léková agentura, ve znění nařízení EP a Rady ES č.1901/2006. Dostupné na: www.esipa.cz
- [33] čl. 6 a násl. nařízení EP a Rady (ES) č. 726/2004. Dostupné na: www.esipa.cz
- [34] Rozhodnutí EK ze dne 21.12.2020, přípravek Comirnaty bude veden v seznamu léčivých přípravků v EU pod č. EU/1/20/1528. Dostupné na: https://ec.europa.eu/health/documents/community‑register/html/h1528.htm
- [35] Směrnice Evropského parlamentu a Rady 2001/83/ES ze dne 6. listopadu 2001, o kodexu Společenství týkajícího se humánních léčivých přípravků.
- [36] Gómez‑Aguado I, Rodríguez‑Castejón J, Vicente‑Pascual M, et al. Nanomedicines to deliver mRNA: state of the art and future perspectives. Nanomaterials 2020; 10: 364.
- [37] Shin MD, Shukla S, Chung YH, et al. COVID‑19 vaccine development and a potential nanomaterial path forward. Nat Nanotechn 2020; 8: 646−655.
- [38] Čečetková B, Smetana J, Chlíbek R. Současnost klinických studií očkovacích látek v České republice. Epidemiol Mikrobiol Imunol 2014; 4: 278−284.