Účinná léčba revmatických diagnóz a maximální omezení rizik
Kardiovaskulární riziko u pacientů s revmatoidní artritidou a jeho management
Sympozia společnosti Pfizer na letošním kongresu Evropské ligy proti revmatismu (EULAR) se zaměřila především na bezpečnost léčby. První z nich se věnovalo kardiovaskulárnímu (KV) riziku u pacientů s revmatoidní artritidou (RA). Klíčovými tématy byly současné nástroje pro hodnocení KV rizik a jejich užitečnost u pacientů s RA a dále doporučení EULAR pro management KV rizik u pacientů s RA. Prezentace se věnovaly také KV datům z klinických hodnocení s tofacitinibem, pozornost byla upřena na klinickou studii ORAL Surveillance.
Kardiovaskulární riziko u pacientů
s revmatoidní artritidou a jeho management
Sympozia společnosti Pfizer na letošním kongresu Evropské ligy proti revmatismu (EULAR) se zaměřila především na bezpečnost léčby. První z nich se věnovalo kardiovaskulárnímu (KV) riziku u pacientů s revmatoidní artritidou (RA). Klíčovými tématy byly současné nástroje pro hodnocení KV rizik a jejich užitečnost u pacientů s RA a dále doporučení EULAR pro management KV rizik u pacientů s RA. Prezentace se věnovaly také KV datům z klinických hodnocení s tofacitinibem, pozornost byla upřena na klinickou studii ORAL Surveillance.
Nástroje pro hodnocení KV rizik: fungují?
První přednášky se ujal docent Jon Giles (Columbia University, New York, USA). V úvodu konstatoval, že KV onemocnění jsou ve vyspělých zemích na předních příčkách žebříčku příčin úmrtí. Revmatoidní artritida je asociována se zvýšeným rizikem rozvoje aterosklerotických KV onemocnění, KV mortality i subklinicky probíhající aterosklerózy. Metaanalýza observačních studií [1] doložila, že mortalita na KV onemocnění je u pacientů s RA ve srovnání s běžnou populací zvýšena přibližně o 50 %. Zatížení aterosklerózou je u RA vyšší, bylo doloženo, že prevalence a závažnost koronární kalcifikace je u pacientů s RA zvýšená [2]. Akcelerovaná KV morbidita může souviset s dokladovanou vyšší prevalencí a větším rozsahem všech typů (kalcifikovaných, smíšených i nekalcifikovaných) koronárních plátů u pacientů s RA [3]. Práce Mäki Petäjä a kol. [4] dokonce potvrdila, že pacienti s RA bez KV onemocnění mají oproti kontrolám s doloženým stabilním KV onemocněním větší zánět v aortě. Mechanismem zvýšeného KV rizika je pravděpodobně subklinická vaskulitida [4], koronární pláty jsou více postiženy zánětem a náchylné k ruptuře [5].
V incidenci aterosklerotických KV onemocnění byl v posledních letech zaznamenán pozitivní trend. Švédská populační studie doložila 40% redukci incidence akutního koronárního syndromu u populace s RA (n = 15 744) i bez ní (n = 70 889) [6]. Mezi skupinami s RA a bez ní nebyl zaznamenán výrazný rozdíl, včetně kohorty s krátkou dobou od stanovení diagnózy RA, což pravděpodobně odráží dnešní poměrně rychlou kontrolu aktivity RA díky účinné léčbě.
„Jaké rysy RA mohou hrát úlohu v KV rizikovosti, zatím jistě nevíme,“ zamyslel se doc. Giles. Jednou z variant může být obecně vyšší prevalence tradičních rizikových KV faktorů u pacientů s RA, jako jsou hypertenze, diabetes mellitus nebo kouření, které je zároveň rizikovým faktorem RA. KV rizikové faktory mohou modifikovat roli systémového zánětu v progresi v průběhu času [6]. Nebo mohou tyto faktory v kombinaci s rizikovými faktory specifickými pro RA působit synergicky a mít větší dopad. Mezi nimi uvedl přednášející autoimunitu, systémový zánět, určité genetické faktory, specifické cirkulující subsety T lymfocytů; vliv může mít také léčba, stres či úzkost a deprese.
Na posouzení dopadu rizikových faktorů KV onemocnění se u velké mezinárodní kohorty pacientů s RA zaměřila studie Crowsonové a kol. [7]. Po dobu průměrně 5,8 roku sledovala 5 638 pacientů s RA bez KV onemocnění. Data pocházela ze 13 center v Evropě, Severní Americe a Africe.
Docent Giles upozornil na hodnotu lipoproteinů s nízkou hustotou, která opakovaně poukazuje na tzv. lipidový paradox, tj. překvapivě vyšší riziko KV událostí pozorované u pacientů s RA s velmi nízkými hodnotami sérových lipidů [8]. Mechanismus nebyl dosud zcela vysvětlen.
V kontextu systémového zánětu
je možné u pacientů s RA chronicky pozorovat změny
hodnot lipoproteinů a s tím související aterogenicitu.
Ve snaze předejít aterosklerotickým KV onemocněním je
doporučeno využívat kalkulátory rizika, které by měly pomoci
určit bezpříznakové pacienty, u nichž by primární
prevence aterosklerotických KV onemocnění byla přínosná [9].
Kalkulátory rizika zavedené k použití v obecné
populaci se liší v predikovaných výstupech (tab. 1)
a také v parametrech, které zahrnují (např. věk,
pohlaví, kouření, diabetes, BMI, hodnoty cholesterolu, CRP aj.).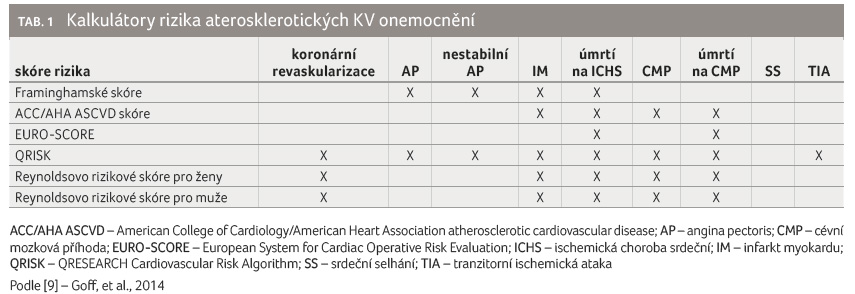
Přesné posouzení rizika aterosklerotického KV onemocnění je nezbytné pro efektivní zvážení rizik a přínosů terapie v primární prevenci. Prospektivní epidemiologická studie, jejímiž autory jsou DeFilippis a kol., prokázala u čtyř z pěti rizikových skóre, včetně nového skóre ACC/AHA ASCVD, nadhodnocení rizika v obecné populaci o 25–115 % [10]. Práce Crowsonové a kol. [11] sledující užitečnost prediktivních nástrojů u pacientů s RA naopak zjistila podhodnocení rizika KV onemocnění zejména u nemocných ve vyšším věku a u pacientů s pozitivním revmatoidním faktorem. Uvedená data podtrhují potřebu přesnějších nástrojů k predikci rizika KV onemocnění u pacientů s RA. Ani vyvíjené kalkulátory rizika specifické pro pacienty s RA nedosáhly lepších výsledků [12].
Revmatoidní artritida je dle amerických doporučení pro primární prevenci aterosklerotických KV onemocnění řazena mezi faktory zvyšující riziko [13]. Přednášející upozornil na svoji práci zaměřenou na využití klinických indikátorů specifických pro RA, které by identifikovaly pacienty, u nichž by bylo vhodné realizovat screening a prevenci KV onemocnění. Jako užitečný nástroj stratifikace rizika zde bylo využito CAC (coronary artery calcium) skóre hodnocené výpočetní tomografií s hraniční hodnotou CAC ≥ 100 jednotek [14]. Práce vyzdvihuje, že rozumné využívání současných nástrojů by mohlo pomoci identifikovat pacienty s RA, pro něž by byl další screening přínosem.
Kardiovaskulární data u moderní léčby RA
Profesorka Maya H Buch (University of Manchester, Spojené království) navázala další přednáškou. V úvodu připomněla více než stoletou historii léčby RA a zamyslela se nad otázkou, kolik toho víme o KV účincích moderní léčby. Pozornost soustředila na nejnovější skupinu inhibitorů Janusových kináz (JAK). Tato léková skupina prokázala účinnost v terapii pacientů s RA a KV bezpečnost byla v úvodu klinického vývoje této terapie často skloňována. Léčivo urazí od preklinického výzkumu přes klinické hodnocení až po schválení dlouhou cestu, jeho účinnost a bezpečnost je po zavedení do klinické praxe dále sledována v dlouhodobém horizontu. Toto sledování má význam také z hlediska různorodosti populace, která je oproti populaci v rámci klinického hodnocení pestřejší a může přinést nová zjištění. Vedle doložení účinnosti léčby je zásadní také její bezpečnost a celkový efekt, tj. účinky terapie i v oblasti mimokloubní.
V rámci KV bezpečnosti antirevmatické léčby připomněla profesorka Buch metaanalýzu Roubillové a kol., která demonstrovala snížení rizika KV příhod inhibitory tumor nekrotizujícího faktoru (TNF) [15]. Podílet se na něm může kontrola prozánětlivé aktivity TNF, jak naznačují experimentální data, která ukázala zlepšení endoteliální funkce a redukci aterosklerózy [16].
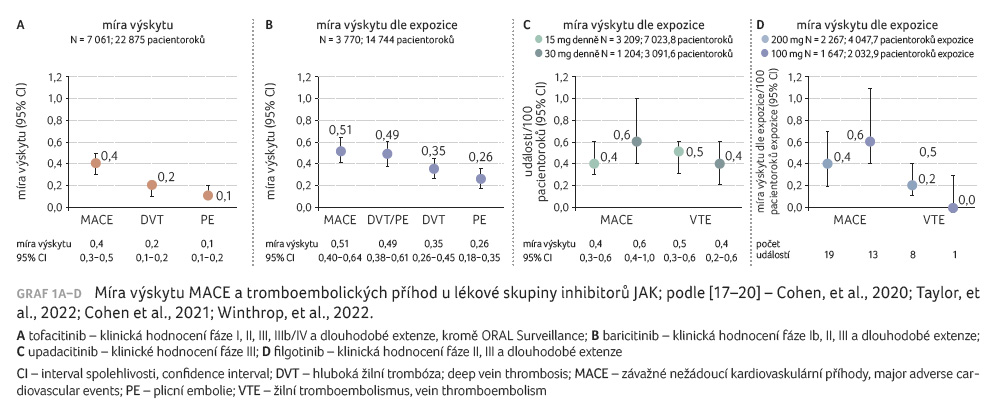
Přednášející se dále věnovala lékové skupině inhibitorů JAK. Prezentovala výsledky integrovaných analýz bezpečnosti dostupných klinických dat, které doložily nízkou incidenci závažných nežádoucích kardiovaskulárních příhod (major adverse cardiovascular events, MACE) a tromboembolických příhod u léčených pacientů (graf 1A–D) [17–20] s mírou výskytu obdobnou jiným biologickým antirevmatickým chorobu modifikujícím léčivům (disease modifying antirheumatic drugs, bDMARDs). Nejedná se o head to head srovnání, data mezi sebou nelze přímo porovnávat, ale ukazují celkové výsledky hodnocení.
V souvislosti se zvýšením
sérových koncentrací lipidů a četnosti malignit pozorovaným
během vývoje léku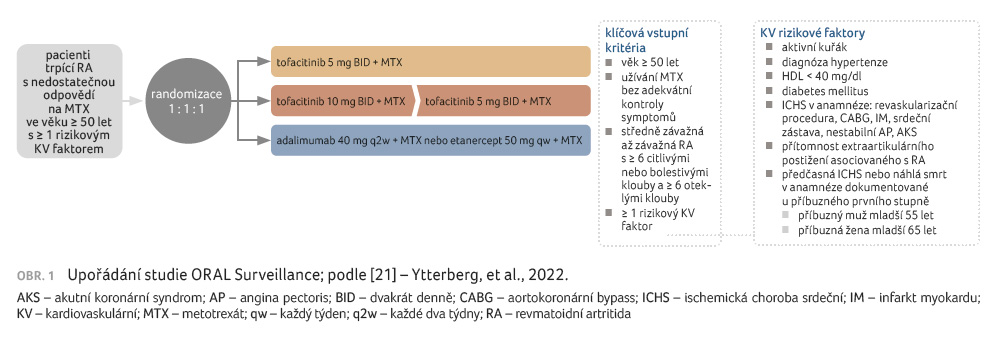 byla na požadavek amerického Úřadu pro
kontrolu potravin a léčiv (Food and Drug Administration, FDA)
uskutečněna prospektivní head to head studie s cílem
porovnat bezpečnost tofacitinibu s inhibitorem TNF [21]. Oral
Rheumatoid Arthritis Trial (ORAL) Surveillance, randomizovaná
otevřená postregistrační studie non inferiority, měla
ověřit hypotézu, že riziko závažných nežádoucích KV příhod
(MACE) nebo malignit, s výjimkou nemelanomového karcinomu
kůže, není při terapii tofacitinibem alespoň 1,8krát vyšší
oproti terapii inhibitorem TNF. Uspořádání studie
a charakteristiky zařazených pacientů uvádí obr. 1
a tab. 2.
byla na požadavek amerického Úřadu pro
kontrolu potravin a léčiv (Food and Drug Administration, FDA)
uskutečněna prospektivní head to head studie s cílem
porovnat bezpečnost tofacitinibu s inhibitorem TNF [21]. Oral
Rheumatoid Arthritis Trial (ORAL) Surveillance, randomizovaná
otevřená postregistrační studie non inferiority, měla
ověřit hypotézu, že riziko závažných nežádoucích KV příhod
(MACE) nebo malignit, s výjimkou nemelanomového karcinomu
kůže, není při terapii tofacitinibem alespoň 1,8krát vyšší
oproti terapii inhibitorem TNF. Uspořádání studie
a charakteristiky zařazených pacientů uvádí obr. 1
a tab. 2.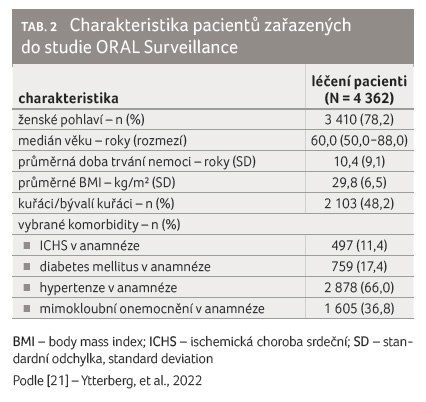
Jak demonstruje graf 2A, B, do studie ORAL Surveillance byl oproti ostatním klinickým hodnocením s tofacitinibem zařazen vyšší podíl pacientů se zvýšeným KV rizikem [22,23].
Tofacitinib dostávalo 1 455 pacientů
v dávce 5 mg 2× denně, 1 455 pacientů v dávce
10 mg 2× denně a 1 451 sledovaných dostávalo
inhibitor TNF. Medián sledování činil čtyři roky,
non inferiorita tofacitinibu nebyla prokázána. Incidence MACE
a malignit byla při sloučení dávek tofacitinibu vyšší
(3,4 % [98 pacientů] a 4,2 % [122 pacientů]) než
u inhibitoru TNF (2,5 % [37 pacientů] a 2,9 % [42
pacientů]). Poměry rizik (hazard ratio, HR) byly 1,33 (95% interval
spolehlivosti [CI] 0,91–1,94) pro MACE a 1,48 (95% CI
1,04–2,09) pro malignity. Nejčastěji hlášenou MACE byl
nefatální infarkt myokardu, nejfrekventovanější malignitu
zaznamenanou během terapie tofacitinibem představoval karcinom plic
[21].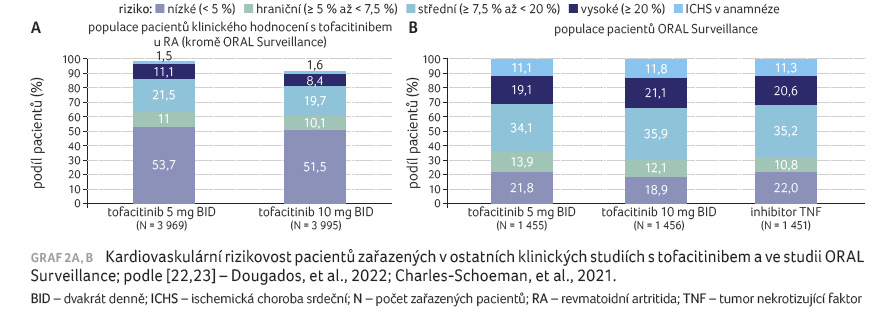
Profesorka Buch upozornila na heterogenitu populace pacientů s RA v klinické praxi. Do kontrastu s daty ORAL Surveillance dala studii STAR RA [24], která sledovala KV bezpečnost tofacitinibu v reálné klinické praxi a důkazy o zvýšeném riziku KV důsledků (včetně hospitalizace pro infarkt myokardu a cévní mozkovou příhodu) užívání tofacitinibu nepotvrdila. Zvýšené riziko KV důsledků nebylo statisticky významné. Data z reálné praxe (real world evidence, RWE) obvykle zahrnují rozmanitější populaci a umožňují také srovnání s dalšími léčivy, které není v randomizovaném klinickém hodnocení možné. Limitací RWE je vyšší náchylnost ke zkreslení (bias) a absence standardizace.
Přednášející shrnula, že účinnost inhibitorů JAK byla doložena napříč podskupinami pacientů s RA. Stejně tak byl v širokém rozsahu etablován jejich bezpečnostní profil. Dostupná KV data jsou informací pro lékaře s cílem činit individualizovaná rozhodnutí o léčbě dle charakteristik pacienta.
Doporučení EULAR a budoucí směry pro management KV rizika u pacientů s RA
S další přednáškou vystoupila doktorka Anne Grete Semb (Diakonhjemmet Hospital, Oslo, Norsko). V úvodu upozornila, že navzdory riziku KV onemocnění u pacientů s RA je pozornost věnovaná tomuto tématu omezená. Tito pacienti jsou poddiagnostikovaní a z hlediska KV rizika v primární péči nedostatečně sledováni a vedeni. V prezentaci se dále zaměřila na některá klíčová doporučení EULAR pro management KV rizika u pacientů se zánětlivými kloubními nemocemi [25].
Posouzení KV rizika je doporučeno u všech pacientů s RA, ankylozující spondylitidou (AS) a psoriatickou artritidou alespoň jednou za pět let a přehodnoceno by mělo být po velkých změnách v antirevmatické léčbě. Modely predikující KV riziko u pacientů s RA by měly být přizpůsobeny násobícím faktorem 1,5, pokud toto již není v modelu zahrnuto. Rutinní zhodnocení KV rizika (např. SCORE nebo rizikové skóre ASCVD) může podpořit časnou identifikaci rizikových pacientů. U pacientů s nízkým KV rizikem je doporučen screening každých pět let, u nemocných ve středním riziku častější, obzvláště při rychlejší progresi nemoci. Nemocní s vysokým rizikem nebo již doloženým KV onemocněním by měli být léčeni dle existujících guidelines pro management rizikových faktorů. Doporučení Evropské kardiologické společnosti zmiňují, že je třeba zvážit zhodnocení KV rizika u dospělých s chronickým zánětlivým onemocněním [26]. U pacientů s RA by měl být jako součást zhodnocení KV rizika zvážen screening asymptomatických aterosklerotických plátů pomocí ultrazvuku karotid. U pacientů s RA byla doložena vysoká incidence karotických plátů a ztluštění vrstvy intimy medie [27,28]. Toto vyšetření je výhodné z hlediska nákladové efektivity a pro pacienta nepředstavuje riziko expozice radiaci. Další doporučení se týká životního stylu; všem pacientům by měl být zdůrazněn přínos zdravé diety, pravidelného cvičení a zanechání kouření a měli by být ve změně životního stylu podporováni (dotazem, radou i pomocí).
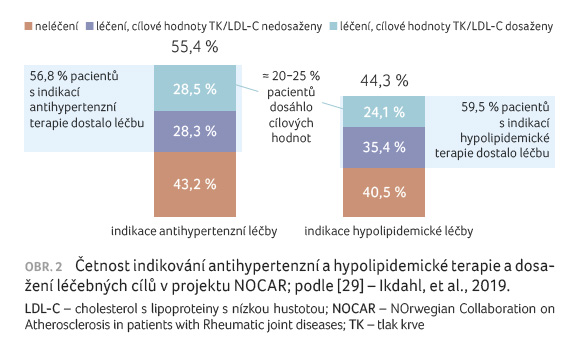
Přednášející dále přiblížila projekt NOCAR (The Norwegian Collaboration on Atherosclerotic disease in patients with Rheumatic joint diseases), který byl zahájen v dubnu 2014 a vytkl si za cíl zkvalitnit péči a zhodnotit, jak probíhá identifikace KV ri
zika u pacientů s RA. Výsledky analýzy byly dokončeny v roce 2018 [29]. Doporučená léčba a/nebo odpovídající léčebné cíle nebyly zahájeny nebo jich nebylo dosaženo přibližně u 50 % pacientů (obr. 2).
Doktorka Semb závěrem uvedla, že doporučení EULAR detailně popisují management KV onemocnění u pacientů se zánětlivými revmatickými nemocemi. Zdůraznila potřebu včasné a vhodné intervence modifikovatelných rizikových faktorů, jimiž jsou vysoký krevní tlak a hyperlipidemie. Pro identifikaci pacientů s rizikem aterosklerotických KV onemocnění je zásadní úzká spolupráce mezi kardiologem, revmatologem a praktickým lékařem.
Nalezení rovnováhy: Účinná léčba
AS při řízení bezpečnosti a rizika
Druhé sympozium zaměřené na AS zahájila profesorka Désirée van der Heijde (Leiden University Medical Centre, Nizozemsko). Mezi klíčová témata patřily shrnutí imunopatogeneze a projevů AS, volba moderní léčby podle léčebných priorit – postavení již zavedené terapie inhibitory TNF a blokátorů interleukinu 17 (IL 17) a nedávno schválené léčebné modality inhibice JAK. Diskutovány byly bezpečnost léčby a význam managementu KV rizika u pacientů s AS.
Imunopatogenetické pochody vedoucí ke klinickým projevům axSpA
S první prezentací vystoupil profesor Francesco Ciccia (University of Campania Luigi Vanvitelli, Neapol, Itálie). Axiální spondyloartritida (axSpA) představuje heterogenní onemocnění s rozmanitou klinickou manifestací. Vedle bolesti zad, daktylitid a entezitid se může prezentovat artritidou periferních kloubů s přidruženým postižením oka (uveitida), kůže (psoriáza) či trávicího traktu (střevní záněty) [30]. Přednášející uvedl, že dosud nevíme, zda fenotypová heterogenita onemocnění souvisí s heterogenitou patofyziologických pochodů, jinými slovy, zda jsou konkrétní cytokiny spojeny s určitými fázemi nemoci.
V patofyziologii axSpA jsou klíčovými axiální zánět, destrukce kosti a její novotvorba. Primární patologické děje probíhají v oblasti entezí. Spolu s rizikovými faktory (genetická predispozice, dysbióza, mechanický stres aj.) se v patofyziologii uplatňuje právě nepřiměřená odpověď na mechanický stres a dysregulace reparace tkání [31]. Na základě patogeneze je racionální cílit v léčbě na klíčové signální cesty, které jsou u těchto pacientů patologicky aktivované. Jednou z nich je využívaná dráha TNF a v léčbě užívané inhibitory TNF [32]. Klíčovou roli v patogenezi axSpA hraje dále signální dráha IL 23/IL 17. V léčbě se osvědčily inhibitory IL 17, naproti tomu se ukázalo, že inhibitory IL 23 nejsou u axSpA dostatečně efektivní. Pravděpodobným vysvětlením je možná tvorba IL 17 i nezávisle na IL 23 [33]. Třetí zapojenou je dráha JAK STAT a v léčbě nově využívané inhibitory JAK (JAK1 nebo JAK1/3) [34]. Janusovy kinázy jsou klíčovými přenašeči cytokinových signálů v pomocných Th17 buňkách, a proto jsou slibnými cíli pro léčbu AS v potlačení produkce zánětlivých působků a zánětu. Doložen byl také význam zánětlivé osy střevo sakroiliakální klouby na podkladě modulace imunitních funkcí lymfatických buněk s produkcí cytokinů [35]. Asociace s AS a pravděpodobná úloha v patogenenezi onemocnění byly doloženy rovněž u receptorů pro IL 7 [36] nebo populace paměťových CD8+ T buněk [37].
Profesor Ciccia shrnul, že v populaci pacientů s axSpA je možné pozorovat rozmanitou klinickou manifestaci nemoci. Patogeneze axSpA se účastní řada buněk a signálních drah, které mohou představovat vhodný cíl pro účinnou terapii. Hierarchii cytokinů je třeba dále zkoumat k pochopení heterogenity projevů.
Pokročilé možnosti léčby AS: sdílené rozhodnutí zdravotníka a pacienta
Doktorka Helena Marzo Ortega (Leeds Teaching Hospitals Trust and University of Leeds, Spojené království) se ve své prezentaci zaměřila na moderní možnosti terapie AS. V úvodu připomněla, že znalosti o AS a na ně navazující dostupné možnosti léčby se v posledních dvou dekádách významně proměnily.
Hodnocení výsledků léčby se dnes neomezuje pouze na sledování aktivity nemoci pomocí různých indexů (ASAS, ASDAS), mezi sledované domény patří rovněž bolest, ranní ztuhlost, únava, fyzické funkce, celkové fungování a nežádoucí příhody. U léčby modifikující onemocnění (DMT) jsou povinné navíc extramuskuloskeletální projevy, periferní projevy a strukturální poškození. Jako důležité ukazatele jsou dále definovány pohyblivost páteře, spánek, práce a zaměstnání [38].
S rozšiřujícími se možnostmi
terapie přichází na řadu také rozhodování o léčbě.
Pacienti se mezi sebou liší charakteristikami (např. věk,
pohlaví, status HLA B27, hodnota C reaktivního proteinu
[CRP]), které mohou mít vliv na míru odpovědi na léčbu.
O těchto faktorech, které mají vliv na efekt léčby
bDMARDs, je toho, zejména z léčby inhibitory TNF, známo již
poměrně hodně [39–41]. Z tohoto pohledu se mezi dobré
prognostické faktory řadí mužské pohlaví, mladší věk,
pozitivita antigenu HLA B27 a vysoká zánětlivá aktivita
(hodnota CRP). Přednášející upozornila, že případnější než
otázka, které léčivo použít, je odpověď na otázku, kdy
je použít. Je známo, že kratší trvání nemoci, tedy časná
diagnóza, se pojí s lepší odpovědí na léčbu [42]
a switch na další bDMARD je účinný, nicméně spojen
s horší odpovědí na terapii [43]. Jak prezentovala
doktorka Ortega na shrnujícím obrázku (graf 3A, B)
[44−54], jakkoliv se nejedná o head to head
srovnání, již zavedená léčiva mají obdobnou účinnost,
parametru ASAS20 (20% zlepšení dle Assessment in Ankylosing
Spondylitis) dosáhlo v klinických hodnoceních zhruba 60 %
pacientů a představují účinnou terapii AS. Dlouhodobé
sledování již také doložilo dlouhodobou účinnost terapie
a prodloužení přežití pacientů s AS [55].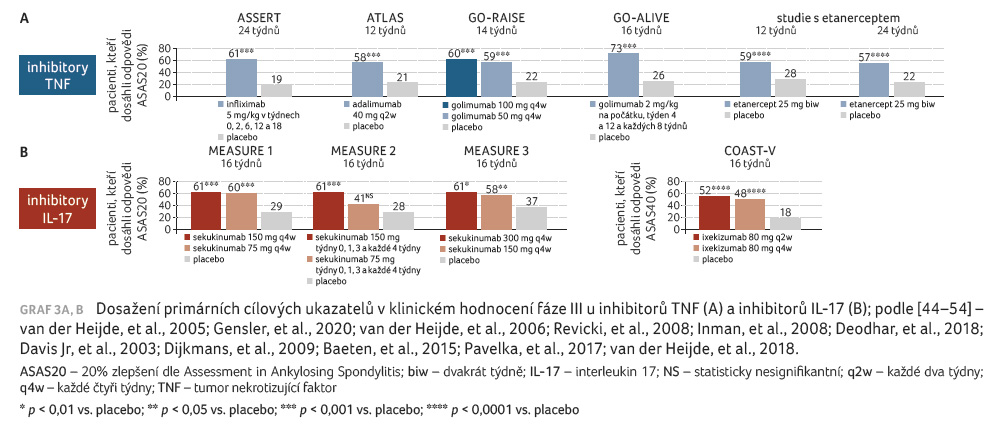
Nicméně stále velký podíl pacientů na léčbu neodpovídá, a proto jsou potřeba další terapeutické možnosti. Takovou variantu představují inhibitory JAK. Účinnost tofacitinibu v léčbě AS doložila studie fáze III [56], při srovnání s placebem byla léčba spojena s velmi rychlou redukcí projevů AS, která byla zachována až do týdne 48. Již v druhém týdnu dosáhlo 50 % pacientů odpovědi ASAS20 a polovina pacientů dosáhla ve čtvrtém týdnu odpovědi ASAS40. Pozorována byla rovněž redukce aktivity nemoci měřená indexem ASDAS (Ankylosing Spondylitis Disease Activity Score), která byla zachována od týdne 16 až do týdne 48. Efektem léčby, který má pro pacienty asi nejzásadnější význam, je zmírnění bolesti zad; významné redukce bolesti dosáhli pacienti již ve druhém týdnu léčby a tento trend dále pokračoval. Zlepšení bylo dosaženo také při sledování únavy. „Malá molekula tofacitinibu podávaná v tabletové formě tak představuje pro další velkou skupinu pacientů rychlé řešení symptomů a známek AS a léčbu se setrvalou účinností,“ shrnula přednášející.
Dalším inhibitorem JAK schváleným pro léčbu AS je upadacitinib. V pivotní studii SELECT AXIS 1 pro indikaci AS bylo dosaženo primárního cílového ukazatele účinnosti – odpovědi ASAS40 ve 14. týdnu – a nízká aktivita nemoci byla doložena až do týdne 64 [57]. Redukce bolesti zad byla zaznamenána v druhém týdnu a setrvala až do týdne 64.
Doktorka Ortega shrnula, že ke zhodnocení účinnosti léčby AS je možné použít různé klinické a pacientem referované parametry. Při diskutování o možnostech léčby je třeba vzít v úvahu fenotyp onemocnění a vedle účinnosti terapie v oblasti kloubů také možný efekt na extramuskuloskeletální manifestace (kůže, oči, přidružená střevní onemocnění). Mělo by se jednat o sdílené rozhodnutí s pacientem. Biologické DMARDs doložily svoji účinnost, kterou podporují již data z dlouhodobého sledování. Inhibitory JAK představují alternativu v léčbě, vyznačují se rychlým nástupem účinku a setrvalou redukcí aktivity nemoci.
Zhodnocení KV rizika moderní léčby AS
Doktorka Lianne Gensler (University of California, San Francisco, USA), která se ujala poslední prezentace, se v úvodu věnovala rizikovým faktorům, jež se u pacientů s AS mohou objevit. Jednak jsou to již výše zmíněné extramuskuloskeletální manifestace – mohou být přítomny již v čase diagnózy AS nebo se mohou objevit v pozdějším průběhu. Častými komorbiditami zánětlivých revmatických diagnóz jsou rovněž osteoporóza [58] a KV onemocnění [59]. Metaanalýza klinických studií doložila signifikantně vyšší riziko vzniku KV událostí u pacientů s AS oproti kontrolám [59]. Managementu KV rizika u pacientů se zánětlivými revmatickými chorobami se věnuje doporučení EULAR [25]. Jednotlivým doporučením se ve své prezentaci věnovala doktorka Semb (výše). Jedná se zejména o důslednou kontrolu aktivity nemoci, která může KV riziko snížit, o zhodnocení rizikovosti u jednotlivých pacientů dle národních guidelines, doporučení úpravy životního stylu a předepisování nesteroidních antiflogistik s opatrností, zejména u pacientů s prokázaným KV onemocněním. Lékaři by si zvýšeného rizika u nemocných s revmatologickými diagnózami oproti běžné populaci měli být vědomi.
Doktorka Gensler se podobně jako další přednášející věnovala bezpečnostnímu hledisku moderní léčby AS. Znovu upozornila na riziko bias a různorodost hodnocených populací v publikovaných a výše uvedených pracích a na odlišnosti mezi daty ze sdružených analýz bezpečnosti oproti výsledkům randomizovaných studií. Shrnula, že bezpečnostní profil inhibitorů JAK pozorovaný u pacientů s aktivní AS byl konzistentní s bezpečnostním profilem u léčených pacientů s RA a psoriatickou artritidou, z hlediska bezpečnosti je třeba dalšího sledování [56,60].
Redakčně zpracovala PharmDr. Kateřina Viktorová
Seznam použité literatury
- [1] Aviña‑Zubieta JA, Choi HK, Sadatsafavi M, et al. Risk of cardiovascular mortality in patients with rheumatoid arthritis: a meta‑analysis of observational studies. Arthritis Rheum 2008; 59: 1690–1697.
- [2] Chung CP, Oeser A, Raggi P, et al. Increased coronary‑artery atherosclerosis in rheumatoid arthritis: relationship to disease duration and cardiovascular risk factors. Arthritis Rheum 2005; 52: 3045–3053.
- [3] Karpouzas GA, Malpeso J, Choi T‑Y, et al. Prevalence, extent and composition of coronary plaque in patients with rheumatoid arthritis without symptoms or prior diagnosis of coronary artery disease. Ann Rheum Dis 2014; 73: 1797–1804.
- [4] Mäki‑Petäjä KM, Elkhawad M, Cheriyan J, et al. Anti‑Tumor Necrosis Factor‑α Therapy Reduces Aortic Inflammation and Stiffness in Patients With Rheumatoid Arthritis. Circulation 2012; 126: 2473–2480.
- [5] Aubry MC, Maradit‑Kremers H, Reinalda MS, et al. Differences in atherosclerotic coronary heart disease between subjects with and without rheumatoid arthritis. J Rheumatol 2007; 34: 937–942.
- [6] del Rincón I, Polak JF, O’Leary DH, et al. Systemic inflammation and cardiovascular risk factors predict rapid progression of atherosclerosis in rheumatoid arthritis. Ann Rheum Dis 2015; 74: 1118–1123.
- [7] Crowson CS, Rollefstad S, Ikdahl E, et al. Impact of risk factors associated with cardiovascular outcomes in patients with rheumatoid arthritis. Ann Rheum Dis 2018; 77: 48–54.
- [8] Myasoedova E, Crowson CS, Kremers HM, et al. Lipid paradox in rheumatoid arthritis: the impact of serum lipid measures and systemic inflammation on the risk of cardiovascular disease. Ann Rheum Dis 2011; 70: 482–487.
- [9] Goff DC, Lloyd‑Jones DM, Bennett G, et al. 2013 ACC/AHA guideline on the assessment of cardiovascular risk: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2014; 129(25 Suppl 2): S49–S73.
- [10] DeFilippis AP, Young R, Carrubba CJ, et al. An analysis of calibration and discrimination among multiple cardiovascular risk scores in a modern multiethnic cohort. Ann Intern Med 2015; 162: 266–275.
- [11] Crowson CS, Matteson EL, Roger VL, et al. Usefulness of risk scores to estimate the risk of cardiovascular disease in patients with rheumatoid arthritis. Am J Cardiol 2012; 110: 420–424.
- [12] Wahlin B, Innala L, Magnusson S, et al. Performance of the Expanded Cardiovascular Risk Prediction Score for Rheumatoid Arthritis Is Not Superior to the ACC/AHA Risk Calculator. J Rheumatol 2019; 46: 130–137.
- [13] Grundy SM, Stone NJ, Bailey AL, et al. 2018 AHA/ACC/AACVPR/AAPA/
- [14] Giles J, Chung C, Chester M, et al. Indicators of Actionable Levels of Atherosclerosis in RA Patients Who Appear to Have Low or Intermediate Atherosclerotic Cardiovascular Risk Based on Standard Risk Algorithms. Arthritis Rheum 2019; 71: Abstr. Nr. 0921.
- [15] Roubille C, Richer V, Starnino T, et al. The effects of tumour necrosis factor inhibitors, methotrexate, non‑steroidal anti‑inflammatory drugs and corticosteroids on cardiovascular events in rheumatoid arthritis, psoriasis and psoriatic arthritis: a systematic review and meta‑analysis. Ann Rheum Dis 2015; 74: 480–489.
- [16] Ursini F, Leporini C, Bene F, et al. Anti‑TNF‑alpha agents and endothelial function in rheumatoid arthritis: a systematic review and meta‑analysis. Sci Rep 2017; 7: 5346.
- [17] Cohen SB, Tanaka Y, Mariette X, et al. Long‑term safety of tofacitinib up to 9.5 years: a comprehensive integrated analysis of the rheumatoid arthritis clinical development programme. RMD Open 2020; 6: e001395.
- [18] Taylor PC, Takeuchi T, Burmester GR, et al. Safety of baricitinib for the treatment of rheumatoid arthritis over a median of 4.6 and up to 9.3 years of treatment: final results from long‑term extension study and integrated database. Ann Rheum Dis 2022; 81: 335–343.
- [19] Cohen SB, van Vollenhoven R, Curtise JR, et al. POS0220 Integrated safety profile of upadacitinib with up to 4,5 years of exposure in patients with rheumatoid arthritis. Ann Rheum Dis 2021; 80(Suppl 1): 328–329.
- [20] Winthrop KL, Tanaka Y, Takeuchi T, et al. Integrated safety analysis of filgotinib in patients with moderately to severely active rheumatoid arthritis receiving treatment over a median of 1.6 years. Ann Rheum Dis 2022; 81: 184–192.
- [21] Ytterberg SR, Bhatt DL, Mikuls TR, et al. Cardiovascular and Cancer Risk with Tofacitinib in Rheumatoid Arthritis. N Engl J Med 2022; 386: 316–326.
- [22] Dougados M, Charles‑Schoeman C, Szekanecz Z, et al. Impact of baseline cardiovascular risk on the incidence of major adverse cardiovascular events in the tofacitinib rheumatoid arthritis clinical programme. Ann Rheum Dis 2022; 81(Suppl. 1): Abstr. OP0264.
- [23] Charles‑Schoeman C, Buch M, Dougados M, et al. Risk Factors for Major Adverse Cardiovascular Events in Patients Aged ≥ 50 Years with RA and ≥ 1 Additional Cardiovascular Risk Factor: Results from a Phase 3b/4 Randomized Safety Study of Tofacitinib vs TNF Inhibitors. ACR Meeting Abstracts 2021; Abstr. Nr. 0958.
- [24] Khosrow‑Khavar F, Kim SC, Lee H, et al. Tofacitinib and risk of cardiovascular outcomes: results from the Safety of TofAcitinib in Routine care patients with Rheumatoid Arthritis (STAR‑RA) study. Ann Rheum Dis 2022; 81: 798–804.
- [25] Agca R, Heslinga SC, Rollefstad S, et al. EULAR recommendations for cardiovascular disease risk management in patients with rheumatoid arthritis and other forms of inflammatory joint disorders: 2015/2016 update. Ann Rheum Dis 2017; 76: 17–28.
- [26] Visseren FLJ, Mach F, Smulders YM, et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J 2021; 42: 3227–3337.
- [27] Corrales, González‑Juanatey C, Peiró ME, et al. Carotid ultrasound is useful for the cardiovascular risk stratification of patients with rheumatoid arthritis: results of a population‑based study. Ann Rheum Dis 2014; 73: 722–727.
- [28] Tyrrell PN, Beyene J, Feldman BM, et al. Rheumatic disease and carotid intima‑media thickness: a systematic review and meta‑analysis. Arterioscler Thromb Vasc Biol 2010; 30: 1014–1026.
- [29] Ikdahl E, Wibetoe G, Rollefstad S, et al. Guideline recommended treatment to targets of cardiovascular risk is inadequate in patients with inflammatory joint diseases. Int J Cardiol 2019; 274: 311–318.
- [30] Robinson PC, van der Linden S, Khan MA, Taylor WJ. Axial spondyloarthritis: concept, construct, classification and implications for therapy. Nat Rev Rheumatol 2021; 17: 109–118.
- [31] Watad A, Bridgewood C, Russell T, et al. The Early Phases of Ankylosing Spondylitis: Emerging Insights From Clinical and Basic Science. Front Immunol 2018; 9: 2668.
- [32] Zhang H, Shi N, Diao Z, et al. Therapeutic potential of TNFα inhibitors in chronic inflammatory disorders: Past and future. Genes Dis 2021; 8: 38–47.
- [33] Ritchlin C, Adamopoulos IE. Axial spondyloarthritis: new advances in diagnosis and management. BMJ 2021; 372: m4447.
- [34] Hammitzsch A, Lorenz G, Moog P. Impact of Janus Kinase Inhibition on the Treatment of Axial Spondyloarthropathies. Front Immunol 2020; 11: 591176.
- [35] Ciccia F, Guggino G, Rizzo A, et al. Type 3 innate lymphoid cells producing IL‑17 and IL‑22 are expanded in the gut, in the peripheral blood, synovial fluid and bone marrow of patients with ankylosing spondylitis. Ann Rheum Dis 2015; 74: 1739–1747.
- [36] Gracey E, Qaiyum Z, Almaghlouth I, et al. IL‑7 primes IL‑17 in mucosal‑associated invariant T (MAIT) cells, which contribute to the Th17‑axis in ankylosing spondylitis. Ann Rheum Dis 2016; 75: 2124–2132.
- [37] Qaiyum Z, Gracey E, Yao Y, Inman RD. Integrin and transcriptomic profiles identify a distinctive synovial CD8+ T cell subpopulation in spondyloarthritis. Ann Rheum Dis 2019; 78: 1566–1575.
- [38] Navarro‑Compán V, Boel A, Boonen A, et al. The ASAS‑OMERACT core domain set for axial spondyloarthritis. Semin Arthritis Rheum 2021; 51: 1342–1349.
- [39] van der Heijde D, Ramiro S, Landewé R, et al. 2016 update of the ASAS‑EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017; 76: 978–991.
- [40] van der Horst‑Bruinsma I, Zack DJ, Szumski A, Koenig AS. Female patients with ankylosing spondylitis: analysis of the impact of gender across treatment studies. Ann Rheum Dis 2013; 72: 1221–1224.
- [41] Poddubnyy D, Sieper J. Treatment of Axial Spondyloarthritis: What Does the Future Hold? Curr Rheumatol Rep 2020; 22: 47.
- [42] Rudwaleit M, Listing J, Brandt J, et al. Prediction of a major clinical response (BASDAI 50) to tumour necrosis factor alpha blockers in ankylosing spondylitis. Ann Rheum Dis 2004; 63: 665–670.
- [43] Navarro‑Compán V, Plasencia‑Rodriguez C, de Miguel E, et al. Switching biological disease‑modifying antirheumatic drugs in patients with axial spondyloarthritis: results from a systematic literature review. RMD Open 2017; 3: e000524.
- [44] van der Heijde D, Dijkmans B, Geusens P, et al. Efficacy and safety of infliximab in patients with ankylosing spondylitis: results of a randomized, placebo‑controlled trial (ASSERT). Arthritis Rheum 2005; 52: 582–591.
- [45] Gensler LS, Chakravarty SD, Cameron C, et al. Propensity score matching/reweighting analysis comparing intravenous golimumab to infliximab for ankylosing spondylitis using data from the GO‑ALIVE and ASSERT trials. Clin Rheumatol 2020; 39: 2907–2917.
- [46] van der Heijde D, Kivitz A, Schiff MH, et al. Efficacy and safety of adalimumab in patients with ankylosing spondylitis: results of a multicenter, randomized, double‑blind, placebo‑controlled trial. Arthritis Rheum 2006; 54: 2136–2146.
- [47] Revicki DA, Luo MP, Wordsworth P, et al. Adalimumab reduces pain, fatigue, and stiffness in patients with ankylosing spondylitis: results from the adalimumab trial evaluating long‑term safety and efficacy for ankylosing spondylitis (ATLAS). J Rheumatol 2008; 35: 1346–1353.
- [48] Inman RD, Davis Jr JC, van der Heijde D, et al. Efficacy and safety of golimumab in patients with ankylosing spondylitis: results of a randomized, double‑blind, placebo‑controlled, phase III trial. Arthritis Rheum 2008; 58: 3402–3412.
- [49] Deodhar A, Reveille JD, Harrison DD, et al. Safety and Efficacy of Golimumab Administered Intravenously in Adults with Ankylosing Spondylitis: Results through Week 28 of the GO‑ALIVE Study. J Rheumatol 2018; 45: 341–348.
- [50] Davis Jr JC, van der Heijde D, Braun J, et al. Recombinant human tumor necrosis factor receptor (etanercept) for treating ankylosing spondylitis: a randomized, controlled trial. Arthritis Rheum 2003; 48: 3230–3236.
- [51] Dijkmans B, Emery P, Hakala M, et al. Etanercept in the longterm treatment of patients with ankylosing spondylitis. J Rheumatol 2009; 36: 1256–1264.
- [52] Baeten D, Sieper J, Braun J, et al. Secukinumab, an Interleukin‑17A Inhibitor, in Ankylosing Spondylitis. N Engl J Med 2015; 373: 2534–2548.
- [53] Pavelka K, Kivitz A, Dokoupilova E, et al. Efficacy, safety, and tolerability of secukinumab in patients with active ankylosing spondylitis: a randomized, double‑blind phase 3 study, MEASURE 3. Arthritis Res Ther 2017; 19: 285.
- [54] van der Heijde D, Wei JC, Dougados M, et al. Ixekizumab, an interleukin‑17A antagonist in the treatment of ankylosing spondylitis or radiographic axial spondyloarthritis in patients previously untreated with biological disease‑modifying anti‑rheumatic drugs (COAST‑V): 16 week results of a phase 3 randomised, double‑blind, active‑controlled and placebo‑controlled trial. Lancet 2018; 392: 2441–2451.
- [55] Yahya F, Gaffney k, Hamilton L, et al. Tumour necrosis factor inhibitor survival and predictors of response in axial spondyloarthritis‑findings from a United Kingdom cohort. Rheumatology (Oxford) 2018; 57: 619–624.
- [56] Deodhar A, Sliwinska‑Stanczyk P, Xu H, et al. Tofacitinib for the treatment of ankylosing spondylitis: a phase III, randomised, double‑blind, placebo‑controlled study. Ann Rheum Dis 2021; 80: 1004–1013.
- [57] Deodhar A, van der Heijde D, Sieper J, et l. Safety and Efficacy of Upadacitinib in Patients With Active Ankylosing Spondylitis and an Inadequate Response to Nonsteroidal Antiinflammatory Drug Therapy: One‑Year Results of a Double‑Blind, Placebo‑Controlled Study and Open‑Label Extension. Arthritis Rheumatol 2022; 74: 70–80.
- [58] Hinze AM, Louie GH. Osteoporosis Management in Ankylosing Spondylitis. Curr Treatm Opt Rheumatol 2016; 2: 271–282.
- [59] Mathieu S, Soubrier M. Cardiovascular events in ankylosing spondylitis: a 2018 meta‑analysis. Ann Rheum Dis 2019; 78: e57.
- [60] van der Heijde D, Song IH, Pandan AL, et al. Efficacy and safety of upadacitinib in patients with active ankylosing spondylitis (SELECT‑AXIS 1): a multicentre, randomised, double‑blind, placebo‑controlled, phase 2/3 trial. Lancet 2019; 394: 2108–2117.