Účinnost antagonistů receptorů AT1 pro angiotenzin II (sartanů) v léčbě chronického srdečního selhání
Chronické srdeční selhání postihuje 0,4–2 % populace s výrazným nárůstem ve vyšších věkových skupinách. Ve farmakoterapii se uplatňují látky tlumící regulační mechanismy hyperaktivované srdečním selháváním, především inhibitory ACE (ve světle klinických studií zvláště perindopril, ramipril), -blokátory (karvedilol, metoprolol) a spironolakton. V současné době se v léčbě CHSS začínají prosazovat i antagonisté receptorů AT1 pro angiotenzin II, tzv. sartany, zasahující podobně jako inhibitory ACE do regulační osy renin-angiotenzin-aldosteron. Vliv sartanů na morbiditu a mortalitu nemocných s chronickým srdečním selháním byl hodnocen již několika randomizovanými klinickými studiemi, avšak často se statisticky nevýznamnými výsledky. Článek uvádí přehled nejvýznamnějších studií analyzujících účinnost sartanů v léčbě srdečního selhání a provádí syntézu výsledků 22 klinických studií. Bylo tak prokázáno statisticky významné snížení celkové mortality o 14 % ve prospěch sartanů. K prevenci jednoho úmrtí je zapotřebí léčit 39 nemocných (NNT).
Úvod
Chronické srdeční selhání (CHSS) je významným a často diskutovaným medicínským tématem. Důvodem je jednak vysoká prevalence tohoto onemocnění v populaci (CHSS postihuje 0,4–2 % populace s výrazným nárůstem ve vyšších věkových skupinách; pro východní Evropu je udáván výskyt 1,3 %, což by odpovídalo 130 000 nemocným v České republice [1]), jednak velmi špatná prognóza nemocných. Moderní farmakoterapie totiž srdeční selhání nevymýtí ani nevyléčí, prodlužuje však život postižených a zlepšuje jeho kvalitu.
Z farmakologické léčby jsou na výsluní látky tlumící regulační mechanismy hyperaktivované srdečním selháváním, především inhibitory ACE (ve světle klinických studií zvláště perindopril [2], ramipril [3]), b-blokátory (karvedilol [4], popř. metoprolol [5]) a spironolakton [6].
V současné době se v léčbě CHSS začínají prosazovat i antagonisté receptorů AT1 pro angiotenzin II, tzv. sartany (ARB), zasahující do regulační osy renin-angiotenzin-aldosteron (RAA) podobně jako inhibitory ACE. Mají komplexní farmakologické účinky a zdají se být perspektivní terapeutickou možností léčby CHSS. Vliv sartanů na morbiditu a mortalitu nemocných s CHSS byl hodnocen již několika randomizovanými klinickými studiemi, avšak často se statisticky nevýznamnými výsledky. Statistická analýza výsledků přesně vybraných klinických studií s konkrétními antagonisty AT1 by mohla, v souvislosti se značným zvýšením počtu jedinců sledované populace, přinést objektivnější, statisticky významné zhodnocení přínosu této farmakologické skupiny v léčbě CHSS.
Antagonisté receptorů AT1 pro angiotenzin II
Důvodem k podávání sartanů je, alespoň prozatím, nesnášenlivost léčby inhibitory ACE. Nelze však opomenout skutečnost, že konverze angiotenzinu I na angiotenzin II je zprostředkována vedle ACE též nespecifickými tkáňovými proteázami, jejichž význam za patologických stavů roste. Např. při srdečním selhání je touto cestou konvertováno až 30 % angiotenzinu I. Antagonismus receptorů AT1 se vyznačuje širokým spektrem farmakodynamických účinků, které mohou zlepšit prognózu nejen pacientů se srdečním selháním (SS). Konkrétně nastává:
– ‑vazodilatace,
– ‑snížení systolického i diastolického krevního tlaku,
– ‑snížení sekrece aldosteronu,
– ‑snížení sekrece vazopresinu a ACTH,
– ‑snížení koagulace,
– ‑bránění aktivaci hypertrofie a fibrotizace myokardu,
– ‑bránění aktivaci vaskulární hypertrofie,
– ‑bránění rozvoji aterosklerózy ve všech stadiích vývoje.
Receptory AT1 jsou zodpovědné za téměř veškerý účinek angiotenzinu II, a tudíž právě jejich antagonisté mají v klinické medicíně rozhodující význam.
Stimulace receptorů AT2, k níž dochází při léčbě sartany ve zvýšené míře, je pro nemocné pozitivní – projevuje se účinkem vazodilatačním, antiproliferačním, endotel-protektivním, a dále vyvolává uvolnění bradykininu, oxidu dusnatého a apoptózu [7].
Sartany nemají na receptoru AT1 žádnou parciální agonistickou aktivitu. Nevykazují afinitu k ostatním receptorům, jako jsou AT2 a další méně charakterizované receptory AT. Funkční význam těchto receptorů není znám, stejně jako projevy jejich možné zvýšené stimulace angiotenzinem II, jehož hladiny se podáváním sartanů zvyšují.
Samotnými sartany v doporučených dávkách nejsou významně ovlivněny hladiny draslíku v séru, podávání sartanů téměř nemění glomerulární filtraci a slabě zvyšuje průtok plazmy ledvinami. Sartany významně snižují mikroalbuminurii a koncentraci kyseliny močové v krvi. Snížení proteinurie se využívá při renálním selhání, ať už při současném onemocnění diabetem 2. typu nebo bez přítomnosti diabetu mellitu.
Zdá se, že telmisartan má navíc parciální agonistickou aktivitu na receptorech PPAR-g (Peroxisome Proliferator-Activated Receptor-g), což se projevuje snížením glykémie, inzulinové rezistence a vylepšením lipidového profilu [8]. Navíc, ve srovnání s čistými agonisty PPAR-g receptorů (pioglitazon, rosiglitazon), nedocházelo k nárůstu hmotnosti a k retenci tekutin. Pokud se výše uvedené farmakologické účinky potvrdí ve velkých klinických studiích, telmisartan bude jistě patřit k léčivům první volby v prevenci a léčbě metabolického syndromu a diabetu. Již nyní je ale jasné, že ostatní sartany tuto cennou a zajímavou farmakologickou aktivitu postrádají.
Užívání antagonistů receptorů AT1 pro angiotenzin II v léčbě srdečního selhání bylo zavedeno nedávno. Losartan a valsartan představují 1. generaci, kandesartan, irbesartan, eprosartan, telmisartan, tasosartan, olmesartan, saprisartan a zolasartan jsou řazeny ke 2. generaci.
Statistická analýza
K získání klinických dat byl využit převážně informační systém MEDLINE. V této databázi byly vyhledány všechny uvedené informace o klinických studiích s jednotlivými antagonisty receptorů AT1, které byly publikovány v anglickém jazyce v letech 1990–2004. K vyhledávání byly zvoleny názvy jednotlivých sartanů a klíčová slova – angiotensine II receptor blockers, angiotensine II receptor antagonists, heart failure, chronic heart failure. Kromě toho byly zadány limity vyhledávání – randomized clinical trial a English language.
Klinické studie, které byly dále statisticky zpracovány, musely být:
– ‑kontrolované, tj. srovnávající účinky konkrétního sartanu s inhibitorem ACE, popř. s konvenční terapií;
– ‑randomizované, tj. s náhodným zařazením pacientů do sartanové nebo kontrolní skupiny;
– ‑prezentující výsledky celkové mortality nebo počty hospitalizací pro akutní zhoršení SS bez ohledu na to, zda tyto údaje byly stanoveny jako primární cíl studie či nikoli;
– ‑sledující pacienty se symptomatickým SS (NYHA II–IV).
Veškerá data prezentovaná a zpracovávaná v této práci byla čerpána z originálních článků autorů klinických studií. Za účelem statistické analýzy celkové mortality a hospitalizací pro exacerbaci SS byly zjištěny počty nemocných v sartanové a placebové skupině a počty zemřelých, resp. hospitalizovaných v těchto skupinách.
Po zhodnocení účinnosti sartanů na celkovou mortalitu a počty hospitalizací pro SS byly ještě pro tyto cílové parametry vytvořeny podskupiny podle typu kontroly, resp. podle vlastního provádění léčby (ARB vs. konvenční léčba, ARB vs. ACEI, ARB vs. ARB + ACEI).
Shromážděné výsledky byly získány přístupem intention-to-treat (úmysl léčit), podle kterého jsou všichni pacienti posuzováni jako rizikoví po celou dobu od zařazení do studie do předem určeného konce sledování, bez ohledu na to, zdali léčbu přerušili.
Všechna data pocházejí z prospektivních kontrolovaných studií s různou délkou klinického sledování. Odhad míry asociace, tj. vztahu mezi expozicí blokátorům receptorů AT1 a hospitalizací či mortalitou, byl proveden pomocí parametru OR (odds ratio, poměr šancí), který vyjadřuje pravděpodobnost rozvoje nemoci (hospitalizace) či úmrtí u exponovaných osob oproti neexponovaným. Bylo vypočítáno jako podíl dvou incidencí: incidence hospitalizace (úmrtí) ve skupině sartanů a incidence hospitalizace (úmrtí) v kontrolní skupině (tab. 1).
K posouzení statistické spolehlivosti odhadu OR byl vypočítán 95% konfidenční interval (95% CI) neboli interval spolehlivosti pro pětiprocentní hladinu významnosti. Když konfidenční interval zahrnoval číslo 1, tj. nulovou hypotézu (p > 0,05), zjištěné OR bylo označeno za statisticky nesignifikantní na zvolené hladině významnosti.
Z každé studie byly vypočteny hodnoty OR a 95% CI pro výsledky celkové mortality a počtu hospitalizovaných. Celkové odhady OR byly získány stejnou metodou ze sumarizovaných dat všech studií. Stejné postupy byly po pečlivém třídění dat využity v dílčích analýzách předem stanovených podskupin.
U statisticky významných hodnot byl navíc vypočítán parametr NNT (number needed to treat), který udává potřebný počet léčených pacientů k prevenci sledovaného rizika (mortalita, hospitalizace) u jednoho z nich.
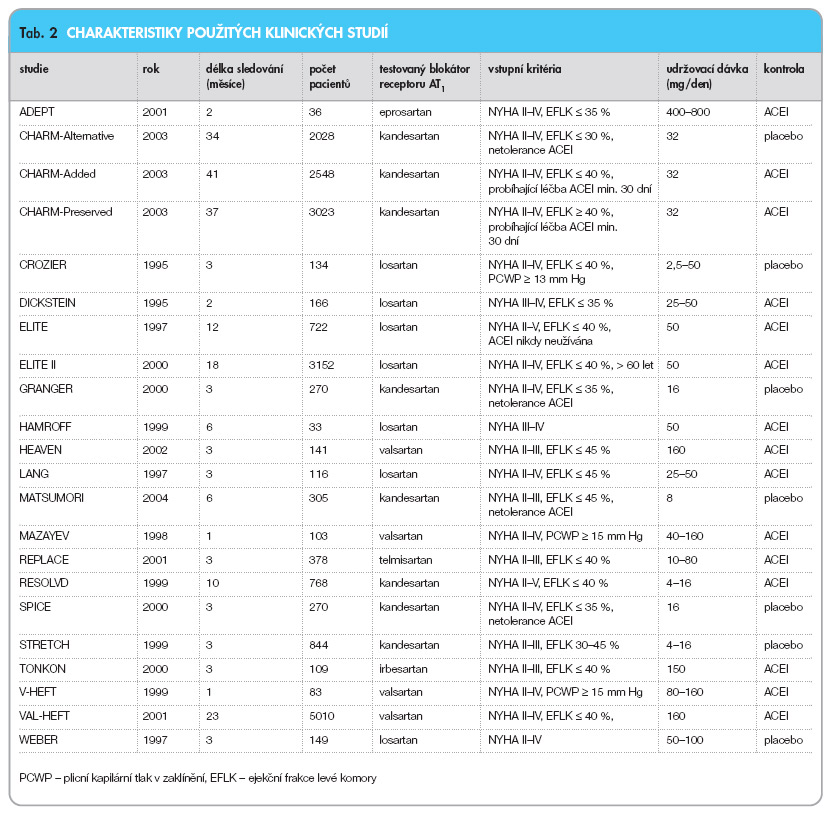
Základní informace o uspořádání analyzovaných studií včetně charakteristik jejich populací přehledně shrnuje tab. 2.
Výše uvedená vstupní kritéria tedy splnilo 22 klinických studií realizovaných v letech 1997–2004, sledujících celkem 20 388 pacientů, z toho 11 053 v sartanové a 9335 v kontrolní skupině.
Sedm studií hodnotilo účinek sartanů proti placebu, osm studií srovnávalo účinek sartanů a inhibitorů ACE. Zbývajících sedm klinických studií srovnávalo společný efekt sartanů s ACEI proti samotným inhibitorům ACE. Studie MAZAYEV hodnotila účinek valsartanu zároveň proti placebu a inhibitorům ACE. Obdobně studie RESOLVD sledovala jak vliv kombinační léčby kandesartanem s enalaprilem, tak i účinek léčby kandesartanem samotným proti léčbě inhibitorem ACE. Podle těchto charakteristik byly pak také vytvořeny hodnocené podskupiny.
Doba klinického sledování dosahovala v jednotlivých studiích 2–41 měsíců. Všechny studie sledovaly nemocné se symptomatickým SS (NYHA II a výše), u 18 z nich byla podmínkou pro zařazení snížená ejekční frakce levé komory (EFLK). Naopak podmínkou zařazení do studie CHARM-Preserved byla zachovaná EFLK (≥≥ 40 %). Do studie CROZIER, MAZAYEV a V-HEFT byli zapojeni pouze pacienti se zvýšeným tlakem v zaklínění (PCWD ≥≥ 13 mm Hg, resp. 15 mm Hg). Efekt sartanů proti placebu byl hodnocen v podstatě pouze u nemocných netolerujících inhibitory ACE (CHARM-Alternative, CROZIER, GRANGER, MATSUMORI, SPICE, STRETCH a WEBER).
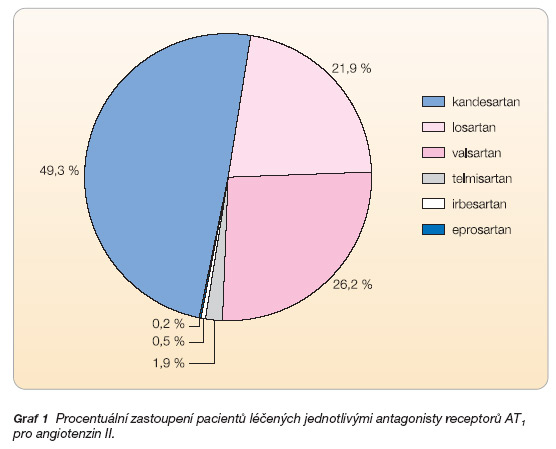
Klinický přínos pro nemocné se srdečním selháním byl sledován u kandesartanu (8 studií), losartanu (7 studií), valsartanu (4 studie), telmisartanu (1 studie), irbesartanu (1 studie) a eprosartanu (1 studie). Přesné procento zastoupení jednotlivých sartanů ve studiích této statistické analýzy shrnuje graf 1.
K nejrozsáhlejším a nejpropracovanějším klinickým studiím, jež byly zahrnuty do této analýzy, určitě patří studie CHARM, ELITE II a Val-HEFT.
Studie CHARM probíhala ve třech paralelních větvích po dobu 2–3 let s více než 7000 nemocnými. Primárním cílem bylo sledování četnosti kardiovaskulární mortality a hospitalizací pro zhoršené SS.
Do první větve, CHARM-Alternative [8], která trvala 34 měsíců, byli zařazeni nemocní s nízkou ejekční frakcí (do 30 %) a s intolerancí léčby inhibitory ACE. Ta byla nejčastěji zapříčiněna výskytem kašle (72 %), symptomatickou hypotenzí (13 %) a renální dysfunkcí (12 %). Po randomizaci pacienti užívali kandesartan (n = 1013, cílová dávka 32 mg jednou denně) nebo placebo (n = 1015). Kandesartan byl těmito nemocnými se symptomatickým CHSS dobře tolerován a redukoval jejich kardiovaskulární mortalitu i morbiditu.
Do druhé větve, CHARM-Added [9], byli zařazeni opět nemocní s nízkou ejekční frakcí (≤≤ 40 %), ale byl jim přidán kandesartan (n = 1276, cílová dávka 32 mg jednou denně) nebo placebo (n = 1272) k probíhající léčbě inhibitorem ACE. K nejčastěji užívaným inhibitorům ACE (74 %) patřil enalapril, lisinopril, kaptopril a ramipril. V průměru byly podávány v denních dávkách 17 mg, 17 mg, 82,5 mg a 6,8 mg v kandesartanové i placebové skupině; 55 % nemocných bylo navíc léčeno b-blokátorem a 17 % nemocných bylo léčeno spironolaktonem. Tato klinická studie probíhala 41 měsíců. Kardiovaskulární úmrtí, resp. prodělané hospitalizace pro zhoršené SS, byly zaznamenány u 302 pacientů (23,7 %), resp. u 309 pacientů (24,2 %) v kandesartanové skupině a u 347 pacientů (27,3 %), resp. u 356 pacientů (28,0 %) v placebové skupině. Závěr této studie tedy říká, že přidání kandesartanu k inhibitoru ACE v léčbě pacientů s CHSS a sníženou ejekční frakcí levé komory snižuje riziko kardiovaskulární mortality o 16 % a riziko hospitalizace o 14 %. Prospěšný účinek kandesartanu byl též zřetelný u podskupin léčených b-blokátorem či spironolaktonem.
Konečně třetí větev, CHARM-Preserved [10], testovala populaci (NYHA II–IV) se srdečním selháním a se zachovalou funkcí levé komory (ejekční frakce ≥≥ 40 %). Zde by se mělo připomenout, že celá polovina pacientů s CHSS má zachovalou funkci levé komory. Stejně jako v podstudii Added byl kandesartan přidáván k již probíhající léčbě inhibitory ACE opět v cílové dávce 32 mg jednou denně po dobu 37 měsíců. Kandesartanová skupina čítala 1514 a placebová 1509 nemocných. Počty kardiovaskulárních úmrtí se mezi oběma skupinami nelišily (170 vs. 170), ale méně pacientů léčených sartanem, 230 (15 %) vs. 279 (18,5 %) nemocných, bylo hospitalizováno pro zhoršené SS. Přidání kandesartanu k inhibitorům ACE v léčbě těchto pacientů tedy snižovalo riziko zhoršení SS o 18 %, avšak na celkovou srdeční mortalitu vliv nemělo.
Další velká randomizovaná dvojitě zaslepená studie ELITE II [11] srovnávala efekt léčby losartanem oproti léčbě kaptoprilem na morbiditu a mortalitu, a dále sledovala bezpečnost a toleranci obou látek ovlivňujících osu renin-angiotenzin-aldosteron.
Studie probíhala v 289 centrech 46 států, přičemž bylo vybráno 3152 pacientů se SS starších než 60 let s klasifikací NYHA II–IV a ejekční frakcí ≤≤ 40 %. Z tohoto počtu bylo 1578 pacientů přiřazeno do losartanové a 1578 do kaptoprilové skupiny. Losartan se podával jednou denně v dávce 12,5 mg, která se postupně zvyšovala až na cílových 50 mg denně. Kaptopril ve skupině druhé byl indikován třikrát denně v počáteční dávce 6,25 mg a cílové 50 mg denně.
Primárním cílem bylo sledování celkové mortality, sekundárním potom sledování kombinace náhlé srdeční smrti nebo resuscitace pro srdeční zástavu. Samozřejmě se zaznamenávaly i počty hospitalizací s kardiovaskulárním onemocněním, všechny hospitalizace atd.
Ve skupině léčené losartanem bylo zaznamenáno celkem 280 (17,7 %) úmrtí, v kaptoprilové 250 (15,9 %) (hazard ratio 1,13; 95,7% CI: 0,95–1,35, p = 0,16). Procenta výskytu náhlé srdeční smrti nebo resuscitace pro srdeční zástavu se mezi oběma skupinami také signifikantně nelišila (9,0 vs. 7,3 %, 1,25; 0,98–1,60), p = 0,08). Hospitalizací pro SS bylo ve skupině angiotenzinového blokátoru zjištěno 270 (17,1 %), u pacientů léčených inhibitorem ACE pak 293 (18,6 %). Signifikantně méně nemocných léčených losartanem přerušilo léčbu kvůli nežádoucím účinkům (kašel).
Studie Val-HeFT (Valsartan Heart Failure Trial) [12] randomizovala 5010 pacientů v 302 zdravotních centrech 16 států k užívání valsartanu (n = 2511) 160 mg dvakrát denně či placeba (n = 2499). Všichni nemocní se dali charakterizovat klinicky stabilním CHSS – NYHA klasifikací II–IV, echokardiograficky prokázanou EF levé komory ≤ 40 % a dilatací levé komory. Celých 93 % pacientů bylo v průběhu studie léčeno inhibitory ACE. Průměrné denní dávky byly 17 mg enalaprilu, 19 mg lisinoprilu, 80 mg kaptoprilu, 6 mg ramiprilu a 23 mg chinaprilu. 35 % nemocných užívalo b-blokátory – 15 % z nich karvedilol, 12 % metoprolol a 3 % atenolol. Pouze 5 % pacientů bylo léčeno spironolaktonem. Průměrná doba sledování byla 23 měsíců.
Přidání valsartanu k léčbě těchto nemocných nemělo na mortalitu žádný vliv. Jinak tomu však bylo s vlivem valsartanu na počty hospitalizací pro zhoršené SS: v jeho skupině bylo hospitalizováno celkem 923 (36,8 %) pacientů, v placebové skupině pak 1189 (47,6 %) nemocných.
Mírné zvýšení EF levé komory bylo pozorováno v obou skupinách: 4 % ve skupině léčené valsartanem vs. 3,2 % ve skupině, které bylo podáváno placebo. K snížení NYHA klasifikace došlo u 23,1 % osob léčených valsartanem a 20,7 % u placeba.
Také jsou známy výsledky léčby čtyř podskupin podle užívání či neužívaní inhibitorů ACE a b-blokátorů. Nejlepších výsledků bylo dosaženo u pacientů neužívajících ani inhibitor ACE ani b-blokátor. Přidání sartanu k jedné z těchto skupin léčiv může být také ještě označeno za pozitivní. Avšak ve skupině pacientů léčených inhibitory ACE i b-blokátory užívání valsartanu zvyšovalo incidenci kombinovaného rizika i celkové mortality!
Výsledky
Vliv antagonistů receptorů AT1 pro angiotenzin II na mortalitu
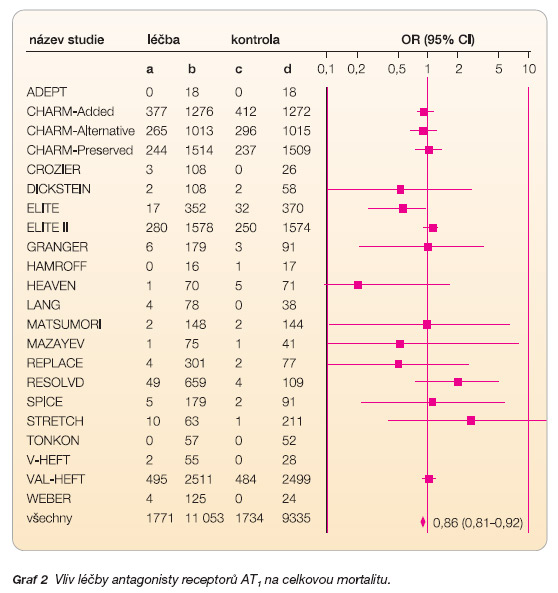
Sloučením výsledků všech 22 studií bylo dokázáno statisticky významné snížení celkové mortality o 14 % ve prospěch sartanů – OR 0,86 (95% CI: 0,81–0,92), přičemž jen minimum samostatných klinických studií publikovalo statisticky signifikantní výsledky snížení rizika tohoto sledovaného parametru (graf 2).
K prevenci jednoho úmrtí je potřeba léčit 39 nemocných (NNT).
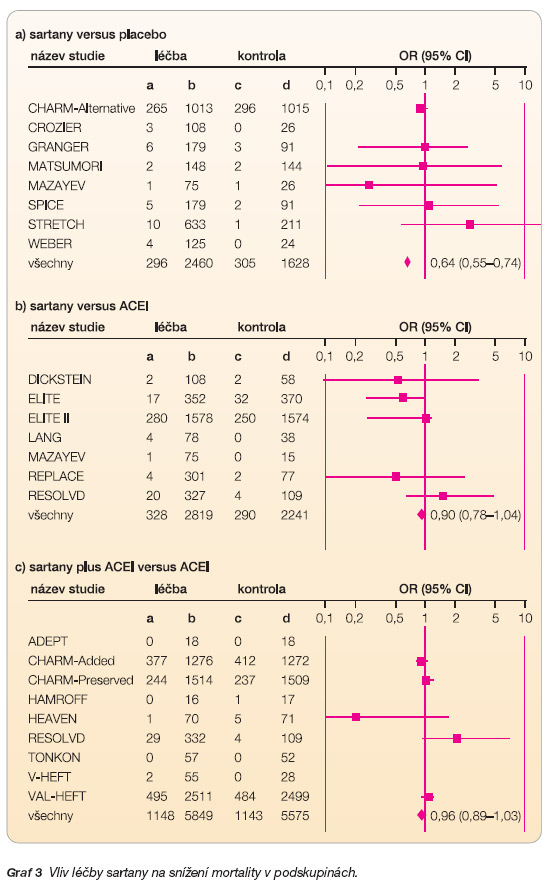
Dílčí analýza celkové mortality všech tří podskupin (sartany vs. placebo, sartany vs. ACEI, sartany + ACEI vs. ACEI) dospěla k podobným výsledkům – graf 3.
Statisticky významné hodnocení však poskytla pouze podskupina hodnotící vliv podávání sartanů proti podávání placeba – OR 0,64 (95% CI: 0,55–0,74), NNT 15. Ze zbývajících dvou je však minimálně jasné, že sartany oproti kontrole mortalitu nezvyšují.
Vliv antagonistů receptorů AT1 na počty hospitalizovaných pro zhoršené SS
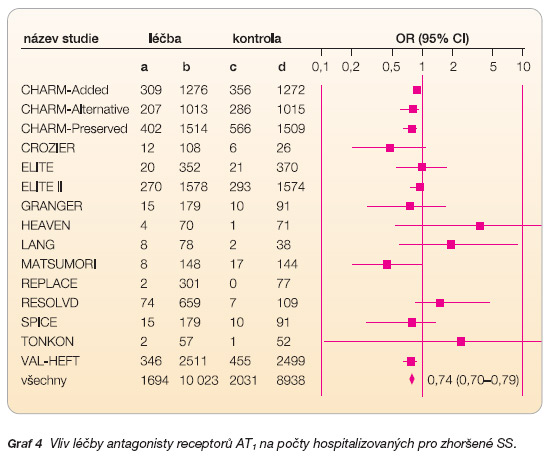
Statistická analýza výsledků těchto patnácti studií (graf 4) ukázala signifikantní snížení rizika hospitalizace pro exacerbaci SS o 26 % ve prospěch antagonistů receptorů AT1 – OR 0,74 (95% CI: 0,70–0,79). K prevenci jedné hospitalizace pro SS musí být léčeno 17 nemocných (NNT).
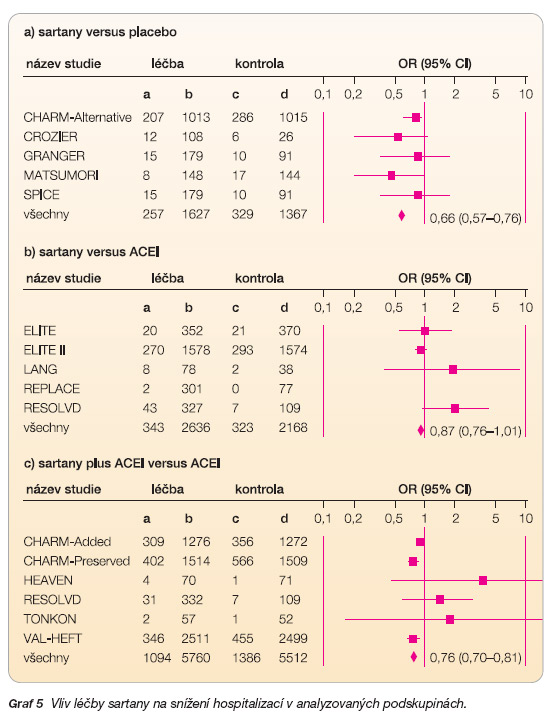
Dílčí analýza tří podskupin sledující počty hospitalizací pro SS (graf 5) zaznamenala jejich signifikantní snížení přirozeně ve skupině sartanu vs. placebo – OR 0,66 (95% CI: 0,57–0,76), NNT 12, a také u nemocných léčených kombinací sartanu a inhibitoru ACE proti léčbě samotným inhibitorem ACE – RR 0,76 (95% CI: 0,70–0,81), NNT 16. Snížení počtu hospitalizací ve zbývající podskupině bohužel nebylo statisticky významné.
Diskuse
Metaanalýza klinických studií se sartany v léčbě nemocných s CHSS, prováděná v roce 2001 Jongem a kol. [13], zpracovávala klinická data ze 17 studií (celkem 12 469 pacientů). Využívala stejnou charakteristiku vyjádření míry pravděpodobnosti rozvoje nemoci, tzv. odds ratio (poměr šancí), jejíž pomocí také hodnotila vliv léčby sartany na mortalitu a hospitalizace pro SS. Publikované výsledky neprokázaly snížení celkové mortality – OR 0,96 (95% CI: 0,75–1,23), ani snížení počtu hospitalizací – OR 0,86 (95% CI: 0,69–1,06).
Další možnost srovnání nabízí studie Dimopoulose a kol. [14], kteří se zabývali také vlivem antagonistů receptorů AT1 na mortalitu a morbiditu u pacientů se SS léčených inhibitory ACE s b-blokátory nebo bez nich. U všech těchto pacientů byla redukována mortalita, avšak statisticky nevýznamně – OR 0,97 (95% CI: 0,87–1,08).
Z jednotlivých podskupin byl nejvyšší přínos léčby logicky zaznamenán v té, která hodnotila sartany versus placebo. Celková mortalita byla redukována o 36 % – OR 0,64 (95% CI: 0,55–0,74) a počty hospitalizovaných o 34 % – OR 0,66 (95% CI: 0,57–0,76). Lee a kol. [15] ve své metaanalýze zahrnuli 38 080 pacientů se SS a vysokým rizikem akutního IM; ve stejné podskupině bylo dosaženo srovnatelných výsledků: snížení mortality – OR 0,83 (95% CI: 0,69–1,00), snížení počtu hospitalizací – OR 0,64 (95% CI: 0,53–0,78) v porovnání s placebem.
Sartany ve srovnání s inhibitory ACE redukovaly oba sledované parametry rovnocenně, avšak statisticky nevýznamně; celkovou mortalitu o 10 % – OR 0,90 (95% CI: 0,78–1,04) a počet hospitalizací o 13 % – OR 0,87 (95% CI: 0,76–1,01). Lee a kol. dosáhli v této podskupině také nesignifikantních výsledků; snížení mortality – OR 1,06 (95% CI: 0,90–1,26), vliv na hospitalizace – OR 0,95 (95% CI: 0,80–1,13).
Jako poslední byl hodnocen přínos kombinační léčby sartany s ACEI ve srovnání s léčbou ACEI. Zde se jednoznačně potvrdil pozitivní vliv kombinační léčby na počty hospitalizovaných, došlo k jejich snížení o 24 % – OR 0,76 (95% CI: 0,70–0,81), nicméně u těchto nemocných nebylo zaznamenáno statisticky významné snížení celkové mortality – OR 0,96 (95% CI: 0,89–1,03).
Lee a spolupracovníci publikovali obdobnou redukci hospitalizací v této podskupině – OR 0,77 (95% CI: 0,69–0,87), k redukci celkové mortality nedošlo – OR 0,97 (95% CI: 0,87–1,08).
S ohledem na výše uvedené výsledky je však nutné konstatovat, že prezentovaná statistická metaanalýza spolu se svými výsledky obsahuje jistě několik omezení. V prvé řadě je limitována kvalitou a rozsahem souboru dat prezentovaných v jednotlivých studiích, ostatně jako všechny analýzy tohoto typu.
Protože klinické studie s pozitivními výsledky jsou obecně zveřejňovány častěji, mohlo dojít k tzv. informační předpojatosti, k systematické chybě v odhadu studovaného efektu nazývané bias, a tudíž ke zkreslení závěru ve prospěch sartanů. Za jeden z dalších zdrojů tohoto zkreslení můžeme považovat např. limitovanou vyhledávací databázi či upřednostnění anglicky publikovaných studií.
Veškeré statistické výpočty představují jen odhady, jež se s určitým stupněm spolehlivosti vztahují ke sledované skupině pacientů, kterou tvoří přesně vybraní a monitorovaní jedinci.
Závěr
K vytvoření metaanalýzy hodnotící efektivitu antagonistů receptorů AT1 pro angiotenzin II (sartanů) v léčbě symptomatického CHSS bylo použito 22 randomizovaných, dvojitě zaslepených prospektivních klinických studií, provedených v letech 1997–2004, prezentujících výsledky celkové mortality nebo počty hospitalizací pro akutní zhoršení SS: ADEPT, CHARM-Alternative, CHARM-Added, CHARM-Preserved, CROZIER, DICKSTEIN, ELITE, ELITE II, GRANGER, HAMROFF, HEAVEN, LANG, MATSUMORI, MAZAYEV, REPLACE, RESOLVD, SPICE, STRETCH, TONKON, V-HEFT, VAL-HEFT, WEBER. Celkem bylo sledováno 20 388 pacientů, z toho 11 053 v sartanové a 9335 v kontrolní skupině.
Pro jednotlivé statistické výpočty byl použit statistický program pro klinická data Confidence interval calculator (v4, November 2002), pomocí něhož byl získán parametr OR – poměr šancí (odds ratio), vyjadřující pravděpodobnost rozvoje nemoci (hospitalizace) či úmrtí u exponovaných osob oproti neexponovaným. K posouzení statistické spolehlivosti odhadu OR byl vypočítán 95% konfidenční interval (95% CI) neboli interval spolehlivosti pro pětiprocentní hladinu významnosti. Pokud konfidenční interval zahrnoval číslo 1, tj. nulovou hypotézu (p > 0,05), zjištěné OR bylo označeno za statisticky nesignifikantní na zvolené hladině významnosti.
Metaanalýzou všech 22 studií bylo dokázáno statisticky významné snížení celkové mortality o 14 % ve prospěch sartanů, přičemž jen minimum samostatných klinických studií publikovalo statisticky signifikantní výsledky snížení rizika tohoto sledovaného parametru. K prevenci jednoho úmrtí je zapotřebí léčit 39 nemocných (NNT).
Statistická analýza výsledků patnácti studií, uvádějících údaje o počtu hospitalizovaných, ukázala signifikantní snížení rizika hospitalizace pro exacerbaci SS o 26 % ve prospěch sartanů. K prevenci jedné hospitalizace pro SS musí být léčeno 17 nemocných (NNT).
Závěrem je tedy možno tvrdit, že byla jednoznačně prokázána účinnost léčby sartany proti podávání placeba. Efektivita účinků sartanů a ACEI na celkovou mortalitu nemocných a jejich hospitalizaci byla srovnatelná. Proto lze skupinu sartanů považovat za vhodnou alternativu ACEI jakožto léků volby u pacientů se SS.
Seznam použité literatury
- [1] Špinar J, Vítovec J. Chronické srdeční selhání – diagnostika. Doporučené postupy. Projekt MZ ČR zpracovaný ČLS JEP za podpory grantu IGA MZ ČR 5390–3, 2002.
- [2] Ferrari R. Perindopril and Remodeling in Elderly with Acute Myocardial Infarction Investigators. Arch Intern Med 2006; 166: 659–666.
- [3] Yusuf S, Sleight P, Pogue J, et al. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. The Heart Outcomes Prevention Evaluation Study Investigators. N Engl J Med 2000; 342: 145–153.
- [4] Vera-Llonch M, Menzin J, Richner RE, Oster G. Cost-effectiveness results from the US Carvedilol Heart Failure Trials Program. Ann Pharmacother 2001; 35: 846–851.
- [5] Hjalmarson A, Fagerberg B. MERIT-HF mortality and morbidity data. Basic Res Cardiol 2000; 95 (Suppl. 1): 98–103.
- [6] Pitt B, Zannad F, Remme WJ, et al. The Effect of Spironolactone on Morbidity and Mortality in Patients with Severe Heart Failure. N Engl J Med 1999; 341: 709–717.
- [7] Bultas J. Nové farmakologické postupy v léčbě chronického srdečního selhání. Kardiol Rev 2003; 4: 1214–1255 – příloha Kardiofórum, 7–17.
- [8] Granger CB, McMurray JJ, Yusuf S, et al. CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function intolerant to angiotensin-converting-enzyme inhibitors: the CHARM-Alternative trial. Lancet 2003; 362: 772–776.
- [9] McMurray JJ, Ostergren J, Swedberg K, et al. CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function taking angiotensin-converting-enzyme inhibitors: the CHARM-Added trial. Lancet 2003; 362: 767–771.
- [10] Yusuf S, Pfeffer MA, Swedberg K, et al. CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet 2003; 362: 777–781.
- [11] Pitt B, Poole-Wilson PA, Segal R, et al. Effect of losartan compared with captopril on mortality in patients with symptomatic heart failure: randomised trial – the Losartan Heart Failure Survival Study ELITE II. Lancet 2000; 355: 1582–1587.
- [12] Cohn JN, Tognoni G, for the Valsartan Heart Failure Trial Investigators. A randomized trial of angiotensin-receptor blocker valsartan in chronic heart failure. N Engl J Med 2001; 345: 1667–1675.
- [13] Jong P, Demers C, McKelvie RS, Liu PP. Angiotensin receptor blockers in heart failure: meta-analysis of randomized controlled trials. J Am Coll Cardiol 2002; 39: 463–470.
- [14] Dimopoulos K, Salukhe TV, Coats AJ, et al. Meta-analyses of mortality and morbidity effects of an angiotensin receptor blocker in patients with chronic heart failure already receiving an ACE inhibitor (alone or with a beta-blocker). Int J Cardiol 2004; 93: 105–111.
- [15] Lee VC, Rhew DC, Dylan M, et al. Meta-analysis: angiotensin-receptor blockers in chronic heart failure and high-risk acute myocardial infarction. Ann Intern Med 2004; 141: 693–704.