Upadacitinib – nová alternativa léčby psoriatické artritidy
Souhrn:
Pavelka K. Upadacitinib – nová alternativa léčby psoriatické artritidy. Remedia 2021; 31: 499–505.
Terapie psoriatické artritidy (PsA) se výrazně zlepšila nástupem biologických a cílených chorobu modifikujících antirevmatických léků (DMARDs). V současné době je pro léčbu PsA indikováno pět anti‑TNF přípravků, dva blokátory IL‑17, blokátor IL‑12/23 a inhibitor fosfodiesterázy 4 apremilast. Nicméně část pacientů s PsA stále zůstává ve stavu střední nebo vysoké aktivity. Dalším problémem je heterogenita PsA, která způsobuje, že některé přípravky nepokrývají celé spektrum projevů nemoci. Novou alternativou léčby imunitně podmíněných zánětlivých revmatických onemocnění je blokáda signální transdukce inhibitory Janusových kináz (JAK), která se ukázala být velmi účinnou u revmatoidní artritidy a ankylozující spondylitidy. Novým, vysoce selektivním inhibitorem JAK1 je upadacitinib. Nedávno byla dokončena fáze III klinického zkoušení u PsA pod názvem SELECT‑PsA‑1, což byla randomizovaná, placebem a aktivním komparátorem kontrolovaná studie u nemocných s PsA. Do studie bylo zařazeno celkem 1 704 pacientů. Pacienti byli randomizováni do skupin: upadacitinib 15 mg denně, upadacitinib 30 mg denně, adalimumab 40 mg s.c. obtýden a placebo. Primárním cílovým ukazatelem byla odpověď ACR v týdnu 12, byla docílena u 70,6 % pacientů léčených 15 mg upadacitinibu, u 78,5 % pacientů léčených upadacitinibem v dávce 30 mg, ve 36,2 % v placebové skupině a v 65 % ve skupině s adalimumabem. Signifikantního zlepšení proti placebu bylo dosaženo v obou skupinách s léčbou upadacitinibem – v dávkách 15 mg a 30 mg – ve většině sekundárních ukazatelů, včetně indexů hodnotících kvalitu života, ale i rentgenovou progresi. Tolerance léčby byla dobrá a oproti studiím s upadacitinibem v jiných indikacích nepřineslo sledování bezpečnosti léčby žádné nové poznatky. Při dávce 30 mg upadacitinibu byly častější závažné infekce a infekce herpes zoster. V laboratorních výsledcích se pak řídce vyskytovaly neutropenie, elevace aktivity kreatinkinázy a elevace hodnot jaterních testů. Upadacitinib v dávce 15 mg denně může představovat novou alternativu léčby PsA.
Summary:
Pavelka K. Upadacitinib – a new treatment alternative for psoriatic arthritis. Remedia 2021; 31: 499–505.
The therapy of psoriatic arthritis (PsA) has significantly improved with the advent of biologic and targeted disease‑modifying drugs (DMARDs). Currently, there are five anti‑TNF products, two IL‑17 blockers, an IL‑12/23 blocker and apremilast, a phosphodiesterase‑4 inhibitor indicated for the treatment of PsA. However, some patients with PsA still stay in medium to high activity level. Another problem is the heterogenity of PsA; some medicinal products do not cover the whole spectrum of disease symptoms. A new treatment alternative of immune‑mediated inflammatory rheumatic diseases is the blockade of signal transduction with Janus kinase (JAK) inhibitors that has proved to be very effective in rheumatoid arthritis and ankylosing spondylitis. Upadacitinib is a new, highly selective JAK1 inhibitor. A phase III clinical trial in PsA has recently been completed under a SELECT‑PsA name that was a randomized, placebo‑ and active comparator‑controlled study in patients with PsA. A total of 1,704 patients were included in the study. The patients were randomized into these groups: upadacitinib 15 mg a day, upadacitinib 30 mg a day, adalimumab 40 mg subcutaneously once every 14 days and a placebo. The primary endpoint was ACR response in week 12; achieved in 70.6% of patients treated with 15 mg of upadacitinib, in 78.5% of patients treated with 30 mg of upadacitinib, in 36.2% of patients with placebo, and 65% of patients treated with adalimumab. A significant improvement compared with placebo was achieved in both groups treated with upadacitinib (dose 15 and 30 mg) in most of the secondary endpoints, including the indices of the quality of life but also the X‑ray progression. The treatment was well‑tolerated and the safety evaluation did not bring any new information compared with upadacitinib studies in other indications. Severe infections and herpes zoster infections were more common in patients treated with 30 mg of upadacitinib. Laboratory tests revealed rare neutropenias, creatine kinase activity elevation as well as liver tests elevations. Upadacitinib administered at a dose of 15 mg daily may represent a new treatment alternative of PsA.
Key words: psoriatic arthritis, biologic treatment, upadacitinib.
Úvod
Psoriatická artritida (PsA) je chronické autoimunitní zánětlivé onemocnění, které řadíme v novějším konceptu do skupiny tzv. periferních spondyloartritid. Jde o velmi heterogenní onemocnění, kdy kromě postižení kůže a nehtů a muskuloskeletálního systému je často přítomno i postižení gastrointestinálního traktu ve formě idiopatického střevního zánětu a oční postižení ve formě akutní přední uveitidy. PsA může mít i celou řadu komorbidit, a to především kardiovaskulárních, metabolických a psychiatrických, což vše způsobuje výrazné zhoršení kvality života nemocných [1,2].
Terapie PsA by se měla optimálně
skládat z nefarmakologické, farmakologické a ev.
i chirurgické léčby. Prostředky farmakologické léčby se
v posledních dvou dekádách značně rozšířily. Kromě tzv.
konvenčních syntetických chorobu modifikujících antirevmatických
léků (disease modifying antirheumatic drugs, DMARDs), k nimž
řadíme metotrexát, sulfasalazin a leflunomid, máme
k dispozici širší škálu biologických DMARDs, kam
k přípravkům proti tumor nekrotizujícímu faktoru alfa
(anti TNF) [3] přibyly blokátory interleukinu (IL) 17 [4,5]
a blokátory IL 12/23 [6]. Zcela novou skupinu DMARDs pak
představují tzv. cílené syntetické DMARDs. Jde chemicky o malé
molekuly, které ale cíleně ovlivňují některé struktury
důležité v iniciaci a udržování zánětlivé
aktivity. Řadíme sem inhibitor fosfodiesterázy 4 (PDE4) apremilast
[7] a inhibitory Janusových kináz (JAK) [8]. Vývoj
a armamentarium biologických a cílených léků u PsA
shrnuje obrázek 1.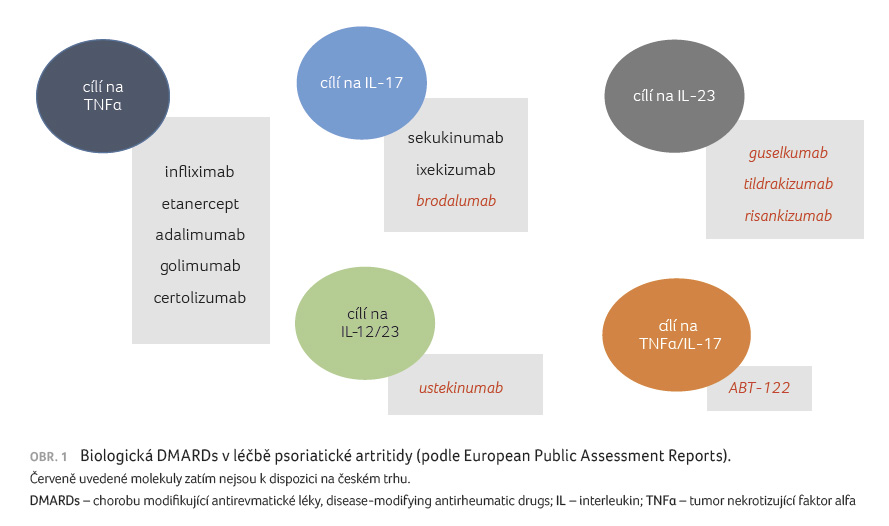
Mechanismus účinku inhibitorů JAK u spondyloartritid
V patogenezi PsA má významnou úlohu osa IL 23/17. Interleukin 23 přispívá k diferenciaci Th17, ale i dalších buněk, které produkují IL 17A, IL 22 a TNF alfa. Tyto efektorové cytokiny pak jsou asociovány s produkcí v keratinocytech a změnami při psoriatické nemoci a s erozemi a kostní novotvorbou u spondyloartritid, ačkoliv přesný mechanismus změněného fenotypu v kůži a kloubu není zcela objasněn [9]. Řada imunitních buněk a jejich efektorových molekul (cytokiny, interferony, růstové faktory) používá různé kombinace JAK jako signální transduktory a aktivátory transkripčních molekul (STAT). Intracelulární blokáda signální transdukce JAK1 je experimentálně i klinicky velmi úspěšná při potlačení zánětlivé aktivity.
Upadacitinib (UPA) je perorální reverzibilní inhibitor JAK, vysoce selektivní k blokádě JAK1, která má nejvyšší prozánětlivý potenciál. Upadacitinib byl rozsáhle ověřován ve fázi III klinického zkoušení v indikaci léčby revmatoidní artritidy. V dávce 15 mg podávané jednou denně byl účinnější než adalimumab [10]. Dále byl zkoušen v indikaci léčby ankylozující spondylitidy [11]. Efekt upadacitinibu u ankylozující spondylitidy byl rychlý a mohutný a primárního cílového ukazatele ASAS 40 (40% zlepšení dle Assessment in SpondyloArthritis international Society) v týdnu 14 bylo dosaženo při léčbě upadacitinibem v 52 % oproti 26 % v placebové skupině (p = 0,0003).
Upadacitinib v léčbě psoriatické artritidy – studie SELECT PsA 1
Metodologie
SELECT PsA 1 byla
randomizovaná, placebem a aktivním komparátorem kontrolovaná
studie fáze III. Pacienti byli randomizováni do skupin: 15 mg
UPA denně, 30 mg UPA denně, adalimumab 40 mg s.c. obtýden
a placebo. Uspořádání studie je uvedeno na obrázku 2 [12].
Primárním cílovým ukazatelem byla odpověď ACR 20 (20% zlepšení dle American College of Rheumatology) v týdnu 12. Dále bylo vytyčeno celkem 14 sekundárních cílových ukazatelů, které hodnotily jednak aktivitu PsA (např. minimální aktivita PsA MDA, počet oteklých kloubů, entezitický index CRP), jednak rentgenovou (RTG) progresi PsA (skóre Sharp van der Heijde), hodnocení se týkalo rovněž rozsahu psoriázy (Psoriasis Area and Severity Index, PASI), a dále pak se studie zaměřila na ukazatele hodnotící funkci a kvalitu života, dnes často označované jako PRO (patient reported outcomes), konkrétně v této studii HAQ DI (Health Assessment Questionnaire Disability Index), SF 36 (36 Item Short Form Survey) a skóre FACIT (Functional Assessment of Chronic Illness Therapy) pro hodnocení únavy.
Pacienti
Do studie byli zařazováni pacienti, kteří splňovali kritéria CASPAR (ClASsification criteria for Psoriatic Arthritis) pro PsA. Aktivita PsA byla definována jako tři a více oteklých kloubů, tři a více citlivých kloubů, dále zvýšená hodnota C reaktivního proteinu stanoveného vysoce senzitivní metodou (high sensitivity C reactive protein, hsCRP) nad normu nebo přítomnost jedné a více erozí na RTG. Dále patřilo mezi vstupní kritéria selhání léčby jedním konvenčním syntetickým DMARD. Vylučujícím kritériem byla předcházející léčba biologickými DMARDs nebo inhibitorem JAK. Pacienti také museli mít současnou nebo anamnestickou psoriázu.
Výsledky
Do studie bylo zařazeno celkem
1 704 pacientů. Demografická charakteristika pacientů, aktivita
jejich PsA i anamnestické údaje o předcházející
medikaci a komedikaci jsou uvedeny v tabulce 1.
Jednotlivá ramena studie se statisticky významně nelišila.
Průměrný věk byl 50−52 let, trvání PsA 6−6,2 roku,
entezitida byla přítomna u 57−63 % pacientů, současné
používání konvenčních syntetických DMARDs na začátku
studie uvádělo 81−82 % pacientů, průměrně bylo doloženo 11
oteklých kloubů, 20 citlivých kloubů, PASI 10−11.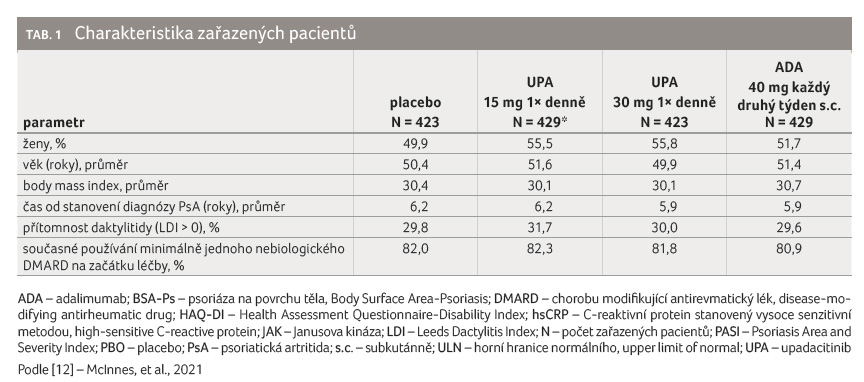
V týdnu 12 bylo odpovědi ACR 20
dosaženo u 70,6 % pacientů léčených 15 mg UPA, u 78,5 %
s dávkou 30 mg UPA, u 36, 2 % v placebové
skupině a u 65 % ve skupině adalimumabu.
Rozdíly mezi skupinami byly následující: UPA 15 mg vs. placebo
34,5 procentního bodu (95% CI 28,2−40,7, p < 0,001),
UPA 30 mg vs. placebo 42,3 procentního bodu (95% CI 36,3−48,3
p < 0,001) a UPA 15 mg vs. adalimumab
5,6 procentního bodu (95% CI 0,6−11,8, p < 0,001),
UPA 30 mg vs. adalimumab 13,5 procentního bodu (95% CI 7,5−19,4,
p < 0,001). Obě definované dávky UPA tedy
splnily předdefinovanou definici non inferiority oproti
adalimumabu. UPA 30 mg splnil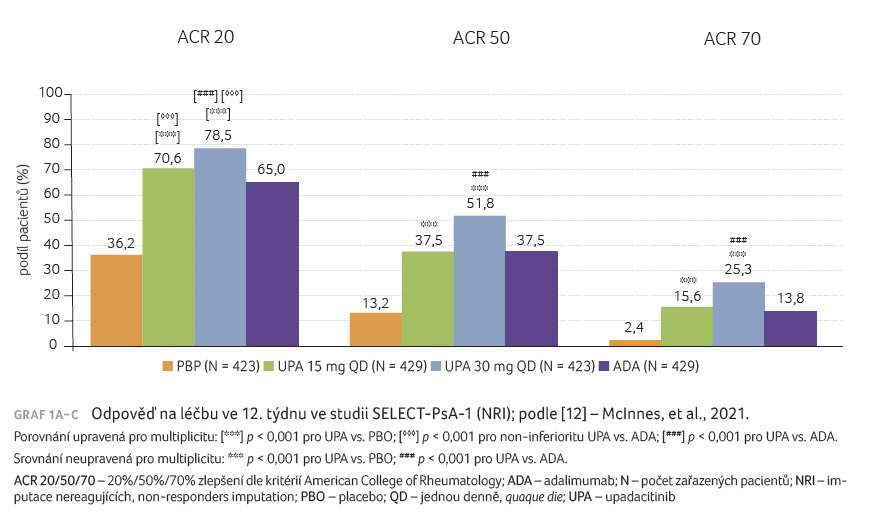 definici superiority oproti
adalimumabu v docílení odpovědi ACR 20, ale dávka 15 mg
UPA nebyla superiorní oproti adalimumabu (graf 1A−C). Další
sekundární cílové ukazatele, ve kterých byly UPA 15 mg
i UPA 30 mg signifikantně lepší než placebo, představovaly
změny skóre HAQ DI od počátku studie (graf 2),
podíl pacientů s hodnotou IGA (Investigator Global Assessment)
u psoriázy 0−1, podíl pacientů s PASI 75 (75% zlepšení
Psoriasis Area and Severity Index), změna rentgenového Sharpova
skóre modifikovaného dle van der Heijde (graf 3), procento
pacientů s minimální aktivitou nemoci (minimal disease
activity, MDA) (graf 4), změna skóre SF 36 a skóre
FACIT.
definici superiority oproti
adalimumabu v docílení odpovědi ACR 20, ale dávka 15 mg
UPA nebyla superiorní oproti adalimumabu (graf 1A−C). Další
sekundární cílové ukazatele, ve kterých byly UPA 15 mg
i UPA 30 mg signifikantně lepší než placebo, představovaly
změny skóre HAQ DI od počátku studie (graf 2),
podíl pacientů s hodnotou IGA (Investigator Global Assessment)
u psoriázy 0−1, podíl pacientů s PASI 75 (75% zlepšení
Psoriasis Area and Severity Index), změna rentgenového Sharpova
skóre modifikovaného dle van der Heijde (graf 3), procento
pacientů s minimální aktivitou nemoci (minimal disease
activity, MDA) (graf 4), změna skóre SF 36 a skóre
FACIT.
Bezpečnost léčby
V průběhu studie do 24. týdne
byl výskyt nežádoucích účinků, včetně závažných infekcí,
podobný při podávání dávky 15 mg UPA a adalimumabu,
ale byl častější při dávce 30 mg UPA. Nejčastějším
nežádoucím účinkem byly infekce dýchacího traktu. Závažné
infekce se vyskytly v 1,2 % u pacientů léčených UPA
15 mg, v 2,3 % při léčbě UPA 30 mg, v 0,9 % při
podávání placeba a v 0,7 % ve skupině
adalimumabu. Také oportunní infekce byly četnější, vyskytl se
jeden případ kandidové uretritidy při dávce UPA 15 mg a jeden
případ infekce Pneumocystis jirovecii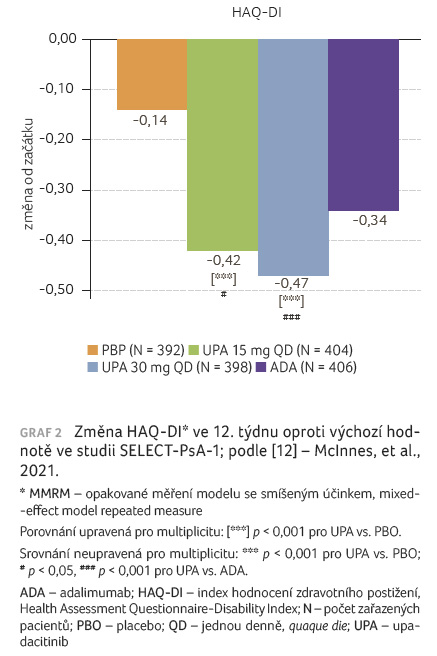 a cytomegalovirem
při UPA 30 mg. Herpes zoster byl diagnostikován u čtyř
pacientů léčených UPA 15 mg, u pěti pacientů ze skupiny
UPA 30 mg, u tří pacientů z placebové větve a nebyl
doložen u nikoho ze skupiny s adalimumabem. Žádný
signál nebyl zaznamenán u malignit. Nebyly zjištěny častější
kardiovaskulární nežádoucí účinky, vyskytl se ale jeden případ
plicního embolismu (PE) ve skupině UPA 30 mg a jeden
případ hluboké žilní trombózy (DVT) byl zaznamenán po placebu
a dva během léčby adalimumabem. Z laboratorních
ukazatelů nutno zmínit neutropenii, která byla častější po UPA
než po placebu. Výskyt stupně 3 závažnosti poklesu
počtu neutrofilů a lymfocytů byl vyšší ve skupině
UPA 30 mg. Z dalších laboratorních ukazatelů nutno zmínit
stupeň 3 a 4 zvýšení aktivity kreatinkinázy při podávání
UPA oproti placebu. Bylo také pozorováno častější zvýšení
hodnot LDL a HDL cholesterolu po UPA proti placebu, ale
celkový poměr LDL a HLD cholesterolu se nezměnil.
a cytomegalovirem
při UPA 30 mg. Herpes zoster byl diagnostikován u čtyř
pacientů léčených UPA 15 mg, u pěti pacientů ze skupiny
UPA 30 mg, u tří pacientů z placebové větve a nebyl
doložen u nikoho ze skupiny s adalimumabem. Žádný
signál nebyl zaznamenán u malignit. Nebyly zjištěny častější
kardiovaskulární nežádoucí účinky, vyskytl se ale jeden případ
plicního embolismu (PE) ve skupině UPA 30 mg a jeden
případ hluboké žilní trombózy (DVT) byl zaznamenán po placebu
a dva během léčby adalimumabem. Z laboratorních
ukazatelů nutno zmínit neutropenii, která byla častější po UPA
než po placebu. Výskyt stupně 3 závažnosti poklesu
počtu neutrofilů a lymfocytů byl vyšší ve skupině
UPA 30 mg. Z dalších laboratorních ukazatelů nutno zmínit
stupeň 3 a 4 zvýšení aktivity kreatinkinázy při podávání
UPA oproti placebu. Bylo také pozorováno častější zvýšení
hodnot LDL a HDL cholesterolu po UPA proti placebu, ale
celkový poměr LDL a HLD cholesterolu se nezměnil.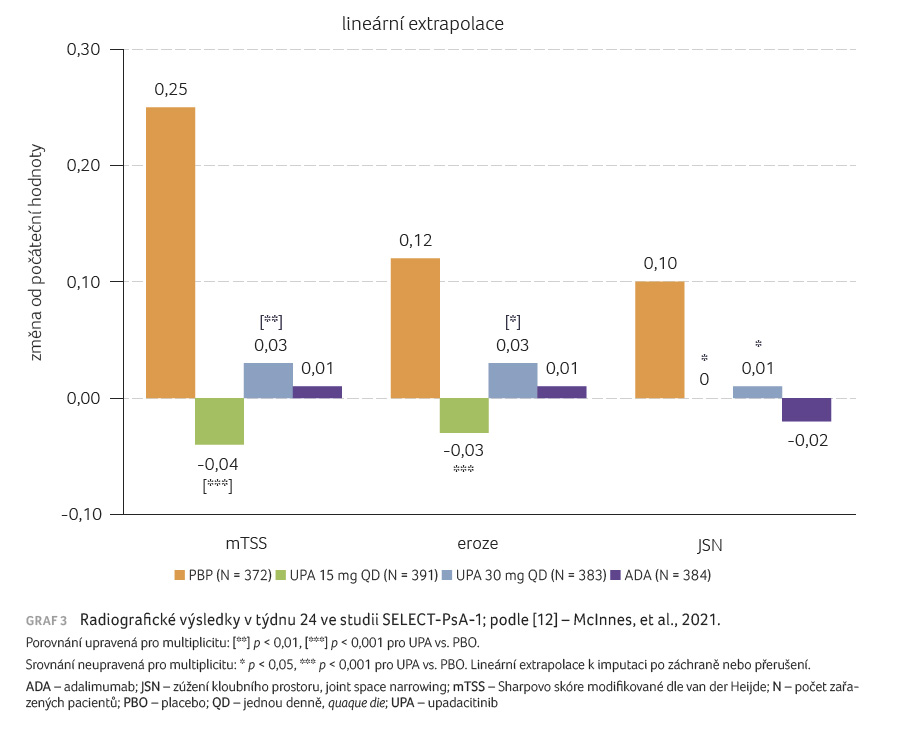
Diskuse
Studie SELECT-PsA-1 prokázala, že nový selektivní inhibitor JAK1 upadacitinib je účinným lékem pro PsA, dávka 15 mg i dávka 30 mg byly účinnější než placebo. Výsledky byly signifikantně lepší u všech ukazatelů posuzujících muskuloskeletální příznaky včetně hodnocení aktivity PsA, docílení minimální aktivity nemoci, potlačení entezitidy, daktylitidy, únavnosti, zlepšení funkce, ale též ovlivnění vlastní psoriázy a dále zpomalení rentgenové progrese PsA. Lze tedy hovořit o komplexním chorobu modifikujícím efektu na PsA.
Ve studii byla také větev
s aktivním komparátorem adalimumabem. Obě dávky
upadacitinibu splnily oproti adalimumabu kritéria non inferiority.
Dávka 30 mg pak oproti adalimumabu splnila kritéria superiority.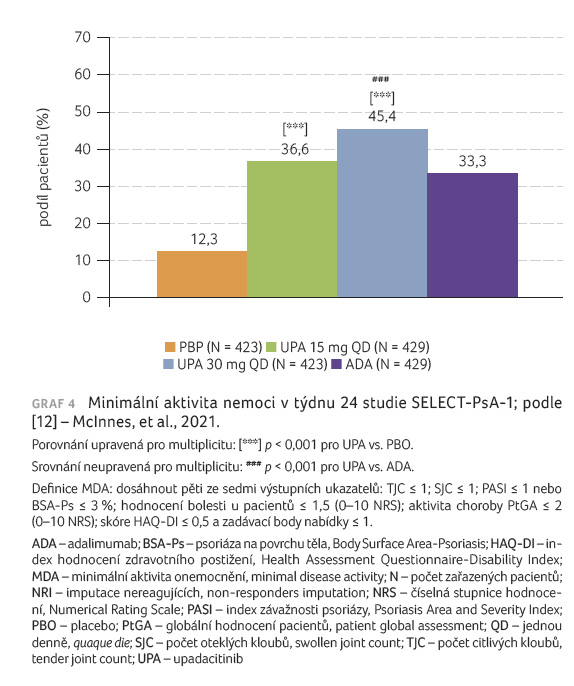
Bezpečnostní profil upadacitinibu byl všeobecně obdobný jako ve studiích s upadacitinibem u revmatoidní artritidy, ale vzhledem k heterogenitě studií není srovnání možné. Je však nutné poukázat na vyšší výskyt závažných infekcí ve skupině s dávkou upadacitinibu 30 mg. Byl také zaznamenán hraničně signifikantně vyšší výskyt herpes zoster. V integrované analýze tří studií s upadacitinibem bylo ve skupině UPA 15 mg 7 (1,1 %) případů, po placebu 5 (0,8 %), po UPA 30 mg 13 (2 %) a po adalimumabu 0 výskytů.
Dalším sledovaným nežádoucím účinkem byl výskyt DVE a PE. Jedna PE se vyskytla ve skupině UPA 30 mg, jeden případ DVE byl ve skupině s placebem a dvě ve skupině s adalimumabem. Ani integrovaná analýza tří kohortových studií s UPA zvýšené riziko DVE a PE neprokázala [13]. Otázka zvýšeného rizika DVT a PE po všech inhibitorech JAK je stále předmětem výzkumu. Např. jedna kohortová studie s tofacitinibem u pacientů starších 50 let s jedním kardiovaskulárním rizikovým faktorem prokázala zvýšené riziko venózního tromboembolismu (VTE) a plicního embolismu [14], zatímco nová studie ze Spojených států amerických, která integrovala tři velké databáze zdravotních pojišťoven, zvýšené riziko VTE a PE při podávání inhibitorů JAK oproti anti TNF léčbě neprokázala [15].
Z dalších nežádoucích účinků je možné zmínit častější výskyt abnormalit výsledků jaterních testů po léčbě UPA 30 mg. Dále pak mírně vyšší výskyt případů se závažnějším vzestupem hodnot kreatininu.
Podobně jako při léčbě dalšími inhibitory JAK a IL 6 byl zaznamenán častější vzestup hodnot LDL i HDL cholesterolu, přičemž ale poměr HDL/LDL zůstával nezměněn. Změny ve spektru lipidů zatím také nevedly ke zvýšení rizika velkých kardiovaskulárních příhod (tzv. MACE).
Závěrem je možné konstatovat, že upadacitinib má u psoriatické artritidy dobrý poměr účinnosti a bezpečnosti a může představovat novou alternativu léčby PsA. Výhodou oproti biologickým DMARDs může být perorální podávání a absence imunogenicity.
Práce byla podpořena projektem koncepčního rozvoje Ministerstva zdravotnictví ČR výzkumné organizace 00023728 Revmatologický ústav.
Seznam použité literatury
- [1] Ritchlin CT, Colbert RA, Gladman DD. Psoriatic arthritis. N Engl J Med 2017; 376: 957−970.
- [2] Fernandez‑Carballido C, Martín‑Martínez MA, García‑Gómez C, et al. Impact of comorbidity on physical function in patients with ankylosing spondylitis and psoriatic arthritis attending rheumatology clinics. Results from cardiovascular in rheumatology (CARMA) study. Arthritis Care Res 2020; 72: 822−828.
- [3] Mease PJ, Gladmann DD, Collier DH, et al. Etanercept and MTX as monotherapy or in combination for psoriatic arthritis: primary results from randomized, controlled trial phase III trial. Arthritis Rheumatol 2019; 71: 1112−1124.
- [4] McInnes IB, Mease PJ, Kirkham B, et al. Secukinumab, a human anti‑interleukin‑17 monoclonal antibody in patients with psoriatic arthritis (FUTURE 2) a randomised, double blind, placebo controlled phase 3 trial. Lancet 2015; 386: 1137−1146.
- [5] Cahndran V, van der Heijde D, Fleischmann R, et al. Ixekizumab treatment of biologic naive patients with active psoriatic arthritis: 3 year results from a phase III. Clinical trial (SPIRIT‑P2). Rheumatology 2020; 59: 2774−2784.
- [6] Ritchlin C, Rahman P, Kavanaugh A, et al. Efficacy and safety of the anti IL‑12/23 p 40 monoclonal antibody, ustekinumab in patients with active psoriatic arthritis despite conventional non‑biological anti‑tumour necrosis factor therapy: 6‑months and 1 year results of the phase 3, multicentre, double blind, placebo controlled randomised PSUMMIT 2 trial. Ann Rheum Dis 2014; 73: 990−999.
- [7] Tanaka Y. The JAK inhibitors: do they bring a paradigm shift for the management of rheumatic diseases? Rheumatology 2019; 58(Suppl.1): i1−i13.
- [8] Hammitzsch A, Lorenz G, Moog P, et al. Impact of Janus Kinase inhibition on treatment of axial spondyloarthritis. Front Immunol 2020; 11: 591176.
- [9] Sherlock JP, Joyce‑Shaikh B, Turner SP, et al. IL‑23 induces spondyloarthropathy by acting on ROR‑gama T+ CD3+ CD4.CD8 entheseal resident T cells. Nat Med 2012; 18: 1069−1076.
- [10] Fleischmann R, Pangan AL, Song I‑H, et al. Upadacitinib versus placebo or adalimumab in patients with rheumatoid arthritis and an inadequate response to methotrexate: results of a phase III, double‑blind, randomized controlled trial. Arthritis Rheumatol 2019; 71: 1788−1800.
- [11] van der Heijde D, Siong IH, Pangan AL, et al. Efficacy and safety if upadacitinib in patients with active ankylosing spondylitis (SELECT‑AXIS 1) a multicentre, randomised double blind, placebo‑controlled, phase 2/3 trial. Lancet 2019; 394: 2108−2117.
- [12] McInnes IB, Anderson JK, Magrey M, et al. Trial of upadacitinib and adalimumab for psoriatic arthritis. N Engl J Med 2021; 384: 1227−1239.
- [13] Cohen SB, Van Vollenhoven R, Curtis JR, et al. Safety profile of upadacitinib up to 3 years of exposure in patients with rheumatoid arthritis. Ann Rheum Dis 2020; 79(Suppl. 1): 315.
- [14] Tisková zpráva Pfizer, 2021
- [15] Desai RJ, Pawar A, Khosrow‑Khavar F, et al. Risk of venous thromboembolism associated with tofacitinib in patients with rheumatoid arthritis: a population‑based cohort study. Rheumatology 2021; doi: 10.1093/rheumatology/keab294.