Variabilita hladin hemoglobinu u nemocných s chronickým onemocněním ledvin a její vliv na mortalitu
Variabilita hladin hemoglobinu, kterou lze také vnímat jako kolísání v koncentracích hemoglobinu, je jev, s nímž se setkáváme u nemocných se selháním ledvin léčených erytropoézu stimulujícími léky nebo železem velmi často. Výkyvy v koncentraci hemoglobinu jsou dány jeho fyziologickým kolísáním a podmínkami, za nichž se měří. Doposud se jako nejčastější parametry pro vyjádření variability hladin hemoglobinu používala fluktuace hladin hemoglobinu (výkyv v koncentracích hemoglobinu mimo stanovenou mez – nad či pod cílové rozmezí) nebo tzv. cycling hemoglobinu. Cycling hemoglobinu, který je již klinicky významný, znamená změnu v koncentraci hemoglobinu větší než 15 g/l, která trvá po dobu minimálně 8 týdnů. Variabilitu hladin hemoglobinu lze ale posuzovat i podle řady dalších parametrů, které mají větší či menší vztah k mortalitě léčených nemocných. Řada prací prokazuje, že celková mortalita nemocných a riziko hospitalizace se zvyšuje až dvojnásobně u pacientů, u kterých je koncentrace hemoglobinu trvale vychýlena směrem dolů, tedy je nižší než doporučovaná dolní mez (110 g/l). Velká variabilita hladin hemoglobinu se vyskytuje zejména u pacientů, kde zahajujeme terapii erytropoézu stimulu-jícími léky nebo železem. Neadekvátní dávky těchto léků, časté úpravy dávkování a frekvence jejich podávání nebo snaha dosáhnout cílových hodnot hemoglobinu co nejdříve jsou příčinou toho, že se variabilita objevuje. U nemocných s dlouhodobě zavedenou léčbou je zjištění přítomnosti cyclingu hemoglobinu vždy důvodem k tomu, abychom pátrali po možné příčině jeho vzniku a tu se snažili odstranit (krevní ztráty, malignita, nedostatečná suplementace železem, infekce s vysokými hladinami hepcidinu, malnutrice a další). Důležité pro snížení incidence variability hladin hemoglobinu je respektovat zákonitosti erytropoézy a pokusit se léčbu co nejvíce přiblížit fyziologickým pochodům ve zdravém organismu.
Úvod
Anémie je častou komplikací chronických onemocnění ledvin (CKD), zejména při jejich terminálním selhání. Zavedení erytropoézu stimulujících léků (ESA) do léčby těchto nemocných výrazně snížilo potřebu podávat jim transfuze krve a zlepšilo kvalitu jejich života [1]. O cílových hodnotách hemoglo-binu (Hb) u nemocných s CKD se stále ještě diskutuje. Nebo lépe řečeno, opět diskutuje. Evropská doporučení pro léčbu anémie z roku 2004 doporučují udržovat hladinu Hb v rozmezí 110–130 g/l, přičemž u nemocných se srdečním selháváním, u diabetiků a nemocných s ischemickou chorobou dolních končetin má být dosaženo cílové hladiny Hb mezi 110–120 g/l [2]. Za jednoznačně nežádoucí je pak po-važován vzestup koncentrace Hb nad 140 g/l. Doporučení EMA (European Medicines Agency) z roku 2008 pak navrhují cílové hodnoty Hb mezi 100–120 g/l a koncentrace Hb při léčbě by neměla přesáhnout 120 g/l. Americká doporučení mají jako cílové hodnoty stanoveny koncentrace Hb 110–120 g/l s tím, že nedoporučují při korekci anémie překročit koncentraci Hb vyšší než 130 g/l [3]. Jisté je, že snaha o normalizaci hodnot Hb na úroveň zdravých jedinců není podle výsledků studií z poslední doby spojena se snížením morbidity/mortality, spíše naopak [4–6]. Očekává se proto, že pro cílové hodnoty Hb budou v nejbližší době stanoveny hranice nižší než doposud. Americká FDA (Food and Drug Administration) dokonce v červnu 2011 vydala doporučení, aby se léčba anémie u dialyzovaných nemocných zahajovala až při poklesu koncentrace Hb pod 100 g/l a aby se léčba ukončovala při překročení koncentrace hemoglobinu 110 g/l. Velký důraz je kladen na indivi-duální přístup k jednotlivým nemocným, kdy je potřeba zohlednit jejich celkový stav, adaptaci na anémii, komorbidity a vykonávanou fyzickou aktivitu.
Anémie obecně vede k hypoxii ve tkáních, která je hlavním stimulem pro zvýšení produkce erytropoetinu (EPO) ledvinami. Zvýšená sekrece EPO trvá do té doby, než dojde k úpravě hladiny Hb. Endogenní sekrece je kontinuální proces a koncentrace EPO opakovaně měřené v séru mají prakticky tvar přímky, jejíž sklon je dán délkou trvání anémie a její závažností. Jedním ze základních rozdílů, kterými se liší působení endogenního EPO na prekurzorové buňky v kostní dřeni zdravých jedinců a těch s CKD léčených ESA, je kolísání koncentrací EPO a s tím spojená variabilita hladin Hb. Toto kolísání v koncentracích Hb je velmi častým jevem u nemocných léčených ESA, a to zejména těch na hemodialýze (HD). Postiženi bývají především nemocní krátce po zahájení dialyzační léčby. Tato skutečnost není až tak překvapivá, protože velká část nemocných v predialýze (nemocní s CKD stadia 4 a 5 dosud neléčení dialýzou) není ESA léčena vůbec a vstupuje do HD léčení s poměrně níz-kými hodnotami Hb a malými zásobami železa. Jedna z retrospektivních multicentrických studií sledujících 4333 nemocných zahajujících dialyzační léčbu ukázala, že 68 % pacientů mělo při prvním vyšetření na dialyzační jednotce koncentraci Hb < 110 g/l [7]. Další skutečností je fakt, že se stále více do chronické HD léčby zařazují nemocní s celou řadou komorbidit, které se podílejí na zhoršené utilizaci železa a relativní rezistenci na léčbu ESA. K varia-bilitě hladin Hb může také přispívat příliš časté zvyšování dávek ESA, aniž bychom vyčkali efektu již podané terapie. To pak může vést k „přestřelení“ koncentrací Hb nad horní hranici doporučených hodnot [8].
Definice variability hladin hemoglobinu
Variabilitu hladin Hb, kterou označili jako cycling Hb, poprvé popsali Fishbane a Berns v roce 2005 [9]. Cycling Hb byl definován jako oscilace Hb od průměrné křivky Hb, která musí mít amplitudu větší než 15 g/l (rozdíl mezi nejnižší a nejvyšší naměřenou hodnotou Hb) a tato oscilace v koncentraci Hb musí trvat nejméně 8 tý-dnů (tzn. že po dobu 8 týdnů dojde ke změně v koncentraci Hb o více než 15 g/l). Poté se Hb vrací na průměrné hodnoty u daného nemocného. Autoři v tomto článku vyhodnocovali výskyt cyclingu Hb během 1 roku HD léčby u 281 nemocných. Zjistili, že výkyvy v koncentraci Hb nad stanovené limity (110–125 g/l) trpělo více než 90 % pacientů. U nemocných se vyskytl průměrný počet výkyvů koncen-trací Hb mimo doporučené meze 3,1 Ī 1,1krát za rok a průměrná amplituda výkyvu byla 25 g/l. Nejčastějšími faktory, které ovlivňovaly výkyv koncentrace Hb směrem nad doporučenou mez, byly: zvýšení dávky podávaného ESA (u 84 % případů), zahájení léčby intravenózním železem (u 27 %), propuštění z nemocnice (u 36 %). Naopak mezi faktory ovlivňující výkyv koncentrace Hb směrem dolů patřily: snížení dávky ESA (u 62 %) či setrvání v léčbě stávajícími dávkami (u 15 %), infekce (u 6 %), ukončení parenterální aplikace železa (5 %) a hospitalizace (u 14 %).
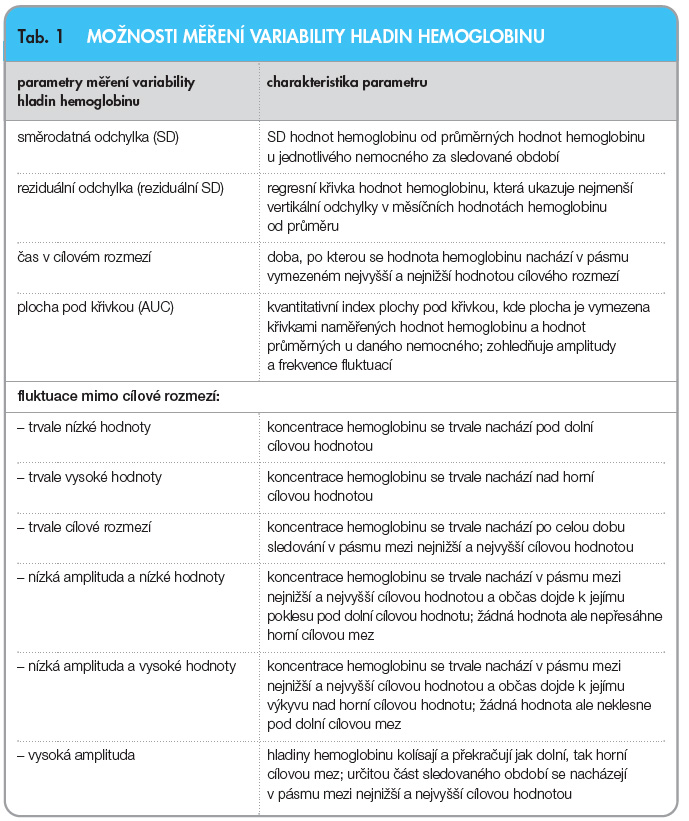 Variabilita hladin Hb se dá posuzovat podle různých parametrů (tab. 1). Pro lepší odhad variability je ideální kombinovat více těchto parametrů dohromady, jelikož tím získáváme lepší představu o tom, co se s koncentracemi Hb ve sledovaném období dělo. Posuzování SD (směrodatné odchylky) hodnot Hb od průměrných hodnot Hb u jednotlivého nemocného za sledované období představuje nejjednodušší metodu, která ale neumožňuje posoudit směr vývoje a celkové trendy ve změnách hladin Hb. Lepší metodou v tomto směru je měření „reziduální SD“. Tato regresní křivka hodnot Hb ukazuje výkyvy hodnot Hb v časovém úseku. Regresní křivka Hb je přímka, která ukazuje nejmenší vertikální odchylky v měsíčních hodnotách Hb od průměru. Její vertikální sklon ukazuje na trend ve vývoji hladin Hb u daného jedince. Má-li křivka horizontální průběh, znamená to, že malé výkyvy směrem nahoru či dolů od průměru jsou v rovnováze a reziduální SD bude nula. Naopak pozitivní vertikální sklon křivky směrem nahoru je způsoben rychlým nárůstem hladin Hb [10]. Dalšími možnostmi, jak stanovovat variabilitu hladin Hb, je určování amplitudy výchylky mimo cílové rozmezí, její frekvenci či délku trvání. Při stanovení fluktuace hodnot mimo cílové rozmezí mohou nastat následující situace: a) trvale nízké hodnoty, b) trvale vysoké hodnoty, c) setrvávání v cílovém rozmezí hodnot, d) nízká amplituda a nízké hodnoty, e) nízká amplituda a vysoké hodnoty, f) vysoká amplituda. Určitou další možností, jak vyjadřovat variabilitu hladin Hb, je čas strávený v cílovém rozmezí („time-in-target“). Cílové rozmezí závisí na doporučených postupech, jimiž se v dané zemi odborná veřejnost řídí či které jsou někde dány regulacemi zdravotních pojišťoven. Většinou se pohybuje mezi 100–120 (125) g/l.
Variabilita hladin Hb se dá posuzovat podle různých parametrů (tab. 1). Pro lepší odhad variability je ideální kombinovat více těchto parametrů dohromady, jelikož tím získáváme lepší představu o tom, co se s koncentracemi Hb ve sledovaném období dělo. Posuzování SD (směrodatné odchylky) hodnot Hb od průměrných hodnot Hb u jednotlivého nemocného za sledované období představuje nejjednodušší metodu, která ale neumožňuje posoudit směr vývoje a celkové trendy ve změnách hladin Hb. Lepší metodou v tomto směru je měření „reziduální SD“. Tato regresní křivka hodnot Hb ukazuje výkyvy hodnot Hb v časovém úseku. Regresní křivka Hb je přímka, která ukazuje nejmenší vertikální odchylky v měsíčních hodnotách Hb od průměru. Její vertikální sklon ukazuje na trend ve vývoji hladin Hb u daného jedince. Má-li křivka horizontální průběh, znamená to, že malé výkyvy směrem nahoru či dolů od průměru jsou v rovnováze a reziduální SD bude nula. Naopak pozitivní vertikální sklon křivky směrem nahoru je způsoben rychlým nárůstem hladin Hb [10]. Dalšími možnostmi, jak stanovovat variabilitu hladin Hb, je určování amplitudy výchylky mimo cílové rozmezí, její frekvenci či délku trvání. Při stanovení fluktuace hodnot mimo cílové rozmezí mohou nastat následující situace: a) trvale nízké hodnoty, b) trvale vysoké hodnoty, c) setrvávání v cílovém rozmezí hodnot, d) nízká amplituda a nízké hodnoty, e) nízká amplituda a vysoké hodnoty, f) vysoká amplituda. Určitou další možností, jak vyjadřovat variabilitu hladin Hb, je čas strávený v cílovém rozmezí („time-in-target“). Cílové rozmezí závisí na doporučených postupech, jimiž se v dané zemi odborná veřejnost řídí či které jsou někde dány regulacemi zdravotních pojišťoven. Většinou se pohybuje mezi 100–120 (125) g/l.
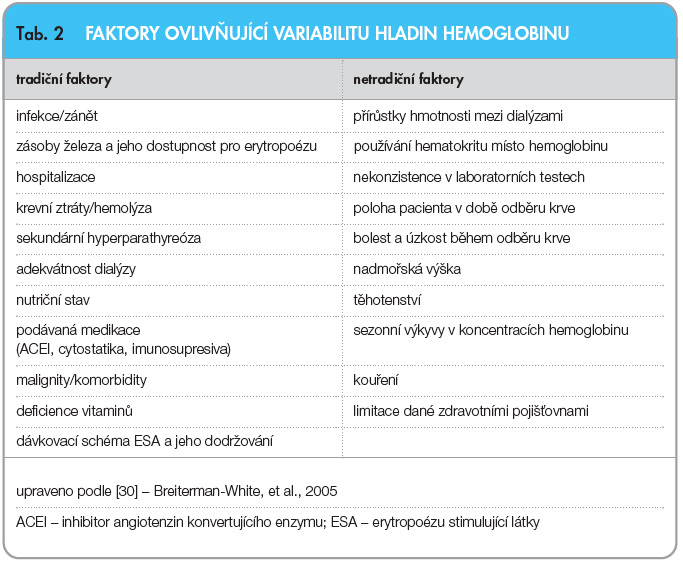 Je tedy vidět, že možností, jak posuzovat kolísání hladin Hb, je řada. U určitého konkrétního pacienta pak hodnoty Hb většinou mírně oscilují kolem svého průměru (který je buď vyšší, či naopak nižší – v závislosti na komorbiditách, medikaci a dalších faktorech) a větší výkyvy splňující kritéria cyclingu se objevují až při určitých zásazích zvenku (viz výčet faktorů ovlivňujících variabilitu Hb, tab. 2).
Je tedy vidět, že možností, jak posuzovat kolísání hladin Hb, je řada. U určitého konkrétního pacienta pak hodnoty Hb většinou mírně oscilují kolem svého průměru (který je buď vyšší, či naopak nižší – v závislosti na komorbiditách, medikaci a dalších faktorech) a větší výkyvy splňující kritéria cyclingu se objevují až při určitých zásazích zvenku (viz výčet faktorů ovlivňujících variabilitu Hb, tab. 2).
Pravou variabilitu v koncentracích hemo-globinu je nutné odlišit od chyby, kterou je zatíženo opakované laboratorní měření koncentrací Hb. Každá laboratoř pracuje s určitou analytickou chybou, jejíž velikost je třeba znát a počítat s ní [11]. Koncentraci Hb také ovlivní správně provedený odběr krve a doba, kdy se odběr provádí (v závislosti na dni v týdnu ve vztahu k provedené dialýze). Tyto skutečnosti mohou ovlivnit změnu koncentrace Hb zhruba o 4 %.
Prevalence variability hladin hemoglobinu
Ve třech amerických studiích byl výskyt trvale nízkých hladin Hb (< 110 g/l) zaznamenán jen u 2 % nemocných, 5,9–6,5 % nemocných mělo hladiny v cílovém rozmezí a u méně než 3 % nemocných byly zjištěny trvale vysoké hladiny Hb (> 130 g/l) [10, 12, 13]. Nízká amplituda a nízké hodnoty Hb byly zaznamenány u 14,8–21,3 % pacientů a nízká amplituda a vysoké hladi-ny Hb u 28,9–36,4 % nemocných. Kolem 40 % nemocných pak mělo vysokou amplitudu hladin Hb (tedy SD ≥ 15 g/l). Ve studii na evropské populaci bylo rozložení ve fluktuaci výrazně jiné. Trvale nízké či vysoké hladiny Hb mělo 6,9 % nemocných, 32,9 % nemocných se ocitlo v kategorii nízká amplituda a nízký Hb a 24,9 % se nacházelo ve třídě nízká amplituda a vysoký Hb [14]. O poznání méně nemocných bylo v kategorii vysoká amplituda (23,1 %). Tato skutečnost svědčí pro fakt, že v Evropě trpí nemocní nižší fluktuací hladin Hb (jejich hladiny Hb jsou tedy konstantnější), ale celkově více nemocných se nachází spíše na úrovni nižších hladin Hb, což koresponduje s faktem, že v USA dostávají nemocní vyšší dávky ESA v porovnání s Evropou (často i přes skutečnost hyporesponzivity na ESA) [15]. Jedním ze základních nedostatků řady studií na toto téma je metodika měření této variability, respektive relevance jednotlivých měřených parametrů pro klinickou praxi.
Variabilita hladin Hb se zdá být častější u nemocných v USA či v ekonomicky vyspělých státech, zatímco v Evropě (zejména střední a východní) vzhledem k určitým finančním regulacím je dostupnost ESA omezena a nárůst hodnot Hb (závislý především na podávané dávce ESA) u řady pacientů je pozvolnější s menšími výkyvy v jeho koncentracích [14].
Vliv variability hladin hemoglobinu na kardiovaskulární a celkovou mortalitu
Jedním z prvních parametrů, který vyhodnocoval vliv koncentrace Hb na celkovou či kardiovaskulární mortalitu, byla koncentrace Hb v cílovém rozmezí, resp. přesahující dolní stanovenou mez. Za tuto hranici se stále považuje koncentrace Hb > 110 g/l. Studie DOPPS sledovala prů-řezově koncentrace Hb u dialyzovaných nemocných v 7 evropských zemích mezi roky 2002–2003 a ukázala, že hodnot Hb > 110 g/l dosahuje trvale jen 55–77 % nemocných, u ostatních hodnoty Hb kolísají pod cílovou hranici [15]. Ukázala také, že intraindividuální variabilita hodnot Hb měřená pomocí SD byla největší u nemocných s hladinami Hb < 100 g/l (SD 13 g/l), nejnižší SD pak byla u nemocných s hladinami Hb pohybujícími se v rozmezí 110–119 g/l. Tato studie také ukázala, že u nemocných ve věku 18–65 let, jejichž hladiny Hb jsou trvale nižší než 100 g/l, exis-tuje o 51 % vyšší riziko úmrtí než ve skupině s hodnotami Hb 110–119 g/l. U lidí starších 65 let tento rozdíl již nebyl tak významný (RR úmrtí se zvýšilo jen o 11 %). Data z USA nejsou o moc příznivější. Studie z roku 2000 ukázala, že u více než 60 % nemocných se hladina Hb pohy-buje mimo cílové doporučené hodnoty 110–120 g/l [16], či dokonce že jen 22 % pacientů má hladinu Hb konzistentně vyšší než 110 g/l [17]. V této studii také autoři ukázali, že hodnoty Hb trvale nižší než 90 g/l jsou spojeny s dvojnásobným rizikem úmrtí oproti hodnotám pohybu-jícím se v cílovém rozmezí. Stejný autor sledoval kohortu 41 000 dialyzovaných nemocných po dobu 2 let a zjišťoval vliv snížených hladin Hb na celkovou a kardiovaskulární mortalitu a na riziko hospitalizace [18]. Pokud nemocní strávili 1–20 % času během sledovaného období s hodnotami Hb < 110 g/l, zvýšilo se jejich riziko úmrtí o 10 % oproti těm, kteří měli po celou dobu sledování koncentraci Hb > 110 g/l. Pokud nemocní strávili v nízké koncentraci Hb 81–100 % času, pak se jejich riziko úmrtí zvýšilo prakticky dvojnásobně. Ve skupině nemocných s kardiovaskulárním onemocněním v anamnéze se riziko úmrtí začalo zvyšovat tehdy, jestliže strávili v nízké koncentraci Hb více než 20 % sledovaného času.
Studie Brunelliho z roku 2008 ukázala, že každá změna v hladině Hb o 10 g/l je spojena se vzestupem rizika celkové mortality o 93 % (HR 1,93; 95% CI: 1,20–3,10) [19]. Současně ale neprokázala, že by mortalita stoupala v závislosti na absolutní výši Hb či na trendu ke zvýšení koncentrací Hb. Jiná práce, z roku 2007, zjistila, že zvýšení reziduální SD o více než 10 g/l zvyšuje riziko úmrtí až o 33 % [20].
Novější studie jsou již sofistikovanější a kromě identifikace rizikových faktorů pro variabilitu Hb používají i řadu různých parametrů a jejich kombinace pro její posouzení. Jedna z velkých studií z poslední doby, která měla za cíl identifikovat rizikové faktory pro variabilitu hladin Hb a dále posoudit její vliv na celkovou mortalitu, byla studie ARO CKD (Analyzing data, Reco-gnizing excellence, Optimizing outcomes) [14]. Do studie bylo zařazeno 5037 nemocných léčených HD, kteří pocházeli z 11 zemí Evropy. Ze studie byli vyčleněni nemocní s epizodou akutního krvácení či nutnosti podání krevní transfuze v době screeningu. Variabilita hladin Hb byla posuzována různými metodami: pomocí stanovení SD od průměrných hodnot nemocného (nejnižší kvartil představovala SD < 5,5 g/l, nejvyšší kvartil SD ≥ 11,6 g/l), reziduální SD, čas strávený v cílovém rozmezí a fluktuace mimo cílové hodnoty. Jako cílové hodnoty byly stanoveny hladiny Hb v rozmezí 110–125 g/l. Hodnoty amplitudy a frekvence fluktuací byly měřeny pomocí nového parametru jako plocha pod křivkou (AUC), přičemž plocha byla vymezena křivkou naměřených hodnot a hodnot průměrných u daného nemocného. AUC ve výsledku pozitivně korelovala s SD (r = 0,85; p < 0,01) i reziduální SD (r = 0,88; p < 0,01), negativní korelace pak byla zaznamenána mezi AUC a časem stráveným v cílovém rozmezí (r = -0,17; p < 0,01). Výsledky z AUC dobře korespondovaly s fluktuací hodnot mimo rozmezí; pacienti, jejichž hodnoty se dlouhodobě pohybovaly v cílovém rozmezí, měli nejnižší medián AUC (350 g/l x počet dní), zatímco nemocní s vysokou amplitudou měli největší medián AUC (1070 g/l x počet dní) a současně i největší rozptyl hodnot AUC (od 310 do 3900 g/l x počet dní). Čas strávený v cílovém rozmezí byl nejdelší u skupiny s nízkou amplitudou a současně s vysokými hodnotami Hb (85 x 50 dní), nejkratší byl u skupiny s vysokou ampli-tudou (73 x 36 dní). Incidentní nemocní (pacienti zařazení do dialyzačního programu po dobu 6 nebo méně měsíců) měli prokazatelně vyšší variabilitu v hladinách Hb a současně delší čas strávili s hladi-nami Hb pohybujícími se pod cílovým rozmezím (< 110 g/l Hb) v porovnání s prevalentními nemocnými. Pacienti v nejvyšším kvartilu AUC byli mladší, hubenější a častěji trpěli diabetem v porovnání s nemocnými v nejnižším kvartilu (a tedy těmi s nejmenší fluktuací hladin Hb). Zároveň tito nemocní častěji patřili do skupiny incidentních nemocných s dočasným cévním přístupem, který se často měnil. Současně měli nižší hodnoty parathormonu a častěji dostávali léky na kardiovaskulární onemocnění nebo ESA. Tato skupina nemocných byla také 3krát častěji hospitalizována než nemocní, kteří byli v nejnižším kvartilu AUC. V multivariantní logistické regresi se jako rizikové faktory pro vysokou variabilitu Hb ukázaly: věk < 30 let, nízké BMI, nemocný léčený HD méně než 6 měsíců, změny v cévním přístupu, používání katétrů, koncentrace Hb < 110 g/l, terapie ESA, terapie ACEI/sartany a hospitalizace.
Průměrná doba sledování nemocných byla 12,4 měsíce. Během sledování zemře-lo celkem 551 nemocných, z toho 220 (40 %) na kardiovaskulární příčiny. Z nich pak 91 zemřelo na srdeční selhání, 32 na akutní infarkt myokardu a 45 na cévní mozkovou příhodu. V celém souboru nemocných nebyla prokázána závislost mortality na variabilitě hladin Hb, ať již tato byla posuzována kteroukoli z uvedených metod (SD, reziduální SD, čas strávený v cílovém rozmezí, AUC). Pokud se ale posuzovala fluktuace hladin Hb mimo cílové hodnoty, pak se tento jediný parametr na mortalitě podílel. Podle Kaplanovy-Meierovy křivky přežívání měly všechny skupiny s fluktuací hladin Hb mimo cílové rozmezí horší přežívání než nemocní, jejichž hodnoty se po celou dobu sledování nacházely v cílovém rozmezí. Podle multivariantní analýzy pak významně zvýšené riziko mortality bylo zaznamenáno u nemocných s konzistentně nízkými hladinami Hb a současně s nízkou amplitudou (HR 1,95) a u těch s trvale nízkými hladinami Hb (HR 2,85). Závěrem tedy autoři konstatovali, že variabilita hladin Hb u nemocných léčených dialýzou je častá, ale celkově nevede ke zvýšení mortality. Jediným faktorem, který zvyšuje riziko mortality, je pokles hladiny Hb pod hodnotu 110 g/l. Velkým nedostatkem této studie bylo sledování nemocných jen po dobu 12 měsíců, což je z hlediska posouzení mortality poměrně krátká doba. Určitým „unikátem“ studie je naopak zavedení nového parametru pro měření variability Hb, a to AUC. Výhodou této metody je skutečnost, že v jednom parametru jsou zahrnuty výsledky měření a sledování dvou údajů, a sice amplitudy výchylky v hladině Hb a frekvence jejího výskytu. Hodnota velmi dobře koreluje jak s individuální směrodatnou odchylkou, tak s reziduální směrodatnou odchylkou daného nemocného.
Z pohledu dlouhodobého vlivu variability hladin Hb na mortalitu nemocných byla zajímavější data prezentována kanadskými autory, kteří sledovali kohortu 154 HD nemocných po dobu 6 let [21]. Ve své studii se zaměřili na posouzení vlivu variability hladin Hb a změn v podávaných dávkách ESA na celkovou mortalitu nemocných. Autoři studie ukázali, že zvýšená mortalita je asociována s rychlejším nárůstem hladin Hb a s použitím vyšších dávek ESA, zatímco rychlejší pokles hladin Hb a dávek ESA mortalitu nemocných nezvyšuje. Každé zvýšení hodnot Hb o 1 g/l/tý-den je spojeno s adjustovaným HR o 1,23 (95% CI: 1,03–1,48; tedy riziko mortality se zvyšuje o 23 %), zatímco každé zvýšení dávky erytropoetinu alfa o 1000 IU má adjustované HR 1,12 (95% CI: 1,01–1,24; tedy riziko mortality se zvyšuje o 12 %). Toto riziko bylo závislé zejména na tom, jak často a o kolik jednotek se měnily dávky ESA.
Variabilita hladin Hb se nevyskytuje jen u dialyzovaných nemocných, ale je častým jevem i u nemocných v predialýze [22]. Autoři sledovali celkem 6165 pacientů z 22 center v 7 zemích po průměrnou dobu 34 měsíců; 49 % pacientů v této kohortě bylo léčeno ESA. Zajímavé bylo, že s varia-bilitou v hladinách Hb se setkali i u nemocných, kteří ESA léčeni nebyli. U nich byla reziduální SD v hladinách Hb 4,9 Ī 4,4 g/l, zatímco ve skupině léčené ESA to bylo 6,8 Ī 4,8 g/l. Stabilnější hodnoty Hb měli nemocní neléčení ESA (52,8 %) v porovnání s těmi, kteří ESA dostávali (26,8 %; p < 0,0001). Během sledování zahájilo dialyzační léčení více nemocných ze skupiny již léčené ESA oproti skupině neléčené (35,9 % vs. 23 %; p < 0,0001). Důvodem zřejmě byla skutečnost, že nemocní léčení ESA měli více komorbidit a byli v horším biologickém stavu (včetně anémie), o čemž vypovídala i potřeba zahájit léčbu ESA Variabilita hladin Hb byla celkově spojena s malým, ale signifikantním vzestupem rizika úmrtí v celé skupině nemocných. Nebyl prokázán vliv podávání ESA (či typ podávaného ESA) na celkové zvýšení mortali-ty. Autoři proto v závěru konstatují, že ne-lze jednoznačně potvrdit, že by variabilita Hb byla kauzálním důvodem zvýšené mortality, ale že příčiny mortality je nutné hledat ve faktorech, které k variabilitě vedou.
Léčebná opatření snižující variabilitu hladin hemoglobinu
Cycling Hb je jev nefyziologický, který se u zdravých osob nevyskytuje. U nemocných s anémií, která je korigována ESA, je to naopak jev velmi častý. Mnohem častěji se s ním setkáváme při zahájení léčby u ESA-naivních (dosud neléčených) nemocných a při podávání ESA s krátkým poločasem účinku. Zahájení léčby anémie těmito preparáty vede k nastartování erytropoézy, ale kolísání hladin EPO (v závislosti na frekvenci podávání ESA) může způsobit, že některé prekurzorové buňky během procesu erytropoézy podlehnou apoptóze, jejíž příčinou je nestálá a nedostatečně vysoká hladina EPO. Tato skutečnost pak způsobuje, že po určité době (která je nutná k vyzrání erytrocytů od pluripotentní progenitorové kmenové buňky až k retiku-locytu; obvykle 21 dní) klesne počet erytrocytů v periferní krvi a tím i hladina Hb. Aby k tomuto procesu nedocházelo, je nutné zajistit pokud možno stabilní a dostatečnou koncentraci EPO v organismu. A toho lze do-sáhnout podáváním ESA s delším poloča-sem účinku, které zajistí stabilnější hladiny EPO (respektive dlouhodobější a stabilnější stimulaci EPO receptorů). Při podávání epoe-tinů s krátkým biologickým poločasem se doporučuje spíše intravenózní aplikace, jelikož subkutánní podání vykazuje větší varia-bilitu ve vstřebávání léčiva [23].
Při korekci anémie a úpravách dávek ESA je také nutno mít na paměti dvě skutečnosti: změny v dávkách ESA či v intervalu jejich podávání by měly být co nejméně časté a tyto změny musí respektovat biologický poločas podávaných ESA. Navíc je nutné vždy vyčkat na to, než efekt podaných ESA můžeme zaznamenat la-boratorně či klinicky (tzn. minimálně 2–3 týdny). Příliš časté úpravy v dávkách ESA významně nahrávají vzniku cyclingu Hb, a proto bychom se jich měli jednoznačně vyvarovat.
Kromě vlivu dlouhodoběji působících ESA na stabilitu hladin Hb se ukazuje, že tyto přípravky přinášejí řadu dalších výhod pro nemocné (méně častá aplikace, menší nároky na skladovací prostory), ale i ekonomické úspory (v udržovací fázi se většinou ukazuje, že pro zajištění stabilní hladiny Hb je potřeba podávat menší dávky dlouhodoběji působících ESA; aplikace šetří čas zdravotnickému personálu a její skladování je také jednodušší) [24–26].
Kromě aplikace ESA ovlivňuje koncentraci Hb a její fluktuaci i celá řada dalších faktorů (tab. 2). Je to především zahájení aplikace železa či podniknutí kroků, které zvyšují jeho biologickou dostupnost (intravenózní podávání; podávání kyseliny askorbové po HD, která zvyšuje uvolňování železa z tkání; léčba zánětu snižuje koncentraci hepcidinu a zlepšuje uvolňování železa z makrofágů). Doplnění kyseliny listové, vitaminu B12 či podání L-karnitinu může být dalším faktorem ovlivňujícím koncentraci Hb, stejně jako změna dialyzačního režimu, léčby hyperparathyreózy, problémy s arteriovenózní fistulí, hospitalizace či infekce. S těmito všemi faktory je nutné počítat při korekci anémie a je nutné do určité míry předvídat, jak tato opatření či komplikace ovlivní koncentraci Hb, a tomu přizpůsobovat dávky podávaných ESA (například snížit dávku o 25 % při vzestupu hladin Hb nad horní mez cílové hodnoty při neměnném intervalu podání; zvýšit dávku o 25% při probíhajícím zánětu či krvácení; podávání ESA ale neukončovat) [27]. Důležité je také v iniciační fázi léčby častěji kontrolovat krevní obraz (alespoň 1krát za 2 týdny). Jedině tak je možné zajis-tit co nejmenší kolísání hladin Hb a snížit jeho variabilitu. Nesmírně důležité je také včas rozpoznat situaci, kdy nemocní ne-odpovídají dostatečně na adekvátní dávky podávaných ESA (tzv. hyporesponzi-vitu). Tento jev je často způsoben řadou exogenních faktorů, které je třeba vyloučit. Pomoci v odhalování tohoto jevu nám může stanovení indexu mezi podávanou dávkou ESA a hodnotami Hb (ESA/Hb index). Pokud je u daného nemocného tento index významně vyšší, než je průměr v ostatní populaci námi léčených nemocných, je nutné pátrat po příčině tohoto stavu [28]. Jinou alternativu představuje monitorace koncentrací Hb pomocí počítačem modulovaného algoritmu. Hb se měří prostřednictvím techniky Crit-Line během každé dialýzy a hodnoty jsou zaznamenávány počítačem. Pomocí speciálního programu se pak modulují trendy v pohybu hladin Hb a to umožní lékařům včas reagovat na jejich změny [29].
Shrnutí
Variabilita hladin Hb u nemocných s CKD léčených ESA je velmi častým jevem, který postihuje převážnou většinu pacientů. Ačkoli řada studií nepřinesla jednoznačné důkazy o škodlivosti tohoto jevu z pohledu celkové či kardiovaskulární mortality, potvrdil se předpoklad, že trvale nízké koncentrace Hb (< 110 g/l) a nízká amplituda s nízkými hodnotami Hb jsou spojeny se zvýšením rizika mortality [13]. Tuto skutečnost bychom měli mít na paměti a vyvarovat se jí. Hodnoty Hb vyšší než 130 g/l již u nemocných s CKD doporučovány nejsou a mohou být spojeny se zvýšeným výskytem cévních mozkových příhod či jiných komplikací.
Vysvětlení pojmů:
Variabilita – kolísání v koncentracích hemo-globinu.
Fluktuace – výkyv v koncentracích hemoglobinu mimo stanovenou mez (nad či pod cílové rozmezí).
Cycling – změna v koncentraci hemoglobinu vyšší než 15 g/l trvající po dobu minimálně 8 týdnů.
Seznam použité literatury
- [2] Locatelli F, Aljama P, Bárány P, et al. Revised European Best Practice Guidelines for the management of anaemia in patients with chronic renal failure. Nephrol Dial Transplant 2004; 19 (Suppl. 2): ii6–ii15.
- [3] KDOQI Clinical Practice Guidelines and Clinical Practice Recommendations for Anemia in Chronic Kidney Disease. AJKD 2006; 47 (Suppl. 3): S33–S53.
- [4] Eckardt KU, Macdougall I, Locatelli F, et al. Effects of epoetin beta on left ventricular mass in patients with chronic kidney disease: echocardiographic results from the CREATE study. J Am Soc Nephrol 2005; 16: 37A, THFC 172.
- [5] Singh AK, Szczech L, Tang KL, et al. Correction of anemia with epoetin alfa in chronic kidney disease. N Engl J Med 2006; 355: 2085–2098.
- [6] Pfeffer MA, Burdmann EA, Chen ChY, et al. A Trial of Darbepoetin Alfa in Type 2 Diabetes and Chronic Kidney Disease. N Engl J Med 2009; 361: 2019–2032.
- [7] Valderrábano F, Hörl WH, Macdougall IC, et al. PRE-dialysis survey on anaemia management. Nephrol Dial Transplant 2003; 18: 89–100.
- [8] Singh AK, Milford E, Fishbane S, et al. Managing anemia in dialysis patients: Hemoglobin cycling and overshoot. Kidney Int 2008; 74: 679–683.
- [9] Fishbane S, Berns JS. Hemoglobin cycling in hemodialysis patients treated with recombinant human erythropoietin. Kidney Int 2005; 68: 1337–1343.
- [10] Arneson TJ, Zaun D, Peng Y, et al. Comparison of methodologies to characterize haemoglobin variability in the US Medicare haemodialysis population. Nephrol Dial Transplant 2009; 24: 1378–1383.
- [11] Van Wyck DB, Alcorn H Jr, Gupta R. Analytical and Biological Variation in Measures of Anemia and Iron Status in Patients Treated With Main-tenance Hemodialysis. Am J Kidney Dis 2010; 56: 540–546.
- [12] Ebben JP, Gilbertson DT, Foley RN, et al. Hemo-globin level variability: Association with comorbidity, intercurrent events, and hospitalizations. CJASN 2006; 1: 1205–1210.
- [13] Gilbertson DT, Ebben JP, Foley RN, et al. Hemo-globin level variability: Association with morta-lity. CJASN 2008; 3: 133–138.
- [14] Eckardt KU, Kim J, Kronenberg F, et al. Hemo-globin variability does not predict mortality in European hemodialysis patients. JASN 2010; 21: 1765–1775.
- [15] Pisoni RL, Bragg-Gresham JL, Young EW, et al. Anemia management and outcomes from 12 countries in the Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis 2004; 44: 94–111.
- [16] Lacson E, Jr, Ofsthun N, Lazarus JM. Effect of variability in anemia management on hemoglobin outcomes in ESRD. Am J Kidney Dis 2003; 41: 111–124.
- [17] Ofsthun N, Labrecque J, Lacson E, et al. The effects of higher hemoglobin levels on mortality and hospitalization in hemodialysis patients. Kidney Int 2003; 63:1908–1914.
- [18] Ofsthun NJ, LaBrecque J, Keen M, et al. The association of mortality and hospitalization with hemoglobin (Hb) and missed dialysis treatments in stage 5 chronic kidney disease (CKD) patients with and without cardiac comorbidities. Abstract and poster presented at the XLII Congress of the European Renal Association – European Dialysis Transplantation Association, Istanbul, Turkey, 4–7, June 2005.
- [19] Brunelli SM, Joffe MM, Israni RK, et al. History-Adjusted Marginal Structural Analysis of the Association between Hemoglobin Variability and Mortality among Chronic Hemodialysis Pa-tients. Clin J Am Soc Nephrol 2008; 3: 777–782.
- [20] Yang W, Israni RK, Brunelli SM, et al. Hemoglobin variability and mortality in ESRD. J Am Soc Nephrol 2007; 18: 3164–3110.
- [21] Lau JH, Gangji AS, Rabbat ChG, et al. Impact of haemoglobin and erythropoietin dose changes on mortality: a secondary analysis of results from randomized anaemia management trial. Nephrol Dial Transplant 2010; 25: 4002–4009.
- [22] Boudville NC, Djurdjev O, Macdougall IC. Hemo-globin Variability in Nondialysis Chronic Kidney Disease: Examining the Association with Mortality. Clin J Am Soc Nephrol 2009; 4: 1176–1182.
- [23] Patel T, Hirter A, Kaufman J, et al. Route of Epoe-tin Administration Influences Hemoglobin Varia-bility in Hemodialysis Patients. Am J Nephrol 2009; 29: 532–537.
- [24] Bock HA, Hirt-Minkowski P, Brünisholz M, et al. Darbepoetin alpha in lower-than-equimolar doses maintains haemoglobin levels in stable haemodialysis patients converting from epoetin al-pha/beta. Nephrol Dial Transplant 2008; 23: 301–308.
- [25] Agarwal AK. Darbepoetin alfa for anemia in chronic kidney disease. Expert Rev Clin Pharmacol 2008; 1(3): 369–379.
- [26] Saueressing U, Kwan JTC, De Cock E, et al. Healthcare resource utilization for anemia management: current practice with erythropoiesis-stimulating agents and the impact of converting to once-monthly C.E.R.A. Blood Purif 2008; 26: 537–546.
- [27] Kalantar-Zadeh K, Aronoff GR. Hemoglobin Varia-bility in Anemia of Chronic Kidney Disease. J Am Soc Nephrol 2009; 20: 479–487.
- [28] Cabrita AA, Pinho A, Malho A, et al. Risk factors for high erythropoiesis stimulating agent resis-tance index in pre-dialysis chronic kidney disease patients, stages 4 and 5. Int Urol Nephrol. Published online: 17 July 2010.
- [29] Ho WR, Germain MJ, Gard J, et al. Use of 12x/month haemoglobin monitoring with a computer algorithm reduces haemoglobin variability. Nephrol Dial Transplant 2010; 25: 2710–2714.
- [30] Breiterman-White R. Hemoglobin variability: managing inevitable changes in clinical status. Nephrol Nursing Journal 2005; 32 (4): 549–552.