Variabilita lékové odpovědi na základě etnicity
Souhrn:
Pavlík T. Variabilita lékové odpovědi na základě etnicity. Remedia 2018; 28: 311–317.
Farmakogenetika, vědní disciplína, která se během poslední dekády stala nedílnou součástí řady léčebných režimů, přinesla zejména zvýšení bezpečnosti a účinnosti farmakoterapie. Význam individualizované farmakoterapie vycházející ze znalosti genetických faktorů je nesporný. Jednou z oblastí, které se farmakogenetika věnuje, je variabilita v lékových odpovědích mezi odlišnými populacemi. Vlivem migrace dochází v Evropě k významným změnám v genofondu. Vedle dosud převažující kavkazské (europoidní) populace narůstá podíl osob přicházejících z Afriky a Asie. V podmínkách České republiky zaujímá významné zastoupení především populace mongoloidní – vietnamská menšina. Odlišná genetická výbava oproti kavkazské populaci, především pak rozdíly v zastoupení jednotlivých polymorfismů, přináší řadu otázek zejména ve vztahu k odlišné citlivosti k léčivům. Migrace tedy představuje v širším kontextu nutnost implementace nových poznatků do již zavedených léčebných režimů. Ty mohou vést ke zvýšení kvality a bezpečnosti poskytované zdravotní péče. Ačkoliv se farmakogenetický přístup již uplatňuje rutinně u nových léčiv (např. onkologie), v případě starších léčiv začlenění nových poznatků do praxe často chybí. Mezi taková léčiva patří warfarin, rosuvastatin, kodein a řada dalších.
Summary:
Pavlik T. The role of ethnicity in the variability of drug response. Remedia 2018; 28: 311–317.
Demografická fakta a změny ve struktuře populace ČR
Struktura obyvatelstva ČR se mění. Z údajů Českého statistického úřadu (ČSÚ) vyplývá, že počet cizinců žijících na našem území dlouhodobě stoupá (graf 1) [2]. Ke konci roku 2016 zde žilo 493 441 cizinců [1]. Dlouhodobě mají nejvyšší zastoupení občané Slovenska (107 251) a Ukrajiny (109 850), třetí v pořadí jsou občané původem z Vietnamu (58 025) [3].
K datu 1. 1. 2016 žilo na území ČR okolo 10,5 milionu obyvatel, na území Prahy více než 1,26 milionu obyvatel [4]. Z přepočtu tedy vyplývá, že cizinci tvoří okolo 4,5 % celkové populace ČR, s významnou kumulací v Praze a ve Středočeském kraji. V roce 2016 žilo v Praze celkem 184 264 cizinců, ve Středočeském kraji pak 64 815 [5]. Celkově tedy na těchto dvou územních celcích žilo více než 50 % všech cizinců s uděleným dlouhodobým pobytem. V samotné Praze pak cizinci tvořili dokonce 14,3 % obyvatel. V některých částech Prahy tvoří cizinci dokonce čtvrtinu populace [5,6].
Farmakogenetika – individualizace farmakoterapie
Jak vyplývá z grafu 1, existuje
patrný nárůst počtu cizinců žijících na území ČR. Populace se postupně
proměňuje a stává se pestřejší. Vzhledem k odlišné genetické výbavě
a relativně vysokému počtu je významná především vietnamská menš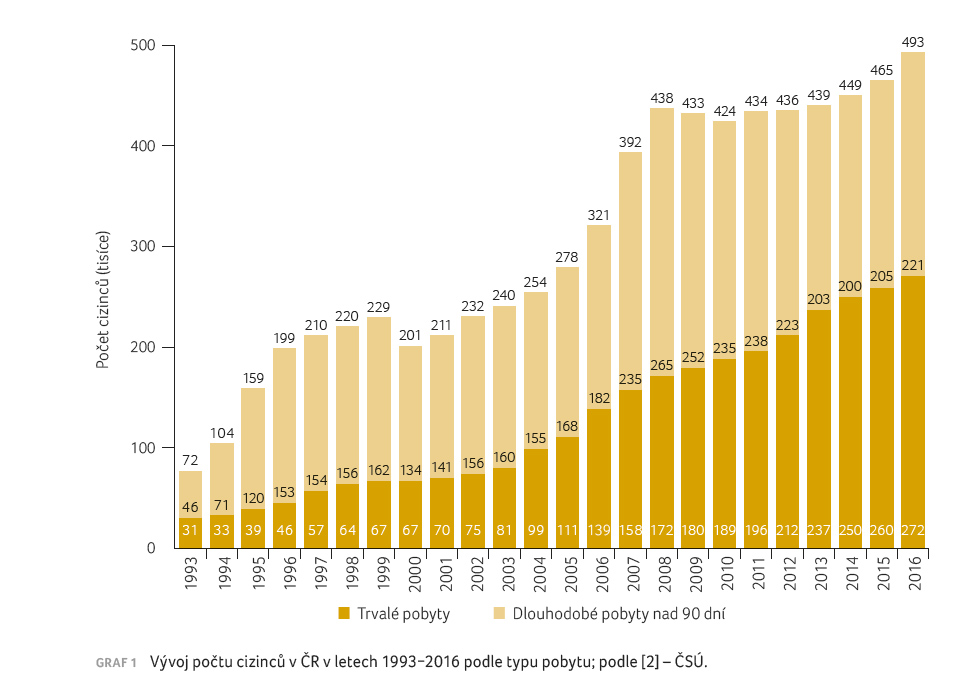 ina,
mongoloidní (asijská) populace. Tyto odlišnosti, které ústí ve větší variabilitu
v lékových odpovědích, přinášejí zajímavou možnost aktualizace léčebných postupů na základě širší
znalosti genetických faktorů, a mohou tak přispět k vyšší bezpečnosti
a účinnosti léčby. V optimálním případě by tedy mohl lékař rozhodovat
nejen na základě negenetických faktorů, které determinují pacienta (věk,
pohlaví, tělesná hmotnost atd.), ale rovněž na základě znalostí jeho
genotypu/fenotypu. Využití farmakogenetiky v individualizaci
farmakoterapie sehrává v posledních letech stále významnější roli.
ina,
mongoloidní (asijská) populace. Tyto odlišnosti, které ústí ve větší variabilitu
v lékových odpovědích, přinášejí zajímavou možnost aktualizace léčebných postupů na základě širší
znalosti genetických faktorů, a mohou tak přispět k vyšší bezpečnosti
a účinnosti léčby. V optimálním případě by tedy mohl lékař rozhodovat
nejen na základě negenetických faktorů, které determinují pacienta (věk,
pohlaví, tělesná hmotnost atd.), ale rovněž na základě znalostí jeho
genotypu/fenotypu. Využití farmakogenetiky v individualizaci
farmakoterapie sehrává v posledních letech stále významnější roli.
Cílem farmakogenetiky je nalezení vztahu mezi informací kódovanou geny a farmakologickou odpovědí. Genotypizace pacienta může přispět k individualizaci farmakoterapie (k tzv. terapii šité na míru). V praxi je obvykle vybrán tzv. kandidátní gen, jehož produkt má vztah k účinku léčiv. Často se jedná o gen, který kóduje enzym účastnící se metabolické přeměny léčiva (vztah k farmakokinetice) nebo cílové místo jeho působení (vztah k farmakodynamice).
Farmakogenetika je již běžně využívána při výzkumu nových léčiv. Zařazení těchto přístupů do klinického hodnocení léčiv je podporováno i regulačními lékovými autoritami, jako je americký Úřad pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) či Evropská léková agentura (European Medicines Agency, EMA). Od roku 2003 dokonce začala vznikat odborná doporučení pro farmakogenetická hodnocení nových léčiv. Farmaceutické společnosti však již před těmito doporučeními zařadily farmakogenetické testování do protokolu klinických hodnocení ve snaze odhalit pacienty s vyšší pravděpodobností úspěšné odpovědi, případně snížit výskyt nežádoucích účinků (NÚ) [7,8]. Výsledkem je začlenění těchto znalostí do souhrnů údajů o léčivých přípravcích (SPC), nebo se dokonce stávají podmínkou indikace či úhrady pojišťovnou (např. erlotinib – průkaz mutace EGFR, trastuzumab – zvýšená exprese HER2, panitumumab – průkaz divokého typu onkogenu RAS – a další).
Dle současných požadavků EMA je doporučeno provádět farmakogenetické testování především v případech, kdy výsledky klinického hodnocení indikují významnou roli polymorfismů enzymů a proteinů s účastí na distribuci, metabolismu či eliminaci léčiva nebo jeho metabolitu. Rovněž v případech, kdy byla pozorována významná interindividuální variabilita ve farmakokinetice nebo byly pozorovány rozdíly mezi etniky [8].
Polymorfismy a jejich vztah k lékové odpovědi
Polymorfismem nazýváme stav, kdy v dané populaci existují pro určitý znak minimálně dvě genetické varianty, tzv. alely. Na rozdíl od mutace, tj. náhodné variability, musí být jejich četnost výskytu v populaci vyšší než 1 %. Pozornost je soustředěna zejména na polymorfismy v kandidátních genech. Nejmenší možnou genetickou změnou, která může nastat, je polymorfismus na úrovni jednoho nukleotidu (SNP – single nucleotide polymorphism), kdy dochází ke změně v jednom páru bází. Teoreticky tedy mohou existovat až čtyři alely pro jeden SNP. Informativnost jednoho SNP může být nicméně malá. Zlepšit ji lze paralelním zpracováním více SNP a analýzou haplotypů. Ty vznikají sdružováním jednotlivých SNP do bloků, které mohou být děděny společně.
Výsledkem genotypizace je genotyp pacienta. Ačkoliv se jedná o stabilní a jasně definovanou informaci, klinická interpretace ve vztahu k účinku léčiv není vždy jasná. Zjištěný genotyp nás neinformuje o vlivu vnějšího prostředí či o jiných vnitřních faktorech. Z tohoto důvodu je využívána tzv. fenotypizace. Jedná se o stanovení individuální aktivity enzymu v konkrétním čase. Ta kromě genetických faktorů započítává i faktory negenetické. Nevýhodou je určitá variabilita v čase. Měření by proto mělo být provedeno opakovaně. Výsledkem je obvykle kategorizace pacientů do skupin s podobným metabolismem – metabolizátor ultrarychlý (UM, ultrarapid metaboliser), rychlý (RM, rapid metaboliser) a pomalý (PM, poor metaboliser).
Rozdíly v účinnosti léčiv u různých populací na základě rasy/etnicity
Již studie z roku 1982, která hodnotila účinnost
léčby arteriální hypertenze u amerických vojenských
veteránů, poukázala na rozdíly v účinnosti některých antihypertenziv mezi kavkazskou a negroidní populací. Cílových hodnot
krevního tlaku dosáhlo ve skupině pacientů léčených betablokátorem propranololem celkem 62 % bělochů,
ve skupině afroamerických pacientů pouze 54 %.
Naopak v případě léčby diuretikem hydrochlorothiazidem byly zaznamenány
lepší výsledky u Afroameričanů (71 %)
oproti bělochům (55 %)
[9]. Výsledkem bylo, že již v roce 1988 Národní spojená komise pro
diagnostiku a léčbu hypertenze ve své 4. hodnotící zprávě vydala
doporučení pro stanovení léčby hypertenze mimo jiné na základě etnicity
[10]. Závěry starších studií z osmdesátých let byly potvrzeny rovněž
v klinických hodnoceních z let devadesátých, kdy atenolol (rovněž
i inhibitor angiotenzin konvertujícího enzymu [ACEI] kaptopril) byl méně účinný
u starších hypertenzních pacientů čern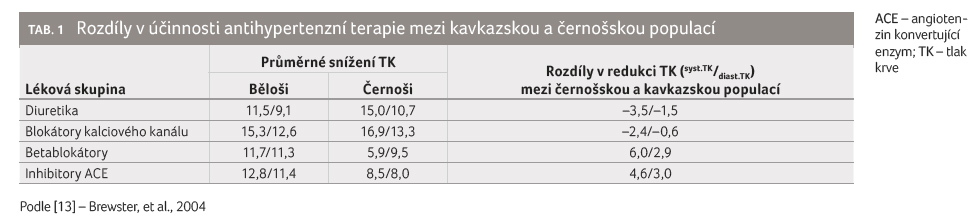 é pleti ve srovnání s hydrochlorothiazidem
a blokátorem
vápníkových kanálů diltiazemem u kavkazské
populace [11,12]. Velké shrnutí pak přinesla metaanalýza z roku 2004,
která hodnotila výsledky klinických studií publikovaných v letech
1984−1998 (tab. 1). Ta potvrdila rozdílnou účinnost
antihypertenziv mezi kavkazskou a negroidní populací, kdy lze očekávat
vyšší přínos terapie diuretiky a blokátory vápníkových kanálů
u pacientů černé pleti, zatímco vyšší účinnost betablokátorů
a inhibitorů ACE u populace kavkazské [13]. V případě inhibitorů ACE a černošských pacientů
je dokonce popsáno vyšší riziko angioedému ve srovnání s jinými
rasami.
é pleti ve srovnání s hydrochlorothiazidem
a blokátorem
vápníkových kanálů diltiazemem u kavkazské
populace [11,12]. Velké shrnutí pak přinesla metaanalýza z roku 2004,
která hodnotila výsledky klinických studií publikovaných v letech
1984−1998 (tab. 1). Ta potvrdila rozdílnou účinnost
antihypertenziv mezi kavkazskou a negroidní populací, kdy lze očekávat
vyšší přínos terapie diuretiky a blokátory vápníkových kanálů
u pacientů černé pleti, zatímco vyšší účinnost betablokátorů
a inhibitorů ACE u populace kavkazské [13]. V případě inhibitorů ACE a černošských pacientů
je dokonce popsáno vyšší riziko angioedému ve srovnání s jinými
rasami.
O tom, že může etnikum determinovat účinnost léčiva, svědčí rovněž příklad léčivého přípravku BiDilÒ (isosorbid dinitrát/hydralazin), který je zaregistrován v USA výhradně pro léčbu srdečního selhání u Afroameričanů [14]. Mezi podobné příklady, kdy rasa sehrává významnou roli v účinnosti a snášenlivosti terapie, můžeme zařadit i další široce předepisovaná léčiva, např. kodein, warfarin, rosuvastin a další.
Významnou oblastí diskutovanou v posledních letech, kde etnicita a farmakogenetika stojí v centru zájmu, je onkologie, především léčba inhibitory proteinových kináz. U řady těchto léčiv je pozorována vyšší účinnost u pacientů východoasijského původu. Jedná se například o erlotinib [15–19], gefitinib [20–23], lapatinib [24,25] a regorafenib [26–28]. Nejde nicméně o skupinový efekt, neboť například u ruxolitinibu a osimertinibu žádné mezietnické rozdíly v účinnosti hlášeny nebyly. Se zvýšenou účinností uvedených „small drugs“ u této skupiny pacientů je na druhou stranu spojena také zvýšená citlivost s vyšší mírou rozvoje vážnějších NÚ. Opět ale existují výjimky, kdy např. u ceritinibu a krizotinibu je u východoasijských pacientů výskyt NÚ nižší [29]. Na základě těchto etnických rozdílů a v souladu s požadavky EMA je doporučena u těchto léčiv genotypizace jak během klinického výzkumu, tak v běžné klinické praxi [30].
Kodein – rizikové léčivo pro pacienty původem z Afriky?
Při hledání příčin odlišné citlivosti vůči léčivům mezi jednotlivými etniky je pozornost soustředěna právě na vliv genetických faktorů. V některých případech je tento vztah v odborné veřejnosti již dobře znám, v jiných je souvislost teprve hledána. Klasickým příkladem je rozdílné zastoupení fenotypů CYP2D6 (pomalí, intermediární, rychlí a ultrarychlí metabolizátoři) mezi populacemi. To je dáno rozdílným zastoupením polymorfismů genu CYP2D6. Nejčastější defektní alelou kavkazské populace je CYP2D6*4 (12−21 % populace). Výsledná aktivita enzymu CYP2D6 je oslabena a klinicky ústí ve fenotyp pomalého metabolizátora. Výskyt tohoto fenotypu v kavkazské populaci je popisován mezi 6−10 %. U asijské populace je nejčastěji zastoupena defektní alela CYP2D6*10. Tu lze nalézt přibližně u poloviny populace. I přesto je v této populaci výskyt pomalých metabolizátorů pouze kolem 1−2 % [31]. Obdobně je tomu u populace arabské. Tento zdánlivý rozpor je dán skutečností, že variantní (defektní) alely s označením *3, *4, *5 kódují inaktivní enzymy, zatímco alely *10, *17 kódují enzymy s aktivitou pouze sníženou [32]. Příkladem z klinické praxe je snížení analgetického účinku tramadolu u pomalých metabolizátorů. I přesto, že je u tohoto fenotypu sérová koncentrace tramadolu zvýšena přibližně o 20 %, dochází ke snížení přeměny tramadolu na účinnější metabolit o‑desmetyltramadol o 40 % během dalšího kroku metabolizace, což je příčinou snížené účinnosti [33]. Obdobně je redukována demetylace kodeinu na morfin, což opět vede ke snížení analgetického účinku.
Na opačném pólu stojí fenotyp ultrarychlých
metabolizátorů, který je podmíněn duplikací až multiplikací genu CYP2D6
(CYP2D6*2xn, CYP2D6*Nxn), což vede ke zvýšení enzymatické aktivity enzymu
[32]. Nejvyšší výskyt je v populacích Středního východu, severní Afriky
a Etiopie, kde dosahuje až 29% zastoupení, viz tab. 2.
V případě 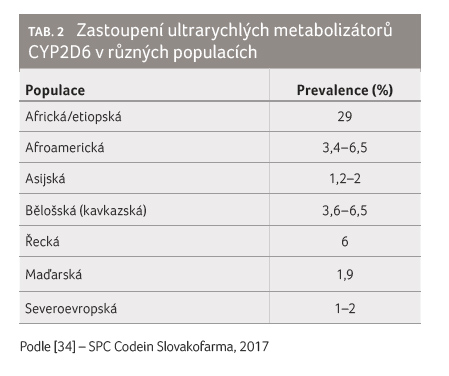 kavkazské a afroamerické populace je nižší a pohybuje
se mezi 3,5–6,5 %
[34]. U pacientů tohoto fenotypu je například zvýšené riziko oběhového
a respiračního útlumu s život ohrožujícími až
fatálními důsledky po podání kodeinu, neboť je
akcentována přeměna kodeinu na morfin, což vede k vyšším sérovým koncentracím morfinu. Jak uvádí
SPC přípravku Codein Slovakofarma, podání kodeinu u ultrarychlých
metabolizátorů je dokonce kontraindikováno [34]. U osob původem
z Afriky a Středního východu je tedy namístě zvýšená opatrnost při
podání morfinu
s ohledem na vyšší zastoupení fenotypu
ultrarychlých metabolizátorů.
kavkazské a afroamerické populace je nižší a pohybuje
se mezi 3,5–6,5 %
[34]. U pacientů tohoto fenotypu je například zvýšené riziko oběhového
a respiračního útlumu s život ohrožujícími až
fatálními důsledky po podání kodeinu, neboť je
akcentována přeměna kodeinu na morfin, což vede k vyšším sérovým koncentracím morfinu. Jak uvádí
SPC přípravku Codein Slovakofarma, podání kodeinu u ultrarychlých
metabolizátorů je dokonce kontraindikováno [34]. U osob původem
z Afriky a Středního východu je tedy namístě zvýšená opatrnost při
podání morfinu
s ohledem na vyšší zastoupení fenotypu
ultrarychlých metabolizátorů.
Přesto při podrobnějším rozboru africké populace nacházíme významné rozdíly v zastoupení jednotlivých polymorfismů, a to nejen pro gen CYP2D6. Jak ukazuje studie z roku 2017, jedná se tedy o poměrně heterogenní skupinu [35]. Z rozdílného zastoupení jednotlivých polymorfismů CYP450 lze odvodit také rozdílné zastoupení jednotlivých fenotypů.
Mezi další léčiva metabolizovaná prostřednictvím CYP2D6 patří například amitriptylin, aripiprazol, atomoxetin, karvedilol, dextrometorfan, dihydrokodein, donepezil, duloxetin, galantamin, hydrokodon, imipramin, metoklopramid, metoprolol, mianserin, mirtazapin, paroxetin, propafenon, propranolol, risperidon, tamoxifen, venlafaxin a další [32,36]. U řady z nich je tedy vhodné s možností odlišné rychlosti metabolizace počítat, i když související informace často v SPC uvedených léčiv chybějí. Jednou z mála výjimek je například SPC tricyklického antidepresiva amitriptylinu (Amitriptylin Slovakofarma). Zde je uvedena potřeba 50% redukce dávky u pomalých metabolizátorů CYP2D6 nebo CYP2C19 [37]. Potřebné snížení dávky by se mohlo týkat až 10 % pacientů naší populace.
Warfarin – opět v centru pozornosti
Dnes je již popsáno více než tisíc polymorfismů ve více než 30 genech, které by mohly různým způsobem ovlivňovat účinek, a tedy i dávkování warfarinu. Zatím nejlépe popsanými jsou polymorfismy v genech pro CYP2C9 a VKORC1 (vitamin‑K‑epoxid‑reduktázový komplex 1) [38–40].
Polymorfismus CYP2C9
V případě variantních forem CYP2C9 (CYP2C9*2, *3, *4, *5, *6, *11) dochází k ovlivnění farmakokinetiky, tj. ke zpomalení přeměny levotočivé formy S‑warfarinu na močí vylučovaný metabolit. Naopak variantní formy genu VKORC1 vedou k vyšší citlivosti cílového místa účinku warfarinu. Mezi obvykle stanovované polymorfismy patří 3673 G>A a 1173 C>T. V případě polymorfismů CYP2C9 je popisováno ovlivnění dávky warfarinu přibližně z 18 %, v případě VKORC1 dokonce 30% [41]. Vliv těchto polymorfismů je aditivní. Dalšími studovanými faktory jsou polymorfismy pro apolipoprotein E (APOE), CYP4F2, EPHX1 (epoxide hydrolase 1), GGCX (gamaglutamyl karboxyláza) a další. Nicméně dosud se zdá být jejich vliv méně významný než v případě polymorfismů CYP2C9 a VKORC1 [40]. Celkový vliv genetických faktorů ve vztahu k variabilitě v odpovědi na warfarin je odhadován na 50 % v rámci jedné populace [42].
Méně známým faktem je rozdílná potřeba dávek warfarinu u různých populací (kavkazská, mongoloidní, negroidní). Z publikovaných studií vyplynula potřeba nejvyšších dávek u Afroameričanů, kdy se průměrná denní dávka pohybovala okolo 6,1 mg, u kavkazské populace pak okolo 5,1 mg a u Asiatů pouze 3,4 mg denně [38,39,42,43]. Tyto rozdíly jsou připisovány v neposlední řadě právě rozdílnému zastoupení polymorfismů CYP2C9 a VKORC1 mezi uvedenými populacemi [38].
V případě variantní alely CYP2C9*2 bylo nejvyšší
zastoupení u kavkazské populace (8−18 %),
negroidní a mongoloidní populace vykazovaly pouze vzácné zastoupení (tab. 3). V případě CYP2C9*3 je zastoupení vyrovnanější,
nicméně i zde je nejvyšší u kavkazské populace (5−13 %) [38]. To b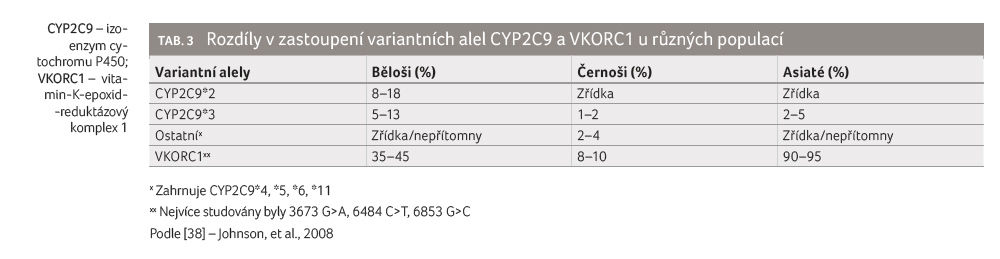 y mohlo
vysvětlovat odlišnou citlivost vůči warfarinu u kavkazské populace v porovnání
s Afroameričany, nikoliv však v porovnání s Asiaty.
y mohlo
vysvětlovat odlišnou citlivost vůči warfarinu u kavkazské populace v porovnání
s Afroameričany, nikoliv však v porovnání s Asiaty.
Zkoumáno bylo rovněž zastoupení dalších méně se vyskytujících variantních alel, především CYP2C9*4, *5, *6 a *11 [44,45]. I zde byly nalezeny rozdíly v zastoupení mezi populacemi, význam je nicméně dosud zkoumán. Významné je, že polymorfismy CYP2C9*5, CYP2C9*6 a CYP2C9*11 byly dosud nalezeny pouze u negroidní rasy. V případě CYP2C9*11 je dokonce výskyt podobný jako v případě CYP2C9*2 a CYP2C9*3 [45].
Polymorfismus VKORC1
VKORC1 představuje cílové místo působení warfarinu. Změny v genu kódujícím tento komplex tedy vedou k ovlivnění jeho farmakodynamiky. Gen VKORC1 kóduje transmembránový protein složený ze 163 aminokyselin, ten tvoří podjednotku komplexu epoxid reduktázy a je nezbytný pro karboxylaci zbytků glutamových kyselin koagulačních proteinů [42]. I zde existuje řada polymorfismů spojených s tímto genem. Jedním ze dvou nejčastěji citovaných polymorfismů je SNP v promotorové části genu označovaný jako 3673 G>A nebo také ‑1639 G>A. Druhým pak SNP lokalizovaný v prvním intronu 1173 C>T. U těchto dvou polymorfismů byla prokázána těsná vazba, a proto je dostačující detekce pouze jednoho z polymorfismů (častěji 3673 G>A). Ačkoliv byla publikována řada studií, které sledovaly vliv dalších genetických mutací VKORC1 ve vztahu k dávce warfarinu, nebyla popsána vyšší přesnost odhadu předpokládané dávky warfarinu než za použití SNP 3673 G>A [46].
Znalost genotypů VKORC1 a CYP2C9 lze dnes v praxi využít pro odhad správné dávky warfarinu pomocí výpočetních algoritmů. Na rozdíl od běžného dávkování inkorporují kromě negenetických faktorů také faktory genetické. S výhodou se dají využít u kavkazské i asijské rasy. Určitou komplikací je však nižší stupeň vazebné nerovnováhy u jednotlivých SNP VKORC1 u černošské populace. U této populace je odhadován vliv genetických faktorů pouze na 10 % oproti 50 % u populace kavkazské a asijské [38,45]. Spolehlivost běžně využívaných algoritmů je pak u této skupiny výrazně snížena. Výběr jednoho zástupce SNP, který by jednoduchým způsobem určil citlivost k warfarinu, je proto obtížný. Navzdory tomu se i přes uvedenou vazebnou nerovnováhu a velký počet SNP VKORC1 jeví spojitost mezi polymorfismy 3673 G>A, 1173 C>T a dávkováním warfarinu u této populace jako nejpřínosnější [38].
I když se zmínky o vlivu polymorfismů a rasy objevily v doporučeních odborných společností již v letech 2012 a 2014 [47,48], stále chybí začlenění těchto znalostí do SPC přípravků a do běžné klinické praxe. Z výsledků je tedy patrné, že dávka 5 mg denně, která je doporučována při úvodu warfarinizace, odpovídá spíše kavkazské populaci. U mongoloidní populace hrozí zvýšené riziko krvácení, a naopak u negroidní populace spíše riziko nedostatečné dávky s rizikem tromboembolické nemoci.
Rosuvastatin
Jednou z mála léčivých látek, u které je v SPC registrovaných léčivých přípravků uvedeno odlišné dávkování na základě rasy, je rosuvastatin [49]. Konkrétně u asijských pacientů je doporučena úvodní dávka 5 mg/den (u kavkazské populace 10 mg/den), dávka 40 mg/den je dokonce u této skupiny pacientů kontraindikována. Za tímto doporučením stojí zjištění, že u této skupiny pacientů (Japonci, Číňané, Filipínci, Vietnamci, Korejci) byla zaznamenána až dvojnásobná systémová expozice léčivu oproti kavkazské a černošské populaci (plocha pod křivkou plazmatické koncentrace, AUC, i maximální plazmatická koncentrace, cmax).
Rosuvastatin patří mezi hydrofilní molekuly. Osud tohoto léčiva v organismu je ovlivněn aktivitou transportních systémů, především pak OATP1B1 a 1B3 (organic anion transporting polypeptide − transport do hepatocytu) a BCRP (breast cancer resistance protein − transport z hepatocytu do žluči) [50]. Významná je pak přítomnost variantních alel SNP genů kódujících uvedené systémy. V případě OATP1B1 se jedná o polymorfismy genu SLCO1B1 (solute carrier organic anion transporter 1B1), v případě BCRP pak o polymorfismy genu ABCG2 (ATP binding casette G2) [51–54]. Právě rozdíly v zastoupení jednotlivých variantních alel uvedených genů mezi etniky mohou vysvětlit odlišnou účinnost a snášenlivost rosuvastatinu mezi nimi, neboť u uvedené skupiny se vyskytují variantní alely jak pro SLCO1B1 (c.388A>G a c.521T>C), tak pro ABCG2 (c.421C>A) výrazně častěji (14 % a 35 %) oproti kavkazské populaci (2,7 % a 14,0 %) [55−57].
Při podrobnějším pohledu na zastoupení variantních alel
polymorfismu OATP1B1 (c.521T>C) se frekvence u východoasijské populace
pohybuje v rozmezí 15,0−21,6 %,
11,9–13,5 %
u kavkazské populace a 0,7–11,5 %
u populace Afroameričanů. V případě ABCG2 (c.421C>A) jsou rozdíly ještě
výraznější. Jak ukazuje tabulka 4,
u výcho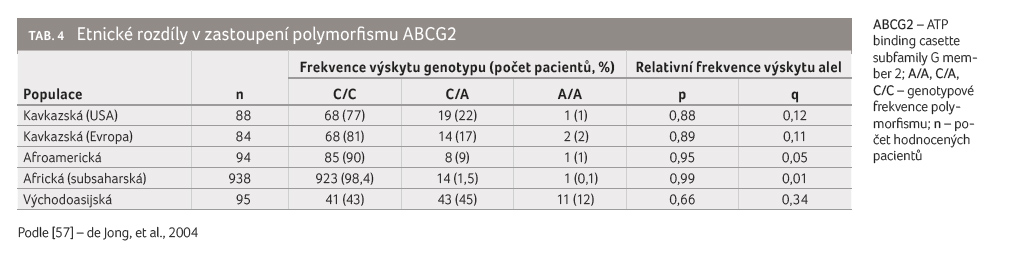 doasijské populace je zastoupení 30–60 %, u kavkazské a afroamerické
pouze 5−10 %
[30,57].
doasijské populace je zastoupení 30–60 %, u kavkazské a afroamerické
pouze 5−10 %
[30,57].
I přes potvrzení rozdílného zastoupení variantních alel a s nimi spojenou vyšší citlivost k rosuvastatinu ukazují některé studie, že je spíše výhodnější vycházet ze znalosti genotypů než z pouhé etnicity. Neboť při srovnání AUC a cmax u pacientů nesoucích pouze divoký typ alel nebyly nalezeny významné rozdíly napříč etniky [50].
Přestože