Věkem podmíněná makulární degenerace – aktuální možnosti farmakoterapie v České republice
Souhrn:
Věkem podmíněná makulární degenerace (VPMD) představuje závažný zdravotní a socioekonomický problém. Onemocnění postihuje žlutou skvrnu oka a snižuje centrální zrakovou ostrost. Přesnější zobrazovací metody přinášejí stále nové poznatky o patofyziologii nemoci. Přístup k léčbě VPMD prodělal v posledních letech významný vývoj. Léčebné metody zaznamenaly posun od pouhé snahy o stabilizaci choroby k dosažení maximálního zlepšení zrakové ostrosti. Lékem první volby u vlhké formy VPMD jsou inhibitory vaskulárního endotelového růstového faktoru (vascular endothelial growth factor, VEGF) aplikované do sklivce postiženého oka. Účinně blokují vazbu a aktivaci receptorů pro VEGF a proliferaci endotelových buněk a tím inhibují růst abnormálních nových cév a snižují nadměrnou cévní permeabilitu. Podmínkou je včasná diagnostika a rychlé zahájení bezpečné a účinné léčby. Při terapii vlhké formy VPMD je nezbytné zajistit dlouhodobé sledování a individuální přístup. Je důležité mít na paměti, že náklady na léčbu vlhké formy VPMD jsou nižší než náklady na péči o slabozraké a nevidomé osoby. Vývoj nových léčiv a léčebných postupů směřuje k prodlužování doby účinku, ke snižování frekvence dávkování přípravků a k novým mechanismům působení léčiv. Účinná léčba suché formy VPMD v současné době stále není k dispozici.
Key words:
wet AMD – anti-VEGF – ranibizumab – aflibercept – dry AMD.
Summary:
Age related macular degeneration (AMD) is a major health and socio economic problem. The disease affects the macula of the eye and reduces visual acuity. More accurate imaging methods keep bringing new knowledge about the pathophysiology of the disease. Approach to the treatment of AMD has undergone significant development in recent years. Treatment methods have shifted from mere attempts to stabilize the disease towards attempts to achieve maximum improvement of visual acuity. First line of the treatment of wet AMD is represented by inhibitors of vascular endothelial growth factor (VEGF) applied to the vitreous of the affected eye. They effectively block the binding and activation of VEGF receptors and proliferation of endothelial cells, thereby inhibiting the growth of new abnormal vessels as well as leakage and edema in the retina. Early diagnosis and rapid safe treatment are essential prerequisites of success. Long term monitoring and personalized treatment are necessary during the treatment of wet AMD. It is important to remember that the costs of treatment of wet AMD are lower than expenses associated with care for blind and visually impaired persons. The development of new drugs and treatments aims at achieving longer duration of action and less frequent treatment as well as new mechanisms of action of drugs. To date, there are no effective treatments for dry AMD.
Úvod
Věkem podmíněná makulární degenerace (VPMD) je závažné multifaktoriální onemocnění žluté skvrny oka. Makula je okrouhlá oblast v centru sítnice, která zpracovává všechny zrakové vjemy. Umožňuje nám číst, rozpoznat tváře, vidět barvy. Makula zároveň vyžaduje dostatečný přísun kvalitních živin, na některých z nich je přímo závislá. V makule probíhají složité metabolické pochody, jejichž narušení může vést k rozvoji degenerativních změn.
V současné době neexistuje kauzální terapie VPMD, ale inhibitory vaskulárního endotelového růstového faktoru (vascular endothelial growth factor, VEGF) mají potenciál stabilizovat a v mnoha případech i zlepšit zrakovou ostrost u pacientů s vlhkou formou VPMD. Pro úspěch léčby je zásadní včasné stanovení diagnózy a doporučení k léčbě [1,2].
Poznámky k věkem podmíněné makulární degeneraci
V ekonomicky vyspělých zemích je VPMD nejčastější příčinou těžkého, nevratného postižení zraku s rozvojem praktické slepoty. Typicky jsou onemocněním postiženi pacienti starší 50 let s rozdílně vyjádřenými symptomy. Základními projevy onemocnění jsou deformace vnímaného obrazu (metamorfopsie), výpad centrální části zorného pole, pokles centrální zrakové ostrosti hůře vnímaný do blízka a charakteristický nález na očním pozadí.
Zvýšená hustota čípků v makule umožňuje ostré barevné vidění. Centrální část makuly je vyživována difuzí 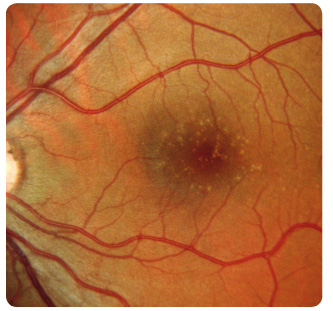 z choriocapillaris. Cévní pleteně choriocapillaris podléhají vlivu VEGF a fyziologicky se obnovují; VEGF velmi významně ovlivňuje propustnost vnitřní hemato‑retinální bariéry tvořené endotelem cév sítnice ve smyslu jejího obrovského zvýšení za hypoxických podmínek. Přirozený VEGF produkují buňky retinálního pigmentového epitelu (RPE) k udržení dobré propustnosti cévnatky. Další funkcí RPE je podpora metabolismu fotoreceptorů, fagocytóza jejich použitých zevních částí a opakované využití zrakového pigmentu. V buňkách RPE se s přibývajícím věkem hromadí nezpracovatelné zbytky, nejvíce lipofuscin, který je směsí částečně natrávených proteinů a lipidů. Aktivace lipofuscinu volnými kyslíkovými radikály urychluje apoptózu buněk RPE následovanou snížením počtu receptorů
z choriocapillaris. Cévní pleteně choriocapillaris podléhají vlivu VEGF a fyziologicky se obnovují; VEGF velmi významně ovlivňuje propustnost vnitřní hemato‑retinální bariéry tvořené endotelem cév sítnice ve smyslu jejího obrovského zvýšení za hypoxických podmínek. Přirozený VEGF produkují buňky retinálního pigmentového epitelu (RPE) k udržení dobré propustnosti cévnatky. Další funkcí RPE je podpora metabolismu fotoreceptorů, fagocytóza jejich použitých zevních částí a opakované využití zrakového pigmentu. V buňkách RPE se s přibývajícím věkem hromadí nezpracovatelné zbytky, nejvíce lipofuscin, který je směsí částečně natrávených proteinů a lipidů. Aktivace lipofuscinu volnými kyslíkovými radikály urychluje apoptózu buněk RPE následovanou snížením počtu receptorů 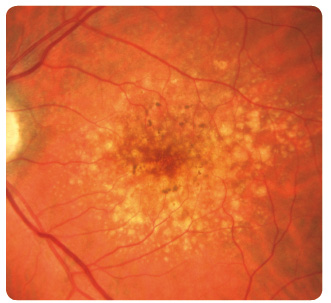 citlivých na světlo. Dochází také ke změnám Bruchovy membrány s hromaděním odpadních produktů a se snížením její propustnosti. Všechny změny se projeví poruchami vidění [1,2].
citlivých na světlo. Dochází také ke změnám Bruchovy membrány s hromaděním odpadních produktů a se snížením její propustnosti. Všechny změny se projeví poruchami vidění [1,2].
Věkem podmíněnou makulární degeneraci rozdělujeme na dvě formy: suchou (atrofickou) a vlhkou (exsudativní).
 Suchou formou je postiženo až 90 % pacientů, ale jen u 12–21 % způsobuje závažnou poruchu zraku. V makulární krajině nemocných nacházíme drúzy a změny RPE. Drúzy dělíme podle vzhledu a velikosti na tvrdé a měkké. Tvrdé drúzy jsou malá ohraničená ložiska žlutavé barvy tvořená hromaděním lipidů v buňkách RPE nebo ukládáním hyalinního materiálu v Bruchově membráně (obr. 1). U pacientů s tímto nálezem je jen malé riziko rozvoje pozdních závažných forem VPMD. Naopak měkké drúzy, které jsou větší, nemají ostré ohraničení a mohou i splývat (obr. 2), jsou spojeny s podstatně vyšším rizikem vzniku vlhké formy VPMD [1–5]. Retinální pigmentový epitel podléhá různým změnám, jako jsou přesuny, proliferace buněk RPE až jejich zánik. Postupně se rozšiřují ohraničené
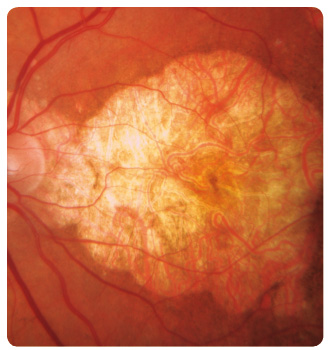
Suchou formou je postiženo až 90 % pacientů, ale jen u 12–21 % způsobuje závažnou poruchu zraku. V makulární krajině nemocných nacházíme drúzy a změny RPE. Drúzy dělíme podle vzhledu a velikosti na tvrdé a měkké. Tvrdé drúzy jsou malá ohraničená ložiska žlutavé barvy tvořená hromaděním lipidů v buňkách RPE nebo ukládáním hyalinního materiálu v Bruchově membráně (obr. 1). U pacientů s tímto nálezem je jen malé riziko rozvoje pozdních závažných forem VPMD. Naopak měkké drúzy, které jsou větší, nemají ostré ohraničení a mohou i splývat (obr. 2), jsou spojeny s podstatně vyšším rizikem vzniku vlhké formy VPMD [1–5]. Retinální pigmentový epitel podléhá různým změnám, jako jsou přesuny, proliferace buněk RPE až jejich zánik. Postupně se rozšiřují ohraničené 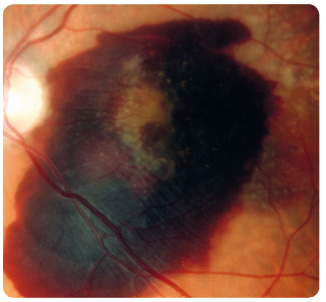 oblasti atrofie RPE, které v pozdních stadiích nabývají mapovitého vzhledu. Geografická atrofie představuje rozvinuté stadium suché formy VPMD (obr. 3). Změny v Bruchově membráně způsobí poškození jejích transportních mechanismů a difuze. Snížení propustnosti pro živiny a kyslík a zhoršený transport odpadních látek mohou vést k hypoxii. Oxidační stres stimuluje v buňkách RPE produkci zejména VEGF, který vyvolá růst chorioideálních
oblasti atrofie RPE, které v pozdních stadiích nabývají mapovitého vzhledu. Geografická atrofie představuje rozvinuté stadium suché formy VPMD (obr. 3). Změny v Bruchově membráně způsobí poškození jejích transportních mechanismů a difuze. Snížení propustnosti pro živiny a kyslík a zhoršený transport odpadních látek mohou vést k hypoxii. Oxidační stres stimuluje v buňkách RPE produkci zejména VEGF, který vyvolá růst chorioideálních ![Obr. 5 Chorioideální neovaskulární membrána ranibizumabu v klinické praxi [17–19]. okultního typu v makule pravého oka zobrazená optickou koherenční tomografií.](https://www.remedia.cz/photo-a-30604---.jpg) neovaskularizací (choroidal neovascularization, CNV). Novotvořené cévy jsou křehké a snadno krvácejí (obr. 4), prosakováním vzniká edém, tvoří se fibrovaskulární a fibrogliální tkáň a terminálně až disciformní jizvení s devastací sítnice, následkem je ztráta zrakové ostrosti. Vzhledem k poloze vůči RPE dělíme chorioideální neovaskulární membrány na dva typy: okultní a klasický. Okultní CNV je přítomna mezi RPE a choriocapillaris a je provázena ablací RPE (obr. 5). Klasická CNV roste mezi RPE a smyslovým epitelem sítnice, ložisko je dobře ohraničené a okraj může být lemován krvácením (obr. 6).
neovaskularizací (choroidal neovascularization, CNV). Novotvořené cévy jsou křehké a snadno krvácejí (obr. 4), prosakováním vzniká edém, tvoří se fibrovaskulární a fibrogliální tkáň a terminálně až disciformní jizvení s devastací sítnice, následkem je ztráta zrakové ostrosti. Vzhledem k poloze vůči RPE dělíme chorioideální neovaskulární membrány na dva typy: okultní a klasický. Okultní CNV je přítomna mezi RPE a choriocapillaris a je provázena ablací RPE (obr. 5). Klasická CNV roste mezi RPE a smyslovým epitelem sítnice, ložisko je dobře ohraničené a okraj může být lemován krvácením (obr. 6).
Přítomnost chorioideální neovaskulární membrány je charakteristická pro vlhkou formu, která postihuje jen 10 % pacientů s VPMD, avšak až u 85 % z nich způsobuje těžkou ztrátu zrakové ostrosti [1,2].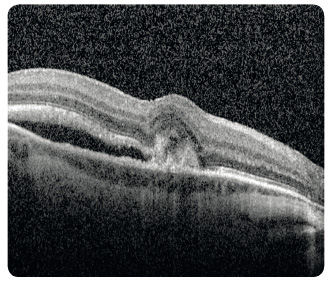
Porucha centrálního vid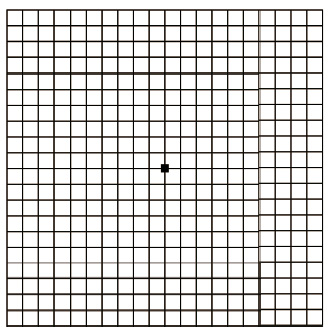 ění postihuje pacienty velice závažně a zhoršuje kvalitu života až o 63 %. Prevalence pozdní VPMD činí v bílé populaci ve věkovém rozmezí 65–74 let 1 %, ve věkovém rozmezí 75–84 let 5 % a v populaci nad 85 let více než 13 %. Významnými neovlivnitelnými rizikovými faktory jsou vyšší věk, etnický původ a genetické vlivy, hlavním ovlivnitelným rizikovým faktorem je kouření cigaret [1,2,6].
ění postihuje pacienty velice závažně a zhoršuje kvalitu života až o 63 %. Prevalence pozdní VPMD činí v bílé populaci ve věkovém rozmezí 65–74 let 1 %, ve věkovém rozmezí 75–84 let 5 % a v populaci nad 85 let více než 13 %. Významnými neovlivnitelnými rizikovými faktory jsou vyšší věk, etnický původ a genetické vlivy, hlavním ovlivnitelným rizikovým faktorem je kouření cigaret [1,2,6].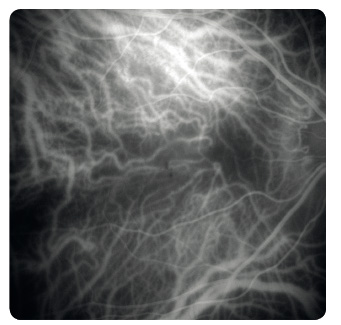
Mezi základní vyšetřovací metody patří stanovení nejlépe korigované zrakové ostrosti do dálky a na blízko. K vyšetřování používáme logaritmické tabule ETDRS (Early Treatment Diabetic Retinopathy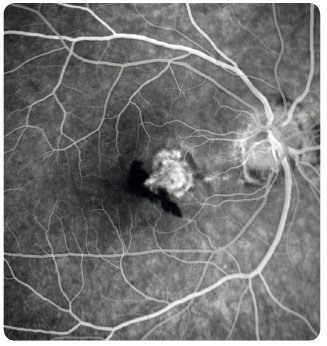 Study). Další metodou je vyšetření Amslerovou mřížkou sloužící k odhalení deformací vnímaného obrazu a výpadků v centru zorného pole (obr. 7). Nezbytné je biomikroskopické vyšetření sítnice v arteficiální mydriáze. Vyšetřeními k upřesnění diagnózy
Study). Další metodou je vyšetření Amslerovou mřížkou sloužící k odhalení deformací vnímaného obrazu a výpadků v centru zorného pole (obr. 7). Nezbytné je biomikroskopické vyšetření sítnice v arteficiální mydriáze. Vyšetřeními k upřesnění diagnózy 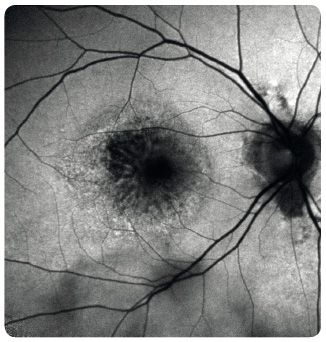 a stanovení optimálního léčebného postupu jsou barevná fotografie sítnice, fluorescenční angiografie (obr. 8), případně angiografie s indocyaninovou zelení (obr. 9), autofluorescence fundu (obr. 10) a optická koherenční tomografie, která využívá odrazu spektra světelného záření od tkání oka a která se stala zlatým standardem mezi zobrazovacími metodami (obr. 11).
a stanovení optimálního léčebného postupu jsou barevná fotografie sítnice, fluorescenční angiografie (obr. 8), případně angiografie s indocyaninovou zelení (obr. 9), autofluorescence fundu (obr. 10) a optická koherenční tomografie, která využívá odrazu spektra světelného záření od tkání oka a která se stala zlatým standardem mezi zobrazovacími metodami (obr. 11).
Léčiva
Mezi léky používané k léčbě neovaskularizací v oblasti oka a registrované v České republice patří v současné době 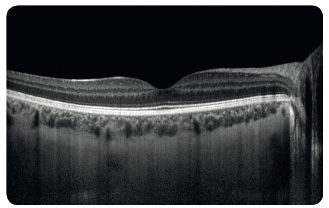 verteporfin, sodná sůl pegaptanibu, ranibizumab a aflibercept.
verteporfin, sodná sůl pegaptanibu, ranibizumab a aflibercept.
Verteporfin
Verteporfin byl v roce 2000 schválen pro použití při fotodynamické terapii (photodynamic therapy, PDT) k léčbě vlhké formy VPMD. Jedná se o směs dvou izomerů benzoporfyrinu, které se kumulují v rychle proliferujících buňkách. Po aktivaci světlem za přítomnosti kyslíku se vytvářejí cytotoxické látky. Chemická vazba kyslíku způsobuje poškození biologických struktur v rozsahu oblasti difuze. Narušení stěny cév vede k trombogenezi a k uzávěru nově tvořených cév. V tomto okamžiku však nastává místní hypoxie vyvolávající vyplavení VEGF, což může být příčinou recidivy růstu CNV a selhání léčby [2,7].
Studie TAP (N = 609) potvrdila stabilizaci zrakové ostrosti u pacientů se subfoveálně lokalizovanou převážně klasickou a minimálně klasickou CNV v prvním i druhém roce sledování. U pacientů s převážně klasickou CNV byl pozorován pozitivní účinek verteporfinu na udržení zrakové ostrosti po 12 měsících u 67 % sledovaných a po 24 měsících u 59 % sledovaných [8]. Studie VIP (N = 339) prokázala přínos PDT u pacientů s okultními CNV po dvou letech sledování [9].
Verteporfin se používá k intravenózní infuzi, aktivace přípravku se provede světelnou stopou pomocí diodového laseru. Kontraindikací PDT je přecitlivělost na léčivou látku nebo na pomocné látky přípravku, porfyrie a závažné poškození funkce jater. Fotodynamická terapie působí selektivně, přímo a bezpečně způsobuje uzávěr neovaskulárních membrán, ovšem v klinické praxi někdy pozorujeme v pozdním období prohloubení degenerativních a atrofických změn sítnice a cévnatky [7]. Verteporfin je v současné době využíván velmi omezeně, především v léčbě polypoidální chorioideální vaskulopatie, a to hlavně v kombinaci s inhibitory VEGF.
Revoluci v léčbě vlhké formy VPMD přineslo právě zavedení anti‑VEGF přípravků. Při vzniku a vývoji CNV hraje zásadní roli molekula VEGF‑A, zejména její izoforma 165. Po specifické vazbě na receptor VEGFR‑2 umístěný na povrchu endotelu cévní stěny se spustí patologický růst novotvořených cév a zvýší se cévní permeabilita. Receptor VEGFR‑1 má regulační funkci v modulaci signálu z VEGFR‑2; VEGF má i vliv systémový, příznivě působí na fyziologickou angiogenezi, na obnovu ischemických tkání v těle, má protizánětlivý efekt, inhibuje trombogenezi a apoptózu, má neuroprotektivní účinky celkové i lokální v oku, kde podporuje Müllerovy buňky a fotoreceptory. Naopak lokální potlačení VEGF experimentálně zvýšilo apoptózu buněk jaderných vrstev sítnice [1,2]. Mezi angiogenní faktory patří i placentární růstový faktor (placental growth factor, PIGF). Váže se pouze na receptor VEGFR‑1, který se nalézá také na povrchu leukocytů; PlGF může působit současně s VEGF‑A a podpořit leukocytární infiltraci a zánět [10]. Použitím anti‑VEGF protilátek jako léčebného prostředku u vlhké formy VPMD blokujeme novotvorbu cév a potlačujeme prosakování tekutiny z cév.
Sodná sůl pegaptanibu
Sodná sůl pegaptanibu byla do klinického užívání uvedena v roce 2004. Jde o pegylovaný modifikovaný oligonukleotid, který se s vysokou afinitou specificky váže pouze na izoformu VEGF‑A 165 a blokuje její vazbu na receptor.
Použití pegaptanibu v léčbě vlhké formy VPMD bylo hodnoceno ve studii V.I.S.I.O.N. (N = 1 208). V 54. týdnu sledování si uchovalo zrakovou ostrost 70 % pacientů. Po dvou letech mělo prospěch z léčby 54 % pacientů léčených pegaptanibem oproti kontrolní skupině bez léčby, kde si zrakovou ostrost uchovalo 45 % pacientů [11].
Pegaptanib se aplikuje injekcí do sklivce postiženého oka jedenkrát za šest týdnů, což představuje devět injekcí do sklivcové dutiny ročně. Pokud nedojde ke zlepšení zrakové ostrosti po aplikaci prvních dvou injekcí, je vhodné zvážit ukončení léčby. Jedna dávka obsahuje 1,65 mg sodné soli pegaptanibu, což odpovídá 0,3 mg volného oligonukleotidu v objemu 90 µl. Biologický poločas pegaptanibu je 10 dnů, vazebnou aktivitu si po podání do sklivce zachovává po dobu nejméně 28 dnů [12]. Pro nižší účinnost oproti ostatním lékům není v součané době pegaptanib téměř používán.
Ranibizumab
Ranibizumab je fragment humanizované monoklonální protilátky produkovaný bakterií Escherichia coli pomocí technologie rekombinantní DNA, který se váže se silnou afinitou na všechny lidské izoformy VEGF‑A a brání vazbě VEGF‑A na receptory VEGFR‑1 a VEGFR‑2. Klinicky je používán od roku 2006. V porovnání se sodnou solí pegaptanibu je skupina pacientů, u kterých došlo ke zlepšení zrakové ostrosti a k vymizení aktivity onemocnění, významně větší.
Studie MARINA (N = 716) a ANCHOR (N = 423) sledovaly změnu zrakové ostrosti při fixním dávkovacím režimu jedenkrát měsíčně po celé určené období léčby vlhké formy VPMD (tab. 1). Zlepšení zrakové ostrosti nebo ztráta méně než 15 písmen optotypů ETDRS byly zaznamenány u 90 % pacientů po dvou letech léčby [13,14]. Režim tří úvodních aplikací ranibizumabu s následnými čtvrtletními podáními účinné látky byl testován ve studiích PIER (N = 184) a EXCITE (N = 353). Zrakovou ostrost si po dobu 12 měsíců uchovalo 90 % pacientů, ale počáteční zlepšení zrakové ostrosti nebylo při čtvrtletním podávání stabilní [15,16]. Individuální dávkovací režim v léčbě vlhké formy VPMD hodnotily studie SAILOR (N = 4 307), SUSTAIN (N = 513) a PrONTO (N = 40). Po úvodních třech aplikacích ranibizumabu bylo podání opakováno pouze při definovaných známkách aktivity léze. V prvním roce byla udržena zraková ostrost u 95 % pacientů. Tento funkční výsledek podporuje používání individuálního dávkovacího režimu ranibizumabu v klinické praxi [17–19].
Doporučená dávka ranibizumabu aplikovaného do sklivce je 0,5 mg, což odpovídá injekci o objemu 50 µl. Léčba se zahajuje jednou injekcí za měsíc do dosažení maximální zrakové ostrosti a/nebo do vymizení příznaků aktivity onemocnění. Zpočátku mohou být potřeba tři nebo více po sobě následujících injekcí. Poté mají být lékařem určeny intervaly kontrol a léčby na základě aktivity onemocnění vyhodnocené podle zrakové ostrosti a/nebo podle anatomických parametrů. Po dosažení maximálního léčebného efektu lze při režimu „treat‑and‑extend“ začít léčebné intervaly postupně prodlužovat, nejvíce o dva týdny, až do opětovného objevení se příznaků aktivity onemocnění nebo zhoršení zraku. Biologický poločas ranibizumabu v prostoru sklivce je 9 dnů, po injekci do sklivce si vazebnou aktivitu zachovává po dobu přibližně 41 dnů (tab. 2) [20,21].
Výsledky dvouletého sledování v běžné klinické praxi na Oční klinice 1. LF UK a VFN v Praze (2007–2009, N = 72) odpovídaly výsledkům uvedených studií. Po sedmi letech léčby (2007–2014, N = 51) byla zraková ostrost zlepšena nebo zůstala zachována u 53 % pacientů, k trvalému snížení výšky sítnice došlo u 72 % léčených. Po dvou letech léčby ranibizumabem nastala praktická slepota pouze u 8 % pacientů, po sedmi letech léčby u 28 % pacientů.
Observační populační studie vycházející z údajů Dánské asociace slabozrakých (N = 11 848) ukázala, že po zavedení léčby anti‑VEGF přípravky došlo v Dánsku po roce 2006 k zásadní změně incidence praktické slepoty podmíněné VPMD. Počet slepých se během jednoho desetiletí snížil o 50 % – z 52,2 případu na 100 000 obyvatel v roce 2000 na 25,7 případu na 100 000 obyvatel v roce 2010 – a předpokládala se tendence k dalšímu snižování [22]. To podpořily matematické simulační studie, které předpověděly, že měsíční aplikace ranibizumabu mají potenciál snížit výskyt praktické slepoty o 72 % [23]. Dlouhodobá klinická data z Oční kliniky 1. LF UK a VFN v Praze tak podporují matematické modely.
Aflibercept
Aflibercept je lékem srovnatelně účinným s ranibizumabem (tab. 1). Do klinické praxe 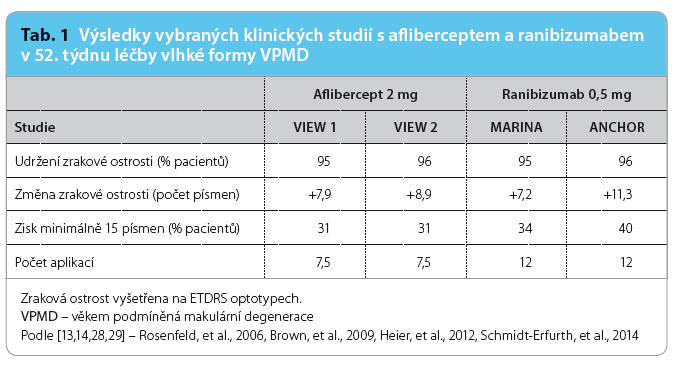 se dostal v roce 2011. Aflibercept je rekombinantní fúzní protein skládající se z částí extracelulárních domén humánních receptorů 1 a 2 pro VEGF fúzovaných na Fc fragment humánního IgG1. Aflibercept (VEGF trap, tzn. „VEGF‑past”) působí jako rozpustný falešný receptor, který váže všechny izoformy VEGF‑A, dále VEGF‑B, PlGF‑1 a PlGF‑2. Vazebná afinita afliberceptu pro VEGF‑A a PlGF je vyšší než afinita jejich přirozených receptorů. Aflibercept tak účinně blokuje vazbu a aktivaci receptorů VEGF a proliferaci endotelových buněk a tím inhibuje růst abnormálních nových cév [24]. Proniká všemi vrstvami sítnice a neindukuje apoptózu [25,26]. U pacientů léčených afliberceptem se obecně snižuje tloušťka sítnice brzy po zahájení léčby, také se zmenšuje plocha léze [27].
se dostal v roce 2011. Aflibercept je rekombinantní fúzní protein skládající se z částí extracelulárních domén humánních receptorů 1 a 2 pro VEGF fúzovaných na Fc fragment humánního IgG1. Aflibercept (VEGF trap, tzn. „VEGF‑past”) působí jako rozpustný falešný receptor, který váže všechny izoformy VEGF‑A, dále VEGF‑B, PlGF‑1 a PlGF‑2. Vazebná afinita afliberceptu pro VEGF‑A a PlGF je vyšší než afinita jejich přirozených receptorů. Aflibercept tak účinně blokuje vazbu a aktivaci receptorů VEGF a proliferaci endotelových buněk a tím inhibuje růst abnormálních nových cév [24]. Proniká všemi vrstvami sítnice a neindukuje apoptózu [25,26]. U pacientů léčených afliberceptem se obecně snižuje tloušťka sítnice brzy po zahájení léčby, také se zmenšuje plocha léze [27].
Bezpečnost a účinnost afliberceptu u pacientů s vlhkou formou VPMD byly hodnoceny ve dvou paralelních studiích s aktivní kontrolou. Ve studii VIEW 1 (N = 1 210) byla zraková ostrost udržena v týdnu 52 u 95,1 % pacientů, ve studii VIEW 2 (N = 1 202) bylo tohoto výsledku dosaženo u 95,6 % pacientů (tab. 1). Podíl pacientů, kteří v týdnu 96 získali minimálně 15 písmen optotypů ETDRS oproti výchozímu stavu, byl 33,4 %. Ve druhém roce studií tak byla účinnost udržena do posledního hodnocení v 96. týdnu. Zmenšení průměrné plochy CNV bylo patrné ve všech skupinách v obou studiích [28,29].
Aflibercept v očním lékařství je určen pro injekci do sklivcové dutiny k docílení lo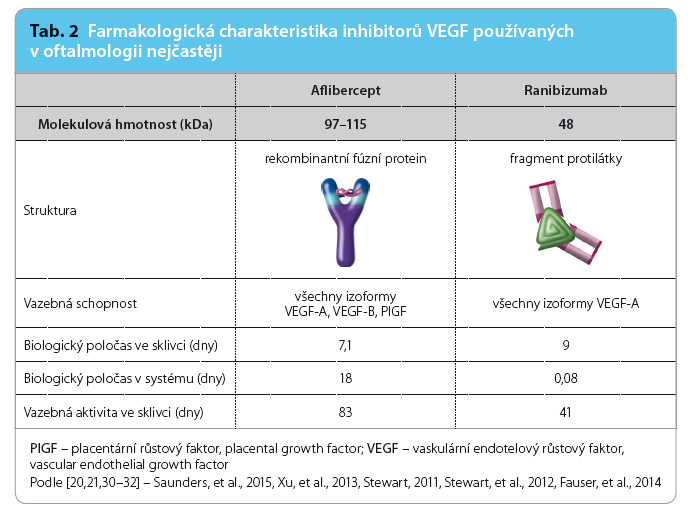 kálního účinku v oku. U vlhké formy VPMD je jednotlivá doporučená dávka 2 mg afliberceptu, což odpovídá 50 µl. Na začátku léčby se podává jedna injekce měsíčně ve třech po sobě jdoucích dávkách, následně se podává jedna injekce každé dva měsíce. Po prvních 12 měsících léčby může být na základě vyšetření zrakové ostrosti a anatomických změn léčebný interval prodloužen. Biologický poločas afliberceptu ve sklivci je 7,1 dne, po podání do sklivce trvá jeho vazebná aktivita přibližně 83 dnů (tab. 2) [30–32].
kálního účinku v oku. U vlhké formy VPMD je jednotlivá doporučená dávka 2 mg afliberceptu, což odpovídá 50 µl. Na začátku léčby se podává jedna injekce měsíčně ve třech po sobě jdoucích dávkách, následně se podává jedna injekce každé dva měsíce. Po prvních 12 měsících léčby může být na základě vyšetření zrakové ostrosti a anatomických změn léčebný interval prodloužen. Biologický poločas afliberceptu ve sklivci je 7,1 dne, po podání do sklivce trvá jeho vazebná aktivita přibližně 83 dnů (tab. 2) [30–32].
V p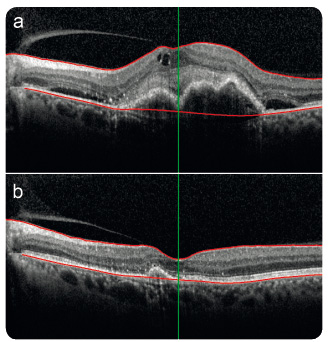 rvním roce léčby v běžné klinické praxi na Oční klinice 1. LF UK a VFN v Praze (2014–2015, N = 43) pacienti získali průměrně 8,0 písmene ETDRS optotypů, přičemž největší zlepšení zrakové ostrosti nastalo u většiny pacientů v průběhu tří měsíců při měsíčním intervalu dávkování afliberceptu (+5,9 písmene), které bylo následně udržováno doporučeným dávkovacím režimem (obr. 12).
rvním roce léčby v běžné klinické praxi na Oční klinice 1. LF UK a VFN v Praze (2014–2015, N = 43) pacienti získali průměrně 8,0 písmene ETDRS optotypů, přičemž největší zlepšení zrakové ostrosti nastalo u většiny pacientů v průběhu tří měsíců při měsíčním intervalu dávkování afliberceptu (+5,9 písmene), které bylo následně udržováno doporučeným dávkovacím režimem (obr. 12).
Všechny uvedené anti‑VEGF přípravky se aplikují do sklivce oka. Injekce musí podávat kvalifikovaný lékař se zkušenostmi s touto formou aplikace. Musí být zajištěna anestezie a asepse, která zahrnuje použití lokálního širokospektrého mikrobicidního prostředku, jakým je např. jodovaný povidon aplikovaný na kůži kolem oka, oční víčko a na povrch oka. Je doporučena chirurgická dezinfekce rukou, použití sterilních rukavic, sterilní roušky a sterilního spekula. Injekční jehla se zasune 3,5–4,0 mm posteriorně od limbu rohovky do prostoru sklivce tak, aby směřovala do centra očního bulbu. Poté se aplikuje doporučený objem přípravku. Ihned po podání léku do sklivcové dutiny by pacienti měli být sledováni s ohledem na riziko zvýšení nitroočního tlaku. Kontraindikací injekce do sklivcové dutiny je aktivní oční nebo periokulární infekce nebo podezření na ni, aktivní závažný nitrooční zánět a hypersenzitivita na léčivou látku nebo na kteroukoli z pomocných látek přípravku. Závažné nežádoucí účinky související s injekční aplikací zahrnují kataraktu, odchlípení sítnice, odloučení zadní sklivcové membrány, endoftalmitidu a zvýšení nitroočního tlaku [11–19,28,29]. Pacienti by měli být poučeni, aby ihned hlásili všechny příznaky, které by mohly svědčit pro endoftalmitidu (bolest oka, světloplachost, zhoršující se vidění, zarudnutí oka), a tyto příznaky by měly být bez prodlení léčeny. Po intravitreálním použití inhibitorů VEGF existuje teoretické riziko vzniku arteriálních tromboembolických příhod, které potenciálně souvisejí se systémovou inhibicí VEGF. Arteriální tromboembolické příhody zahrnují infarkt myokardu, cévní mozkovou příhodu nebo úmrtí z kardiovaskulární příčiny [33].
Účinná léčba suché formy VPMD dosud není k dispozici. Příznivý vliv doplnění vitaminů a minerálů s antioxidačními účinky v kombinaci s makulárními karotenoidy na zastavení nebo zpomalení progrese středně pokročilého a pokročilého stadia VPMD potvrdily studie AREDS (N = 4 757) a AREDS2 (N = 4 203) [34]. Nahrazení beta‑karotenu z původního složení doporučeného studií AREDS za lutein a zeaxantin ve studii AREDS2 vedlo ke snížení rizika vzniku karcinomu plic u kuřáků cigaret. Strategie vyvíjené léčby se aktuálně zaměřuje na ochranu fotoreceptorů a na potlačení zánětlivého procesu.
Dostupné novinky v léčbě
V současné době probíhají vybrané klinické studie fáze III, jejichž cílem je prodloužení doby účinku a snížení frekvence dávkování nových anti‑VEGF přípravků a hodnocení nových mechanismů působení léčiv.
Abicipar pegol patří do rodiny DARPin (designed ankyrin repeat proteins). Jedná se o rekombinantní vazebné proteiny s opakujícím se motivem malých membránových molekul ankyrinů, každý o velikosti 3,5 kDa tvořený 33 aminokyselinami. Jejich povrch vytváří souvislou vazebnou plochu. Abicipar má vysokou specifitu a vysokou afinitu k VEGF‑A a způsobuje jeho dlouhodobou inhibici. Oproti ostatním běžně užívaným léčivům má nižší celkovou molekulovou hmotnost 34 kDa a delší biologický poločas ve sklivci. Díky možnosti variabilního uspořádání ankyrinů v DARPin může být vazebný protein upravován k vazbě různých cílových molekul [35].
Brolucizumab, dříve označovaný jako RTH258 a ESBA1008, je humanizovaný fragment jednořetězcové protilátky s nízkou molekulovou hmotností 26 kDa účinkující proti všem izoformám VEGF‑A. Mezi výhody menší velikosti molekuly patří lepší průnik do cílové tkáně s vyšší lokální koncentrací léčiva a s jeho nižší systémovou expozicí. Předchozí klinická hodnocení prokázala vyšší a déletrvající účinek, než mají běžně používaná léčiva, projevující se větším zlepšením zrakové ostrosti, stabilizací snížené výšky sítnice a prodloužením intervalu aplikací [36].
Conbercept (KH 902) je lék původem z Číny. Jde o rekombinantní fúzní protein složený ze druhé extracelulární domény VEGFR‑1 a ze třetí a čtvrté extracelulární domény VEGFR‑2, které jsou navázány na Fc fragment humánního IgG. Strukturou je tak podobný afliberceptu, kterému však chybí doména 4, díky níž může mít conbercept vyšší afinitu ke všem izoformám VEGF a PlGF [37,38].
E10030 je rekombinantní humánní destičkový růstový faktor (platelet derived growth factor, PDGF), homodimer BB, který vazbou blokuje receptor PDGF‑ß, lokalizovaný na pericytech. Obecně má PDGF dimerickou stukturu. Tvořen je polypeptidovými řetězci A, B, C a D, které mohou vytvářet heterodimer AB nebo homodimery AA, BB, CC nebo DD lišící se afinitou k receptorům. Výsledkem inhibice receptoru PDGF‑ß je porucha regulace a přežívání pericytů s jejich ztrátou; PDGF‑ß a pericyty spolu s VEGF hrají významnou roli v angiogenezi, PDGF a pericyty asistují při formování jizvy. Kombinovaná inhibice VEGF a PDGF prokázala potenciál k účinnější léčbě neovaskularizací a nižší tendenci k tvorbě jizev [39].
Připravované nebo probíhající studie fáze I a II hodnotící nové léky a terapeutické postupy zahrnují genovou terapii, léčbu kmenovými buňkami, opakovaně plnitelné rezervoáry léků, suprachorioideální podávání léčiv či množství přípravků k léčbě suché formy VPMD.
Současná doporučení
Včasná diagnostika a rychlé zahájení léčby vlhké formy VPMD jsou klíčovými podmínkami pro stabilizaci onemocnění a v mnoha případech i pro dosažení zlepšení zrakové ostrosti. Nejpřínosnějšími diagnostickými testy k detekci nově vzniklé nebo recidivující patologické novotvorby cév a k indikaci léčby jsou optická koherenční tomografie a fluorescenční angiografie. Inhibitory vaskulárního endotelového růstového faktoru aplikované do sklivce postiženého oka představují nejúčinnější léčbu vlhké formy VPMD a jsou lékem první volby. Nitrooční injekce anti‑VEGF přípravků jsou všeobecně velmi dobře tolerovány. Jen vzácně jsou spojeny se závažnými komplikacemi, jako je infekční endoftalmitida nebo odchlípení sítnice. Pokud se však objeví jejich příznaky, vyžadují bezodkladný a intenzivní přístup. Při terapii vlhké formy VPMD je nezbytné kontrolovat bezpečnost a účinnost léčby a zajistit dlouhodobé sledování a odpovídající individuální péči podle potřeb pacienta [40].
Fotografie v článku: archiv autora.
Práce byla podpořena grantem SVV UK 260148/2015.
Seznam použité literatury
- [1] Kolář P, et al. Věkem podmíněná makulární degenerace. Praha: Grada Publishing, 2008.
- [2] Kousal B, Dubská Z. Věkem podmíněná makulární degenerace – principy a léčba. Postgrad Med 2010; 12: 257–264.
- [3] Bressler NM, Silva JC, Bressler SB, et al. Clinicopathologic correlation of drusen and retinal pigment epithelial abnormalities in age related macular degeneration. Retina 1994; 14: 130–142.
- [4] Anderson DH, Mullins RF, Hageman GS, et al. A role for local inflammation in the formation of drusen in the aging eye. Am J Ophthalmol 2002; 134: 411–431.
- [5] Johnson LV, Leitner WP, Staples MK, et al. Complement activation and inflammatory processes in Drusen formation and age related macular degeneration. Exp Eye Res 2001; 73: 887–896.
- [6] Khan JC, Thurlby DA, Shahid H, et al. Smoking and age related macular degeneration: the number of pack years of cigarette smoking is a major determinant of risk for both geographic atrophy and choroidal neovascularisation. Br J Ophthalmol 2006; 90: 75–80.
- [7] Meads C, Hyde C. Photodynamic therapy with verteporfin is effective, but how big is its effect? Results of a systematic review. Br J Ophthalmol 2004; 88: 212–217.
- [8] Bressler NM. Photodynamic therapy of subfoveal choroidal neovascularization in age related macular degeneration with verteporfin: two year results of 2 randomized clinical trials tap report 2. Arch Ophthalmol 2001; 119: 198–207.
- [9] Bressler NM. Verteporfin therapy of subfoveal choroidal neovascularization in age related macular degeneration: two year results of a randomized clinical trial including lesions with occult with no classic choroidal neovascularization verteporfin in photodynamic therapy report 2. Am J Ophthalmol 2002; 133: 168–169.
- [10] Hicklin DJ, Ellis LM. Role of the vascular endothelial growth factor pathway in tumor growth and angiogenesis. J Clin Oncol 2005; 23: 1011–1027.
- [11] Chakravarthy U, Adamis AP, Cuninngham ET Jr., et al. Year 2 efficacy results of 2 randomized controlled clinical trials of pegaptanib for neovascular age related macular degeneration. VEGF Inhibition Study in Ocular Neovascularization (V.I.S.I.O.N.) Clinical Trial Group. Ophthalmology 2006; 113: 1508.e1–25.
- [12] Vinores SA. Pegaptanib in the treatment of wet, age related macular degeneration. Int J Nanomedicine 2006; 1: 263–268.
- [13] Rosenfeld PJ, Brown DM, Heier JS, et al. Ranibizumab for neovascular age related macular degeneration. N Engl J Med 2006; 355: 1419–1431.
- [14] Brown DM, Michels M, Kaiser PK, et al. Ranibizumab versus verteporfin photodynamic therapy for neovascular age related macular degeneration: Two year results of the ANCHOR study. Ophthalmology 2009; 116: 57–65.
- [15] Abraham P, Yue H, Wilson L. Randomized, double masked, sham controlled trial of ranibizumab for neovascular age related macular degeneration: PIER study year 2. Am J Ophthalmol 2010; 150: 315–324.
- [16] Schmidt Erfurth U, Eldem B, Guymer R, et al. Efficacy and safety of monthly versus quarterly ranibizumab treatment in neovascular age related macular degeneration: the EXCITE study. Ophthalmology 2011; 118: 831–839.
- [17] Boyer DS, Heier JS, Brown DM, et al. A Phase IIIb study to evaluate the safety of ranibizumab in subjects with neovascular age related macular degeneration. Ophthalmology 2009; 116: 1731–1739.
- [18] Holz FG, Amoaku W, Donate J, et al. Safety and efficacy of a flexible dosing regimen of ranibizumab in neovascular age related macular degeneration: the SUSTAIN study. Ophthalmology 2011; 118: 663–671.
- [19] Fung AE, Lalwani GA, Rosenfeld PJ, et al. An optical coherence tomography guided, variable dosing regimen with intravitreal ranibizumab (Lucentis) for neovascular age related macular degeneration. Am J Ophthalmol 2007; 143: 566–583.
- [20] Saunders DJ, Muether PS, Fauser S. A model of the ocular pharmacokinetics involved in the therapy of neovascular age related macular degeneration with ranibizumab. Br J Ophthalmol 2015; 99: 1554–1559.
- [21] Xu L, Lu T, Tuomi L, et al. Pharmacokinetics of ranibizumab in patients with neovascular age related macular degeneration: a population approach. Invest Ophthalmol Vis Sci 2013; 54: 1616–1624.
- [22] Bloch SB, Larsen M, Munch IC. Incidence of legal blindness from age related macular degeneration in Denmark: year 2000 to 2010. Am J Ophthalmol 2012; 153: 209–213.e2.
- [23] Bressler NM, Doan QV, Varma R, et al. Estimated cases of legal blindness and visual impairment avoided using ranibizumab for choroidal neovascularization: non Hispanic white population in United States with age related macular degeneration. Arch Ophthalmol 2011; 129: 709–717.
- [24] Browning DJ, Kaiser PK, Rosenfeld PJ, et al. Aflibercept for age related macular degeneration: a game changer or quiet addition? Am J Ophthalmol 2012; 154: 222–226.
- [25] Schnichels S, Hagemann U, Januschowski K, et al. Comparative toxicity and proliferation testing of aflibercept, bevacizumab and ranibizumab on different ocular cells. Br J Ophthalmol 2013; 97: 917–923.
- [26] Malik D, Tarek M, Caceres del Carpio J, et al. Safety profiles of anti VEGF drugs: bevacizumab, ranibizumab, aflibercept and ziv aflibercept on human retinal pigment epithelium cells in culture. Br J Ophthalmol 2014; 98 (Suppl 1): i11–16.
- [27] Nguyen QD, Campochiaro PA, Shah SM, et al. Evaluation of very high and very low dose intravitreal aflibercept in patients with neovascular age related macular degeneration. J Ocul Pharmacol Ther 2012; 28: 581–588.
- [28] Heier JS, Brown DM, Chong V, et al. Intravitreal aflibercept (VEGF trap eye) in wet age related macular degeneration. Ophthalmology 2012; 119: 2537–2548.
- [29] Schmidt Erfurth U, Kaiser PK, Korobelnik JF, et al. Intravitreal aflibercept injection for neovascular age related macular degeneration: ninety six week results of the VIEW studies. Ophthalmology 2014; 121: 193–201.
- [30] Stewart MW. What are the half lives of ranibizumab and aflibercept (VEGF trap eye) in human eyes? Calculations with a mathematical model. Eye Rep 2011; 1: e5.
- [31] Stewart MW, Grippon S, Kirkpatrick P. Aflibercept. Nat Rev Drug Discov 2012; 11: 269–270.
- [32] Fauser S, Schwabecker V, Muether PS. Suppression of intraocular vascular endothelial growth factor during aflibercept treatment of age related macular degeneration. Am J Ophthalmol 2014; 158: 532–536.
- [33] Antithrombotic Trialists‘ Collaboration. Collaborative meta analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002; 324: 71–86.
- [34] Age Related Eye Disease Study 2 Research Group. Lutein + zeaxanthin and omega 3 fatty acids for age related macular degeneration: the Age Related Eye Disease Study 2 (AREDS2) randomized clinical trial. JAMA 2013; 309: 2005–2015.
- [35] Souied EH, Devin F, Mauget Faÿsse M, et al. Treatment of exudative age related macular degeneration with a designed ankyrin repeat protein that binds vascular endothelial growth factor: a phase I/II study. Am J Ophthalmol 2014; 158: 724–732.e2.
- [36] Dugel P. Results of ESBA 1008, a single chain antibody fragment for the treatment of neovascular AMD. Annual meeting of the American Society of Retina Specialists, San Diego, California, 9 13. 8. 2014.
- [37] Wang Q, Li T, Wu Z, et al. Novel VEGF decoy receptor fusion protein conbercept targeting multiple VEGF isoforms provide remarkable anti angiogenesis effect in vivo. PLoS One 2013; 8: e70544.
- [38] Nguyen TT, Guymer R. Conbercept (KH 902) for the treatment of neovascular age related macular degeneration. Expert Rev Clin Pharmacol 2015; 8: 541–548.
- [39] Jaffe GJ, Eliott D, Wells JA, et al. A Phase 1 Study of Intravitreous E10030 in Combination with Ranibizumab in Neovascular Age Related Macular Degeneration. Ophthalmology 2016; 123: 78–85.
- [40] Agarwal A, Rhoades WR, Hanout M, et al. Management of neovascular age related macular degeneration: current state of the art care for optimizing visual outcomes and therapies in development. Clin Ophthalmol 2015; 9: 1001–1015.