Vezikulové nosiče liečiv v topickej a transdermálnej aplikácii
Súhrn:
Špaglová M, Čuchorová M, Molitorisová M. Vezikulové nosiče liečiv v topickej a transdermálnej aplikácii. Remedia 2019; 29: 477–480.
Cieľom prípravy liekovej formy je zabezpečiť prívod liečiva na miesto účinku v požadovanej terapeutickej koncentrácii so zanedbateľnými vedľajšími účinkami. Topické prípravky pôsobia lokálne v mieste ich aplikácie na základe prieniku liečiv do vrstiev kože alebo slizníc. Prirodzenou bariérou pre lokálne podanie je koža, ktorá sťažuje prechod liečiva z tradičných topických prípravkov. Navyše, topická aplikácia je výrazne ovplyvnená fyzikálno‑chemickými vlastnosťami liečiva, najmä jeho rozpustnosťou. Jedno z riešení poskytuje využitie nosičov liečiva. Mimoriadnu pozornosť pútajú práve vezikulové nosičové systémy. Nanoštruktúra vezikulových nosičov umožňuje enkapsuláciu liečiva v hydrofilnom jadre alebo lipidovej dvojvrstve, čím zlepšuje distribúciu ťažko rozpustných alebo nestabilných liečiv v koži po topickej alebo transdermálnej aplikácii. Fyzikálno‑chemické vlastnosti vezikulových systémov, ako napr. veľkosť, náboj, tvar či elasticita dvojvrstvy, významne ovplyvňujú ich správanie a tiež ich potenciál ako nosičov liečiv.
Summary:
Spaglova M, Cuchorova M, Molitorisova M. Vesicular drug carrier systems in topical and transdermal application. Remedia 2019; 29: 477–480.
The purpose of drug dosage form preparation is to provide the drug delivery to the location of its action at the desired therapeutic concentration with negligible side effects. Topical formulations act locally at their site of application on the basis of drug penetration into the skin layers. The natural barrier for topical administration is the skin. Due to poor permeability of stratum corneum, dermal transport of drugs from conventional topical preparations is difficult. In addition, topical application is strongly influenced by the physicochemical properties of the drug, particularly its solubility. One of possible solutions is the application of drug carriers in topical dosage forms. Attention is especially focused on vesicular drug carrier systems. The nanostructure of the vesicles allows encapsulation of drugs in the hydrophilic core or lipid bilayer, thereby improving the distribution of poorly soluble or unstable drugs in the skin after topical or transdermal administration. Physicochemical properties of vesicular systems, such as their size, charge, shape or elasticity of the bilayer, significantly affect their behavior as well as their potential as dru
Key words: penetration enhancer, ethosome, transferosome, niosome, liposome.
Vezikulové nosiče liečiv
Vezikuly sú štruktúry zložené
z centrálnej hydrofilnej časti ohraničenej po obvode
jednou alebo viacerými fosfolipidovými dvojvrstvami. Vďaka svojim
amfifilným vlastnostiam môžu lipidové vezikuly slúžiť ako
netoxické promotory penetrácie liečiv [1,2]. Systém dokonca
poskytuje početné možnosti pre enkapsuláciu hydrofilných,
lipofilných aj amfifilných liečiv. Práve preto sa predpokladá,
že lipidové vezikuly dokážu preniesť významné množstvo liečiv
cez kožu a tak urýchliť ich systémovú absorpciu [3,4].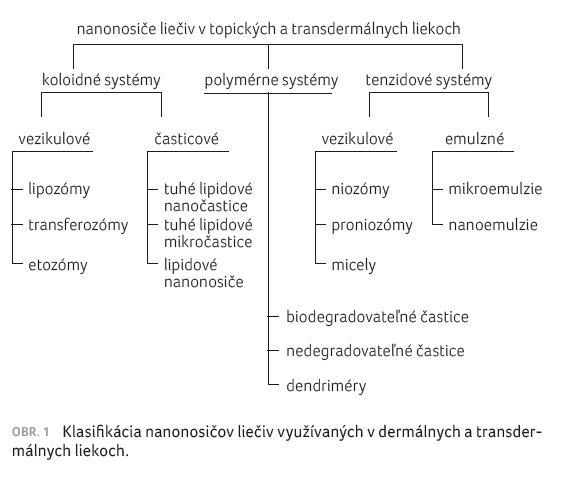
Ako uvádza obrázok 1, z chemického hľadiska je možné nosiče liečiv klasifikovať na koloidné, polymérne a tenzidové [5,6]. Vezikulové nosičové systémy môžu byť nedeformovateľné, napr. lipozómy a niozómy, a deformovateľné (elastické), napr. transferozómy, etozómy (pozri obr. 2) [6].
Lipozómy
Lipozómy
predstavujú sférické vezikuly zložené
z fosfolipidovej dvojvrstvy usporiadanej tak, že v ich
vnútri je uzavreté hydrofilné rozpúšťadlo tvoriace hydrofilné
jadro obsahujúce zapuzdrené hydrofilné liečivo. Ak má byť
lipozóm súčasne nosičom aj pre lipofilné liečivo, toto býva
rozpustené priamo v lipidovej dvojvrstve. Vzhľadom na ich
veľkosť možno rozlišovať malé unilamelárne vezikuly
s veľkosťou do 100 nm, veľké unilamelárne vezikuly
s veľkosťou od 100 nm do 1 μm a najväčšie
unilamelárne vezikuly s veľkosťou nad 1 μm. Pre topickú
aplikáciu sú najperspektívnejšie práve tie najmenšie. Lipozómy
sú tvarovo rozmanité, to znamená, že okrem unilamelárnej môžu
vytvárať aj multilamelárnu, prípadne multivezikulárnu štruktúru
[7,8].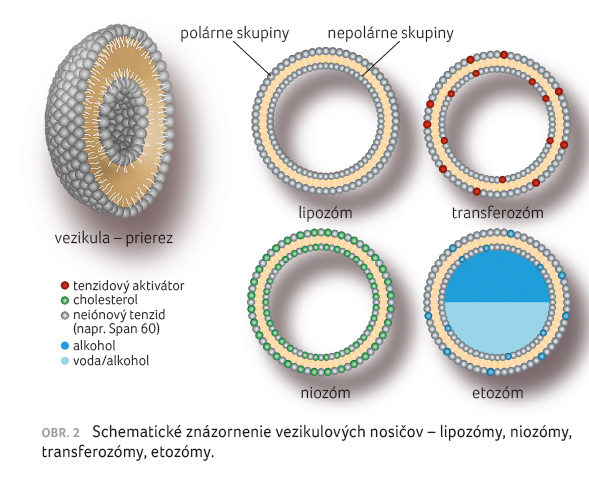
Medzi metódy prípravy lipozómov patrí hydratácia lipidového filmu, emulzifikácia, odparovanie v reverznej fáze, striedavý proces zmrazovania a roztápania a pod. Veľké lipozómy sa formujú spontánne, dispergovaním fosfolipidov vo vode pri teplote vyššej, ako je teplota ich fázového prechodu. V snahe zmenšiť ich veľkosť je potrebné využiť metódu sonifikácie, prípadne vysokotlakovej homogenizácie. Percento enkapsulovaného hydrofilného liečiva závisí od zloženia lipidovej dvojvrstvy a od spôsobu prípravy [9].
Lipozómy sú potenciálnymi nosičmi topicky aplikovaných liečiv, a to vďaka niekoľkým výhodným vlastnostiam. Vyznačujú sa vysokou solubilizačnou kapacitou tak pre hydrofilné, ako aj pre lipofilné liečivá, čo z nich robí ideálne nosiče pre ťažko rozpustné liečivá. Vďaka membráne riadiacej rýchlosť uvoľňovania liečiva sa môžu použiť ako lokálne depotné systémy s postupným uvoľňovaním liečiva (napr. antibiotík, kortikosteroidov, tretinoínu). Lipozómy spôsobujú reverzibilnú reorganizáciu stratum corneum, najvrchnejšej a zároveň najmenej priepustnej vrstvy pokožky [10].
Potenciál lipozómov ako nosičov topicky pôsobiacich liečiv objavili Mezei a Gulasekharam (1980). Vo svojej vedeckej práci zistili 4 až 5 násobne vyššiu koncentráciu triamcinolón acetonidu v pokožke a zamši s nižšími systémovými koncentráciami liečiva po aplikácii lipozomálneho lócia v porovnaní s konvenčným triamcinolónovým prípravkom. Podobné výsledky získali s lipozomálnym gélom (1982), a to aj pre iné liečivá (progesterón, ekonazol, 1985) [11]. Nasledoval rad in vivo, resp. ex vivo vedeckých štúdií, ktoré potvrdzovali zvýšenú kumuláciu liečiva (hydrokortizónu, lidokaínu, tretinoínu, cyklosporínu) v pokožke s minimálnym alebo žiadnym vplyvom na jeho absorpciu [11]. Viaceré vedecké práce sa zaoberajú enkapsuláciou terbinafín hydrochloridu do lipozómov a ich následným hodnotením [12,13]. Tanriverdi a kol. porovnávali uvoľňovanie daného liečiva enkapsulovaného v etozómoch alebo v lipozómoch z chitosanových a karbopolových gélov. Kumulatívne uvoľnené množstvo liečiva stanovené po 24 hodinách sa zvýšilo zo 40 % (za použitia lipozómov) na zhruba 60 % (za použitia etozómov) [13].
Prvým dermálnym lipozomálnym produktom na farmaceutickom trhu bol gél s obsahom antimykotika ekonazolu. Postupne sa portfólio lipozomálnych liekov rozšírilo. V súčasnosti sú registrované mnohé lipozomálne lieky s obsahom rôznych liečiv (amfotericín B, doxorubicín, daunorubicín, verteporfín, cytarabín, morfín sulfát, vinkristín sulfát a i.). Hoci viacerí autori prezentujú lipozómy ako vhodné nosiče transdermálne aplikovaných liečiv, je evidentné, že klasické lipozómy neprenikajú hlboko do kože, ale ostávajú najmä v stratum corneum, resp. vo vrchných vrstvách pokožky. Vzhľadom na spomenuté obmedzené schopnosti transdermálneho prestupu lipozómov sú uvedené liečivá podávané zväčša intravenózne [14]. Registrované sú však dva topické herbálne prípravky na báze lipozómov – dermálny prípravok s obsahom kolchicínu a transdermálny s obsahom katechínov [15].
Podobne ako mnohé iné koloidné nosiče liečiv našli aj lipozómy svoje uplatnenie v kozmetike. V roku 1987 bol na trh uvedený prvý lipozomálny krém proti vráskam renomovanej kozmetickej značky [5]. Od tej doby kozmetický priemysel zaplavili stovky ďalších lipozomálnych produktov. Využívajú sa najmä v krémoch a sérach s hydratačným, zvláčňujúcim alebo „anti aging“ účinkom. Mnohé antioxidanty sú nestále, citlivé na svetlo, zmenu pH či teploty, následkom čoho podliehajú oxidácii. Ak majú byť zachované v prípravku, je potrebné „chrániť“ ich. Riešenie v tomto smere poskytujú enkapsulačné postupy. V kozmetike sa na tento účel využívajú rôzne polymérne nosiče. Konvenčné lipozómy sa využívajú na enkapsuláciu a stabilizáciu najmä antioxidantov, ale aj inak farmakologicky aktívnych látok (polyfenolov z čajovníka, vitamínu E, retinolu, vitamínu C, arbutínu, kurkumínu, epigallokatechín galátu, koenzýmu Q10, tretinoínu, karotenoidov – lykopénu, luteínu a β karoténu) [16]. Hydrofilné biologicky aktívne látky, ako napr. vitamín B a C, sú enkapsulované v hydrofilnom jadre lipozómu, zatiaľ čo lipofilné, ako napríklad vitamín A, koenzým Q10, kyselina linolénová a ceramidy, sú súčasťou lipidovej dvojvrstvy. Lee a kol. syntetizovali sférické silicové hybridné lipozómy s obsahom antioxidačne pôsobiaceho citrusového extraktu z unshiu [17]. Hlavným obmedzením vo využití lipozómov ako nosičov biologicky aktívnych látok je ich nestabilita a možné alergické reakcie spôsobené zvýšenými koncentráciami týchto látok v pokožke a zamši [5,14].
Ďalšie lipozomálne lieky sa nachádzajú v štádiu klinického skúšania. Z topických prípravkov ide najmä o lieky s obsahom lokálnych anestetík, liečiv na terapiu kožných infekcií a kožných ochorení, ako je akné alebo psoriáza. Klinicky sa hodnotí aj transdermálny prípravok s estradiolom na potlačenie menopauzálnych prejavov [7,8]. Mnohé štúdie potvrdili, že čo sa týka kinetiky uvoľňovania liečiva z lipozomálnych gélov, steady state flux (proces difúzie, kedy molekuly látky prestupujú cez bariéru konštantne s časom), sa dosiahne približne po troch hodinách, tzn. že dané systémy možno využiť ako systémy s postupným alebo spomaleným uvoľňovaním.
Niozómy
Niozómy sú vezikuly vytvárané neiónovými povrchovo aktívnymi látkami vo vodnom prostredí. Vyvinuli sa ako lacnejšia alternatíva fosfolipidových vezikúl, teda lipozómov. Majú potenciál ako nosiče hydrofilných aj lipofilných liečiv. Venuje sa im rozsiahla pozornosť, pretože sú vďaka vyššej stabilite a cenovej dostupnosti vhodnou náhradou lipozómov. Ich príprava spočíva v rozpustení cholesterolu a ďalšej povrchovo aktívnej látky spolu s liečivom v zmesi chloroformu a metanolu. Odparovaním rozpúšťadiel sa získa tenký film, ktorý sa čistí a následne hydratuje vodou. Na finálne zmenšenie veľkosti niozómov sa najčastejšie používa ultrazvukové pôsobenie [18].
Niozómy ako nosiče nesteroidného antiflogistika lornoxikamu zabezpečili zvýšenie množstva permeovaného liečiva 1,5 násobne oproti referenčnému vehikulu, výsledkom čoho bola aj výrazná inhibícia edému [19]. Zvýšenie protizápalovej aktivity lornoxikamu prostredníctvom niozómov potvrdzuje aj experimentálna práca Kubharu a kol. [20]. Pando a kol. porovnávali vplyv zvolenej metódy ich prípravy na transdermálnu permeáciu resveratrolu ex vivo difúziou cez kožu prasaťa. Niozómy pripravené modifikovanou injekčnou metódou boli o 21 % efektívnejšie v porovnaní s niozómami pripravenými tenkovrstvovou hydratáciou [21].
Niozómy sú sľubným kľúčom k zlepšeniu penetrácie a ďalších charakteristík biologickej dostupnosti aj pre topicky pôsobiace liečivá, napr. minoxidil. Výsledky vedeckej práce dokazujú, že niozómy s obsahom cholesterolu v kombinácii s tenzidmi BrijTM, resp. SpanTM pripravené tenkovrstvovou hydratáciou zlepšujú perkutánny prestup a zároveň zadržané množstvo minoxidilu v koži [22]. Existuje viacero prístupov, ktorými by sa mohla vysvetliť schopnosť niozómov ovplyvňovať prestup liečiva cez kožu. Jednou z hypotéz je fúzia niozómových vezikúl s vrstvou stratum corneum, čo vedie k zvýšeniu koncentračného gradientu a následne k zlepšeniu prestupu cez pokožku. V súčasnosti sú niozómy predmetom výskumu ako potenciálne nosiče liečiv v terapii zápalových ochorení, diabetes ako aj rakoviny. Okrem toho našli svoje uplatnenie aj v génovej terapii a v kozmetickom priemysle [18,23,24].
Obmedzené transportné schopnosti lipozómov a niozómov [25] podnietili vývoj vezikulových nosičov so zlepšenými transportnými vlastnosťami. Ide o elastické a flexibilné vezikuly, transferozómy a etozómy, ktoré sa osvedčili hlavne v transdermálnych liekových systémoch.
Transferozómy
Transferozómy sú umelé deformovateľné vezikuly. Zložením sú podobné lipozómom, ale navyše obsahujú excipienty zmäkčujúce lipidovú dvojvrstvu, čo zabezpečí ich elasticitu a možnosť penetrovať cez kožu intracelulárnym alebo intercelulárnym spôsobom. Sú zložené z fosfolipidov a aktivátora. Najčastejšie sa ako aktivátor používa povrchovo aktívna látka s jedným uhlíkatým reťazcom a veľkým polomerom zakrivenia destabilizujúcim lipidovú dvojvrstvu vezikúl, čím sa zvyšuje deformovateľnosť dvojvrstvy. Medzi efektívne aktivátory patrí napr. cholát sodný, deoxycholát sodný, Span 60, Span 65, Span 80, Tween 20, Tween 60, Tween 80 [11]. Elasticita vezikúl koreluje s množstvom a štruktúrou inkorporovaného tenzidu [9]. V porovnaní s lipozómami sú transferozómy vďaka vyššej elasticite lepšie prispôsobené na transport farmaceuticky aktívnych látok cez kožu.
Ďalšou významnou charakteristikou je ich biokompatibilita, ľahká odbúrateľnosť a schopnosť chrániť enkapsulované liečivo pred metabolickou degradáciou. Sú efektívnymi nosičmi schopnými transportovať liečivo cez intercelulárne priestory kože 5 až 10 násobne menších rozmerov, ako je ich vlastný priemer, bez výrazných strát [26]. Používajú sa ako nosiče pre rozličné farmaceuticky aktívne látky, ako sú peptidy, proteíny (inzulín, albumíny), DNA, antigény, nutraceutiká, analgetiká, anestetiká, kortikosteroidy, pohlavné hormóny, inzulín atď. Z toho vyplýva, že umožňujú tak systémový, ako aj lokálny účinok liečiva. Využívajú sa ako depotné systémy uvoľňujúce farmaceuticky aktívne látky pomaly a postupne. Výrazne zvyšujú množstvo farmaceuticky aktívnych látok, ktoré permeovalo do kože. Ich transport cez lipidovú matrix rohovinovej vrstvy je dôsledkom hydratácie a osmotického tlaku. Okrem toho tiež poskytujú spôsob neinvazívneho histologického skúmania kože [27,28].
Na trhu sa už objavili prírodné prípravky na báze trasferozómov s obsahom kapsaicínu. Po topickej aplikácii zabezpečujú transferozómy vyššiu absorpciu liečiva v porovnaní s čistým kapsaicínom [15]. Ali a kol. vo svojej experimentálnej práci hodnotili transferozómy ako nosiče populárneho vazodilatátora papaverín hydrochloridu ako alternatívu k bolestivej injekčnej liečbe erektilnej dysfunkcie. Ich vplyv sa hodnotil prostredníctvom Dopplerovho merania prietoku farbiva (Color flow Doppler measurements) na základe zväčšenia priemeru tepny. Po topickej aplikácii transferozomálneho prípravku bolo zaznamenané zväčšenie o viac ako 65 % u troch z deviatich pacientov, zatiaľ čo po aplikácii lieku bez transferozómu len u jedného z deviatich pacientov [29].
Táto skupina vezikulových nosičov však nebola doposiaľ výrazne komercializovaná. K nevýhodám patrí ich chemická nestálosť. Rýchlo podliehajú oxidačnej degradácii. Ich využitie ako nosičov liečiv tiež značne obmedzuje nízka čistota prírodných fosfolipidov a nutnosť ich purifikácie [27].
Etozómy
Etozómy sú lipidové vezikuly
obsahujúce fosfolipidy, vodu a relatívne vysoký obsah
alkoholu (20–50 %) spravidla s krátkym alifatickým
raťazcom (etanol, propylénglykol). Tieto inovatívne vezikuly sú
podobne ako transferozómy veľmi atraktívnymi a potenciálnymi
nosičmi liečiv vďaka schopnosti deformovať sa (obr. 3), čo im umožňuje transportovať liečivo do hlbších
vrstiev kože. Aby sa zvýšila ich stabilita a aby sa zabránilo
ich agregácii, na ich prípravu je vhodnejšie použiť binárnu
zmes etanolu a propylénglykolu [30].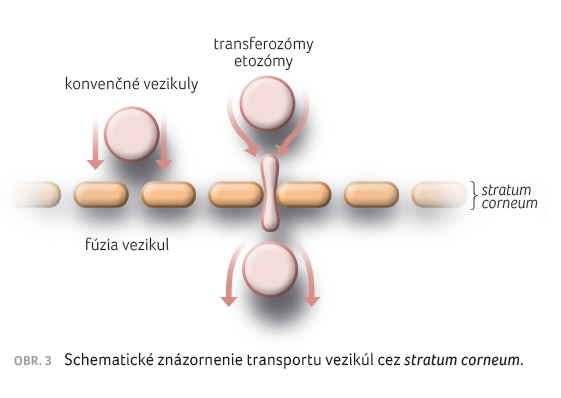
Etozómy sú netoxické, biodegradovateľné vďaka obsahu fosfolipidov a sú schopné pôsobiť ako terapeutické systémy s predĺženým uvoľňovaním liečiva. Ako nosičové systémy predchádzajú lipozómy, pretože dopravujú liečivo do hlbších vrstiev kože a vo vyšších množstvách [31,32]. Jedným z mnohých dôkazov je štúdia transdermálneho etozomálneho versus lipozomálneho prípravku s obsahom psoralénu UV. Výsledky naznačujú 3,5 krát vyšší transdermálny flux liečiva a 2,15 krát vyšší zostatok v koži v prípade použitia etozómov ako nosičov liečiva [33]. Etanol zabezpečuje elasticitu vezikúl, ale zároveň plní aj funkciu promotora penetrácie. Interaguje s polárnymi skupinami fosfolipidov, čo má za následok zníženie teploty topenia lipidov v rohovinovej vrstve, čím sa zlepší celková fluidita a permeabilita bunkových membrán. Ich elasticita zabezpečená prídavkom etanolu im umožňuje prechádzať pórmi, ktoré majú menšie rozmery ako ony samy [34].
Jedným z jednoduchších spôsobov prípravy je rozpustenie lecitínu a liečiva v binárnej zmesi etanolu a propylénglykolu v uzatvorenom prostredí za stáleho miešania pri laboratórnej teplote a za kontinuálneho pridávania vody. Následne sa zmenšuje ich veľkosť už spomínanými metódami [35].
Etozómy boli prvýkrát farmaceuticky testované na dermálne podanie antivirotika, acykloviru. Výsledky potvrdili, že etozómy zlepšujú biologickú dostupnosť acykloviru výraznejšie ako komerčný prípravok [36]. Touitou a kol. porovnávali penetráciu testosterónu z etozomálneho prípravku a z komerčnej náplasti. Množstvo testosterónu v koži po 24 hodinách bolo 7 krát vyššie a množstvo permeovaného liečiva cez kožu do disolučného média až 30 krát vyššie v porovnaní s komerčnou transdermálnou náplasťou [36]. Vedecká štúdia s terbinafín hydrochloridom tiež potvrdila pozitívny vplyv etozómov na transdermálny flux liečiva (Iizhar). Napriek pozitívnym výsledkom vedeckých štúdií využitie etozómov vo farmaceutickej praxi ešte zaostáva. Sú však rozsiahlo využívané v kozmetike. Medzi prvé komerčné produkty na báze etozómov patria anticelulitické krémy, krém s anti aging efektom a vlasové tonikum s antialopetickým účinkom [34].
Záver – potenciál vezikúl
v dermálnej a transdermálnej aplikácii
Ako vyplýva z uvedených skutočností, efektívnosť nosičového systému pre vybrané liečivo závisí jednak od fyzikálno chemických vlastností nosiča, najmä jeho lipidovej zložky, ale tiež od vlastností liečiva. Lipozómy a ich lacnejšia alternatíva niozómy sú vhodnejšie nosiče pre topicky aplikované liečivá, pretože podporujú kumuláciu liečiva vo vrchných vrstvách pokožky. Naopak transferozómy a etozómy majú veľký potenciál uplatniť sa v transdermálnych terapeutických systémoch, pretože sú schopné podporiť permeáciu liečiva hlboko do kože. Prípravky s obsahom liečiva, prípadne farmaceuticky aktívnej látky enkapuslovanej vo vezikulovom nosiči vykazujú jednoznačne lepšie výsledky oproti komerčným. Ich presadenie na farmaceutickom i kozmetickom trhu však bude značne závisieť od ich ekonomickej výhodnosti.
Seznam použité literatury
- [2] Kumar GP, Rajeshwarrao P. Nonionic surfactant vesicular systems for effective drug delivery – an overview. Acta Pharm Sin B 2011; 1: 208–219.
- [3] Honeywell‑Nguyen PL, Bouwstra JA. Vesicles as a tool for transdermal and dermal delivery. Drug Discov Today Technol 2005; 2: 67−74.
- [4] Cevc G. Lipid vesicles and other colloids as drug carriers on the skin. Adv Drug Deliv Rev 2004; 56: 675−711.
- [5] Gad SC. Pharmaceutical Manufacturing Handbook: Production and Processes. New Jersey: John Wiley & Sons 2008.
- [6] Mishra B, Patel BB, Tiwari S. Colloidal nanocarriers: a review on formulation technology, types and applications toward targeted drug delivery. Nanomedicine 2010; 6: 9−24.
- [7] Schubert R. Lipozómy v liekoch. In: Žabka M, et al. Moderné lieky vo farmaceutickej technológii: Bratislava: Slovak Academic Press, 1999.
- [8] Patil SD, Burgess DJ. Liposomes, Design and manufacturing. In: Bugess, DJ (ed.). Injectable Dispersed Systems, Formulation, Processing and Performance. New York: Marcel Dekker, 2005.
- [9] Wu X, Guy RH. Applications of nanoparticles in topical drug delivery and in cosmetics. J Drug Deliv Sci Technol 2009; 19: 371−384.
- [10] Fan Y, Zhang Q. Development of liposomal formulations: From concept to clinical investigations. Asian J Pharm Sci 2013; 8: 79−90.
- [11] Elsayed MMA, Abdallah OY, Naggar VF, Khalafallah NM. Lipid vesicles for skin delivery of drugs: Reviewing three decades of research. Int J Pharm 2007; 332: 1−16.
- [12] Koutsoulas Ch, Suleiman E, Wagner A, Žabka M. Comparative study between synthetic and phospoholipids of natural origin: effect of phospholipid selection on the behavior of topical liposomal dosage form incorporating terbinafine. J Liposome Res 2014; 24: 336−343.
- [13] Tanriverdi ST, Özer Ö. Novel topical formulations of Terbinafine‑HCl for treatment of onychomycosis. Eur J Pharm Sci 2013; 48: 628–636.
- [14] Ghyczy M. Lieky s fosfatidylcholínom a lipozómami‑ vývoj, hodnotenie, perspektívy. In: Žabka M, et al. Moderné lieky vo farmaceutickej technológii. Bratislava: Slovak Academic Press, 1999.
- [15] Ajazuddin SS. Applications of novel drug delivery system for herbal formulations. Fitoterapia 2010; 81: 680−689.
- [16] Tran VV, Moon JY, Lee YCh, et al. Liposomes for delivery of antioxidants in cosmeceuticals: Challenges and development strategies. J Control Release 2019; 300: 114−140.
- [17] Li M, Du Ch, Guo N, et al. Composition design and medical application of liposomes. Eur J Med Chem 2019; 164: 640−653.
- [18] Sharma J, Kalra S, Sharma A, Rani S. Colloidal Drug Carriers. Internet J Fam Pract 2009; 9: 1−6.
- [19] El‑Ridy MS, Yehia SA, Mohsen AM, et al. Formulation of Niosomal Gel for Enhanced Transdermal Lornoxicam Delivery: In‑Vitro and In‑Vivo Evaluation. Curr Drug Deliv 2018; 15: 122−133.
- [20] Kumbhar D, Wavikar P, Vavia P. Niosomal gel of lornoxicam for topical delivery: in vitro assessment and pharmacodynamic activity. AAPS Pharm Sci Tech 2013; 14: 1072−1082.
- [21] Pando D, Matos M, Gutiérrez G, Pazos C. Formulation of resveratrol entrapped niosomes for topical use. Colloids Surf B 2015; 128: 398–404.
- [22] Balakrishnan P, Shanmugam S, Lee WS, et al. Formulation and in vitro assessment of minoxidil niosomes for enhanced skin delivery. Int J Pharm 2009; 377: 1–8.
- [23] Alomrani AH, Al‑Agaby MH, Badran MM, et al. In vitro skin penetration and antimycotic activity of itraconazole loaded niosomes: Various non‑ionic surfactants. J Drug Deliv Sci Technol 2015; 28: 37−45.
- [24] Sohrabi S, Haeri A, Mahboubi A, et al. Chitosan gel‑embedded moxifloxacin niosomes: an efficient antimicrobial hybrid system for burn infection. Int J Biol Macromol 2016; 85: 625−633.
- [25] Kirjavainen M, Urtti A, Jaaskelainen I, et al. Interaction of liposomes with human skin in vitro – The influence of lipid composition and structure. Biochim Biophys Acta 1996; 1304: 179−189.
- [26] Rajan R. Transferosomes – A vesicular transdermal delivery system for enhanced drug permeation. J Adv Pharm Technol Res 2011; 2: 138−143.
- [27] Kumar R, Philip A. Modified Transdermal Technologies: Breaking the barriers of drug permeation via skin. Trop J Pharm Res 2007; 6: 633–644.
- [28] Malakar J, Sen SO, Nayak AK, et al. Formulation, optimization and evaluation of transferosomal gel for transdermal insulin delivery. Saudi Pharm J 2012; 20: 355–363.
- [29] Ali MFM, Salem HF, Abdelmohsen HF, Attia SK. Preparation and clinical evaluation of nano‑transferosomes for treatment of erectile dysfunction. Drug Des Dev Ther 2015; 9: 2431–2447.
- [30] Shen LN, Zhang YT, Wang Q, et al. Enhanced in vitro and in vivo skin deposition of apigenin delivered using ethosomes. Int J Pharm 2014; 460: 280−288.
- [31] Maheshwari RGS, Tekade RK, Sharma PA, et al. Ethosomes and ultradeformable liposomes for transdermal delivery of clotrimazole: A comparative assessment. Saudi Pharm J 2012; 20: 161−170.
- [32] He R, Cui D, Gao F, et al. Preparation of fluorescence ethosomes based on quantum dots and their skin scar penetration properties. Mater Lett 2009; 63: 1662−1664.
- [33] Zhang YT, Shen LN, Wu ZA, et al. Comparison of ethosomes and liposomes for skin delivery of psoralen for psoriasis therapy. Int J Pharm 2014; 471: 449−452.
- [34] Verma P, Pathak K. Therapeutic and cosmeceutical potential of ethosomes: An overview. J Adv Pharm Technol Res 2010; 1: 274−282.
- [35] Chourasia MK, Kang L, Chan SY. Nanosized ethosomes bearing ketoprofen for improved transdermal delivery. Results Pharma Sci 2011; 1: 60–67.
- [36] Touitou E, Dayan N, Bergelson L, et al. Ethosomes – Novel vesicular carriers for enhanced delivery: Characterization and skin penetration properties. J Control Release 2000; 65: 403–418.