Vliv novějších antidiabetik na hmotnost pacientů s diabetem mellitem 2. typu
Přehledný článek shrnuje na základě publikovaných studií a metaanalýz současné poznatky o vlivu novějších perorálních antidiabetik (inkretinových mimetik, gliptinů a glitazonů) na hmotnost pacientů. Diskutován je vliv jednotlivých léků dostupných na českém trhu – exenatidu, liraglutidu, sitagliptinu, vildagliptinu, rosiglitazonu a pioglitazonu – v monoterapii i v kombinaci (včetně klinicky důležitých kombinací s metforminem a sulfonylureovými deriváty) z pohledu účinnosti na kompenzaci diabetu mellitu 2. typu a na růst nebo pokles hmotnosti. Z přehledu studií se tedy dá usoudit, že nejpříznivější efekt na hmotnost mají inkretinová mimetika exanatid a liraglutid. Hmotnostně neutrální jsou gliptiny, sitagliptin a vildagliptin, glitazony vedou k nárůstu hmotnosti, ovšem vykompenzované příznivou redistribucí tuku a pleiotropními pozitivními metabolickými účinky.
Incidence diabetu mellitu 2. typu (DM2T) dosáhla rozměrů globální epidemie zasahující nejen rozvinuté, ale i rozvíjející se státy. Proto bylo během posledních několika let zavedeno do klinické praxe několik nových molekul, respektive farmakologických skupin, umožňujících intenzivnější boj s touto epidemií. Úspěšná léčba DM2T zahrnuje dle nových doporučení ADA/EASD vždy terapii metforminem, která se v případě selhání doplňuje o další perorální antidiabetika (PAD) nebo o inzulin v různých kombinacích. Úspěšnost kombinační léčby ve smyslu dosažení normoglykemie nalačno i postprandiálně je však limitována nežádoucími účinky, a to především hypoglykemií a zvyšováním hmotnosti. Z obavy před zvyšováním hmotnosti je často oddalována intenzifikace léčby [1], a to nejen ze strany lékaře, ale především ze strany pacienta. Zvyšování hmotnosti má totiž negativní vliv nejen na fyziologickou schopnost pacientů dosáhnout dobré kontroly rizikových faktorů spojených s hyperglykemií a celkově zvýšeným kardiovaskulárním rizikem, ale také na jejich pocit spokojenosti se životem (well-being), kvalitu života a na jejich compliance s doporučovanou léčbou [2].
Jedním ze základních požadavků na nově vyvíjené PAD je tedy hmotnostní neutralita, a v ideálním případě schopnost významně snížit hmotnost pacienta. Pojďme tedy rozebrat vliv relativně nových, novějších a úplně nejnovějších antidiabetik na hmotnost pacientů, kteří tyto léky užívají.
Léčba založená na inkretinech
Inkretiny, reprezentované především glukagon-like peptidem 1 (GLP-1) a glukózodependentním inzulinotropním polypeptidem (GIP), jsou peptidy tvořené ve střevě, které se fyziologicky podílejí na regulaci rovnováhy mezi sekrecí inzulinu a glukagonu v reakci na intestinální absorpci glukózy, a to zvýšením sekrece inzulinu a v případě GLP-1 také potlačením sekrece glukagonu. Tento mechanismus je u diabetu 2. typu porušen, což vedlo k vývoji látek, jež tuto aktivitu obnovují. Děje se tak cestou inkretinových mimetik – analog GLP-1, jako je derivát přirozeně se vyskytujícího exendinu exenatid nebo rekombinantní technologií modifikovaný lidský GLP-1 liraglutid. Druhým způsobem je zabránění rozpadu nativního GLP-1 inhibicí dipeptidyl peptidázy 4 (DPP-4), enzymu, který GLP-1 inaktivuje, pomocí sitagliptinu a vildagliptinu.
Léčba založená na inkretinech přináší množství výhod v porovnání se stávající, běžně v praxi používanou léčbou perorálními antidiabetiky [3].
-
Sekrece inzulinu je stimulována a sekrece glukagonu inhibována jen v prostředí hyperglykemie, očekáváme tedy významné snížení rizika hypoglykemie, a naopak významné snížení glykemie v postprandiálním stavu.
-
GLP-1 je potentním stimulátorem pocitu sytosti a dosažení vysokých fyziologických nebo suprafyziologických hladin v oběhu vede ke snížení příjmu potravy a k prodloužení pocitu sytosti, ať už z důvodu zpomalené evakuace žaludku, nebo centrálním mechanismem. Léčba farmaky založenými na inkretinech by tedy měla být neutrální z hlediska hmotnosti nebo vést k jejímu snižování.
-
Existují první důkazy o efektu inkretinových terapeutik na zachování fyziologické funkce B buněk a redukci apoptózy, stejně jako je tomu u nativního GLP-1 [4].
Nevýhody inkretinových terapeutik spočívají hlavně v jejich nežádoucích účincích. V případě GLP-1 analog je to především gastrointestinální nesnášenlivost, jejímiž důsledky jsou nauzea i zvracení, v případě inhibitorů DPP-4 zvýšená náchylnost k infektům horních cest dýchacích a močových cest a bolesti hlavy.
GLP-1 analoga
Exenatid
Exenatid (syntetický exendin-4) je produktem slinných žláz ještěra Heloderma suspectum, s 53% strukturální homologií s lidským GLP-1, s větší afinitou ke GLP-1 receptoru, než má nativní GLP-1. Exenatid není substrátem pro DPP-4, proto má poločas v cirkulaci 3,5–4 hodiny a biologický účinek po dobu 8 hodin od s.c. aplikace. Standardní účinná dávka je 10 mg 2krát denně.
Exenatid se zdá být nejsilnějším induktorem redukce hmotnosti ze všech antidiabetik. Tato schopnost byla prokázána množstvím studií, které byly zařazeny do metaanalýzy Amoriové [5]. Byl demonstrován statisticky signifikantní pokles hmotnosti s váženým průměrem -2,37 kg, který byl progresivní a nedosahoval plató. Nejvíce vyjádřen byl tento pokles ve studii s pravděpodobně největším klinickým významem, tj. replikující situaci, kdy není dosaženo dostatečné kontroly diabetu při léčbě kombinací metformin + sulfonylurea (SU), a je zvažováno podávání inzulinu nebo exenatidu [6]. Tato studie travající 52 týdnů byla koncipována jako non-inferiorní vůči bifázickému inzulinu aspart, zahrnovala 253 pacientů ve větvi s exenatidem podávaným v dávce 10 mg 2krát denně a 248 pacientů ve skupině s bifázickým aspartem 30/70 2krát denně titrovaným k optimální glykemické kontrole. Pacienti léčení exenatidem hmotnost zredukovali, inzulin aspart hmotnost zvyšoval a rozdíl mezi skupinami byl -5,4 kg ve prospěch exenatidu (95% CI: -5,0 až -5,9 kg), při stejné glykemické kontrole.
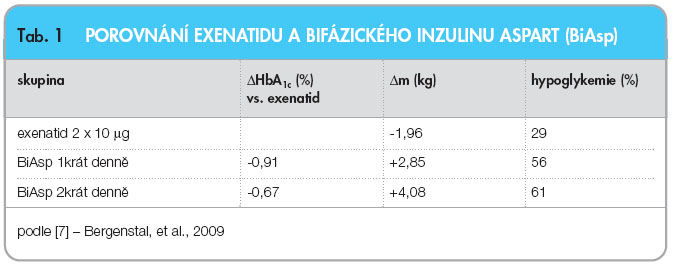 Existuje však novější studie zaměřená na téměř identickou klinickou situaci (372 pacientů rozdělených v poměru 1 : 1 : 1 mezi exenatid a bifázický aspart 30/70 1krát nebo 2krát denně, trvání 24 týdnů), která sice potvrzuje účinek na hmotnost, avšak efekt na kompenzaci glykemie již srovnatelný není [7]. Sami autoři však připouštějí, že nedostatečný efekt exenatidu v této studii mohl být způsoben relativně dlouhým trváním diabetu, přibližně 9 let v průměru, vedoucím ke snížené sekreční rezervě, viz tab. 1.
Existuje však novější studie zaměřená na téměř identickou klinickou situaci (372 pacientů rozdělených v poměru 1 : 1 : 1 mezi exenatid a bifázický aspart 30/70 1krát nebo 2krát denně, trvání 24 týdnů), která sice potvrzuje účinek na hmotnost, avšak efekt na kompenzaci glykemie již srovnatelný není [7]. Sami autoři však připouštějí, že nedostatečný efekt exenatidu v této studii mohl být způsoben relativně dlouhým trváním diabetu, přibližně 9 let v průměru, vedoucím ke snížené sekreční rezervě, viz tab. 1.
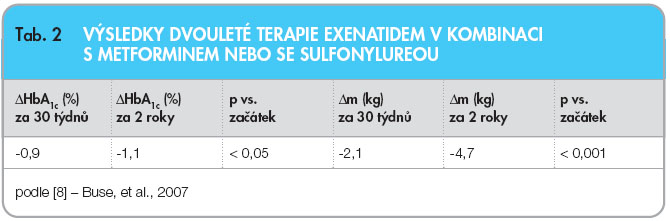 Důkazů, že exenatid je srovnatelný ve svém efektu na kompenzaci diabetu, a navíc má příznivé účinky na hmotnost, je však více než pochybností. Za všechny je potřeba zmínit již delší tzv. open-label prodloužení tří placebem kontrolovaných dvojitě zaslepených studií [8]; tyto studie trvaly 2 roky a sledovaly 974 pacientů, jimž byl přidáván exenatid ke stávající léčbě metforminem nebo sulfonylureou. Plných dvou let sledování dosáhlo 283 pacientů (průměrný věk 57 let, HbA1c 8,3 % dle DCCT, BMI 34 kg.m-2), výsledky studie jsou shrnuty v tab. 2.
Důkazů, že exenatid je srovnatelný ve svém efektu na kompenzaci diabetu, a navíc má příznivé účinky na hmotnost, je však více než pochybností. Za všechny je potřeba zmínit již delší tzv. open-label prodloužení tří placebem kontrolovaných dvojitě zaslepených studií [8]; tyto studie trvaly 2 roky a sledovaly 974 pacientů, jimž byl přidáván exenatid ke stávající léčbě metforminem nebo sulfonylureou. Plných dvou let sledování dosáhlo 283 pacientů (průměrný věk 57 let, HbA1c 8,3 % dle DCCT, BMI 34 kg.m-2), výsledky studie jsou shrnuty v tab. 2.
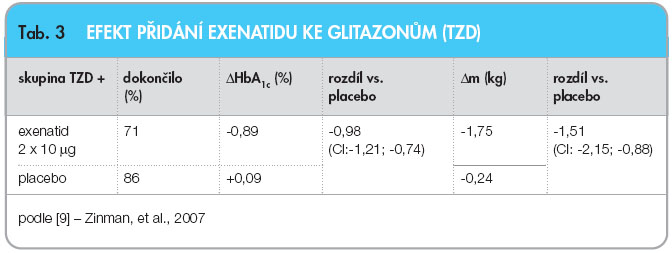 Poslední klinicky významnou situaci simuluje studie přidávající exenatid k thiazolidindionové léčbě ve dvou skupinách – s léčbou metforminem a bez metforminu [9]. Placebem kontrolovaná, randomizovaná, dvojitě slepá studie sledovala po 16 týdnů 121 pacientů v aktivní skupině a 112 pacientů ve skupině, kde bylo podáváno placebo, s bazální hladinou HbA1c 7,9 % dle DCCT. Demonstrovala schopnost exenatidu zabránit přírůstku hmotnosti běžně způsobovanému glitazony, a navíc umožnit ještě i relativně malý, ale statisticky významný pokles hmotnosti, viz tab. 3.
Poslední klinicky významnou situaci simuluje studie přidávající exenatid k thiazolidindionové léčbě ve dvou skupinách – s léčbou metforminem a bez metforminu [9]. Placebem kontrolovaná, randomizovaná, dvojitě slepá studie sledovala po 16 týdnů 121 pacientů v aktivní skupině a 112 pacientů ve skupině, kde bylo podáváno placebo, s bazální hladinou HbA1c 7,9 % dle DCCT. Demonstrovala schopnost exenatidu zabránit přírůstku hmotnosti běžně způsobovanému glitazony, a navíc umožnit ještě i relativně malý, ale statisticky významný pokles hmotnosti, viz tab. 3.
Dá se tedy uzavřít, že exenatid je velmi účinný v redukci hmotnosti. To se ovšem děje za cenu častých a nepříjemných vedlejších účinků, především nauzey a zvracení. Jeho podobná účinnost s inzulinem, se kterým bude nejčastěji srovnáván vzhledem k injekční aplikaci 2krát denně, je zaručena spíše v časnějších stadiích přirozeného průběhu DM2T, kdy je zachována dostatečná sekrece vlastního inzulinu, a primárním problémem je rezistence v periferii a poruchy enteroinzulární osy. Bude zajímavé, jak se bude preskripce exenatidu vyvíjet poté, co bude dostupný dlouhodobě působící exenatid LAR, aplikovaný 1krát týdně.
Liraglutid
Liraglutid je geneticky modifikovaný lidský GLP-1 s 97% strukturální homologií. Podává se 1krát denně subkutánně, po aplikaci asociuje do heptametrů a tvoří depozitum, z něhož se účinná látka postupně vstřebává s poločasem 13 hodin; v oběhu se váže na albumin, což dále prodlužuje jeho účinek.
Poznatky o účinnosti liraglutidu jsou v této fázi založeny především na sérii randomizovaných multicentrických studií LEAD (Liraglutide Effect and Action in Diabetes) fáze III, které dohromady zahrnovaly 6500 účastníků, z nichž 4445 bylo léčeno liraglutidem.
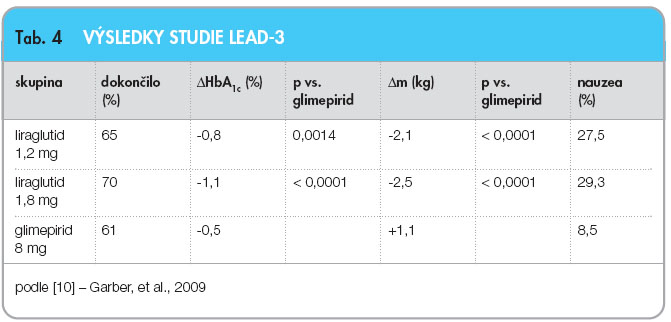 Izolované účinky liraglutidu na hmotnost se nejlépe hodnotí na základě výsledků studie LEAD-3 [10], kde byl liraglutid užíván v monoterapii. Dvojitě zaslepená fáze studie trvala 52 týdnů a na ni navázalo další dvouleté open-label prodloužení. Z celkového počtu 746 pacientů bylo na začátku léčeno 36 % režimovými opatřeními a 64 % monoterapií některým PAD, průměrný věk byl 53 Ī 11 let, BMI 33 Ī 6 kg.m-2, HbA1c 8,3 % Ī 1,1 % dle DCCT. Aktivní skupiny byly léčeny liraglutidem 1,2 mg a 1,8 mg, kontrolní skupina glimepiridem v dávce 8 mg denně. Výsledky studie jsou shrnuty v tab. 4.
Izolované účinky liraglutidu na hmotnost se nejlépe hodnotí na základě výsledků studie LEAD-3 [10], kde byl liraglutid užíván v monoterapii. Dvojitě zaslepená fáze studie trvala 52 týdnů a na ni navázalo další dvouleté open-label prodloužení. Z celkového počtu 746 pacientů bylo na začátku léčeno 36 % režimovými opatřeními a 64 % monoterapií některým PAD, průměrný věk byl 53 Ī 11 let, BMI 33 Ī 6 kg.m-2, HbA1c 8,3 % Ī 1,1 % dle DCCT. Aktivní skupiny byly léčeny liraglutidem 1,2 mg a 1,8 mg, kontrolní skupina glimepiridem v dávce 8 mg denně. Výsledky studie jsou shrnuty v tab. 4.
Prodloužení ve druhé fázi studie o další dva roky ukázalo lepší kompenzaci diabetu a přetrvávající pozitivní vliv na hmotnost v porovnání s glimepiridem, při nižší incidenci hypoglykemií [11]. Z pohledu klinické praxe je však pravděpodobně důležitější, jaký efekt na hmotnost má přidání liraglutidu k ostatním PAD, případně k jejich kombinacím.
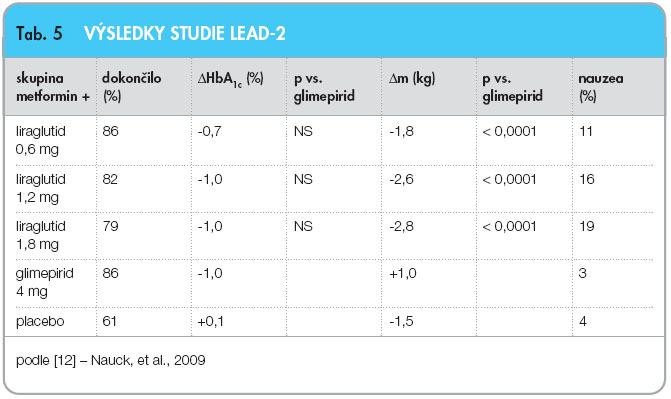 Studie LEAD-2 [12] se věnovala účinnosti liraglutidu v kombinaci s metforminem (1000 mg 2krát denně), byla kontrolována skupinou, která dostávala metformin + placebo a metformin + glimepirid (4 mg denně). Studie trvala 26 týdnů a zahrnovala 1091 účastníků. Při vstupu do studie bylo 35 % nemocných léčeno monoterapií PAD a 65 % již užívalo kombinaci dvou a více PAD, průměrný věk byl 57 Ī 9 let, BMI 30 Ī 5 kg.m-2, HbA1c 8,4 % Ī 1 % dle DCCT. Účinek liraglutidu na hmotnost v kombinaci s ostatními PAD shrnuje tab. 5.
Studie LEAD-2 [12] se věnovala účinnosti liraglutidu v kombinaci s metforminem (1000 mg 2krát denně), byla kontrolována skupinou, která dostávala metformin + placebo a metformin + glimepirid (4 mg denně). Studie trvala 26 týdnů a zahrnovala 1091 účastníků. Při vstupu do studie bylo 35 % nemocných léčeno monoterapií PAD a 65 % již užívalo kombinaci dvou a více PAD, průměrný věk byl 57 Ī 9 let, BMI 30 Ī 5 kg.m-2, HbA1c 8,4 % Ī 1 % dle DCCT. Účinek liraglutidu na hmotnost v kombinaci s ostatními PAD shrnuje tab. 5.
Kombinace liraglutid + metformin je tedy při snižování glykemie stejně účinná jako kombinace glimepirid + metformin, ovšem přidání liraglutidu má se zvyšující se dávkou progresivně příznivější vliv na hmotnost v porovnání s přidáním glimepiridu do dvojkombinace.
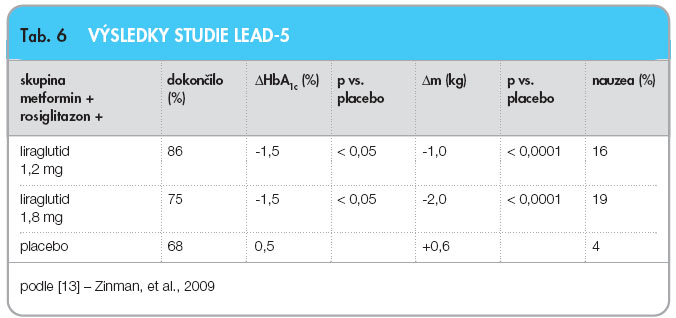 Také je potřeba zmínit fyziologicky jistě opodstatněnou, a proto zajímavou kombinovanou léčbu, která byla předmětem studie LEAD-5 [13]; ke kombinaci metformin 2krát denně 1000 mg + rosiglitazon 4 mg 1krát denně byl přidán liraglutid ve dvou dávkách (1,2 mg nebo 1,8 mg) nebo placebo. Studie trvala 26 týdnů, zúčastnilo se jí 533 pacientů s průměrným věkem 55 Ī 10 let, BMI 33,5 Ī 5,2 kg.m-2, HbA1c 8,3 % dle DCCT. Při vstupu do studie bylo 20 % pacientů léčeno monoterapií, 80 % kombinací dvou a více PAD. Výsledky jsou shrnuty v tab. 6.
Také je potřeba zmínit fyziologicky jistě opodstatněnou, a proto zajímavou kombinovanou léčbu, která byla předmětem studie LEAD-5 [13]; ke kombinaci metformin 2krát denně 1000 mg + rosiglitazon 4 mg 1krát denně byl přidán liraglutid ve dvou dávkách (1,2 mg nebo 1,8 mg) nebo placebo. Studie trvala 26 týdnů, zúčastnilo se jí 533 pacientů s průměrným věkem 55 Ī 10 let, BMI 33,5 Ī 5,2 kg.m-2, HbA1c 8,3 % dle DCCT. Při vstupu do studie bylo 20 % pacientů léčeno monoterapií, 80 % kombinací dvou a více PAD. Výsledky jsou shrnuty v tab. 6.
Důsledkem přidání liraglutidu k této léčbě bylo tedy zabránění vzrůstu hmotnosti, jenž byl pravidlem při terapii glitazony; ve skupině užívající 1,8 mg liraglutidu v kombinaci pak došlo k sice menším úbytkům hmotnosti pacientů, ale stále srovnatelným s úbytky zaznamenanými při monoterapii liraglutidem.
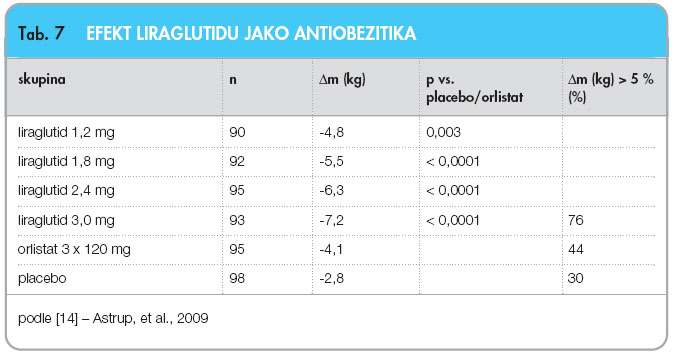 Příznivé účinky liraglutidu na redukci hmotnosti diabetiků vedly k provedení krátké studie u obézních nediabetiků nebo u pacientů s poruchami glukózové tolerance (BMI 30–40 kg.m-2), s výsledky publikovanými v závěru roku 2009 [14]. Výsledek dvojitě zaslepené, placebem nebo aktivním komparátorem (orlistat 3krát 120 mg denně) kontrolované 20týdenní studie s 564 účastníky vystavenými programu behaviorálních modifikací ukazuje tab. 7. Kromě pozitivního efektu na hmotnost měl liraglutid příznivé účinky rovněž na krevní tlak, hladiny krevních lipidů a na frekvenci hypoglykemií [15].
Příznivé účinky liraglutidu na redukci hmotnosti diabetiků vedly k provedení krátké studie u obézních nediabetiků nebo u pacientů s poruchami glukózové tolerance (BMI 30–40 kg.m-2), s výsledky publikovanými v závěru roku 2009 [14]. Výsledek dvojitě zaslepené, placebem nebo aktivním komparátorem (orlistat 3krát 120 mg denně) kontrolované 20týdenní studie s 564 účastníky vystavenými programu behaviorálních modifikací ukazuje tab. 7. Kromě pozitivního efektu na hmotnost měl liraglutid příznivé účinky rovněž na krevní tlak, hladiny krevních lipidů a na frekvenci hypoglykemií [15].
Inhibitory DPP-4 (gliptiny)
Inhibitory dipeptidyl peptidázy 4 mají v porovnání se všemi analogy GLP-1 výhodu v perorální aplikaci a dlouhé době působení, což umožňuje podávání jednou denně. Účinnost gliptinů byla prokázána mnohými non-inferiorními studiemi s metforminem i deriváty sulfonylurey. Na druhou stranu mechanismus účinku všech inhibitorů DPP-4 umožňuje dosažení pouze vysokých fyziologických hladin cirkulujícího GLP-1; nedochází tedy k zásadnímu ovlivnění pocitu sytosti (částečně také proto, že gliptiny nepřestupují přes hematoencefalickou bariéru) a nedochází též ke zpomalení evakuace žaludku [16]; dá se tedy říct, že od inhibitorů DPP-4 všeobecně můžeme očekávat spíše neutrální vliv na hmotnost než její pokles.
Gliptiny se tedy zdají být jako ideální do kombinace s metforminem při nedostatečné kompenzaci, nebo s glitazony, pokud není tolerován metformin.
Sitagliptin
Sitagliptin byl prvním registrovaným inhibitorem dipeptidyl peptidázy 4 (DPP-4) na světě. Je to kompetitivní antagonista pro vazebné místo DPP-4 na GLP-1. Efekt monoterapie sitagliptinem na změnu hmotnosti byl 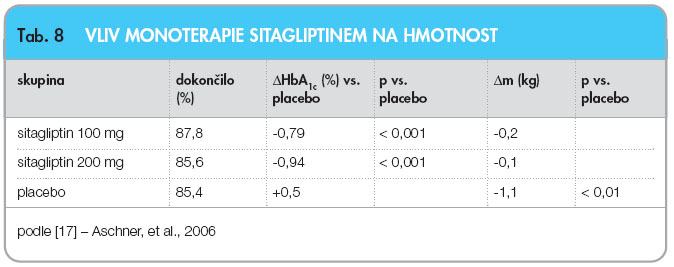 sledován ve třech studiích, ze kterých jsou nejvíce relevantní studie Aschnerovy [17, 18]. Dřívější studie, kontrolovaná placebem, která zahrnovala 741 pacientů bez předchozí terapie PAD, s průměrným věkem 54,2 let, průměrným BMI 30,5 kg.m-2, HbA1c ≤ 8,0 % dle DCCT, léčených sitagliptinem v dávkách 100 mg jednou denně, nebo 200 mg jednou denně a trvající 24 týdnů, je prezentována v tab. 8.
sledován ve třech studiích, ze kterých jsou nejvíce relevantní studie Aschnerovy [17, 18]. Dřívější studie, kontrolovaná placebem, která zahrnovala 741 pacientů bez předchozí terapie PAD, s průměrným věkem 54,2 let, průměrným BMI 30,5 kg.m-2, HbA1c ≤ 8,0 % dle DCCT, léčených sitagliptinem v dávkách 100 mg jednou denně, nebo 200 mg jednou denně a trvající 24 týdnů, je prezentována v tab. 8.
Pozdější studie byla koncipována jako non-inferiorní k metforminu, s 1050 pacienty rozdělenými v poměru 1 : 1 do 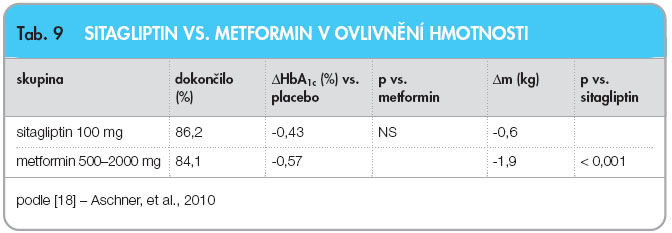 skupiny léčené sitagliptinem 100 mg denně, nebo metforminem 2krát 1000 mg denně titrovaným v rozmezí dávek 500–2000 mg během 5 týdnů. Pacienti nebyli před vstupem do studie léčeni žádným PAD a kritériem zařazení do studie byl HbA1c v rozmezí 6,5–9 % dle DCCT, viz tab. 9.
skupiny léčené sitagliptinem 100 mg denně, nebo metforminem 2krát 1000 mg denně titrovaným v rozmezí dávek 500–2000 mg během 5 týdnů. Pacienti nebyli před vstupem do studie léčeni žádným PAD a kritériem zařazení do studie byl HbA1c v rozmezí 6,5–9 % dle DCCT, viz tab. 9.
Obě studie tedy potvrdily váhovou neutralitu sitagliptinu, což se při porovnání s metforminem jeví jako určitá nevýhoda, ovšem vyvážená lepší tolerancí z pohledu GIT vedlejších příznaků (rozdíl v incidenci průjmů p < 0,001, v incidenci nauzey p = 0,032) ve prospěch sitagliptinu. Metaanalýza účinků inkretinových terapeutik z pohledu efektu na hmotnost, zahrnující 13 studií [5], ukázala malý nárůst hmotnosti v rozsahu +0,5 kg (95% CI: 0,3–0,7 kg) v porovnání s placebem.
Účinky léčby kombinací sitagliptinu s metforminem byly nejlépe demonstrovány v non-inferiorní studii Nauckově [19], kde komparátorem bylo 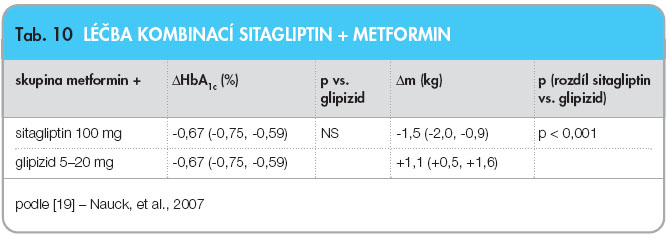 přidání glipizidu při nedostatečné kompenzaci dosažené monoterapií metforminem. Studie zahrnovala 1172 pacientů užívajících minimálně 1500 mg metforminu denně, randomizovaných do 2 skupin, s přidáváním buď sitagliptinu 100 mg denně (n = 588), nebo glipizidu do maximální dávky 20 mg denně (n = 584) po dobu 52 týdnů (tab. 10).
přidání glipizidu při nedostatečné kompenzaci dosažené monoterapií metforminem. Studie zahrnovala 1172 pacientů užívajících minimálně 1500 mg metforminu denně, randomizovaných do 2 skupin, s přidáváním buď sitagliptinu 100 mg denně (n = 588), nebo glipizidu do maximální dávky 20 mg denně (n = 584) po dobu 52 týdnů (tab. 10).
Vildagliptin
Vildagliptin, stejně jako sitagliptin, je substrátem pro DPP-4 a inhibuje tento cílový enzym s vyskou afinitou. Velké množství iniciálních studií v trvání typicky 24 týdnů prokázalo, stejně jako u sitagliptinu, hmotnostní neutralitu, případně tendenci k úbytku hmotnosti pacientů. Například Dejager [20] dokumentoval u 632 pacientů rozdělených do 4 skupin (1. vildagliptin 2 x 50 mg, 2. vildagliptin 3 x 50 mg, 3. vildagliptin 1 x 100 mg, 4. placebo) pokles hmotnosti v rozsahu 0,3–1,8 kg v nejvyšší aktivní skupině, kde ovšem dávka vildagliptinu výrazně překračovala dávku schválenou ke klinické terapii.
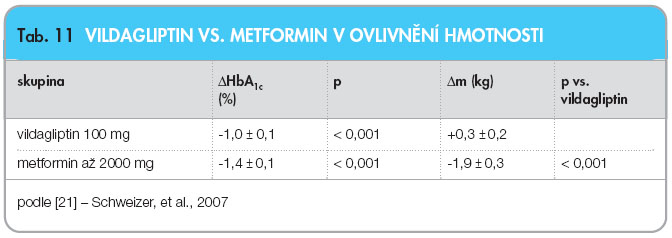 Non-inferiorní dvojitě slepá, randomizovaná, multicentrická studie [21] porovnávající vildagliptin 100 mg (n = 526) a metformin titrovaný do dávky 2000 mg (n = 254) s HbA1c 7,5–11 % dle DCCT, která trvala již jeden rok, dále prokázala hmotnostní neutralitu, viz tab. 11.
Non-inferiorní dvojitě slepá, randomizovaná, multicentrická studie [21] porovnávající vildagliptin 100 mg (n = 526) a metformin titrovaný do dávky 2000 mg (n = 254) s HbA1c 7,5–11 % dle DCCT, která trvala již jeden rok, dále prokázala hmotnostní neutralitu, viz tab. 11.
Ve studii Bosiho a kol. [22], trvající 24 týdnů, byl přidáván vildagliptin ke stávající stabilní monoterapii metforminem 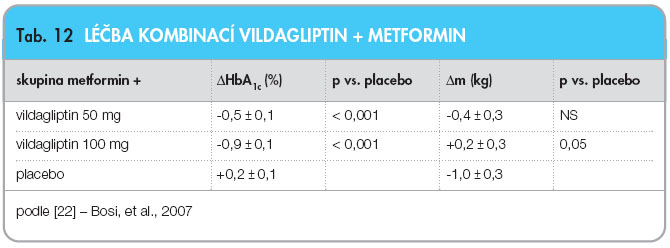 (1500 mg) při nedostatečné kompenzaci (HbA1c 7,5–11 % dle DCCT). V první skupině byl přidán vildagliptin v dávce 50 mg denně (n = 177), ve druhé vildagliptin 100 mg denně (n = 185), třetí skupina byla kontrolována placebem (n = 182). Důsledky léčby na hmotnost pacientů ukazuje tab. 12.
(1500 mg) při nedostatečné kompenzaci (HbA1c 7,5–11 % dle DCCT). V první skupině byl přidán vildagliptin v dávce 50 mg denně (n = 177), ve druhé vildagliptin 100 mg denně (n = 185), třetí skupina byla kontrolována placebem (n = 182). Důsledky léčby na hmotnost pacientů ukazuje tab. 12.
V obou aktivních skupinách pak přibližně jedna třetina pacientů přibrala více než 1 kg, jedna třetina si udržela hmotnost Ī 1 kg a jedna třetina pacientů zhubla o více než 1 kg [22].
Léčba založená na stimulaci PPAR-g (thiazolidindiony, glitazony)
Léčba glitazony, stejně tak jako inzulinem a deriváty sulfonylurey, je jednoznačně spojena s nárůstem hmotnosti. Proto kombinace těchto léčiv vedou k největším přírůstkům hmotnosti, a naopak kombinace s metforminem riziko nárůstu hmotnosti minimalizuje. Zvyšování hmotnosti při monoterapii glitazony je však přesto spojeno nejen s celkově zlepšenou kompenzací diabetu, ale také s dokumentovaným snížením inzulinové rezistence, prodlužující zachování vlastní sekrece inzulinu.
Dva mechanismy se ukázaly jako zásadní při vysvětlení tohoto zdánlivého paradoxu: redistribuce tukové tkáně a retence tekutin.
Redistribuce tukové tkáně
Několik studií přesvědčivě dokumentovalo nárůst podkožní tukové tkáně a současně pokles masy viscerálního tuku. Tato redistribuce bývá vysvětlována stimulací PPAR-g receptorů glitazony, což má za následek podporu diferenciace preadipocytů podkožní tukové tkáně v malé tukové buňky, zatímco ve viscerální tukové tkáni stimulace stejných receptorů vede k apoptóze diferencovaných, hypertrofických adipocytů [23]. Nejnovější zvířecí studie ukazují také na roli centrálních mechanismů uskutečňovaných cestou modifikace exprese AGP a hladin plazmatického leptinu [24].
Mechanismů, které by mohly být zodpovědné za retenci tekutin při léčbě thiazolidindiony (TZD), bylo ve zvířecích modelech navrženo několik, například zvýšená tubulární reabsorpce sodíku [25] nebo změny vaskulární hemodynamiky nebo permeability v souvislosti s lepší inzulinovou senzitivitou [26]. Preklinická data nyní potvrzují, že alespoň část retence tekutin jde na vrub přímému účinku TZD na renání tubulus [27]. Nezdá se však, že prokazatelné zlepšení inzulinové senzitivity dokumentované hyperinzulinemickým euglykemickým clampem po 12 týdnech užívání TZD je spojeno se změnami průtoku krve předloktím nebo se změnami kapilární permeability [28]. (Pozn. Clamp, hyperinzulinový euglykemický – metoda používaná v diabetologii k vyšetřování účinnosti inzulinu in vivo. Náročný test používaný zejména ve výzkumu. Při standardně navozené hyperinzulinemii se hodnotí množství glukózy spotřebované k udržení glykemie na požadované hodnotě. Při normálním působení inzulinu je toto množství vyšší. Při clampu hyperglykemickém se udržuje konstantní hyperglykemie, a sleduje se, a tudíž se i vyšetřuje sekrece inzulinu).
Rosiglitazon
Existuje množství studií dokumentujících příznivý vliv rosiglitazonu na redistribuci tukové tkáně. Za všechny zmíním studii, kterou publikoval Carey a kol. [29]. Spočívala ve zhodnocení inzulinové senzitivity hyperinzulinemickým clampem a v hodnocení distribuce tukové tkáně pomocí MRI, DEXA a magentické rezonanční spektroskopie u 33 pacientů před zahájením podávání rosiglitazonu v dávce 2krát 4 mg denně, nebo placeba a po 16 týdnech jejich podávání. Inzulinová senzitivita se zlepšila o 86 % (p < 0,05), subkutánní tuková hmota v abdominální krajině vzrostla o 8 % (p = 0,02), intraabdominální množství tuku se nezvětšilo, ale výrazně pokleslo množství intrahepatického tuku, a to o 45 % oproti vstupním hodnotám. Hmotnost v aktivní skupině vzrostla o 2,1 Ī 2,0 kg (p = 0,05) oproti placebu.
Přestože efekt TZD na hmotnost je dlouho znám, diskutován a zkoumán, studií zaměřených na tuto problematiku není mnoho. Je však k dispozici množství údajů z velkých dlouhodobých studií (ADOPT, RECORD), včetně dat týkajících se hmotnosti. Studie RECORD se primárně zabývala kardiovaskulárními důsledky u pacientů léčených rosiglitazonem. Pacienti byli rozděleni do tří skupin: metformin (MET) + SU, metformin + rosiglitazon (ROSI) a SU + rosiglitazon. Osmnáctiměsíční sledování 1122 pacientů s HbA1c 7,1–9,0 % dle DCCT [30] ukázalo srovnatelné výsledky ovlivnění kompenzace diabetu ve všech třech skupinách (ROSI nebo SU přidaný k MET: rozdíl 0,07 %; 95% CI: -0,09, 0,23; ROSI nebo MET přidaný k SU: rozdíl 0,06 %; 95% CI: -0,09, 0,20). Stejně tak nebyly po 6 měsících zjištěny rozdíly v glykemii nalačno. Rozdíly v hmotnosti ale statisticky signifikantní byly: rozdíl v přírůstku hmotnosti v porovnání se sulfonylureou byl +1,2 kg (95% CI: 0,4, 2,0), p = 0,003, v porovnání s metforminem vedlo podávání rosiglitazonu ke zvýšení hmotnosti o 4,3 kg (95% CI: 3,6, 5,1), p < 0,001. Výsledky čtyřletého sledování v rámci studie ADOPT také opětně prokázaly statisticky signifikantní nárůst hmotnosti: o 5,6 kg při léčbě rosiglitazonem, o 1,8 kg při léčbě glimepiridem a snížení hmotnosti průměrně o 2,8 kg ve skupině léčené metforminem [31], přestože rosiglitazon nezávisle na hmotnosti a kompenzaci diabetu zlepšoval zánětlivé parametry asociované s obezitou, měřené pomocí hladiny CRP.
Pioglitazon
Stejně tak máme k dispozici množství informací o příznivém vlivu pioglitazonu na viscerální tukovou tkáň. Například Miyazaki [32] demonstroval pomocí MRI a oGTT zlepšenou kompenzaci DM2T i periferní a hepatální inzulinovou senzitivitu i přes zvýšení tělesné hmotnosti za 16 týdnů léčby pioglitazonem v dávce 45 mg denně průměrně o 3 kg, Ī 4 kg (p < 0,05).
A obdobně jako u rosiglitazonu, informace o nárůstu hmotnosti jsou derivované ze studií zaměřených na jiné parametry. Jedna metaanalýza [33] udává významnou změnu o +4 kg za 16 týdnů. Publikace výsledků studie PROactive, která byla zaměřena na kardiovaskulární účinky pioglitazonu, s průměrnou dobou sledování 34,5 měsíce, také dokumentovala průměrné zvýšení hmotnosti o 4 kg [34].
V materiálech EMEA [35] je uvedeno pouze konstatování, že při monoterapii pioglitazonem 45 mg denně se hmotnost zvyšuje podle různých evropských studií průměrně o 1,4 kg a podle studií amerických o 3,0 kg; informace o kombinační terapii udávají za dobu 72 týdnů u pacientů užívajících dávky maximálně 30 mg pioglitazonu denně se sulfonylureou nebo s metforminem přírůstek v řádu 5 kg za 12–16 týdnů, kdy dosahuje plató a dále se nezvyšuje. Kombinace pioglitazonu a novějších preparátů, především inhibitorů DPP-4, byly předmětem rozsáhlejších studií [36]. Kombinační terapie se sitagliptinem 100 mg denně nevedla k dalšímu zvyšování hmotnosti v porovnání s pioglitazonem samotným podávaným v dávce 30–45 mg denně: během 24 týdnů sledování to bylo +1,8 kg při kombinaci pioglitazon + sitagliptin, +1,5 kg při kombinaci pioglitazon + placebo, NS. Kombinace s vildagliptinem však k nárůstu hmotnosti v porovnání s placebem vedla: pioglitazon 30 mg denně + vildagliptin 100 mg denně znamenaly zvýšení hmotnosti o 2,1 kg, pioglitazon 30 mg denně + placebo zvýšily hmotnost pacientů o 1,4 kg. Zatímco tyto výsledky zjištěné při léčbě pioglitazonem v kombinované léčbě naznačovaly pouze trend směrem ke statistické významnosti [37], podávání klinicky standardně používané dávky pioglitazon 45 mg denně + vildagliptin 100 mg denně vs. placebo, s níž bylo spojeno zvýšení hmotnosti pacientů o 2,7 kg, oproti zvýšení o 1,4 kg při podávání placeba (p = 0,03), už statisticky signifikantní údaje přineslo [38].
Seznam použité literatury
- [1] Grant R, Adams AS, Trinacty CM, et al. Relation-ship between patient mediacation adherence and subsequent clinical inertia in Type 2 diabetes glycaemic management. Diabetes Care 2007; 30: 807–812.
- [2] Hermansen K, Mortensen LS. Bodyweight changes associated with antihyperglycemic agents in type 2 diabetes mellitus. Drug Saf 2007; 30: 1127–1142.
- [3] Drucker DJ, Nauck MA. The incretin system: glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in Type 2 diabetes. Lancet 2006; 368: 1696–1705.
- [4] Deacon CF. Therapeutic strategies based on GLP-1. Diabetes 2004; 9: 2181–2189.
- [5] Amori RE, Lau J, Pittas AG. Efficacy and Safety of Incretin Therapy in Type 2 Diabetes. Systematic Review and Meta-analysis. JAMA 2007; 298: 194–206.
- [6] Nauck MA, Duran S, Kim D, et al. A comparison of twice-daily exenatide and biphasic insulin aspart in patients with type 2 diabetes who were suboptimally controlled with sulfonylurea and metformin: a non-inferiority study. Diabetologia 2007; 50: 259–267.
- [7] Bergenstal R, Lewin A, Bailey T, et al. za NovoLog Mix-vs.-Exenatide Study Group. Efficacy and safety of biphasic insulin aspart 70/30 versus exenatide in subjects with type 2 diabetes failing to achieve glycemic control with metformin and a sulfonylurea. Curr Med Res Opin 2009; 25: 65–75.
- [8] Buse JB, Klonoff DC, Nielsen LL, et al. Metabolic effects of two years of exenatide treatment on diabetes, obesity, and hepatic biomarkers in patients with type 2 diabetes: an interim analysis of data from the open-label, uncontrolled extension of three double-blind, placebo-controlled trials. Clin Ther 2007; 29: 139–153.
- [9] Zinman B, Hoogwerf BJ, Durán García S, et.al. The effect of adding exenatide to a thiazolidinedione in suboptimally controlled type 2 diabetes: a randomized trial. Ann Intern Med 2007; 146: 477–185.
- [10] Garber A, Henry R, Ratner R, et al. Liraglutide versus glimepiride monotherapy for Type 2 diabetes (LEAD 3 mono): a randomised, 52-week, phase III, double-blind, parallel-treatment trial. Lancet 2009; 373: 473–481.
- [11] Garber A, Henry R, Ratner R, et al. Monotherapy with liraglutide, a once-daily human GLP-1 analog, provdes sustained reductions in A1c, FPG, and weight compared with glimepiride in Type 2 diabetes. LEAD-3 mono 2-year results. Diabetes 2009; 58 (Suppl. 1): 162-OR.
- [12] Nauck M, Frid A, Hermansen K, et al. Efficacy and safety comparison of liraglutide, glimepiride and placebo, all in combination with metformin, in type 2 diabetes: LEAD-2 study. Diabetes Care 2009; 3: 84–90.
- [13] Zinman B, Gerich J, Buse JB, et al. Efficacy and safety of the human glucagon-like peptide-1 analog liraglutide in combination with metformin and thiazolidinedione in patients with type 2 diabetes (LEAD-4 Met+TZD). Diabetes Care 2009; 32: 1224–1230.
- [14] Astrup A, Rösner S, van Gaal L, et al. Effects of liraglutide in the treatment of obesity: a randomised, double-blind, placebo-controlled study. Lancet 2009; 374: 1606–1616.
- [15] Rossi MC, Nicolucci A. Liraglutide in Type 2 diabetes: from pharmacological development to clinical practice. Acta Biomed 2009; 80: 93–101.
- [16] Verspohl EJ. Novel therapeutics for Type 2 diabetes: Incretin hormone mimetics (glucagon-like peptide-1 receptor agonists) and dipeptidyl peptidase-4 inhibitors. Pharmacology & Therapeutics 2009; 124: 113–138.
- [17] Aschner P, Kipnes MS, Lunceford JK, Effect of the dipeptidyl peptidase-4 inhibitor sitagliptin as monotherapy on glycemic control in patients with type 2 diabetes. Diabetes Care 2006; 29: 2632–2637.
- [18] Aschner P, Katzeff HL, Guo H. Efficacy and safety of monotherapy of sitagliptin compared with metformin in patients with type 2 diabetes. Diabetes Obes Metab 2010; 12: 252–261
- [19] Nauck MA, Meininger G, Sheng D, et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor, sitagliptin, compared with the sulphonylurea, glipizide, in patients with Type 2 diabetes inadequately controlled on metformin alone: a randomized, double-blind, non-inferiority trial. Diabetes Obes Metab 2007; 9: 194–205
- [20] Dejager S, Razac S, Foley JE, et al. Vildagliptin in drug-naive patients with type 2 diabetes: a 24-week, double-blind, randomized, placebo-controlled, multiple-dose study. Horm Metab Res 2007; 39: 218–223.
- [21] Schweizer A, Couturier A, Foley JE, et al. Comparison between vildagliptin and metformin to sustain reductions in HbA(1c) over 1 year in drug-naive patients with Type 2 diabetes. Diabet Med 2007; 24: 955–961.
- [22] Bosi E, Camisasca RP, Collober C, et al. Effects of vildagliptin on glucose control over 24 weeks in patients with type 2 diabetes inadequately controlled with metformin. Diabetes Care 2007; 30: 890–895.
- [23] Nakamura T, Funahashi T, Yamashita S, et al. Thiazolidinedione derivative improves fat distribution and multiple risk factors in subjects with visceral fat accumulation-double-blind placebo-controlled trial. Diabetes Res Clin Pract 2001; 54: 181–190.
- [24] Aubert G, Burnier M, Dulloo A, et al. Neuroendocrine characterization and anorexigenic effects of telmisartan in diet- and glitazone-induced weight gain. Metabolism 2010; 59: 25–32.
- [25] Muto S, Miyata Y, Imai M, et al. Troglitazone stimulates basolateral rheogenic Na+/HCO3- cotrans-port activity in rabbit proximal straight tubules. Exp Nephrol 2001; 9: 191–197.
- [26] Walker AB, Naderali EK, Chattington PD, et al. Differential vasoactive effects of the insulin sensitizers rosiglitazone (BRL 49653) and troglitazone on human small arteries in vitro. Diabetes 1998; 47: 810–814.
- [27] Karalliedde J, Buckingham RE. Thiazolidinediones and their fluid-related adverse effects: facts, fiction and putative management strategies. Drug Saf 2007; 30: 741–753.
- [28] Rennings AJ, Smits P, Stewart MW, et al. Fluid retention and vascular effects of rosiglitazone in obese, insulin-resistant, nondiabetic subjects. Diabetes Care 2006; 29: 581–587.
- [29] Carey DG, Cowin GJ, Galloway GJ, et al. Effect of rosiglitazone on insulin sensitivity and body composition in type 2 diabetic patients. Obes Res 2002; 10: 1008–1015.
- [30] Home PD, Jones NP, Pocock SJ, et al. Rosiglitazone RECORD study: glucose control outcomes at 18 months. Diabet Med 2007; 24: 626–634.
- [31] Kahn SE, Haffner SM, Viberti G. Rosiglitazone decreases C-reactive protein to a greater extent relative to glyburide and metformin over 4 years despite greater weight gain: observations from a Diabetes Outcome Progression Trial (ADOPT). Diabetes Care 2010; 33: 177–183.
- [32] Miyazaki Y, Mahankali A, Matsuda M, et al. Effect of pioglitazone on abdominal fat distribution and insulin sensitivity in type 2 diabetic patients. J Clin Endocrinol Metab 2002; 87: 2784–2791.
- [33] Chilcott J, Tappenden P, Jones ML, et al. A systematic review of the clinical effectiveness of pioglitazone in the treatment of type 2 diabetes mellitus. Clinical Therapeutics 2001; 23: 1792–1823.
- [34] Dormandy JA, Charbonnel B, Eckland DJA. Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events): a randomised controlled trial. Lancet 2005; 366 (9493): 1279–1289.
- [35] http://www.ema. europa.eu/humandocs/PDFs/ EPAR/Actos/201400en6.pdf
- [36] Rosenstock J, Brazg R, Andryuk PJ, et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor sitagliptin added to ongoing pioglitazone therapy in patients with type 2 diabetes: a 24-week, multicenter, randomized, double-blind, placebo-controlled, parallel-group study. Clin Ther 2006; 28: 1556–1568.
- [37] Rosenstock J, Kim SW, Baron MA, et al. Efficacy and tolerability of initial combination therapy with vildagliptin and pioglitazone compared with component monotherapy in patients with type 2 diabetes. Diabetes Obes Metab 2007; 9: 175–185.
- [38] Garber AJ, Schweizer A, Baron MA, et al. Vildagliptin in combination with pioglitazone improves glycaemic control in patients with type 2 diabetes failing thiazolidinedione monotherapy: a randomized, placebo-controlled study. Diabetes Obes Metab 2007; 9: 166–174.