Vývoj osteologie v ČR, denosumab a romosozumab v léčbě osteoporózy
V Plzni se ve dnech 10.–11. května 2024 konala již XV. celostátní konference Sekundární osteoporóza. Tato široce navštěvovaná odborná akce opět zaujala zajímavým programem s důrazem na mezioborovou spolupráci.
Historie a rozvoj osteologie v České republice a jak se na něm podílela společnost Amgen
Prof. MUDr. Vladimír Palička, CSc., dr. h. c., předseda Společnosti pro metabolická onemocnění skeletu ČLS JEP, (Osteocentrum FN a LF UK v Hradci Králové) se v úvodní přednášce ponořil do historie osteologie v naší zemi. Připomněl, že první „osteologický seminář“ uspořádali 2. února 1970 ve Výzkumném ústavu chorob revmatických nadšenci pro obor. V říjnu 1986 vznikla Osteoartrologická sekce České revmatologické společnosti. Tato sekce, jak vyzdvihl přednášející, se jako jediná stala členem Evropské aliance revmatologických asociací (EULAR) a od roku 1991 i The European Federation & Forum for Osteopathy (EFFO). Návrh na vznik samostatné Společnosti pro metabolická onemocnění skeletu (SMOS) byl podepsán 27. března 1995, následně byla 2. května schválena předsednictvem ČLS JEP a 20. listopadu potvrzena sjezdem delegátů. Prvním předsedou se stal prof. MUDr. Stanislav Havelka, CSc. Ten se rovněž zasadil o vznik odborného časopisu; od roku 1996 začal vycházet Osteologický bulletin. V roce 2018 došlo k jeho změně na Clinical Osteology. Význam časopisu pro edukaci a komunikaci vidí profesor Palička i v dnešní době.
Přednášející připomněl také významné osobnosti, které se zasadily o rozvoj oboru. Byly jimi například již zmíněný první předseda společnosti prof. MUDr. Stanislav Havelka, CSc., (1927–2004) nebo prof. MUDr. Jaroslav Blahoš, DrSc., (1930–2018), na jehož počest byla zavedena tzv. Blahošova přednáška.
Co se týče historie osteologických odborných akcí, první osteologická konference SMOS s účastí slovenských kolegů se konala v Praze v roce 1996. V následujícím roce byla založena slovenská odborná společnost SOMOK (Spoločnosť pre osteoporózu a metabolické ochorenia kostí) a od roku 1999 se konají pravidelné společné kongresy. Česká osteologie se záhy etablovala také v mezinárodním měřítku. V květnu 2006 hostila Praha 33. kongres ECTS (European Calcified Tissue Society), který přivítal na 2 500 zahraničních účastníků a zaznělo na něm 550 přednášek. Od roku 2006 má tradici rovněž komornější setkávání odborníků ze střední Evropy – Central European Summit on Osteoporosis. Přednášející zmínil rovněž ECTS Training Course v roce 2018 a přítomné nalákal na další celosvětový kongres osteologie, který se bude konat v Praze v roce 2026.
S rozvojem osteologie souvisí i založení Katedry klinické osteologie IPVZ v roce 2011 s možností nástavbové atestace z klinické osteologie a od roku 2018 vznikla i samostatná odbornost klinická osteologie. Vznikají doporučené postupy, stanoviska, Populační program časného záchytu osteoporózy v ČR.
V další části prezentace vysvětlil profesor Palička význam spolupráce s farmaceutickou společností Amgen, která umožňuje komunikaci a sdílení potřeb odborníků. V osteologii započala tato kooperace od roku 2009, kdy byl do praxe zaveden denosumab. Od roku 2010 probíhá pravidelná odborná spolupráce v podobě Bone Academy. Letošní již 15. ročník se bude konat 14. listopadu v Praze. Mezi další společné akce patří podpora pacientských aktivit (nyní ve spolupráci s Revma ligou), osvětové kampaně, tiskové konference nebo tvorba edukačních materiálů pro pacienty.
V historickém pohledu na léčbu je zřetelná narůstající efektivita dostupných terapeutických možností; od fluoridů a kalcitoninu přes obrovský zlom v možnostech léčby se zavedením antiresorpční léčby bisfosfonáty, přes stroncium ranelát ke zcela nové možnosti léčby denosumabem a možnostem osteoanabolické léčby teriparatidem a nyní i romosozumabem.
Jaké perspektivy vidí přednášející? Aktuálně se velmi rozšiřují diagnostické kapacity a léčebné možnosti, do léčby jsou díky rozšíření možnosti preskripce zapojeni i praktičtí lékaři a gynekologové. Stoupá i obecný zájem o osteoporózu (pacienti, preventivní programy, diagnostika i léčebné možnosti). Profesor Palička věří, že se zvýší i počet odborníků, kteří se zabývají touto problematikou, a jako důležitou vidí právě vzájemnou spolupráci, jež povede ve svém důsledku ke zlepšení péče o nemocné.
Klinické zkušenosti s dlouhodobou terapií léčivým přípravkem Prolia
Druhým sdělením navázal předseda organizačního výboru konference doc. MUDr. Václav Vyskočil, Ph.D., (Osteocentrum, II. interní klinika, Traumacentrum, Klinika ortopedie a traumatologie pohybového ústrojí LF UK a FN Plzeň). V úvodu se zamyslel nad tím, co nás na léčivém přípravku k léčbě osteoporózy zajímá. Zejména jde o o bezpečnost a účinnost léčby. Důležitý je efekt na kortikální kost, která je z 80 % odpovědná za pevnost kosti. Dále nás zajímá nástup účinku – v osteologii doba, od kdy dokáže léčba zabránit vzniku zlomeniny. Redukce všech typů zlomenin zvyšuje důvěru pacienta v léčbu. Efekt na denzitu kostního minerálu (BMD) a markery může být brán jako podružný, ale představuje významný faktor pro compliance a perzistenci pacienta na léčbě, které jsou u dlouhodobé terapie klíčové. Stabilní pozitivní vývoj a sdílení výsledků s pacientem hrají také roli. Neméně důležité jsou vedlejší účinky a jejich vývoj v čase.
Denosumab je humánní monoklonální protilátka, která se váže na RANKL, čímž zabraňuje aktivaci receptoru RANK a inhibuje výrazně aktivitu a transformaci osteoklastů. Pro léčbu osteoporózy byl schválen v roce 2010 na základě své silné antiresorpční aktivity, která způsobuje klinicky významné zvýšení BMD a snižuje riziko zlomenin v klíčových místech skeletu. Desetiletá extenze studie FREEDOM přinesla další důkazní podporu pro denosumab jako vysoce účinnou antiosteoporózní terapii u pacientů s vysokým rizikem zlomenin [1]. Recentní metaanalýza srovnávající účinnost a bezpečnost denosumabu, teriparatidu a bisfosfonátů u pacientů s glukokortikoidy indukovanou osteoporózou potvrdila jeho výbornou účinnost u tohoto onemocnění. Zejména vyšší účinnost při zlepšování BMD bederní páteře a krčku stehenní kosti a snižování fraktur obratlů oproti terapii bisfosfonáty [2].
Práce autorů Iconaru a kol. porovnávala rychlosti působení farmakologické léčby v prevenci hrozících osteoporotických zlomenin. Perorální bisfosfonáty významně snižují riziko zlomenin pouze po více než jednom roce léčby. Rychlejší snížení rizika zlomenin je pozorováno u zoledronátu a denosumabu nebo u anabolických látek [3].
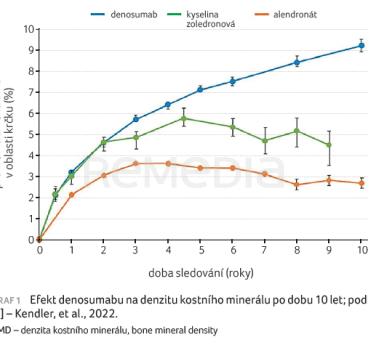 Přednášející dále prezentoval efekt denosumabu na BMD, který je v porovnání s dalšími léčivy výrazný [1], graf 1. Studie z reálného prostředí doložila vedle vysoké míry perzistence pacientů na léčbě i setrvalý nárůst BMD krčku s podáním každé další dávky denosumabu a výrazný pokles hodnoty CTX (C‑terminální příčně vázaný telopeptid kolagenu typu I) po první dávce [4].
Přednášející dále prezentoval efekt denosumabu na BMD, který je v porovnání s dalšími léčivy výrazný [1], graf 1. Studie z reálného prostředí doložila vedle vysoké míry perzistence pacientů na léčbě i setrvalý nárůst BMD krčku s podáním každé další dávky denosumabu a výrazný pokles hodnoty CTX (C‑terminální příčně vázaný telopeptid kolagenu typu I) po první dávce [4].
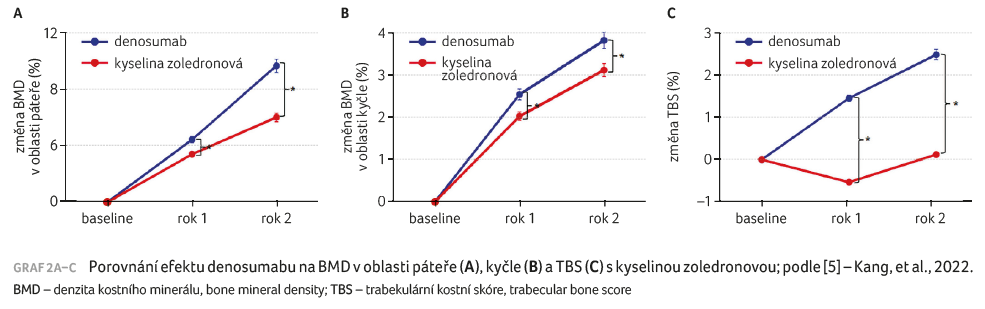
Denosumab a kyselina zoledronová v současnosti představují nejúčinnější antiresorpční látky pro léčbu osteoporózy. Navzdory podobným účinkům na kostní resorpci mají tyto látky odlišné mechanismy účinku. Korejská studie si dala za cíl porovnat jejich účinek na BMD, trabekulární kostní skóre (TBS), markery kostního obratu a perzistenci po dvouletém podávání [5]. U postmenopauzálních žen s osteoporózou byla léčba denosumabem spojena s větším nárůstem BMD na všech měřených místech skeletu, s výraznějším zvýšením TBS (graf 2A–C) a větší inhibicí kostní remodelace ve srovnání s kyselinou zoledronovou.
Dlouhodobý efekt denosumabu na mikroarchitekturu kosti (dle TBS i míru degradace trámčiny) doložila i další post hoc analýza studie FREEDOM a její extenze [6].
 Dlouhodobá terapie denosumabem vedla také ke snížení rizika zlomeniny horních končetin (včetně zápěstí, předloktí a pažní kosti), které představují významnou zátěž u postmenopauzálních žen s osteoporózou [7]. Docent Vyskočil dále vyzdvihl práci Dempsera a kol. sledující efekt dlouhodobého podávání denosumabu na histomorfometrii a mineralizaci kostí u žen s postmenopauzální osteoporózou pomocí fluorochromového barvení. Výsledky dokládající normální histologii, nízkou rychlost remodelace kosti a zvýšenou mineralizaci matrix a spolu s udržením nízké četnosti zlomenin po dobu až 10 let naznačují, že silná prodloužená inhibice remodelace nezhoršuje pevnost kosti [8].
Dlouhodobá terapie denosumabem vedla také ke snížení rizika zlomeniny horních končetin (včetně zápěstí, předloktí a pažní kosti), které představují významnou zátěž u postmenopauzálních žen s osteoporózou [7]. Docent Vyskočil dále vyzdvihl práci Dempsera a kol. sledující efekt dlouhodobého podávání denosumabu na histomorfometrii a mineralizaci kostí u žen s postmenopauzální osteoporózou pomocí fluorochromového barvení. Výsledky dokládající normální histologii, nízkou rychlost remodelace kosti a zvýšenou mineralizaci matrix a spolu s udržením nízké četnosti zlomenin po dobu až 10 let naznačují, že silná prodloužená inhibice remodelace nezhoršuje pevnost kosti [8].
Přednášející dále prezentoval vlastní výsledky z klinické praxe, které potvrzují dobrou účinnost denosumabu z klinického hodnocení, a v závěru seznámil přítomné s kazuistikou stoleté pacientky, kterou má v péči od roku 2001. Pacientka byla původně léčena bisfosfonáty, následovaly tzv. drug holiday a posledních pět let je léčena denosumabem (LP Prolia).
Moje první klinické zkušenosti s romosozumabem
O první zkušenosti s novým přípravkem pro terapii osteoporózy – romosozumabem (Evenity) – se s přítomnými podělili MUDr. Richard Pikner, Ph.D., (Oddělení klinických laboratoří, Klatovská nemocnice) a MUDr. František Šenk (Osteologické centrum Kraje Vysočina – Nemocnice Havlíčkův Brod).
Romosozumab je humanizovaná monoklonální protilátka, která váže a inhibuje sklerostin, čímž se podněcuje tvorba kosti v důsledku aktivace buněk kostní výstelky, zvyšuje produkci kostní hmoty osteoblasty a nábor osteoprogenitorových buněk. Romosozumab navíc vede ke změnám v expresi mediátorů osteoklastů, čímž se snižuje resorpce kosti. Tento duální účinek na zvýšení tvorby kosti a snížení její resorpce má za následek rychlý nárůst trabekulární a kortikální kostní hmoty, zlepšení struktury a pevnosti kostí. Romosozumab je prvním anabolickým lékem, který je možné podávat v první linii léčby.
Primář Pikner připomněl, že každá prodělaná osteoporotická zlomenina zvyšuje riziko další zlomeniny. Nejrizikovější jsou první dva roky a i poté zůstává riziko zvýšené. Tento fakt poskytuje racionální podklad pro co nejčasnější zahájení účinné intervence. Antiporotická terapie snižuje riziko o 30–70 %. Anabolická terapie je efektivnější než bisfosfonáty a je efektivnější u dosud neléčených.
Přednášející představil soubor pacientek sledovaných od října 2023 ve věkovém rozmezí 50–84 let, pouze čtyři pacientky byly mladší 65 let. Všechny splnily indikační úhradová kritéria léčivého přípravku Evenity, tj. postmenopauzální ženy s těžkou osteoporózou s vysokým rizikem opakovaných zlomenin definovanou prokázanou ztrátou kostní hmoty celotělovým denzitometrem (T‑skóre ≤ –2,5 SD) na standardních měřených místech (bederní páteř, proximální femur, ev. předloktí) a proděláním osteoporotické (křehké) zlomeniny. Zároveň nebyly diagnostikovány infarkt myokardu (IM) a/nebo cévní mozková příhoda (CMP). Sledovány byly sérové markery PINP (N‑terminální propeptid prokolagenu typu I) a CTX, měření kostní denzity pomocí dvouenergiové RTG absorpční fotometrie (DXA) před zahájením a šest měsíců po zahájení terapie (před 6. dávkou). Hodnocena byla změna BMD, kostních markerů a nežádoucí účinky léčby. Jeho sledování zahrnuje celkem osm pacientek. Primář Pikner konstatoval ohromující nárůst kostní denzity během půl roku o více než 5 %. Na druhou stranu nebyl zaznamenán signifikantní nárůst hodnot kostních markerů. Nebyly zaznamenány žádné nežádoucí účinky spojené s aplikací romosozumabu. Přednášející uvedl, že je již zvědav na výsledky po jednom roce léčby.
V závěru přednášející shrnul, že vítá mírnější úhradová kritéria, z vlastní zkušenosti může potvrdit, že u léčených pacientek došlo k více než významnému zlepšení BMD po šesti měsících. Kostní markery na druhou stranu nevykazovaly interpretovatelné změny. Snahu o samoaplikaci léčby využila část pacientek.
MUDr. František Šenk v navazujícím sdělení prezentoval kazuistiky dvou pacientek.
První pacientka, rok narození 1954, výška 153 cm, hmotnost 61,5 kg. Otec kardiak, dále rodinná anamnéza stran kardiovaskulárních onemocnění či osteoporózy negativní. Vstupní vyšetření absolvovala v říjnu 2023. Pacientka byla doporučena z onkologie. V srpnu 2022 u ní byl diagnostikován karcinom prsu l. sin., prodělala neoadjuvantní chemoterapii, v březnu 2023 radikální mastektomii s exenterací levé axily, radioterapii a od konce března 2023 je léčena inhibitory aromatázy. Dále je léčena pro hyperurikemii a hypertenzi. Menopauza v padesáti letech, bez hormonální substituce (HRT). Mléčné výrobky konzumuje, pohyb dostatečný, nepadá, bez stomatologických potíží. Co se týče fraktur, v 58 letech si po pádu na náledí zlomila pravé zápěstí, RTG vyšetření hrudní páteře ukázalo mírné snížení těl ve vrcholu kyfózy, RTG lumbosakrální (LS) páteře bez komprese. Scintigrafie skeletu v lednu 2023 byla bez nálezu metastáz či komprese obratlů. V medikaci letrozol, perindopril/indapamid/amlodipin 5 mg/1,25 mg/5 mg, betaxolol 25 mg, alopurinol 100 mg, pantoprazol 40 mg p.p. Vstupní laboratorní hodnoty byly v normě, včetně jaterních testů a renálních funkcí, krevní obraz v normě, močový nález přiměřený, tyreotropní hormon (TSH) v normě, mírně snížená hodnota vitaminu D (71,7 nmol/l). Markery kostního obratu CTX 750 ng/l, PINP 60,9 µg/l. Denzitometrie L1–2 T‑skóre (Ts) –4,5, Z‑skóre (Zs) –2,8; prox. femur Ts –2,5, Zs –1,1; krček femuru Ts –2,8, Zs –1,2.
Diagnostikována byla manifestní vysokoobratová postmenopauzální osteoporóza potencovaná onkologickou anamnézou. Indikována substituce vápníku a vitaminu D (500 mg/1 000 IU 1× denně, cholekalciferol 10 kapek 1× týdně), romosozumab 105 mg s.c. (2 injekce 1× měsíčně) na jeden rok. Indikační kritéria pro romosozumab splněna (menopauzální, nízkoenergetická fraktura, Ts –2,5 a méně, absence IM/CMP v anamnéze).
Kontrolní vyšetření po půlroce provedeno 3. dubna 2024. Kontrolní laboratoř: kalciofosfátový metabolismus v séru a moči přiměřený, alkalická fosfatáza v normě, hodnota vitaminu D se zvýšila na 98 nmol/l, CTX 360 ng/l, PINP 78,5 µg/l, kontrolní denzitometrie: L1–2 Ts –3,6, Zs –1,9 (nárůst o 17,4 %), prox. femur Ts –2,2, Zs –0,7 (nárůst o 5,8 %), krček femuru Ts –2,6, Zs –1 (nárůst o 3,2 %). Tolerance léčby byla dobrá, bez nežádoucích účinků.
Druhý případ představuje předléčená pacientka, rok narození 1952, výška 167 cm, hmotnost 64 kg, byla doporučena z ortopedie, vstupní vyšetření absolvovala v květnu 2009. Otec kardiak, zemřel na IM, bratr – karcinom prostaty, druhý bratr – karcinom ledviny, výskyt osteoporózy v rodině neguje.
Od třiceti let v péči revmatologie pro séronegativní revmatoidní artritidu IIb, pro recidivující tracheobronchitidy je v péči alergologa, prodělala operaci peritonzilárního abscesu, dvakrát operaci nosní přepážky, v r. 1992 plastika močového měchýře, bilat. ovarektomie pro cysty, v r. 2015 pásový opar v oblasti hrudníku, v květnu 2019 rekonstrukce pánevního dna pro poruchu mikce, v listopadu 2019 reoperace pro stresovou inkontinenci. V lednu 2021 prodělala středně významný covid‑19 s nutností hospitalizace s dlouhodobými problémy v podobě pruritu. Trpí hemoroidy, chronická žilní insuficience dolních končetin.
Menopauza ve 40 letech (ovariektomie), HRT 1998–2007. Mléčné výrobky konzumuje, pohyb dostatečný, nepadá, bez stomatologických potíží. V roce 2009 bez anamnézy fraktur, negativní byl i snímek páteře. Pozdější snímek páteře pro horšící se bolesti páteře v květnu 2009 ukázal v oblasti hrudní páteře klínovité komprese ve vrcholu hrudní kyfózy s maximem v Th8–9 (ventrální snížení o polovinu výšky obratlového těla), LS páteř bez komprese. Jednalo se o náhodný nález bez anamnézy úrazu. V medikaci lansoprazol 20 mg, diosmin 500 mg, acidum folicum a metotrexát v letech 2013–2021, hydroxychlorochin 200 mg od r. 2020, adalimumab 40 mg od r. 2021, cetirizin 10 mg, nimesulid p.p., ibuprofen p.p., systémové kortikoidy pouze půl roku v r. 2014 (methylprednisolon 8 mg).
Osteologická medikace na spádovém pracovišti: pouze suplementace vápníku 500 mg 1× denně, několik let bez vitaminu D3. Dále užívala alendronát 70 mg v letech 1998–2001, lososí kalcitonin 200 µg v letech 2002–2003, alendronát 70 mg v období 2003–2009.
Dle vstupního laboratorního vyšetření základní biochemie séra v normě, včetně jaterních a renálních funkcí, krevní obraz v normě, močový nález přiměřený, TSH v normě, cholesterol 7 mmol/l, hodnota vitaminu D v té době nevyšetřována. Markery kostního obratu CTX 329 ng/l, osteokalcin 4,5 µg/l, dle denzitometrie L1–4 Ts –3,7, Zs –2,7, prox. femur Ts –0,7, Zs 0,1, krček femuru Ts –1,4, Zs –0,4.
Diagnóza byla uzavřena jako postovarektomická osteoporóza bez prevalentní patologické fraktury u pacientky s revmatoidní artritidou. Zahájena byla léčba vápníkem a vitaminem D (500 mg/400 IU 1× denně) a ibandronátem 150 mg 1‑0‑0 1× měsíčně. Terapii bylo v průběhu času nutné opakovaně měnit. Perorální ibandronát byl po čtyřech letech pro polykací potíže nahrazen intravenózní (i.v.) formou (ibandronát 3 mg i.v.). Ten byl po půlroce vysazen pro suspektní alergii a přešlo se na denosumab 60 mg s.c. Denosumab byl po třech letech nahrazen pro nárůst frekvence infekcí močových cest zoledronátem 5 mg i.v. 1× ročně. Po čtyřech letech aplikace následovaly tzv. drug holiday. Vývoj BMD v čase byl uspokojivý v oblasti krčku a kyčle, ale v oblasti páteře BMD nikdy nedosáhl přiměřených hodnot.
Při kontrolním vyšetření po roce, v říjnu 2023, došlo dle laboratorního vyšetření k nárůstu parametru osteoresorpce (CTX 139 ng/l v r. 2022, nyní 233 ng/l) a k poklesu osteoanabolického parametru (PINP 18,2 µg/l v r. 2022, nyní 16,7 µg/l). Pokles kostní denzity byl mírný, nesignifikantní. Hodnota TBS L1–4 1,25 byla přiměřeně snížená k věku, T‑skóre adjustované na TBS –3,6, mikroarchitektura trabekulární kosti snížená.
Pro vysoké riziko patologické fraktury s významně sníženým indexem odolnosti trabekulární kosti byl do léčby přidán romosozumab v dávce 105 mg s.c. (ve dvou injekcích 1× měsíčně) na jeden rok. Léčba vápníkem a vitaminem D zachována.
Po půlroce při kontrolním vyšetření zjištěn pokles hodnoty CTX na 121 ng/l, zvýšení hodnoty PINP na 29,2 µg/l a dle denzitometrie došlo poprvé u pacientky k výraznému zlepšení v oblasti páteře: L1–4 Ts –2,8, Zs –1,1 (+9,7 %), prox. femur Ts –0,3, Zs 1,3 (+1,6 %) a krček femuru Ts –1,3, Zs 0,5 (+0,1 %). Léčbu pacientka dobře toleruje, bez nežádoucích účinků, romosozumab si aplikuje sama.
Romosozumab, poznatky z klinických studií a reálné klinické praxe
Romosozumabu a datům z klinických studií i reálné praxe se ve své přednášce podrobněji věnoval Dr. Cesar Libanati (Loma Linda, Kalifornie, USA). V úvodu připomněl mechanismus účinku romosozumabu a jeho duální působení – zvýšení kostní formace a potlačení kostní resorpce. Tento efekt reflektují změny sérových markerů kostní formace a nárůst BMD [9,10]. Chavassieux a kol. hodnotící ve své práci účinky romosozumabu na kostní tkáň u podskupiny pacientek ze studie FRAME doložili výrazné zvýšení dynamických parametrů tvorby kostní hmoty a pokles parametrů resorpce [11]. Studie ARCH potvrdila, že jeden rok podávání romosozumabu vede k většímu nárůstu BMD ve srovnání s alendronátem a že T‑skóre dosažené při obou terapiích souvisí s následným rizikem zlomenin [12]. Jasný vztah mezi T‑skóre dosaženým v oblasti krčku při léčbě a rizikem následných fraktur doložila také extenze FREEDOM s denosumabem [13]. Tato data podporují použití T‑skóre jako terapeutického cíle pro pacienty s osteoporózou.
Přednášející dále osvětlil, pro koho je terapie romosozumabem určena. Jedná se o pacientky ve velmi vysokém riziku vzniku zlomenin s osteoporózou a s frakturou v anamnéze. Poukázal na smutný fakt, že pouze malý podíl pacientů po zlomenině je dále léčen antiosteoporotickou terapií. Za faktory velmi vysoké rizikovosti jsou považovány recentní fraktura, vyšší věk, nízká BMD, u předchozí zlomeniny hraje roli také její lokalizace. Až 50 % pacientů prodělá další zlomeninu do dvou let.
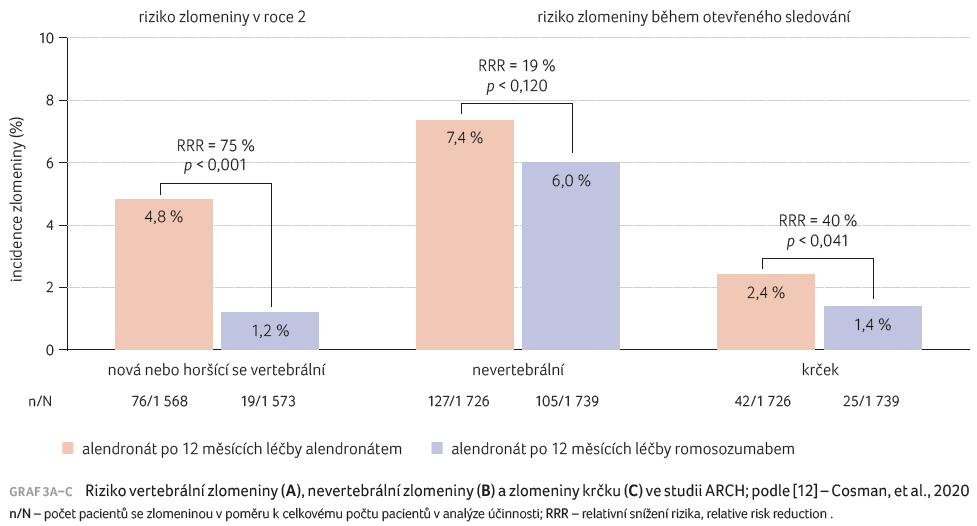 Doktor Libanati zmínil výsledky studie ARCH. U postmenopauzálních žen s osteoporózou, které měly vysoké riziko zlomenin, vedla léčba romosozumabem po dobu 12 měsíců následovaná alendronátem k významně nižšímu riziku zlomenin než podávání pouze alendronátu po celé léčebné období (graf 3A–C) [12]. Výsledky označil za data porovnávající alendronát vs. alendronát.
Doktor Libanati zmínil výsledky studie ARCH. U postmenopauzálních žen s osteoporózou, které měly vysoké riziko zlomenin, vedla léčba romosozumabem po dobu 12 měsíců následovaná alendronátem k významně nižšímu riziku zlomenin než podávání pouze alendronátu po celé léčebné období (graf 3A–C) [12]. Výsledky označil za data porovnávající alendronát vs. alendronát.
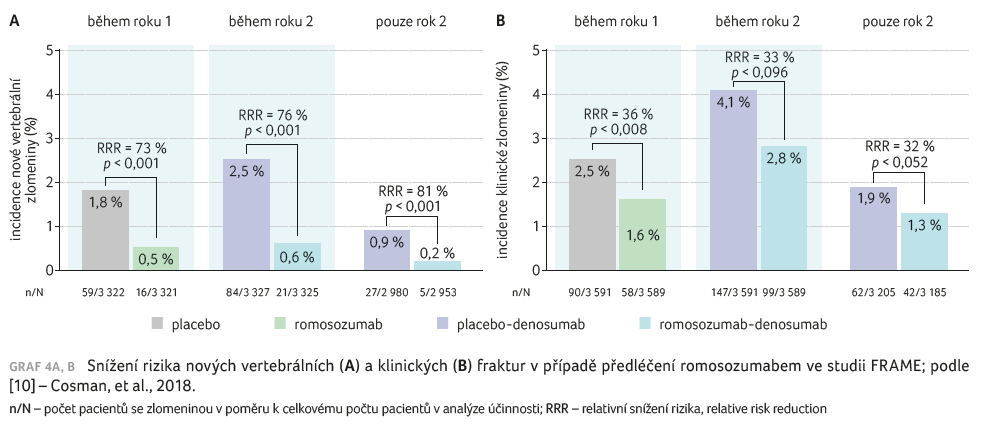
Obdobně ve studii FRAME, kdy pacientky dostávaly romosozumab 210 mg s.c. nebo placebo jednou měsíčně po dobu 12 měsíců a následně denosumab 60 mg s.c. jednou za 6 měsíců v obou skupinách po dobu 12 měsíců, je zřejmá redukce rizika fraktur u pacientek předléčených romosozumabem (graf 4A, B) [10].
Na porovnání strukturálních změn při podávání romosozumabu oproti alendronátu se zaměřila analýza studie ARCH, jejímiž autory byli Brown a kol. [14]. Významně větší zvýšení pevnosti kosti bylo zaznamenáno ve skupině s romosozumabem.
Je doloženo, že předchozí léčba bisfosfonáty zeslabuje účinek teriparatidu na novotvorbu kosti. Doktor Libanati dále představil výsledky studie, která si dala za cíl porovnat účinky 12měsíční léčby romosozumabem oproti léčbě teriparatidem na BMD u žen s postmenopauzální osteoporózou přecházejících z terapie bisfosfonáty [15]. Romosozumab vedl ke zvýšení BMD v oblasti krčku, které nebylo pozorováno u teriparatidu.
 Prozkoumat vliv předchozí léčby osteoporózy (bisfosfonáty, teriparatid nebo denosumab) na odpověď na léčbu romosozumabem následovanou denosumabem u pacientek s postmenopauzální osteoporózou si dala za cíl práce Ebina a kol. [16]. Předchozí léčba ovlivnila zvýšení BMD po léčbě romosozumabem, ale neovlivnila zvýšení BMD po léčbě denosumabem, na kterou přešly pacientky po romosozumabu.
Prozkoumat vliv předchozí léčby osteoporózy (bisfosfonáty, teriparatid nebo denosumab) na odpověď na léčbu romosozumabem následovanou denosumabem u pacientek s postmenopauzální osteoporózou si dala za cíl práce Ebina a kol. [16]. Předchozí léčba ovlivnila zvýšení BMD po léčbě romosozumabem, ale neovlivnila zvýšení BMD po léčbě denosumabem, na kterou přešly pacientky po romosozumabu.
V závěru přednášející zmínil bezpečnost léčby romosozumabem. Léčba je obecně dobře tolerována, mezi její nejčastější nežádoucí účinky patří lokální reakce v místě vpichu (bolest, zčervenání). Zvýšený výskyt kardiovaskulárních příhod, který byl pozorován při léčbě romosozumabem oproti alendronátu, ale ne proti placebu, mohl mít dle přednášejícího tři vysvětlení. Romosozumab může skutečně zvyšovat riziko, nebo může mít alendronát určitý protektivní efekt, nebo jde o náhodné zjištění. Romosozumab je nicméně z bezpečnostních důvodů kontraindikován u pacientů s anamnézou IM a/nebo CMP.
Doktor Libanati v závěru shrnul, že romosozumab představuje důležitou modalitu léčby osteoporózy u menopauzálních pacientek ve velmi vysokém riziku zlomeniny. Nárůst BMD při 12měsíční léčbě romosozumabem je spojen s rychlým snížením rizika zlomeniny. Sekvenční léčba, kdy je romosozumab následován antiresorpčním přípravkem, vede k rychlé a setrvalé redukci rizika fraktur.
Literatura
[1] Kendler DL, Cosman F, Stad RK, Ferrari S. Denosumab in the Treatment of Osteoporosis: 10 Years Later: A Narrative Review. Adv Ther 2022; 39: 58–74.
[2] Dong L, Jiang L, Xu Z, Zhang X. Denosumab, teriparatide and bisphosphonates for glucocorticoid‑induced osteoporosis: a Bayesian network meta‑analysis. Front Pharmacol 2024; 15: 1336075.
[3] Iconaru L, Baleanu F, Charles A, et al. Which treatment to prevent an imminent fracture? Bone Rep 2021: 15: 101105.
[4] Boschitsch E, Naegele O, Klinger A, Brix‑Samoylenko H. Long‑term persistence with denosumab: real‑world data from the Austrian Osteoporosis Clinic (AOC). A retrospective data analysis. Osteoporos Int 2022; 33: 263–272.
[5] Kang T, Park SY, Lee SH, et al. Comparison of Denosumab and Zoledronic Acid in Postmenopausal Women With Osteoporosis: Bone Mineral Density (BMD) and Trabecular Bone Score (TBS). J Korean Med Sci 2022; 37: e68.
[6] Didier H, McDermott M, Huang S, et al. Long‑term effect of denosumab on bone microarchitecture as assessed by tissue thickness‑adjusted trabecular bone score in postmenopausal women with osteoporosis: results from FREEDOM and its open‑label extension. Osteoporos Int 2023; 34: 1075–1084.
[7] Bilezikian JP, Lin CJF, Brown JP, et al. Long‑term denosumab treatment restores cortical bone loss and reduces fracture risk at the forearm and humerus: analyses from the FREEDOM Extension cross‑over group. Osteoporos Int 2019; 30: 1855–1864.
[8] Dempser DW, Brown JP, Fahrleitner‑Pammer A, et al. Effects of Long‑Term Denosumab on Bone Histomorphometry and Mineralization in Women With Postmenopausal Osteoporosis. J Clin Endocrinol Metab 2018; 103: 2498–2509.
[9] Cosman F, Crittenden DB, Adachi JD, et al. Romosozumab Treatment in Postmenopausal Women with Osteoporosis. N Engl J Med 2016; 375: 1532–1543.
[10] Cosman F, Crittenden DB, Ferrari S, et al. FRAME Study: The Foundation Effect of Building Bone With 1 Year of Romosozumab Leads to Continued Lower Fracture Risk After Transition to Denosumab. J Bone Miner Res 2018; 33: 1219–1226.
[11] Chavassieux P, Chapurlat R, Portero‑Muzy N, et al. Bone‑Forming and Antiresorptive Effects of Romosozumab in Postmenopausal Women With Osteoporosis: Bone Histomorphometry and Microcomputed Tomography Analysis After 2 and 12 Months of Treatment. J Bone Miner Res 2019; 34: 1597–1608.
[12] Cosman F, Lewiecki EM, Ebeling PR, et al. T‑Score as an Indicator of Fracture Risk During Treatment With Romosozumab or Alendronate in the ARCH Trial. J Bone Miner Res 2020; 35: 1333–1342.
[13] Ferrari S, Libanati C, Lin CJF, et al. Relationship between bone mineral density T‑score and nonvertebral fracture risk over 10 years of denosumab treatment. J Bone Miner Res 2019; 34: 1033–1040.
[14] Brown JP, Engelke K, Keaveny TM, et al. Romosozumab improves lumbar spine bone mass and bone strength parameters relative to alendronate in postmenopausal women: results from the Active‑Controlled Fracture Study in Postmenopausal Women With Osteoporosis at High Risk (ARCH) trial. J Bone Miner Res 2021; 36: 2139–2152.
[15] Langdahl BL, Libanati C, Crittenden DB, et al. Romosozumab (sclerostin monoclonal antibody) versus teriparatide in postmenopausal women with osteoporosis transitioning from oral bisphosphonate therapy: a randomised, open‑label, phase 3 trial. Lancet 2017; 390: 1585–1594.
[16] Ebina K, Etani Y, Tsuboi H, et al. Effects of prior osteoporosis treatment on the treatment response of romosozumab followed by denosumab in patients with postmenopausal osteoporosis. Osteoporos Int 2022; 33: 1807–1813.