Význam inzulinových analog v léčbě diabetes mellitus 2. typu
Souhrn:
Se vstupem nových antidiabetik do klinické praxe se možnosti léčby diabetes mellitus 2. typu opět rozšířily. Stává se snadnějším vybrat typ léčby, který podle druhu patofyziologické poruchy pacient individuálně potřebuje. Přestože nová antidiabetika více šetří funkci β‑buněk pankreatu, část pacientů s diabetem 2. typu stále potřebuje k zabezpečení kompenzace inzulinoterapii. Nová generace inzulinových analog je stejně účinná jako předchozí, má delší trvání účinku, je spojena s nižším rizikem vzniku hypoglykemií a s menšími přírůstky tělesné hmotnosti. Principem delšího trvání účinku nových inzulinových analog je větší molekulární číslo nebo depotní povrch, které ovlivňují clearance a absorpci inzulinu. Nové generace inzulinových analog s nižším rizikem hypoglykemií umožňují bezpečnější titraci inzulinu a tím rychlejší dosažení požadovaných cílů kompenzace. Kombinace inzulinových analog s agonisty receptorů GLP‑1, s inhibitory DPP‑4 nebo s glifloziny snižuje významně přírůstky hmotnosti i spotřebu inzulinu. Flexibilnější inzulinové režimy zlepšují adherenci pacienta k inzulinoterapii a zlepšují kvalitu života.
Key words: new generations of insulin analogues – type 2 diabetes mellitus – combined therapy – GLP‑1 receptor agonists – DPP‑4 inhibitors – gliflozines.
Summary:
The therapy of type 2 diabetes mellitus is expanding rapidly as a consequence of introduction of new antidiabetic drugs. This facilitates the selection for the patient of a type of therapy which suits the particular type of disease corresponding to the type of pathophysiological disorder. Despite the fact that new antidiabetic drugs are more considerate to the function of β-cells, a part of patients with type 2 diabetes mellitus requires insulin therapy to ensure glycaemic control. The new generation of insulin analogues is just as effective as the previous one, but, however, has a longer period of duration of action, a lower risk of hypoglycaemia, and lower weight increases. The principle behind the longer duration of effect of the new insulin analogues is related to the higher molecular number or depot surface which influences clearing and absorption of insulin. New generations of insulin analogues with decreased risk of hypoglycaemia enable safer titration of insulin and thus faster achievement of the required aims of compensation. Combination of insulin analogues with GLP‑1 receptor agonists, DPP‑4 inhibitors or gliflozines significantly lowers weight growth and insulin consumption. More flexible insulin regimens improve adherence of the patient to insulin therapy while improving life quality.
Úvod
Vzhledem k progresivnímu charakteru onemocnění je u diabetiků 2. typu v indikovaných případech potřeba zahájit a intenzifikovat léčbu inzulinem, aby byla substituována porucha normální fyziologie sekrece inzulinu, tj. zabezpečení 50 % bazální sekrece inzulinu během dne a 50 % prandiální sekrece v odpovědi na podnět jídlem. Inzulinov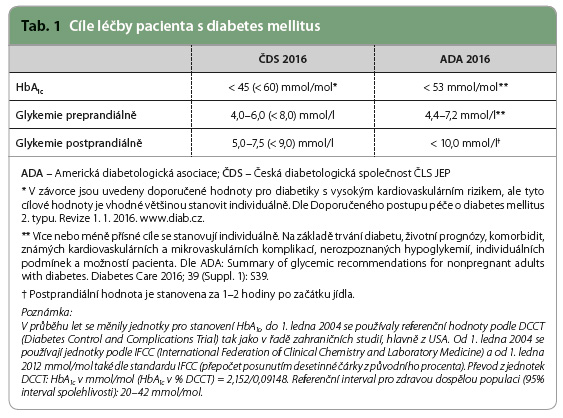 á analoga (lispro, aspart, glulisin) navodí po subkutánní injekci vyšší inzulinemii a mají rychlejší nástup účinku než humánní krátce působící inzulin. Bazální inzulinová analoga (detemir, glargin 100 U/ml a glargin 300 U/ml, degludec) mají delší trvání účinku, menší intraindividuální variabilitu, větší předvídatelnost účinku, jejich podávání provází méně hypoglykemií a mají výhodnější hmotnostní profil, než mají středně dlouho působící inzuliny. Je potřeba méně aplikací k tomu, aby byla zabezpečena suprese produkce glukózy mezi jídly a přes noc. Podání inzulinu glargin 100 U/ml snižovalo u pacientů ve studiích oproti inzulinu NPH (Neutral Protamine Hagedorn) riziko hypoglykemií o 42–48 % [1]. Podobně i inzulin detemir oproti inzulinu NPH snižoval riziko vzniku nočních hypoglykemických příhod o 34 % [2]. Přehled výsledků studií z databází s rychle působícími inzulinovými analogy prokázal snížení výskytu těžkých hypoglykemických příhod ve srovnání s krátce působícím humánním inzulinem (21,8 vs. 46,1 příhody na 100 osob/rok) [3]. Výhody nižších přírůstků hmotnosti při podávání inzulinu detemir se potvrdily v řadě studií srovnávajících inzulin detemir oproti inzulinu NPH u diabetiků 1. a 2. typu (1–2 kg v intervalu 16–52 týdnů trvání studií) [4]. Inzulinová analoga zlepšují adherenci pacienta k léčbě. Pro pacienta je výhodnější, pokud si může aplikovat bazální inzulin jedenkrát denně v libovolný čas a prandiální inzulin s jídlem v dávce odpovídající dávce sacharidů nebo energetickému obsahu stravy než aplikovat středně dlouze působící inzulin nejméně dvakrát denně a krátce působící humánní inzulin 30 minut před jídlem s rizikem hypoglykemií mezi jídly a v noci. Cílové hodnoty léčby pacienta s diabetem ukazuje tab. 1.
á analoga (lispro, aspart, glulisin) navodí po subkutánní injekci vyšší inzulinemii a mají rychlejší nástup účinku než humánní krátce působící inzulin. Bazální inzulinová analoga (detemir, glargin 100 U/ml a glargin 300 U/ml, degludec) mají delší trvání účinku, menší intraindividuální variabilitu, větší předvídatelnost účinku, jejich podávání provází méně hypoglykemií a mají výhodnější hmotnostní profil, než mají středně dlouho působící inzuliny. Je potřeba méně aplikací k tomu, aby byla zabezpečena suprese produkce glukózy mezi jídly a přes noc. Podání inzulinu glargin 100 U/ml snižovalo u pacientů ve studiích oproti inzulinu NPH (Neutral Protamine Hagedorn) riziko hypoglykemií o 42–48 % [1]. Podobně i inzulin detemir oproti inzulinu NPH snižoval riziko vzniku nočních hypoglykemických příhod o 34 % [2]. Přehled výsledků studií z databází s rychle působícími inzulinovými analogy prokázal snížení výskytu těžkých hypoglykemických příhod ve srovnání s krátce působícím humánním inzulinem (21,8 vs. 46,1 příhody na 100 osob/rok) [3]. Výhody nižších přírůstků hmotnosti při podávání inzulinu detemir se potvrdily v řadě studií srovnávajících inzulin detemir oproti inzulinu NPH u diabetiků 1. a 2. typu (1–2 kg v intervalu 16–52 týdnů trvání studií) [4]. Inzulinová analoga zlepšují adherenci pacienta k léčbě. Pro pacienta je výhodnější, pokud si může aplikovat bazální inzulin jedenkrát denně v libovolný čas a prandiální inzulin s jídlem v dávce odpovídající dávce sacharidů nebo energetickému obsahu stravy než aplikovat středně dlouze působící inzulin nejméně dvakrát denně a krátce působící humánní inzulin 30 minut před jídlem s rizikem hypoglykemií mezi jídly a v noci. Cílové hodnoty léčby pacienta s diabetem ukazuje tab. 1.
Současné postavení inzulinoterapie v léčbě diabetu
Všechny odborné diabetologické společnosti doporučují udržovat kompenzaci diabetu od počátku onemocnění v cílových hodnotách, které se přizpůsobují věku, možnostem a komorbiditám pacienta. Při monoterapii perorálními antidiabetiky lze očekávat snížení hodnoty glykovaného hemoglobinu (HbA1c) o 2 %; o 3 % lze snížit hodnotu HbA1c při podávání perorálních antidiabetik v trojkombinaci [5]. U pacientů s HbA1c > 10 % (86 mmol/mol) nelze spolehlivě očekávat snížení hodnoty HbA1c < 7 % (53 mmol/mol) při samotné léčbě perorálními antidiabetiky. Stanovisko Americké diabetologické asociace a Evropské asociace pro studium diabetu (American Diabetes Association/European Association for the Study of Diabetes, ADA/EASD) týkající se léčby diabetu 2. typu umožňuje zahájit léčbu přímo dvojkombinací při hodnotě HbA1c ≥ 75 mmol/mol (dle ČDS: nad 60 mmol/mol kombinace PAD, nad 75 mmol/mol inzulinoterapie). Inzulinoterapie se v těchto doporučeních dostala do druhé linie léčby hned za terapii představovanou kombinací diety, fyzické zátěže a podáváním metforminu, pokud není dosaženo požadovaných cílů kompenzace [6].
Přestože postupy k zahájení inzulinoterapie jsou v doporučeních odborných společností stanoveny, prokázalo se [7], že velká část pacientů (43 %) požadovaných hodnot HbA1c < 7 % nedosahuje. Retrospektivní studie [8] dokumentovala, že pacienti s diabetes mellitus 2. typu měli přibližně pět let od doby stanovení diagnózy hodnotu HbA1c > 8 % a asi deset let – do zahájení inzulinoterapie – hodnotu HbA1c > 7 %. V jiných studiích [9,10] autoři zjistili, že po stanovení diagnózy je průměrná doba do zahájení inzulinoterapie 11,5 roku s hodnotou HbA1c 9–10 %. Mezi hlavní bariéry zahájení inzulinoterapie patří obava lékařů z nedostatečné adherence pacienta k terapii inzulinem, dále obava z nežádoucích účinků, jako je riziko hypoglykemií a hmotnostních přírůstků, a negativní vliv na „well being“ (pocit pohody) a na kvalitu života pacienta. Do studie DAWN2 [11] bylo zařazeno 8 274 diabetiků 1. a 2. typu ze 17 zemí léčených dietou, perorálními antidiabetiky (PAD) a inzulinem. Více než 50 % pacientů ve studii se domnívalo, že inzulin je příčinou jejich hmotnostního přírůstku, a obávali se zvýšení tělesné hmotnosti
Bazální inzulinová analoga
Inzulin glargin 100 U/ml patří mezi bazální inzulinová analoga, která jsou používána v léčbě diabetu 1. i 2. typu. Inzulin glargin má prodloužené trvání a bezvrcholový průběh účinku. Je u něj prokázána dlouhodobá bezpečnost a účinnost, jeho podávání provází nízké riziko vzniku hypoglykemických příhod. Kardiovaskulární bezpečnost byla ověřena studií ORIGIN [12] u pacientů s prediabetem a s nově zjištěným diabetem 2. typu. Inzulin glargin má prodloužený účinek vzhledem k posunutí izoelektrického bodu molekuly s následkem tvorby hexamerů a precipitátů v podkoží při hodnotě pH 7,6 [13,14]. Inzulin detemir se vzhledem k acylaci molekulou mastné kyseliny váže na albumin, ze kterého se pozvolna uvolňuje. Bazální inzulinová analoga ve srovnání s inzulinem NPH mají větší reprodukovatelnost absorpce po subkutánním podání, dobrou účinnost a s jejich podáváním je spojeno menší riziko vzniku hypoglykemických příhod. V metaanalýze studií [15] byla porovnávána dlouhodobě účinkující analoga inzulin detemir a inzulin glargin s inzulinem NPH u diabetiků 2. typu. Terapie bazálními analogy vedla k signifikantnímu snížení výskytu nočních a symptomatických hypoglykemií (p < 0,01) a léčba inzulinem detemir byla spojena s významně nižším přírůstkem tělesné hmotnosti.
Nové generace bazálních inzulinových analog (glargin 300 U/ml, degludec) jsou ve srovnání s předchozí generací (glargin 100 U/ml, detemir) stejně účinné, mají delší trvání účinku, bezvrcholový průběh účinku, menší variabilitu, představují menší riziko výskytu hypoglykemií, zvláště nočních, a nižší hmotnostní přírůstky. Molekulární číslo nebo depotní povrch ovlivňují absorpci a clearance inzulinu.
Inzulin glargin 300 U/ml
Inzulin glargin 300 U/ml je nový typ koncentrovaného bazálního inzulinu, po subkutánní injekci tvoří precipitáty v podkoží, ze kterých je inzulin glargin pomalu uvolňován. Má prodloužený účinek dosahující délky trvání 36 hodin. Vyrovnaného stavu dosahuje po 3–4 dnech podávání, jeho biologický poločas eliminace je 19 hodin. Inzulin glargin má nízké diurnální kolísání inzulinové koncentrace a vysokou reprodukovatelnost při porovnání mezi dny. Jeho funkce byla ověřována v klinickém programu EDITION u diabetiků 1. i 2. typu. EDITION 1 byla studie trvající šest měsíců, která probíhala u diabetiků 2. typu léčených kombinací bazálního a prandiálního inzulinu. Po šesti měsících došlo ve skupině s léčbou glarginem 300 U/ml (Gla 300) k podobnému snížení hodnoty HbA1c jako při léčbě glarginem 100 U/ml (Gla 100). Po šestiměsíční fázi extenze byl zaznamenán ve skupině léčené glarginem 300 U/ml těsně větší pokles hodnoty HbA1c. Studie EDITION 2 zahrnovala diabetiky 2. typu, kteří byli léčeni bazálním inzulinem v kombinaci s perorálními antidiabetiky. Po šesti i 12 měsících se prokázalo podobné snížení hodnoty HbA1c při léčbě glarginem 300 U/ml i glarginem 100 U/ml. Ve studii EDITION 3 byli pacienti s diabetem 2. typu, kteří nedosáhli požadovaných cílů kompenzace diabetu při neinzulinové léčbě, randomizováni k léčbě inzulinem glargin 100 U/ml nebo 300 U/ml, podávání sulfonylurey bylo přerušeno. Po šestiměsíčním podávání byl pokles hodnoty HbA1c podobný v obou skupinách. Metaanalýza dat ze studií EDITION 1, 2 a 3 dokumentovala průměrný pokles hodnoty HbA1c o 1,02 % v obou skupinách po šesti měsících, po dvou měsících byl prokázán výraznější pokles hodnoty HbA1c při léčbě inzulinem glargin 300 U/ml (p = 0,0174). Studie EDITON 4 zahrnula diabetiky 1. typu léčené intenzifikovaným inzulinovým režimem bazál/bolus – pokles hodnoty HbA1c byl skupinově srovnatelný, při podávání inzulinu glargin 300 U/ml došlo k jejímu snížení o 0,42 %, zatímco při podávání inzulinu glargin 100 U/ml byla hodnota HbA1c snížena o 0,44 %. Studie EDITION JP1 a JP2 probíhaly u diabetiků 1. a 2. typu v japonské populaci. I zde se prokázalo srovnatelné zlepšení v poklesu hodnoty HbA1c v obou skupinách.
Pokud jde o dávkování inzulinu, byli pacienti ve studii EDITION 1 a 2 převedeni na léčbu inzulinem glargin 300 U/ml z léčby předchozím bazálním inzulinem v poměru 1 : 1 a při zahajování inzulinoterapie u pacientů léčených původně perorálními antidiabetiky ve studii EDITION 3 byla úvodní dávka inzulinu glargin 300 U/ml 0,2 U/kg. Na konci šestiměsíční studie byla dávka bazálního inzulinu ve studii EDITION 1 a 2 vyšší při léčbě inzulinem glargin 300 U/ml – zvýšila se z 0,92 U/kg/den na 0,97 U/kg/den, při léčbě inzulinem glargin 100 U/ml stoupla z 0,84 U/kg/den na 0,88 U/kg/den. Na konci studie EDITION 3 činila dávka inzulinu glargin 300 U/ml 0,62 U/kg/den a dávka inzulinu glargin 100 U/ml 0,53 U/kg/den. Obdobný nález vyšší spotřeby inzulinu glargin 300 U/ml se prokázal i ve studii EDITION 4 u diabetiků 1. typu – stoupla z 0,38 U/kg/den na 0,47 U/kg/den, zatímco při podávání inzulinu glargin 100 U/ml došlo ke zvýšení z 0,37 U/kg/den na 0,40 U/kg/den. Vyšší spotřeba koncentrovanějšího inzulinu glargin 300 U/ml se přisuzuje delšímu setrvávání aplikovaného depa v podkoží a vlivu tkáňových peptidáz. Tříměsíční substudie EDITION 1 a 2 byla sestavena k posouzení možnosti flexibility dávkování glarginu 300 U/ml. Večerní dávka byla v jedné skupině podávána ve fixním 24hodinovém intervalu a ve druhé skupině v intervalu ±3 hodiny dle běžného dávkování, a to po dva dny a více v každém týdnu. Změna hodnoty HbA1c mezi oběma skupinami byla srovnatelná a srovnatelný byl rovněž výskyt nejméně jedné potvrzené hypoglykemie nebo těžké noční hypoglykemie (flexibilní vs. fixní dávkování ve studii EDITION 1 – 26,8 % vs. 22,6 %, ve studii EDITION 2 – 15,9 % vs. 23,3 %). Ve studii EDITION 4 nebyl prokázán rozdíl v glykemických profilech, ve výskytu hypoglykemií nebo nežádoucích účinků u diabetiků 1. typu při srovnání aplikace ráno nebo večer. Souhrn informací o přípravku (summary of product characteristics, SPC) Toujeo 300 U/ml (inzulin glargin 300 U/ml) umožňuje podávání kdykoliv během dne s tolerancí ±3 hodiny od času podání předchozí dávky.
Ve studiích EDITION 1, 2 a 3 bylo z pohledu výskytu potvrzených hypoglykemických příhod nebo těžkých nočních hypoglykemických příhod ve skupinách s léčbou inzulinem glargin 300 U/ml nebo 100 U/ml dokumentováno srovnatelné nebo snížené riziko při užívání inzulinu glargin 300 U/ml. Ve studii EDITION 1 u pacientů s diabetem 2. typu léčených režimem bazál/bolus došlo ke snížení relativního rizika vzniku jedné nebo více potvrzených hypoglykemií nebo těžkých nočních hypoglykemií od 9. týdne do 6. měsíce trvání studie (p = 0,0045) a od vstupu do studie do 8. týdne jejího trvání, od vstupu do studie do 6. měsíce trvání studie a od vstupu do 12. měsíce trvání studie. Ve studii EDITION 2 u diabetiků léčených kombinací bazálního inzulinu a perorálních antidiabetik vedla léčba inzulinem glargin 300 U/ml k 23% relativnímu snížení rizika vzniku nejméně jedné potvrzené hypoglykemie nebo těžké noční hypoglykemické příhody mezi 9. týdnem a 6. měsícem (p = 0,038) a od vstupu do studie do 8. týdne a od vstupu do studie do 6. měsíce jejího trvání. V metaanalýze studií EDITION 1, 2 a 3 při posunutí rozmezí nočního okna od 22.00 hodin do doby před snídaní se prokázalo nižší riziko vzniku hypoglykemií pro inzulin glargin 300 U/ml. Riziko vzniku nejméně jedné potvrzené hypoglykemie, těžké hypoglykemie nebo těžké noční hypoglykemie bylo u diabetiků 1. typu při podávání inzulinu glargin 300 U/ml srovnatelné s podáváním inzulinu glargin 100 U/ml, nižší bylo při léčbě inzulinem glargin 300 U/ml v době od vstupu studie do jejího 8. týdne, prokázala se tedy bezpečnost při titraci dávky. Ve studii EDITION 2 a 4 a numericky ve studii EDITION 3 bylo zaznamenáno méně přírůstků tělesné hmotnosti při podávání inzulinu glargin 300 U/ml [16–21].
Dle výsledku studií patří inzulin glargin 300 U/ml mezi bazální analoga poskytující srovnatelnou glykemickou kontrolu při podobném nebo nižším riziku vzniku nočních hypoglykemií a zabezpečující nižší přírůstky hmotnosti ve srovnání s inzulinem glargin 100 U/ml. Prodloužený účinek inzulinu glargin 300 U/ml může pomoci pacientům, kteří potřebovali dvě dávky bazálního inzulinu v předchozí době. Převod z užívání dvou dávek tzv. bazálu na užívání dávky jedné byl ve studiích provázen podobnou kontrolou glykemie a nižším rizikem vzniku hypoglykemických příhod. Nižší incidence hypoglykemií v úvodu léčby inzulinem glargin 300 U/ml dokumentuje bezpečnou titraci. Menší aplikovaná dávka do podkoží je pro pacienta komfortnější. Při převodu z léčby bazálním inzulinem podávaným dvakrát denně se počáteční dávka inzulinu glargin 300 U/ml snižuje o 20 %. Při převodu z bazálního inzulinu aplikovaného 1× denně zůstává dávka stejná. U části pacientů se může vyskytnout potřeba dávku o 10–18 % zvýšit. Pokud však zvláště diabetik 1. typu má i při léčbě původním inzulinem sklon k preprandiálním hypoglykemiím, zvýšení dávky nepotřebuje. Titrace k individuálním cílovým hodnotám je nezbytná, vyrovnané koncentrace dosahuje po 3–4 dnech a tehdy by dávka měla být upravována, nejlépe 1× týdně. V tomto smyslu je třeba pacienta edukovat. Zbytečné ponechání trvale zvýšených bolusových dávek po nastolení vyrovnané koncentrace inzulinu může vést individuálně k hypoglykemiím. Počáteční dávka u diabetiků 2. typu, kteří dosud nebyli léčeni inzulinem, je 0,2 U/kg, u diabetiků 1. typu nově diagnostikovaných je individuální a podává se vždy společně s krátkodobě působícím inzulinem k pokrytí jídla. Při převodu zpět na léčbu inzulinem glargin 100 U/ml je nutno dávku o 20 % snížit z důvodu prevence hypoglykemie.
Inzulin degludec
Inzulin degludec patří rovněž mezi zástupce nové generace bazálních inzulinových analog. Má připojenou mastnou kyselinu k lysinu na místě B29 v inzulinovém řetězci. Po subkutánní aplikaci tvoří multihexamerové řetězce, z nichž se uvolňováním zinku tvoří monomery, které se absorbují do krevního oběhu. Biologický poločas eliminace inzulinu je více než 25 hodin. Vyrovnané koncentrace dosahuje rovněž po třech dnech podávání. Prodloužený účinek trvá až 42 hodin a má čtyřikrát nižší variabilitu mezi dny ve srovnání s inzulinem glargin 100 U/ml při clampové studii s dávkováním 0,4 U/kg [22]. Degludec je k dispozici v koncentraci 100 U/ml a 200 U/ml. Účinnost a bezpečnost inzulinu byla sledována rozsáhlým klinickým programem BEGIN. Ve studii u diabetiků 1. typu se prokázal podobný časový profil u obou koncentrací [23]. Dlouhodobý účinek inzulinu degludec rovněž umožňuje podání kdykoliv během dne. Ve srovnání s inzulinem glargin 100 U/ml je spojen s nižším rizikem hypoglykemií, především nočních. Ve studii [24] bylo sledováno 239 diabetiků 1. typu, kteří byli převedeni na léčbu inzulinem degludec z původní léčby jiným typem bazálního inzulinu s aplikací dvakrát denně. Po 21 týdnech byla průměrná hodnota HbA1c snížena ze 78,0 mmol/mol na 72,2 mmol/mol, p < 0,0001. Průměrné snížení bazální dávky představovalo 13 % a celková dávka (bazální a prandiální) byla průměrně snížena o 11 %. Celkový počet hypoglykemických příhod se nezměnil, ale došlo ke snížení výskytu nočních hypoglykemií.
Inzulin degludec je vyráběn i ve fixní kombinaci s krátce působícím inzulinovým analogem aspart (30 % aspart, 70 % degludec), při jejímž užívání byl zaznamenán rychlý nástup účinku krátce působícího inzulinu a pak stabilní bezvrcholový účinek inzulinu degludec. Je určen pro jednodušší inzulinové režimy [25]. V České republice v současnosti není dostupný.
Další dlouhodobě působící inzulinová analoga
Pegylovaný inzulin lispro měl inzulinovou molekulu změněnou tak, že na lysin byl kovalentně navázán polyethylenglykol o velikosti 20 kDa, šlo tedy o větší hydrodynamickou velikost molekuly (71–98 kDa). Pegylovaný inzulin lispro byl hepatopreferenční inzulinové analogum s biologickým poločasem eliminace 2–3 dny, měl preferenční vazbu na inzulinové receptory v játrech a méně v tukové tkáni. Pegylovaný inzulin lispro patřil mezi první zástupce tkáňově selektivních inzulinů. V současnosti je výzkum tohoto přípravku zastaven.
Jsou také publikovány výsledky studií [26] s rekombinantním humánním monomerickým velmi dlouze působícím bazálním inzulinem PE0139. Obsahuje dlouhý polymer připojený k C terminálnímu konci inzulinové molekuly. Po injekční aplikaci tvoří podkožní depo, ze kterého se inzulin uvolňuje jeden až dva týdny. Nebyly zatím prokázány závažné nežádoucí účinky, asi 8 % pacientů vykazovalo mírný lokální erytém. Jsou však nezbytné další studie bezpečnosti a účinnosti.
Bolusová analoga
Krátkodobě účinkující bolusová analoga aspart, lispro a glulisin jsou v praxi dlouhodobě užívána s velmi dobrými účinky na kontrolu postprandiální glykemie. Ve studiích fáze 3a se nachází rychle účinkující inzulin aspart. Dle změny hodnoty HbA1c u diabetiků 1. a 2. typu se prokázala non inferiorita v režimech bazál/bolus. U diabetiků 1. typu došlo ke statisticky signifikantnímu zlepšení hodnoty HbA1c při podávání s jídlem ve srovnání s podáváním po jídle. U diabetiků 2. typu byl zaznamenán signifikantní pokles glykemie po jídle o 0,6 mmol/l. Při použití do inzulinových pump vykazoval lepší farmakokinetické a farmakodynamické vlastnosti než předchozí inzulin aspart [27].
Fixní kombinace bazálních analog s agonisty receptorů GLP 1
Kombinace inzulinu s agonisty receptorů peptidu podobného glukagonu 1 (glucagon like peptide 1 receptor agonists, GLP 1 RA) představuje výhodu komplementárního účinku. Inzulin zvyšuje utilizaci glukózy a snižuje výdej glukózy játry přímým působením ve svalech, v tukové tkáni a v játrech. Agonista GLP 1 stimuluje sekreci inzulinu, inhibuje sekreci glukagonu a zpomaluje vyprazdňování žaludku. Kombinace účinků snižuje glykemii nalačno i postprandiálně, snižuje hepatální produkci glukózy a zvyšuje její utilizaci. Agonisté receptorů GLP 1 vedou k pocitu sytosti, omezují potřebu příjmu potravy a snižují tak tělesnou hmotnost. Tím vyrovnávají hmotnostní přírůstky spojené s nutností titrace a se zvyšováním dávek inzulinu. Jejich podávání rovněž provází nižší riziko vzniku hypoglykemických příhod [28]. Výhody kombinace bazálního inzulinu a agonisty receptorů GLP 1 prokázala studie 4B, GetGoal Duo 2 nebo LIRA ADD2BASAL.
Ve studii 4B [29] byla u diabetiků 2. typu s neuspokojivě kompenzovaným diabetem srovnávána účinnost a bezpečnost přidání exenatidu dvakrát denně nebo inzulinu lispro ke každému jídlu, oběma skupinám byl zároveň podáván postupně titrovaný inzulin glargin s metforminem. Ve studii byla tříměsíční vstupní fáze s titrací inzulinu glargin v kombinaci s metforminem, podávání sulfonylurey bylo přerušeno. Na konci sledování dosáhlo jen 92 pacientů poklesu HbA1c na hodnotu ≤ 7,0 %, ze 7,9 % ± 0,7 % na 6,7 % ± 0,4 %, u 652 pacientů došlo k poklesu z 8,6 % ± 0,8 % na 8,4 % ± 0,9 %. Tito pacienti byli randomizováni buď k přidání exenatidu do léčby 2× denně, nebo k titraci prandiálního inzulinu lispro. Na konci 30týdenního sledování se z hlediska změny hodnoty HbA1c prokázala non inferiorita, hodnota HbA1c poklesla z 8,3 % ± 1,0 % na 7,2 % ± 1,0 % při podávání exenatidu a z 8,2 % ± 0,9 % na 7,2 % ± 1,0 % při podávání inzulinu lispro. Glykemie nalačno se snížila při terapii exenatidem, ale ne při léčbě inzulinem lispro. Postprandiální glykemie poklesla při všech třech denních jídlech v obou skupinách, k nejvýraznějšímu poklesu došlo po obědě při léčbě inzulinem lispro. Dále se výrazněji snížila hmotnost při léčbě exenatidem (–2,5 kg) a zvýšila se při léčbě inzulinem lispro (+2,1 kg), dávka inzulinu glargin se snížila více ve skupině s inzulinem lispro (+10 U) než ve skupině s exenatidem (–5 U). Incidence hypoglykemií byla při léčbě inzulinem lispro vyšší v případě výskytu méně závažných příhod (41 % vs. 30 %)
a potvrzených ne nočních hypoglykemií (34 % vs. 15 %). Menší nežádoucí gastrointestinální účinky byly častěji prokázány při léčbě exenatidem (47 % vs. 13 %).
Randomizovaná otevřená klinická studie GetGoal Duo 2 [30] sledovala diabetiky 2. typu neuspokojivě kompenzované bazálním inzulinem v kombinaci s perorálními antidiabetiky nebo bez nich. V úvodní 12týdenní titrační fázi byla přerušena léčba perorálními antidiabetiky s výjimkou léčby metforminem a upravována dávka inzulinu glargin, pak byli pacienti, jejichž hodnota HbA1c byla vyšší než 7 % a nižší než 9 %, randomizováni v poměru 1 : 1 : 1 k intenzifikaci léčby lixisenatidem v dávce 20 µg podávané 1× denně nebo k léčbě glulisinem podávaným 1× nebo 3× denně k hlavním jídlům. Podle změny hodnoty HbA1c na konci 26. týdne byla opět prokázána non inferiorita kombinace s lixisenatidem oproti kombinaci s glulisinem podávaným 1× i 3× denně, statisticky signifikantní byl pokles hmotnosti při léčbě lixisenatidem ve srovnání s glulisinem podávaným 3× denně (p < 0,0001). Léčba lixisenatidem snížila výskyt symptomatických hypoglykemií o 25 % oproti glulisinu podávanému 1× denně a o 51 % oproti glulisinu podávanému 3× denně. Také výskyt nočních hypoglykemií byl signifikantně nižší při léčbě lixisenatidem než při léčbě glulisinem podávaným 1× denně (p = 0,015) i glulisinem podávaným 3× denně (p = 0,0009).
Cílem studie LIRA-ADD2 BASAL [31], která trvala 26 týdnů, bylo potvrzení superiority přidání liraglutidu oproti placebu ke stávající terapii bazálním inzulinovým analogem v kombinaci s metforminem nebo bez metforminu u 451 diabetiků 2. typu. Hodnota HbA1c se při této léčbě signifikantně snížila o 1,3 %, zatímco při podávání placeba představovalo toto snížení 0,1 % (p < 0,0001). Více pacientů dosáhlo hodnoty HbA1c < 7 % (59 % vs. 14 %, p < 0,0001) a hodnoty HbA1c ≤ 6,5 % (43 % vs. 4 %, p < 0,0001) s použitím nižší dávky inzulinu (35,8 U vs. 40,1 U). Došlo také k poklesu glykemie nalačno (p < 0,0001), k poklesu sedmibodových glykemických profilů, tělesné hmotnosti i systolického krevního tlaku. Přechodné gastrointestinální nežádoucí účinky, méně výrazné hypoglykemie (18,2 % vs. 12,4 %) a zvýšení pulsu (o 4,5 pulsu/min) byly častější při léčbě liraglutidem než při podávání placeba. Nevyskytly se těžké hypoglykemie ani pankreatitida.
Dobré výsledky studií kombinujících bazální inzulinová analoga a agonisty receptorů GLP 1 vedly k vývoji fixních přípravků obsahujících kombinaci obou složek. Fixní kombinace obsahuje v dávkovacím peru 50 U inzulinu degludec a 1,8 mg liraglutidu, tj. jedna dávkovací jednotka obsahuje 1 U inzulinu degludec a 0,036 mg liraglutidu. Fixní kombinace bazálního inzulinu degludec a liraglutidu byla sledována klinickým programem DUAL – ve studiích fáze 3a DUAL I a DUAL II [32–35], dále probíhají studie fáze 3b DUAL III–IX. Ve studii DUAL I byla fixní kombinace srovnávána s léčbou jednotlivými komponentami přidanými k perorálním antidiabetikům. Studie DUAL II srovnávala fixní kombinaci s terapií inzulinem degludec u pacientů s předchozí léčbou bazálním inzulinem, studie DUAL III hodnotila pacienty po převodu z léčby agonisty receptorů GLP 1 na léčbu fixní kombinací ve srovnání s pacienty, jimž byla podávána předchozí léčba agonisty receptorů GLP 1 (exenatid nebo liraglutid) v kombinaci s perorálními antidiabetiky (metformin, pioglitazon nebo sulfonylurea). Ve studii DUAL IV byla posuzována fixní kombinace oproti placebu se sulfonylureou v kombinaci s metforminem nebo bez metforminu, studie DUAL V se zaměřila na sledování léčby fixní kombinací oproti podávání inzulinu glargin v kombinaci s metforminem, studie DUAL VI srovnává titraci inzulinu glargin jedenkrát týdně oproti titraci dvakrát týdně, DUAL VII srovnává stejnou léčbu s režimem bazál/bolus, ve studii DUAL VIII je jako komparátor podáván inzulin glargin (2 roky) a ve studii DUAL IX je srovnáván inzulin glargin přidaný k inhibitorům SGLT2. Studie DUAL RWD provádí sběr dat z praxe.
Ve studii DUAL V byli pacienti neuspokojivě kompenzovaní inzulinem glargin s metforminem podávaným v průměrné dávce 20–50 U randomizováni k léčbě fixní kombinací degludec/liraglutid nebo k další titraci inzulinu glargin s cílem dosáhnout v obou větvích glykemie nalačno 3,9–5 mmol/l. Přípravek s fixní kombinací i inzulin glargin byly titrovány po 2 U. Dávka inzulinu glargin byla neomezená, dávka fixního přípravku dosahovala maximálně 50 U. Počet potvrzených hypoglykemií byl nižší při léčbě fixní kombinací inzulinu degludec/liraglutid ve srovnání s léčbou inzulinem glargin (2,23 U vs. 5,05 U na pacienta/rok; p < 0,001), taktéž byl signifikantně nižší počet nočních hypoglykemií (0,22 vs. 1,23 na pacienta/rok), těžká hypoglykemie byla zaznamenána jen u jednoho pacienta léčeného inzulinem glargin. U pacientů léčených inzulinem glargin se zvýšila hmotnost o 1,8 kg a při léčbě fixní kombinací hmotnost poklesla o 1,4 kg (p < 0,001). Ve skupině s léčbou fixním přípravkem dokončilo studii 90 % pacientů a ve skupině s léčbou inzulinem glargin 95 % pacientů; 71,6 % pacientů s léčbou fixním přípravkem dosáhlo hodnoty HbA1c < 7 %, zatímco u pacientů léčených inzulinem glargin to bylo jen 47 % (p < 0,001). Fixní kombinace inzulinu degludec s liraglutidem prokázala velmi dobrou účinnost v kontrole diabetu, její podávání je provázeno nižším rizikem vzniku hypoglykemií a poklesem tělesné hmotnosti [36].
Dalším fixním přípravkem, s nímž probíhají klinické studie, je kombinace lixisenatidu s glarginem (LixiLan). Využívá komplementárního účinku inzulinového analoga glargin na glykemii nalačno a krátkodobě účinkujícího prandiálního agonisty receptorů GLP 1 lixisenatidu na postprandiální glykemii. LixiLan ve studiích [37] nezvyšoval riziko vzniku hypoglykemií při jakémkoliv snížení hodnoty HbA1c.
Kasuistika
Pacient ve věku 55let se s diabetem 2. typu léčí od roku 2008 perorálními antidiabetiky. V únoru 2015 byl hospitalizován v diabetologickém centru pro závažnou dekompenzaci diabetu, neužíval perorální antidiabetikum gliclazid. Byla u něj zjištěna glykemie 25 mmol/l a hodnota HbA1c 124 mmol/mol, body mass index (BMI) 35,2 kg/m2. Pozdní diabetické komplikace nebyly prokázány. Po kompenzaci krátkodobým humánním inzulinem byl pacientovi indikován metformin 850 mg 2× denně (1 0 1), lixisenatid 20 µg před snídaní a bazální inzulin glargin 10 IU podávaný ve 21.00 hodin. Do září 2015 došlo k postupnému poklesu hodnoty HbA1c na 45 mmol/mol, ke snížení BMI na 33,7 kg/m2. Po roce od předepsání této kombinace má pacient hodnotu HbA1c v normě bez hypoglykemických příhod a s příznivým účinkem na tělesnou hmotnost.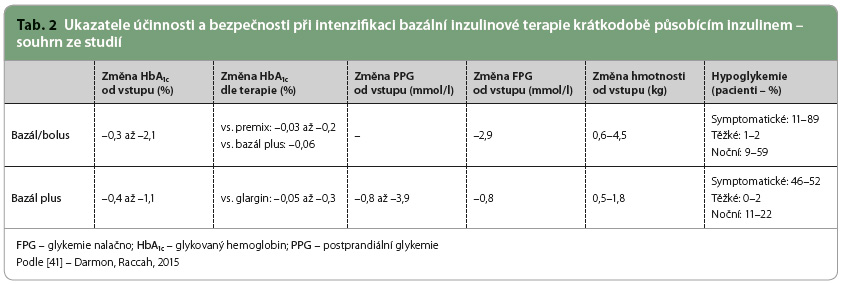
Klinické studie i praktické zkušenosti dokazují dobrou účinnost i bezpečnost léčby kombinací agonistů receptoru GLP 1 s bazálním inzulinem. Pokud pacient nedosahuje požadovaných individuálních cílů kompenzace při léčbě kombinací perorálních antidiabetik, je indikována intenzifikace léčby injekčně podávanými přípravky. Kombinace v jedné injekci je výhodná a pro pacienta jednoduchá. Indikací pro zařazení fixní kombinace inzulin plus agonista receptorů GLP 1 je neuspokojivá kompenzace léčbou bazálním  inzulinem v kombinaci s perorálními antidiabetiky. Poměrně jednoduchý převod, jak bylo dokumentováno např. ve studii DUAL V, na léčbu fixní kombinací nevede k dekompenzaci diabetu a umožňuje bezpečnou titraci k cílovým hodnotám. Oproti režimu bazál/bolus nebo bazál plus s krátkodobým analogem je spojena s menším rizikem hypoglykemií a vede ke snížení tělesné hmotnosti (tab. 2 a 3).
inzulinem v kombinaci s perorálními antidiabetiky. Poměrně jednoduchý převod, jak bylo dokumentováno např. ve studii DUAL V, na léčbu fixní kombinací nevede k dekompenzaci diabetu a umožňuje bezpečnou titraci k cílovým hodnotám. Oproti režimu bazál/bolus nebo bazál plus s krátkodobým analogem je spojena s menším rizikem hypoglykemií a vede ke snížení tělesné hmotnosti (tab. 2 a 3).
Biosimilární inzuliny
Biosimilární inzuliny – biosimilars – jsou kopie biologického léku, např. inzulinu, s doloženou podobností, účinností a bezpečností v klinických studiích. Nově je v praxi k dispozici biosimilární dlouhodobě působící inzulinové analogon LY2963016 glargin. Má identickou sekvenci aminokyselin jako inzulin glargin. Ve studiích [38] se prokázala stejně nízká koncentrace antiinzulinových protilátek proti inzulinu glargin jako při terapii inzulinem glargin, mají tedy podobnou imunogenicitu. V randomizovaných studiích ELEMENT 1 u diabetiků 1. typu [39] a ELEMENT 2 u diabetiků 2. typu [40] byla dokumentována stejná bezpečnost a účinnost jako u inzulinu glargin. Dalším dostupným biosimilárním inzulinem bude zřejmě inzulin lispro.
Závěry
Střednědobé bazální inzuliny (např. inzulin NPH) nezajišťují 24hodinový hypoglykemizující účinek u všech pacientů. Je vhodné používat bazální inzuliny s nižším rizikem výskytu hypoglykemií tak, jak je tomu u nové generace bazálních inzulinových analog. Nižší riziko vzniku hypoglykemie umožní optimální titraci inzulinu a může poskytnout větší pravděpodobnost docílení požadované kompenzace. Případné hmotnostní přírůstky se dají ovlivnit kombinační léčbou např. s inhibitory dipeptidyl peptidázy 4 (DPP 4), s agonisty receptorů GLP 1, s inhibitory sodíko glukózových transportérů 2 (sodium glucose linked transporters, SGLT2) – glifloziny. Výhody těchto kombinací vedly k vývoji fixních přípravků obsahujících bazální inzulinová analoga a agonisty receptorů GLP 1. Injekční kombinační přípravky inzulin/agonista receptorů GLP 1 mají místo v léčbě, pokud nedosáhneme požadované kompenzace diabetu kombinací perorálních antidiabetik nebo kombinací bazálního inzulinu s perorálními antidiabetiky. Oproti intenzifikaci léčby do režimu bazál plus nebo bazál/bolus je léčba těmito přípravky spojena s nižším rizikem vzniku hypoglykemií, se snížením tělesné hmotnosti při srovnatelné účinnosti a se snížením spotřeby inzulinu. Nové flexibilní režimy zlepšují adherenci pacienta k léčbě. Opakovaná edukace k selfmonitoringu a k titraci je nezbytnou součástí postupu.
Seznam použité literatury
- [1] Riddle MC, Rosenstock J, Gerich J. Insulin Glargin 4002 Study Investigators. The treat‑to target trial: randomized addition of glargine or human NPH insulin to oral therapy of type 2 diabetic patients. Diabetes Care 2003; 26: 3080–3086.
- [2] Vague P, Selam JL, Skeie S, et al. Insulin detemir is associated with more predictable glycemic control and reduced risk of hypoglycemia than NPH insulin in patients with type 1 diabetes on basal‑bolus regimen with pre meal insulin aspart. Diabetes Care 2003; 36: 590–596.
- [3] Siebenhofer A, Plank J, Berghold A, et al. Short acting analogues versus regular human insulin in patients with diabetes mellitus. Cochrane Database Syst Rev 2006; 2: CD003287.
- [4] Raslova K, Bogoev M, Raz I, et al. Insulin detemir and insulin aspart: a promising basal‑bolus regimen for type 2 diabetes. Diabetes Res Clin Pract 2004; 66: 103–201.
- [5] Edelman S, Pettus J. Challenges associated with insulin therapy in type 2 diabetes mellitus. Am J Med 2014; 127 (10 Suppl): S11–S16.
- [6] Inzucchi SE, Bergenstal RM, Buse JB, et al. Management of hyperglycemia in type 2 diabetes, 2015: a patient‑centered approach. Diabetes Care 2015; 38: 140–149.
- [7] Cheung BM, Ong KL, Cherny SS, et al. Diabetes prevalence and therapeutic target achievement in the United States 1999–2006. Am J Med 2009; 122: 443–453.
- [8] Caballero AE. Long‑term benefits of insulin therapy and glycemic control in overweight and obese adults with type 2 diabetes. J Diabetes Complications 2009; 23: 143–152.
- [9] Goodall G, Sarpong EM, Hayes C, et al. The consequences of delaying insulin initiation in UK type 2 diabetes patients failing oral hyperglycaemic agents: a modelling study. BMC Endocr Disord 2009; 9: 19.
- [10] Khunti K, Damci T, Meneghini L, et al. Study of Once Daily Levemir (SOLVE): insights into the timing of insulin initiation in people with poorly controlled type 2 diabetes in routine clinical practice. Diabetes Obes Metab 2012; 14: 654–661.
- [11] Peyrot M, Rubin RR, Siminerio LM, on behalf of the International DAWN Advisory Panel: Physician and Nurse Use of Psychosocial Strategies in Diabetes Care: Results of the Cross‑national Diabetes Attitudes, Wishes and Needs (DAWN) Study. Diabetes Care 2006; 29: 1256–1262.
- [12] The ORIGIN Trial Investigators. Basal insulin and cardiovascular and other outcomes in dysglycemia. N Engl J Med 2012; 367: 319–328.
- [13] Šmahelová A. Splní inzulin degludek naše očekávání? Remedia 2014; 24: 81–83.
- [14] Kvapil M. Inzulin glargin: prověřený bazální analog inzulinu. Remedia 2014; 24: 91–93.
- [15] Monami M, Marchionni N, Mannucci E. Long‑acting insulin analogues versus NPH human insulin in type 2 diabetes. A meta‑analysis. Diab Res Clin Pract 2008; 81: 184–189.
- [16] Riddle MC, Bolli GB, Yki‑Järvinen H, et al. One‑year sustained glycemic control and less hypoglycaemia with new insulin glargine 300 U/ml compared with 100 U/ml in people with type 2 diabetes using basal plus meal‑time insulin: the EDITION 1 12‑month randomized trial, including 6‑month extension. Diabetes Obes Metab 2015; DOI: 10.1111/dom.12472.
- [17] Yki‑Järvinen, Bergenstal RM, Bolli GB, et al. Less nocturnal hypoglycaemia and weight gain with new insulin glargine 300 U/ml vs 100 U/ml: 1‑year results in people with type 2 diabetes using basal insulin + OADs (EDITION 2) [abstract 946]. Diabetologia 2014; 57 (Suppl 1): S387.
- [18] Bolli GB, Riddle MC, Bergenstal RM, et al. New insulin glargine 300 U/ml compared with glargine 100 U/ml in insulin‑naïve people with type 2 diabetes on oral glucose‑lowering drugs: a randomized controlled trial (EDITION 3). Diabetes Obes Metab 2015; doi: 10.1111/dom. 12438.
- [19] Home PD, Bergenstal RM, Riddle MC, et al. Glycemic control and hypoglycemia with new insulin glargine 300 U/ml in people with T1DM (EDITION 4) [abstract 80‑LB]. Diabetes 2014; 63 (Suppl 1): LB19.
- [20] Matsuhisa M, Koyama M, Cheng X, et al. New insulin glargine 300 U/ml: glycemic control and hypoglycemia in Japanese people with T1DM (EDITION JP 1) [abstract 88‑LB]. Diabetes 2014; 63 (Suppl 1): LB22.
- [21] Terauchi Y, Koyama M, Cheng X, et al. Glycemic control and hypoglycemia in Japanese people with T2DM receiving new insulin glargine 300 U/ml in combination with OADs (EDITION JP 2) [abstract 94‑LB]. Diabetes 2014; 63 (Suppl 1): LB24.
- [22] Heise T, Hermanski L, Nosek L, et al. Insulin degludec: four times lower pharmacodynamic variability than insulin glargine under steady‑state conditions in type 1 diabetes. Diabetes Obes Metab 2012; 14: 859–864.
- [23] Haahr H, Heise T. A review of the pharmacological properties of insulin degludec and their clinical relevance. Clin Pharmacokinet 2014; 53: 787–800.
- [24] Landstedt‑Hallin L. Changes in HbA1c, insulin dose and incidence of hypoglycemia in patients with type 1 diabetes after switching to insulin degludec in an outpatient setting: an observational study. Curr Med Res Opin 2015; 31: 1487–1493.
- [25] Atkin S, Javed Z, Fulcher G. Insulin degludec and insulin aspart: novel insulins for the management of diabetes mellitus. Ther Adv Chronic Dis 2015; 6: 375–388.
- [26] Marquez F, et al. PE0139, the first recombinant fully human monomeric super‑long‑acting basal insulin to display a sustained nearly peakless insulin profile following a single subcutaneous dose in subjects with T2DM supporting weekly dosing. ADA 2015; abstract 100‑OR.
- [27] Zijlstra E, Heise T, Rikte T, et al. Faster‑acting insulin aspart by continuous subcutaneous insulin infusion: earlier exposure and greater early pharmacokinetic/ /pharmacodynamic effects vs insulin aspart. Diabetologia 2015; 58 (Suppl. 1): S452.
- [28] Porcellati F, Lucidi P, Bolli GB, et al. GLP‑1 RAs as compared to prandial insulin after silure of basal insulin in type 2 diabetes: lessons from the 4B and Get‑Goal DUO 2 trials. Diab Metab 2015; 41: 6S16–6S20.
- [29] Diamant M, Nauck MA, Shaginian R, et al. 4B Study Group. Glucagon‑like peptide 1 receptor agonist or bolus insulin with optimized basal insulin in type 2 diabetes. Diabetes Care 2014; 37: 2763–2773.
- [30] Rosenstock J, Guerci B, Hanefeld M‚ et al. Prandial options to advance basal insulin glargine therapy: testing lixisenatide plus basal insulin versus insulin glulisine either as basal‑plus or basal‑bolus in type 2 diabetes: The GetGoal Duo‑2 Trial. Diabetes Care 2016; Publish Ahead of Print. DOI: 10.2337/dc16‑0014.
- [31] Ahmann A, Rodbard HW, Rosenstock J, et al. Efficacy and safety of liraglutide versus placebo added to basal insulin analogues (with and without metformin) in patients with type 2 diabetes: a randomized, placebo‑controlled trial. Diab Obes Metab 2015; 17: 1056–1064.
- [32] Gough SC, Bode B, Woo V, et al. Efficacy and safety of a fixed‑ratio combination of insulin degludec and liraglutide (IDEgLira) compared with its components given alone: results of phase 3, open‑label, randomised 26‑week, treat‑to‑target trial in insulin‑naïve patients with typ 2 diabetes. Lancet Diabetes Endocrinol 2014; 2: 885–932.
- [33] Buse JB, Vilsbøll T, Thurman J, et al. Contribution of liraglutide in the fixed‑ratio combination of insulin degludec and liraglutide (IDegLira). Diabetes Care 2014; 37: 2926–2933.
- [34] Linjawi S, Bode B, Chaykin L, et al. Efficacy and safety of IDegLira (combination of insulin degludec+liraglutide) in insulin naïve patients with T2D uncontrolled on GLP‑1 receptor agonist (GLP‑1 RA) therapy. Diabetes 2015; 64(Suppl. 1): A255, abstrakt 1002‑P.
- [35] Rodbard HW, Bode B, Harris S, et al. IDEgLira in insulin‑naïve patients with type 2 diabetes (T2D) inadequately controlled on sulphonylureas (SU) alone or in combination with metformin: the DUAL IV study. Diabetes 2015; 64(Suppl.1): A255–A256, abstrakt 1003‑P.
- [36] Lingvay I, Manghi FP, García‑Hernández P, et al. Effect of Insulin Glargine Up‑titration vs Insulin Degludec/Liraglutide on Glycated Hemoglobin Levels in Patients With Uncontrolled Type 2 Diabetes The DUAL V Randomized Clinical Trial. JAMA 2016; 315: 898–907. doi:10.1001/jama.2016.1252
- [37] Rosenstock J, et al. Improved Glucose Control without Increased Hypoglycemia Risk at Any Level of HbA1c Reduction with Insulin Glargine/Lixisenatide Fixed‑Ratio Combination (LixiLan) vs. Insulin Glargine Alone Both Added On to Metformin in Type 2 Diabetes (T2DM). Presented at: American Diabetes Association (ADA) 75th Scientific Sessions; June 5‑9, 2015; Boston. Abstract 169‑OR.
- [38] Ilag LL, Deeg MA, Costigan T, et al. Evaluation of immunogenicity of LY2963016 insulin glargine compared with Lantus® insulin glargine in patients with type 1 or type 2 diabetes mellitus. Diab Obes Metab 2016; 18: 159–168.
- [39] Blevins TC, Dahl D, Rosenstock J, et al. Efficacy and safety of LY2963016 insulin glargine compared with insulin glargine (Lantus®) in patients with type 1 diabetes in a randomized controlled trial: the ELEMENT 1 study. Diab Obes Metab 2015; 17: 726–733.
- [40] Rosenstock J, Hollander P, Bhargava A, et al. Similar efficacy an safety of LY2963016 insulin glargine and insulin glargine (Lantus®) in patients with type 2 diabetes who were insulin‑naïve or previously treated with insulin glargine: a randomized, double‑blind controlled trial (the ELEMENT 2 study). Diab Obes Metab 2015; 17: 734–741.
- [41] Darmon P, Raccah D. Options for intensification of basal insulin in type 2 diabetes: premeal insulin or short‑acting GLP‑1 receptor agonists? Diab Metab 2015; 41: 6S21–6S27.