Železo a jeho využití v organismu
Železo je mikronutrientem nezbytným pro buněčný metabolismus, a tedy i pro homeostázu celého lidského organismu. V článku je pojednáno o regulaci jeho příjmu a eliminace a o roli v různých fyziologických pochodech. Závěrem jsou ve zkratce uvedeny i látky terapeuticky běžně využívané při přetížení organismu železem.
Úvod
Lidské tělo s hmotností přibližně 70 kg obsahuje zhruba 4 g železa. Přibližně 67 % celkových zásob železa v těle je vázáno na hem v erytrocytech jakožto hemoglobin, ve svalech pak jako myoglobin. Dalších 30 % se nachází v enzymech (cytochromy, kataláza aj.), makrofázích, slezině a játrech v podobě feritinu nebo hemosiderinu. Zbývající 3 % představují přirozený denní oběh, tj. jsou přijímána potravou, nebo naopak vylučována močí, potem, žlučí a odloučenými buňkami epitelu.
Fyziologická denní potřeba železa je 5 mg pro muže a 15 mg pro děti a menstruující ženy; u těhotných je uváděna 2,10násobná potřeba. Průměrná strava v našich podmínkách obsahuje přibližně 15–20 mg železa denně, převážně ve formě organické, tedy v mase ve formě hemu, ovšem vstřebáno je pouze množství odpovídající jeho denním ztrátám, tj. asi 0,6 mg/den u mužů a v průměru dvojnásobek u žen.
Kinetika železa
Fyziologická plazmatická koncentrace železa u mužů je 23 μmol/l (130 μg/100 ml) a 19 μmol/l (110 μg/100 ml) u žen. Třebaže většina železa přijatého potravou je přítomna v oxidované formě Fe3+, tato je zejména vlivem kyselého žaludečního prostředí redukována na dvojmocné Fe2+, které se vstřebává především v duodenu a horním jejunu. Absorpce je přitom ovlivněna mnoha dietními faktory, jako jsou např. fytáty, fosfáty a oxaláty, které v kombinaci se železem vytvářejí obtížně vstřebatelné komplexy. Absorpci železa negativně ovlivňují antacida, fluorochinolony, etidronát nebo např. také inhibitory protonové pumpy [1, 2]. V kontextu potravin uveďme, že resorpci železa snižuje např. celozrnný chléb, vejce, mléko, černý čaj, káva aj. Z těchto důvodů je třeba přípravky s obsahem železa užívat buď nalačno, přibližně třicet minut před jídlem, anebo dvě hodiny po jídle.
Další redukce trojmocné formy na dvojmocnou je dosaženo prostřednictvím enzymů na apikální straně enterocytů duodena, označovaných jako Dcytb, tedy duodenální cytochrom B. Vlastní absorpce je následně realizována pomocí transportéru DMT1 (divalent metal transporter); jde o kotransport společně s jedním protonem vodíku. Uvedený transportér však není specifický a uplatňuje se i při vstřebávání jiných kovů, jakými jsou měď, kadmium a mangan; železo vázané na hem je vstřebáváno prostřednictvím endocytózy cestou HCP1.
Jakmile je železo uvnitř enterocytu, jeho další osud závisí na aktuální potřebě organismu. Je-li jej dostatek, je deponováno ve vazbě s globulární bílkovinou apoferitinem za vzniku feritinu (molekuly feritinu v lyzozomálních membránách agregují v depozita označovaná jako hemosiderin). Jediná molekula apoferitinu přitom může obsahovat až 4500 atomů železa v trojmocné podobě. V opačném případě, tj. při vysoké poptávce, je železo vylučováno na bazolaterální straně enterocytů prostřednictvím přenašeče feroportinu s následnou vazbou na bílkoviny, především transferin; za fyziologických okolností je saturován přibližně z 35 % (transmembránový exportní systém feroportinu je bohatě přítomen i na buňkách retikuloendoteliálního systému).
Železo je v krvi transportováno ve vazbě na glykoprotein transferin, jenž se tvoří nejenom v játrech, ale i ve vaječnících, varlatech, mléčné žláze, částečně i v submaxilární slinné žláze a v neposlední řadě i v makrofázích. Ve vazbě s transferinem je železo transportováno mimo jiné do kostní dřeně, kde se daný komplex váže na transferinové receptory (TfR) erytroblastů. Následně je přeneseno do nitra jejich mitochondrií a inkorporováno do protoporfyrinu prostřednictvím hem-syntetázy. Vstup železa z cytosolu do mitochondrií je zajištěn prostřednictvím mitoferinů nacházejících se na vnitřní mitochondriální membráně. Zatímco mitoferin-1 je bohatě přítomen především v buňkách červené krevní řady, mitoferin-2 je přítomen ubikvitérně. Železo je z mitochondrií vylučováno jednak prostřednictvím transportéru ABCB7, jednak ve formě hemu cestou HCP1 [3].
P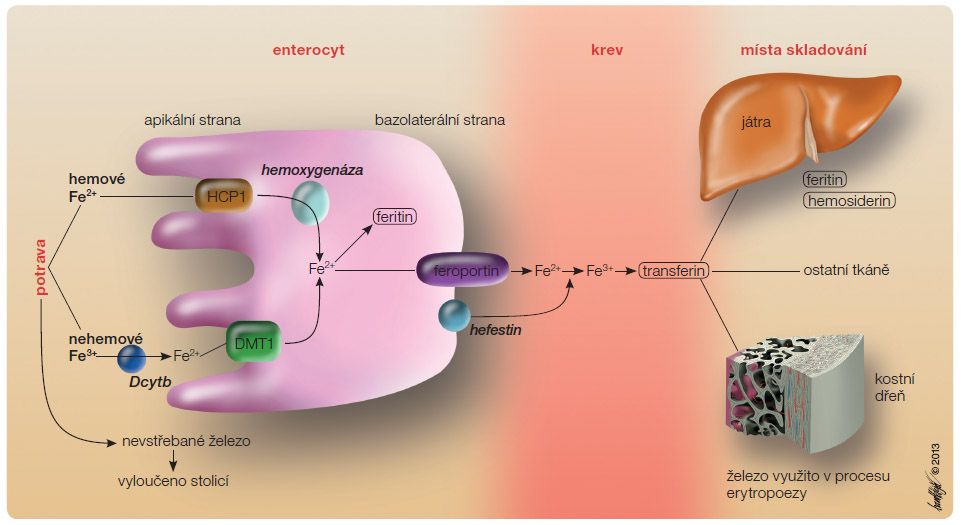 o zániku starých erytrocytů je molekula hemoglobinu katabolizována a železo je ukládáno jako výše uvedený feritin či hemosiderin. Z těchto zásob pak může být opět kdykoliv uvolněno do krevního oběhu a cyklus se tak uzavírá. Metabolismus železa znázorňuje obr. 1.
o zániku starých erytrocytů je molekula hemoglobinu katabolizována a železo je ukládáno jako výše uvedený feritin či hemosiderin. Z těchto zásob pak může být opět kdykoliv uvolněno do krevního oběhu a cyklus se tak uzavírá. Metabolismus železa znázorňuje obr. 1.
Rozsah absorpce železa se řídí aktuální poptávkou organismu. Zvyšuje se tehdy, je-li stimulována erytropoeza v důsledku anémie. Pro nedostatek železa v plazmě svědčí zvýšení koncentrace transferinu, který je však méně saturován, což vede k přesunu železa ze sliznic směrem do krevního oběhu a k omezení jeho ztrát. V opačném případě hladina transferinu klesá a železo se výrazněji přesouvá do apoferitinu, jehož syntéza je železem stimulována i na úrovni translace (zvýšení aktivity příslušné mRNA) [4].
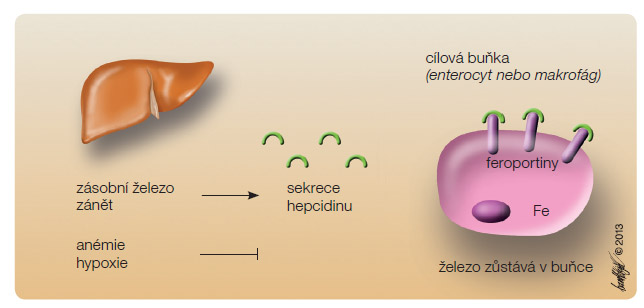 Důležitou roli v metabolismu železa, jak ilustruje obr. 2, sehrává hepcidin, malý peptid o velikosti 25 aminokyselin syntetizovaný především játry. Cirkulující hepcidin na cílových buňkách (tj. buňky retikuloendoteliálního systému – RES – a enterocyty) negativně ovlivňuje expresi feroportinů, podporuje jejich internalizaci a degradaci. Hepcidin tedy blokuje absorpci železa ve střevě a podporuje retenci železa mimo krevní oběh v RES. Tvorba hepcidinu je snížena při hypoxemii a při zvýšené poptávce po železe při erytropoeze, naopak k zesílení tvorby hepcidinu dochází při vysokých zásobách železa v těle, při infekci nebo zánětu [5, 6].
Důležitou roli v metabolismu železa, jak ilustruje obr. 2, sehrává hepcidin, malý peptid o velikosti 25 aminokyselin syntetizovaný především játry. Cirkulující hepcidin na cílových buňkách (tj. buňky retikuloendoteliálního systému – RES – a enterocyty) negativně ovlivňuje expresi feroportinů, podporuje jejich internalizaci a degradaci. Hepcidin tedy blokuje absorpci železa ve střevě a podporuje retenci železa mimo krevní oběh v RES. Tvorba hepcidinu je snížena při hypoxemii a při zvýšené poptávce po železe při erytropoeze, naopak k zesílení tvorby hepcidinu dochází při vysokých zásobách železa v těle, při infekci nebo zánětu [5, 6].
Železo je z lidského těla vylučováno především jako součást odumřelých epitelií, u menstruujících žen se k tomuto přidávají ztráty menstruační krví. Průměrné denní ztráty železa představují 0,5–1,5 mg (při menstruaci 1,5–2,5 mg).
Terapeutické využití železa
Železo je terapeuticky podáváno při jeho depleci v organismu způsobené výraznou krevní ztrátou, zvýšenou poptávkou (těhotenství, novorozenci, kojenci), nedostatečným příjmem v potravě nebo nedostatečnou absorpcí (gastrektomie a jiné stavy vedoucí k poruchám vstřebávání ve střevě aj.).Nejčastěji využívanou formou suplementace železa je síran železnatý, který j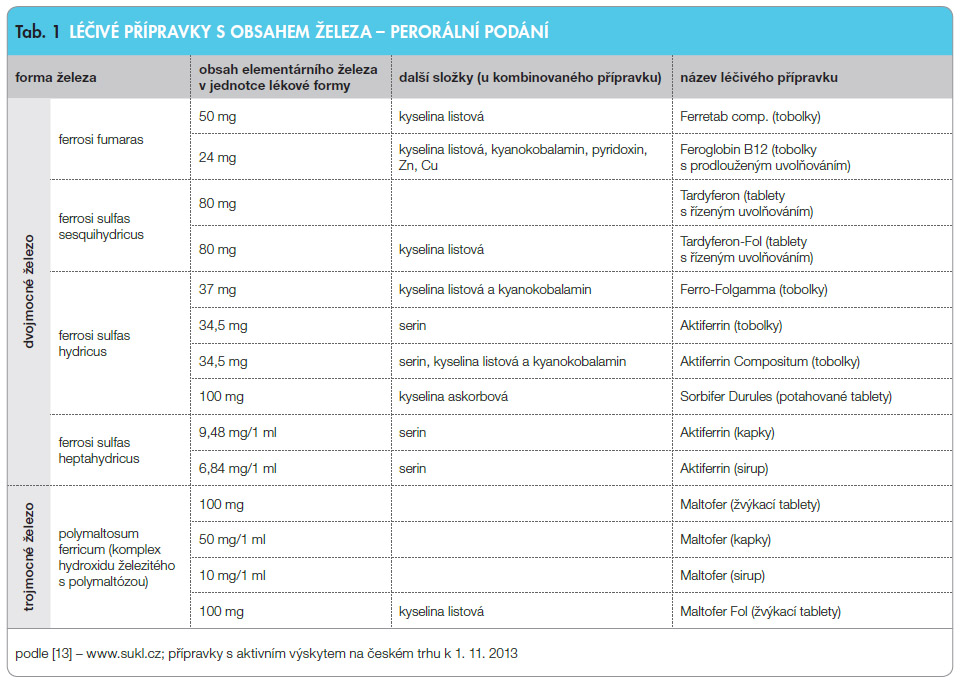 e v České republice dostupný v různých lékových formách. Některé z tablet současně obsahují kyselinu askorbovou, jež zabraňuje oxidaci železa na trojmocnou formu, a mukoproteózu, vysokomolekulární frakci střevní mukózy, která znemožňuje kontakt ionizovaného železa se sliznicí zažívacího traktu a brání tak jejímu podráždění. Využívány jsou však i přípravky s obsahem trojmocného železa, například trojmocné železo v polymaltózovém komplexu, které prakticky nevykazuje prooxidační vlastnosti a interakce s potravou. Železo je rovněž dostupné v kombinaci s jinými účinnými látkami, nejčastěji s vitaminy a minerály.
e v České republice dostupný v různých lékových formách. Některé z tablet současně obsahují kyselinu askorbovou, jež zabraňuje oxidaci železa na trojmocnou formu, a mukoproteózu, vysokomolekulární frakci střevní mukózy, která znemožňuje kontakt ionizovaného železa se sliznicí zažívacího traktu a brání tak jejímu podráždění. Využívány jsou však i přípravky s obsahem trojmocného železa, například trojmocné železo v polymaltózovém komplexu, které prakticky nevykazuje prooxidační vlastnosti a interakce s potravou. Železo je rovněž dostupné v kombinaci s jinými účinnými látkami, nejčastěji s vitaminy a minerály.
Parenterální přípr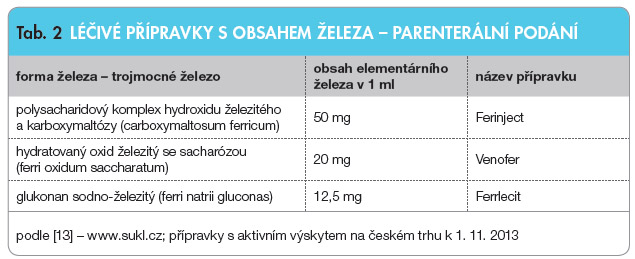 avky jsou určeny především pro léčbu nemocných, u nichž železo nemůže být absorbováno z důvodu malabsorpce, kvůli chirurgickým zákrokům či zánětlivým onemocněním zažívacího traktu. Parenterální podávání železa je vhodné rovněž u nemocných, kteří špatně tolerují perorální léčbu, nebo u osob s renálním selháním. Přípravky s obsahem železa a jejich lékové formy jsou uvedeny v tab. 1 a 2.
avky jsou určeny především pro léčbu nemocných, u nichž železo nemůže být absorbováno z důvodu malabsorpce, kvůli chirurgickým zákrokům či zánětlivým onemocněním zažívacího traktu. Parenterální podávání železa je vhodné rovněž u nemocných, kteří špatně tolerují perorální léčbu, nebo u osob s renálním selháním. Přípravky s obsahem železa a jejich lékové formy jsou uvedeny v tab. 1 a 2.![Graf 1 Vztah mezi hladinou železa v organismu a přežíváním u osob se systolickým srdečním selháním; podle [4] – Jankowska, et al., 2013.](https://www.remedia.cz/photo-a-29507---.jpg)
Nově začíná železo nacházet své uplatnění u nemocných s chronickým srdečním selháním, neboť je dnes již dostatečně klinicky dokumentován vztah mezi jeho deplecí a vyšší mortalitou, jak znázorňuje graf 1 [4]. Vzhledem k tomu, že deplece železa je zjišťována také u dalších chronických onemocnění (idiopatické střevní záněty, revmatoidní artritida, chronické selhání ledvin aj.) s předpokládaným vztahem nejenom ke konkomitantní anémii, lze do budoucna očekávat častější podávání železa rovněž u těchto stavů [7, 8].
Nežádoucí účinky
Nežádoucí účinky podávaného železa jsou povětšinou závislé na dávce. K nejčastějším se jednoznačně řadí nevolnost, průjem (ale i zácpa) a křeče v břiše. Parenterální podání může vést k alergické reakci. S přihlédnutím ke skutečnosti, že železo je významné rovněž pro růst a množení mnoha patogenů, lze očekávat, že výrazná dodávka železa má potenciál zhoršit průběh infekcí.
Akutní intoxikace železem působí nekrotizující gastritidu provázenou zvracením, krvácením a průjmem, případně až selháním oběhu. Léčba je jednak symptomatická, jednak jsou podávány chelátory železa.
Látky snižující přetížení organismu železem
Při akutní nebo chronické intoxikaci železem vyvolané častými krevními převody pro hemolytickou anémii, jejíž příčinou může být např. thalasemie aj., jsou využívány látky snižující přetížení organismu železem. K přetížení železem však stále častěji dochází u onkologických pacientů – příkladem jsou nemocní s myelodysplastickým syndromem léčení allogenní transplantací buněk kostní dřeně [9]. Rovněž jsou tyto látky užívány společně s antracyklinovými antibiotiky (tato cytostatika reagují s volným železem za vzniku reaktivních forem kyslíku) za účelem minimalizace jejich negativního působení na myokard [10].
Účinnost chelátotvorných látek je podmíněna hydrofilitou výsledného komplexu, která je předpokladem pro eliminaci ledvinami (např. dexrazoxan či deferasirox – chelací železa v myokardu omezuje kardiotoxické účinky komplexů železa s antracykliny). Dalšími chelatačními látkami jsou deferoxamin či deferipron. Zatímco deferoxamin u prokaryot působí jako siderofor, tedy látka schopná vázat železo, a lze tedy očekávat i vyšší výskyt infekcí (bakterie vyžadují ke svému růstu a metabolismu železo a při infekci ho odebírají z hostitelského organismu), u látek deferasirox a deferipron byl ve studiích in vitro a v animálních modelech zjištěn fungicidní, baktericidní [11], nebo dokonce antivirotický [12] účinek.
Seznam použité literatury
- [1] Li W, Zeng S, Yu LS, Zhou Q. Pharmacokinetic drug interaction profile of omeprazole with adverse consequences and clinical risk management. Ther Clin Risk Manag 2013; 9: 259–271.
- [2] Marchbanks CR. Drug-drug interactions with fluoroquinolones. Pharmacotherapy 1993; 13: 23S–28S.
- [3] Richardson DR, Lane DJ, Becker EM, et al. Mitochondrial iron trafficking and the integration of iron metabolism between the mitochondrion and cytosol. Proc Natl Acad Sci U.S.A 2010; 107: 10775–10782.
- [4] Jankowska EA, von Haehling S, Anker SD, et al. Iron deficiency and heart failure: diagnostic dilemmas and therapeutic perspectives. Eur Heart J 2013; 34: 816–829.
- [5] Collins JF, Wessling-Resnick M, Knutson MD. Hepcidin regulation of iron transport. J Nutr 2008; 138: 2284–2288.
- [6] Hentze MW, Muckenthaler MU, Galy B, Camaschella C. Two to tango: regulation of Mammalian iron metabolism. Cell 2010; 142: 24–38.
- [7] Kell DB. Iron behaving badly: inappropriate iron chelation as a major contributor to the aetiology of vascular and other progressive inflammatory and degenerative diseases. BMC Med Genomics 2009; 2: 2.
- [8] Weiss G. Iron metabolism in the anemia of chronic disease. Biochim Biophys Acta 2009; 1790: 682–693.
- [9] Pullarkat V. Objectives of iron chelation therapy in myelodysplastic syndromes: more than meets the eye? Blood 2009; 114: 5251–5255.
- [10] Hochster H, Wasserheit C, Speyer J. Cardiotoxicity and cardioprotection during chemotherapy. Curr Opin Oncol 1995; 7: 304–309.
- [11] Chan GC, Chan S, Ho PL, Ha SY. Effects of chelators (deferoxamine, deferiprone and deferasirox) on the growth of Klebsiella pneumoniae and Aeromonas hydrophila isolated from transfusion-dependent thalassemia patients. Hemoglobin 2009; 33: 352–360.
- [12] Hoque M, Hanauske-Abel HM, Palumbo P, et al. Inhibition of HIV-1 gene expression by Ciclopirox and Deferiprone, drugs that prevent hypusination of eukaryotic initiation factor 5A. Retrovirology 2009; 6: 90.
- [13] Databáze léků, www.sukl.cz.