Zlepšení kvality života pacientů s CHOPN – chiméra, nebo reálný cíl?
V přehledovém článku jsou uvedeny názory na kvalitu života, její definice i způsoby hodnocení pomocí dotazníků. Kvalita života související se zdravotním stavem (Health Related Quality of Life – HRQoL) je významným pomocníkem při hodnocení efektivity léčby nemocných s chronickou obstrukční plicní nemocí (CHOPN). V přehledu je uvedeno, s čím HRQoL souvisí více či méně a jak se stanovují její jednotlivé „domény“ pomocí Respiračního dotazníku dle Nemocnice Svatého Jiří v Londýně (SGRQ). Kvalita života nemocných s CHOPN je závislá na mnoha faktorech (symptomy, tíže, věk, exacerbace a léčba farmakologická a nefarmakologická). V další části článku jsou sumarizovány výsledky studií prokazující možnost zlepšit HRQoL pomocí jednotlivých tříd léků. Čtenář se může seznámit s množstvím studií dokládajících, že v této oblasti máme nejvíce dat o dlouhodobě účinném anticholinergiku tiotropiu, které lze považovat za komparátor nových léků či za „zlatý standard“ léčby nemocných s CHOPN. Na závěr jsou uvedeny i výsledky nefarmakologického ovlivnění HRQoL u pacientů s tímto onemocněním.
O kvalitě života (Quality of Life, QoL) běžně hovoříme, čteme o ní v novinách, vnímáme ji ve svém soukromém životě. Snaha zlepšit QoL může být i synonymem nebo součástí naší snahy uzdravit nemocné. Mnoho o tomto pojmu neuvažujeme, předpokládáme, že je celkem jasný a že jej stejně či podobně jako my chápou naši blízcí, známí i naši pacienti.
Je to skutečně tak? Jsou hodnoty, které spojuji právě já s dobrou (optimální) kvalitou života, společné všem ostatním? Je zřejmé, že neexistuje jednoduchá a všemi akceptovaná definice QoL. Kvalita života je ovlivněna množstvím faktorů, které se mohou u jednotlivých subjektů výrazně lišit. Dříve než se začnu věnovat kategorii nám nejbližší – otázkám kvality života v souvislosti se zdravotním stavem (Health Related QoL – HRQoL), pokusím se sumarizovat názory na obecnou definici QoL.
Světová zdravotnická organizace (The World Health Organization – WHO) definuje zdraví, nikoli přímo QoL, jako stav fyzické, duševní i sociální pohody (WHO Quality of Life – WHOQOL-BREF© World Health Organization 2004).
Evropská komise definuje QoL jako „nehmotné aspekty života, tj. zdraví, společenské vztahy, kvalita přírodního prostředí, existující životní podmínky a osobní blahobyt”. Definice tedy zahrnuje jak objektivně zjistitelné environmentální či individuální charakteristiky, tak i charakteristiky pouze subjektivně pociťované [1].
Nejznámější a patrně i nejcitovanější model subjektivní QoL vytvořilo Centrum pro podporu zdraví při Univerzitě Toronto [2, 3]. Jde o vícedi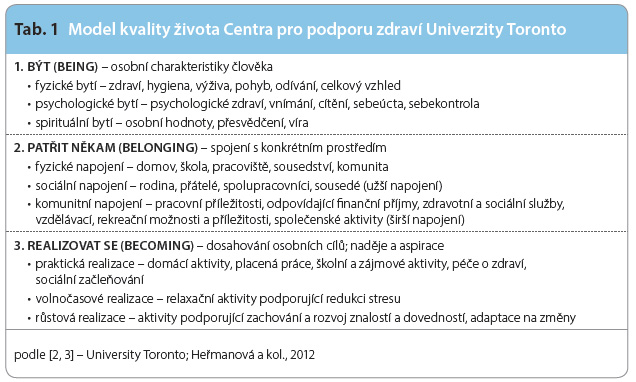 menzionální model, který vychází z holistického pojetí QoL, nicméně i on je strukturován do tří základních oblastí (být, někam patřit, realizovat se), viz tab. 1.
menzionální model, který vychází z holistického pojetí QoL, nicméně i on je strukturován do tří základních oblastí (být, někam patřit, realizovat se), viz tab. 1.
Payne [4] definuje QoL jako důsledek interakce mnoha různých faktorů: sociálních, zdravotních, ekonomických a environmentálních, které ovlivňují lidský rozvoj na úrovni jednotlivců i celých společností. Pojem QoL by měl obsahovat údaje o fyzickém, psychickém a psychosociálním stavu jedince. Na QoL je pohlíženo jako na vícerozměrnou veličinu a obvykle je definována jako „subjektivní posouzení vlastní životní situace“.
Kvalita života související se zdravotním stavem
Termíny QoL a HRQoL se v medicíně často zaměňují; nejedná se však o synonyma, ale o dva různé pojmy. QoL představuje zcela subjektivní a individuální hodnocení založené na osobním vnímání ve vztahu k dané kultuře a hodnotovému žebříčku jednotlivce. Naopak HRQoL je určena rozsahem limitace očekávaných fyzických výkonů, emocionální a sociální pohody v důsledku změny (zhoršení vs. zlepšení) zdravotního stavu nebo v důsledku nutných léčebných opatření. Může být měřena pomocí dotazníků, které dovedou standardizovaným způsobem zhodnotit dopad nemoci i posoudit, jak změny zdravotního stavu (ve smyslu plus i minus) ovlivní QoL; HRQoL vyjadřuje rozdíl mezi přáním a očekáváním subjektu a realitou různých omezení způsobených nemocí, a lze ji tedy ovlivnit jak zlepšením zdravotního stavu, tak také i adaptací nemocného na různé limitace [5]. Pojem HRQoL je třeba odlišovat od pojmu „funkční kapacita” – ta představuje pouze jednu ze složek HRQoL (odhad tolerovaných denních aktivit). Měření HRQoL nenahrazuje při hodnocení zdravotního stavu fyziologické ukazatele, ale může je vhodně doplňovat tím, že k nim přidá takové parametry, které vnímá pacient.
Podle Jonese by dotazník HRQoL měl kvantifikovat, jak významně nemoc ovlivňuje každodenní život a dobrou pohodu (well being) standardizovaným způsobem. Je potřeba stanovit, čím je HRQoL ovlivněna, na kterých faktorech plynoucích z nemoci je více či méně závislá (validizace HRQoL). Například u nemocných s chronickou obstrukční plicní nemocí (CHOPN) bylo prokázáno, že zvětšující se funkční reziduální kapacita plic může zhoršovat dušnost a snižovat toleranci fyzické zátěže nezávisle na snižování usilovného výdechového objemu (forced expiratory volume in 1 second – FEV1), a dále to, že spolu špatně korelují měření obstrukční ventilační poruchy a omezení fyzické výkonnosti.
Až 50 ![Graf 1 Souvislosti změn v HRQoL měřené pomocí SGRQ během jednoho roku s ostatními měřenými parametry aktivity CHOPN: 6MWT, frekvence pískotů, stupeň dušnosti podle MRC, deprese a FEV1; podle [5] – Jones, 1995. FEV1 – usilovný výdechový objem za 1 sekundu; HRQoL – kvalita života v souvislosti se zdravotním stavem; CHOPN – chronická obstrukční plicní nemoc; 6MWT – šestiminutový test chůzí; MRC – Medical Research Council; SGRQ – Respirační dotazník dle Nemocnice Svatého Jiří](https://www.remedia.cz/photo-a-29718---.jpg) % HRQoL může být spojováno s rysy nemoci, jako např. s kašlem, s pískoty, s omezením schopnosti chůze hodnoceným šestiminutovým testem chůzí (Six Minute Walk Test – 6MWT), slabostí či s anxietou. Současně je zřejmé, že z poloviny je HRQoL ovlivněna jinými než tradičně měřenými faktory. Jak dalece a s čím souvisí HRQoL měřená pomocí Respiračního dotazníku dle Nemocnice Svatého Jiří (SGRQ), znázorňuje graf 1 [5].
% HRQoL může být spojováno s rysy nemoci, jako např. s kašlem, s pískoty, s omezením schopnosti chůze hodnoceným šestiminutovým testem chůzí (Six Minute Walk Test – 6MWT), slabostí či s anxietou. Současně je zřejmé, že z poloviny je HRQoL ovlivněna jinými než tradičně měřenými faktory. Jak dalece a s čím souvisí HRQoL měřená pomocí Respiračního dotazníku dle Nemocnice Svatého Jiří (SGRQ), znázorňuje graf 1 [5].
Ve výzkumné a klinické praxi se používá pět různých metodik hodnocení a sledování QoL:
- spontánní oznamování (výpověď člověka);
- psychometrické testy (umožňují pozorovat i jemnější změny kvality života);
- aktivní dotazování (rozhovor, dotazníky);
- nepřímá měřítka (používají se u osob s omezenou schopností se vyjadřovat);
- pozorování.
V medicínské praxi se HRQoL zjišťuje („měří“) dvěma typy dotazníků. První využívá jednu širokou otázku, např.: „Jak významně Vám Vaše nemoc omezuje Vaše denní aktivity?“ Odpověď pak je kvantifikována dle umístění bodu na škále od „žádné omezení“ až po „velmi silné omezení“ aktivit. Druhý typ dotazníků je zaměřen na jednotlivé oblasti života a dle odpovědí kvantifikuje, jak významně jsou tyto oblasti existující nemocí narušeny [5]. Pomocí dotazníků se snažíme získat odpověď i na otázku, jak významně je nemoc ovlivněna léčbou. Při tom se řeší dvě základní otázky: jaké proměnné veličiny máme brát v potaz a kde je práh, který musí být překročen, abychom mohli zlepšení považovat za klinicky významné.
Dotazníky k hodnocení HRQoL
K ohodnocení HRQoL existuje množství dotazníků. WHO například doporučuje dotazník WHOQOL 100 (WHO Quality of Life) [6]. Tento dotazník v nezkrácené verzi sestává ze 100 otázek, které pokrývají 6 „domén“ týkajících se kvality života: fyzické zdraví, prožívání (psychická úroveň), fyzická nezávislost (soběstačnost), sociální vztahy (zázemí), prostředí a duchovní oblast. Existuje i jeho zkrácená podoba, tzv. WHOQOL-BREF o 26 položkách, které jsou rozděleny do 4 domén týkajících se kvality života: fyzické zdraví, prožívání, sociální vztahy a prostředí. Francouzský dotazník SQUALA (Subjective Quality of Life Analysis) posuzuje 23 oblastí života. Zjišťuje rozdíl mezi přáním a skutečností i současnou životní realitu, poskytuje výsledek ve formě profilu umožňujícího porovnávat mezi sebou osoby s ohledem na to, jaké oblasti života jsou nejvíce postiženy. Jeho vyplnění zabere zhruba 15 minut.
Dotazníky v pneumologii
V pneumologii se uplatňují jak obecné dotazníky zaměřené na HRQoL, které umožňují srovnání HRQoL u pacientů s různými onemocněními, tak i dotazníky specifické pro určité onemocnění (např. CHOPN). Vedle určení HRQoL jsou užitečné i při posuzování efektu léčby a pro určení progrese klinického stavu. Obě metody mají své výhody i nevýhody, někdy se mohou doplňovat.
Příkladem obecného dotazníku k hodnocení HRQoL, který se při sledování pacientů s CHOPN běžně používá, je SF-36 (Short Form 36 questionnaire). Jeho výhodou je, že je relativně krátký a že byl přeložen do několika jazyků. Navíc je u CHOPN ověřený a ví se, že má dobrou citlivost, přestože se jedná o generický (obecně použitelný) nástroj. SF-36 hodnotí omezení fyzických a sociálních aktivit, fyzickou bolest, celkový psychický stav, vitalitu a celkové vnímání vlastního zdravotního stavu.V respirační medicíně jsou nejznámější následující dotazníky na HRQoL: SGRQ, Evropský dotazník EuroQol EQ‑5D (European Quality of Life five dimensions questionnaire) a dotazník CRQ (Chronic Respiratory Disease Questionnaire) [7].
SGRQ je navržen jako dotazník se 76 hodnocenými položkami, které pacient vyplňuje samostatně. Třemi hlavními oblastmi, které hodnotí, jsou symptomy, aktivita a dopad onemocnění na každodenní život [8]. Oddíl zaměřený na symptomy má osm otázek hodnotících výskyt symptomů v uplynulém období (minimálně za jeden měsíc, lépe během posledních tří měsíců až jednoho roku). Dotazy ve druhém oddíle jsou cíleny na denní aktivity, psychosociální funkce, zaměstnání, léčbu aj. a třetí část hodnotí dopad neboli význam negativních faktorů nemoci na QoL. Celkové skóre může kolísat mezi hodnotami 0 (úplné zdraví) a 100 (nejhorší zdravotní stav). Pokud se stav nemocných zlepšuje, mají počty jednotek SGRQ minusové znaménko, což někdy může poněkud komplikovat pochopení efektu léčby čtenářům nedostatečně obeznámeným s tímto uspořádáním.
Dotazník EuroQol EQ-5D byl vyvinut multidisciplinární skupinou výzkumníků z několika evropských zemí (tzv. EuroQol Group). Kvalita života nemocných je měřena pomocí 5 objektivních ukazatelů fyzického a psychického zdraví, jimiž jsou 1. pohyblivost, 2. sebeobsluha, 3. obvyklá činnost, 4. bolesti/obtíže, 5. úzkost/deprese (tzv. EQ-5D index), a dále pomocí subjektivního ukazatele, kdy nemocný na tzv. vizuální analogové škále se stupnicí 0 až 100 (0 – nejhorší zdravotní stav, 100 – nejlepší zdravotní stav) označí hodnotu svého aktuálního subjektivního zdravotního stavu (tzv. EQ-5D VAS).
Dotazník CRQ vyvinuli Guyatt a kol. [9] k vyhodnocení efektu léčby na QoL pacientů s chronickou obstrukcí dýchacích cest. Tento dotazník se ve 20 otázkách soustředí na čtyři hlavní oblasti, jimiž jsou dušnost, únava, emoční stav a „kontrola“ nemoci. Další dotazník byl vytvořen na McGillově univerzitě v Montrealu a posuzuje tři oblasti: symptomy, funkční stav a pocity nemocného. Zahrnuje celkem 29 položek, z nichž 17 patří do tzv. specifického modulu CHOPN a 12 bylo převzato z dotazníku SF-36. Ve specifickém modulu CHOPN je 6 otázek zaměřených na symptomy, na subjektivní pocity je cíleno 10 otázek (5 ze specifického modulu CHOPN a 5 z dotazníku SF-36) a omezení funkční výkonnosti zkoumá 13 otázek (6 otázek ze specifického modulu CHOPN a 7 otázek z dotazníku SF-36) [10, 11].
Korelace a klinicky významná změna skóre
Korelace mezi FEV1 a SGRQ existuje, avšak není příliš silná. Z FEV1 nelze u individuálního nemocného predikovat jeho QoL. Například se ukázalo, že i když měli nemocní dobré hodnoty FEV1, svědčily jejich výsledky, dle SGRQ, pro významné zhoršení HRQoL [5]. Z toho vyplývá, že spirometrie je málo senzitivní k detekci časných důsledků CHOPN.
Pro každý dotazník hodnotící HRQoL by měl být také určen práh minimální klinicky významné změny skóre. Minimální klinicky významnou změnu skóre 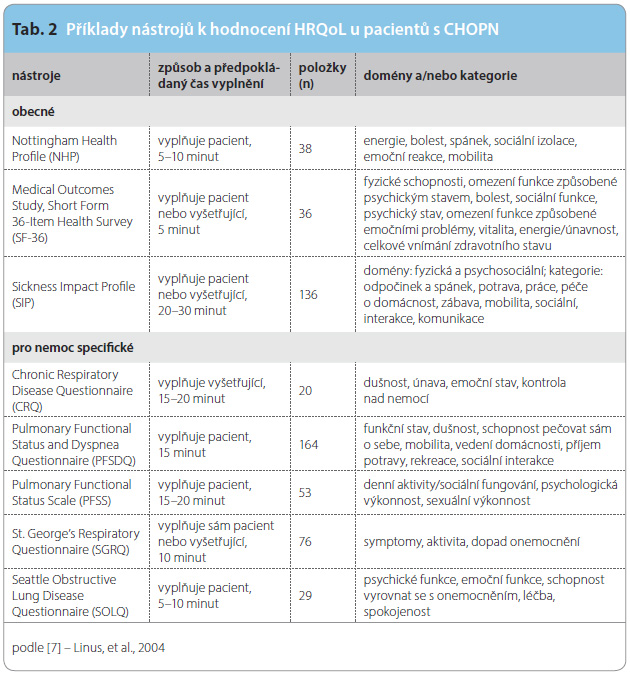 můžeme definovat jako nejmenší potřebnou změnu v dílčím nebo celkovém skóre, která je významná pro pacienta nebo lékaře, jenž chce posoudit, zdali je jeho léčebné opatření účinné. Někdy může nastat situace, že skóre HRQoL se statisticky významně změní, ale změna přitom nemusí být klinicky významná.
můžeme definovat jako nejmenší potřebnou změnu v dílčím nebo celkovém skóre, která je významná pro pacienta nebo lékaře, jenž chce posoudit, zdali je jeho léčebné opatření účinné. Někdy může nastat situace, že skóre HRQoL se statisticky významně změní, ale změna přitom nemusí být klinicky významná.
Z výsledků multivariantní analýzy, ve které byly změny v SGRQ vztaženy k měřitelným ukazatelům nemoci, jako je 6MWT, frekvence pískotů aj., vyplynulo, že změna o 4 jednotky byla klinicky významná. Jinou metodou, která potvrdila významnost změny SGRQ o 4 jednotky, byly výsledky velkých randomizovaných studií, kdy sami nemocní hodnotili výsledky své léčby. Ti, kteří uváděli mírné zlepšení, dosahovali změny v SGRQ o 3 až 4 jednotky, nemocní s významnou odezvou na léčbu se zlepšili v tomto hodnocení o 8 až 12 jednotek SGRQ [5].
Příklady dotazníků, které se používají u pacientů s CHOPN, ukazuje tab. 2.
Přestože má HRQoL více dimenzí, u nemocných s CHOPN je HRQoL nejvíce ovlivněna stupněm dušnosti. Tento symptom nemoci vypovídá o HRQoL přesněji než tíže onemocnění měřená pomocí FEV1 [12], což není překvapivé, neboť dušnost a FEV1 spolu korelují jen „slabě“ [13]. Hodnocení stupně dušnosti je proto vřazeno do všech dotazníků na HRQoL specifických pro CHOPN. Z uvedených popisů „obecných“ i „specifických“ dotazníků na HRQoL vyplývá, že jejich vyplňování nemusí být pro nemocné s CHOPN vždy jednoduché, mnohdy je i časově náročné, což limituje využití dotazníků v praxi.
Dotazník CAT
Tento problém by měl odstranit jednoduchý, i u nás již dobře známý dotazník CAT (COPD Assessment Test). V tomto „testu“ jsou hodnoceny běžné symptomy a aktivity, jako je kašel, dušnost, spánek a další, v osmi otázkách se škálou odpovědí 0 (bez omezení) až 5 (nejhorší možnost, např. „nevyjdu vůbec z domu“). Skóre tak může kolísat mezi 0 až 40. Augusti a kol. publikovali v roce 2012 článek o hodnocení změn v HRQoL pomocí CAT u souboru nemocných s akutní exacerbací a u nemocných se stabilním onemocněním. Dotazník CAT od sebe obě skupiny dobře odlišil (15,8 vs. 22,4, p < 0,01) a prokázal také výbornou korelaci s výsledky SGRQ. Autoři uzavírají, že dotazník CAT je dosti senzitivní k prokázání změn zdravotního stavu spojených s exacerbací [14].
S dotazníkem CAT počítá i poslední doporučení Globální iniciativy pro chronickou obstrukční plicní nemoc (GOLD) jako s alternativou k měření dušnosti pomocí modifikované stupnice Medical Research Council (mMRC). Nicméně dosud nebyla potvrzena predikce mortality dle CAT a hraniční hodnota vyjádřená číslovkou 10 pro hranici mezi hodnotami charakterizovanými jako „málo příznaků“ a „hodně příznaků“ byla stanovena arbitrárně.
Souhrnem lze říci, že hodnocení HRQoL pomohlo překonat mylnou představu o tom, že plicní funkční hodnoty jsou jediným nástrojem pro vyhodnocení tíže, dopadu, progrese a vývoje CHOPN.
HRQoL a komorbidity
CHOPN patří mezi nejčastější oslabující nemoci dospělých na světě. Podle WHO jí trpí 210 milionů osob a 3 miliony ročně na ni umírají [15]; CHOPN je spojena s vysokou morbiditou i mortalitou a s významným zhoršením HRQoL nejenom v pokročilých stadiích. Podle posledních odhadů The Global Burden of Disease Study byla CHOPN v roce 2010 třetí nejčastější příčinou úmrtí na světě a na devátém místě v počtu ztracených roků života (disability-adjusted life years – DALYs) [16, 17].
Některé studie z poslední doby prokázaly zlepšování prognózy – prodlužování života nemocných s CHOPN. Tak například Almagro prokázal pokles rizika úmrtí ve skupině nemocných sledovaných po dobu tří let od propuštění z nemocnice (léčeni byli pro akutní exacerbaci CHOPN) v letech 2003–2004 (zemřelo 38,7 %) oproti stejné kohortě nemocných z let 1996–1997 (zemřelo 47,4 %), p = 0,017 [18]. Z faktu, že CHOPN patří mezi ne zcela vyléčitelná onemocnění, vyplývá, že bude přibývat starších nemocných s množstvím komorbidit a s celkově zhoršeným zdravotním stavem, a tedy se zhoršenou QoL. Při hodnocení nemocných s CHOPN tak přibudou k tradičním parametrům, jako je mortalita a morbidita, i další kritéria – zachování či zlepšení QoL, prevence progresivního oslabování organismu i míra adaptace na obtíže spojené s nemocí.
Kvalita života, jak vyplývá z výše uvedeného, významně závisí na mnoha faktorech. Jedním z nich jsou komorbidity. Podle nedávné skotské studie, kdy bylo prověřováno 1,7 milionu nemocných evidovaných u praktických lékařů, byla CHOPN na 11. místě z hlediska prevalence, která dosáhla v této studii 3,2 %. Pouze 18 % z těchto pacientů trpělo CHOPN bez jiné doprovodné nemoci a 47 % z nich mělo tři a více nemocí. Četnost výskytu komorbidit u nejča![Graf 2 Počty komorbidit u nemocných s častými onemocněními; podle [19] – Barnett, et al., 2012. IM – infarkt myokardu; TIA – tranzitorní ischemická ataka](https://www.remedia.cz/photo-a-29720---.jpg) stějších onemocnění ukazuje graf 2 [19].
stějších onemocnění ukazuje graf 2 [19].
Podobné výsledky přinesla i holandská studie posuzující více než 212 000 osob evidovaných u praktických lékařů. Prevalence CHOPN dosahovala u osob starších 55 let 9,8 % a 84 % nemocných s CHOPN v uvedené věkové kategorii mělo jednu či více komorbidit [20]. Tak častý souběh doprovodných nemocí s CHOPN vede mnoho autorů k úvahám o tom, že CHOPN je jen jednou komponentou, jedním projevem „multimorbiditního syndromu“. Je zřejmé, že v ovlivnění HRQoL se nemoci mohou kombinovat, což bylo doloženo výsledky několika studií. Tak bylo prokázáno, že kombinace nemocí srdce a CHOPN měla negativní synergický efekt na HRQoL a stejně tak existence komorbidit zhoršovala HRQoL ve všech ukazatelích v porovnání se stejnými nemocnými s CHOPN bez komorbidit [21]. Z výše uvedeného vyplývá rovněž otázka, kdo – jaký specialista – by se měl o nemocné s mnoha nemocemi starat. Je nepochybné, že navštěvovat různé specialisty pro současně existující nemoci je pro pacienty zatěžující, mnohdy neekonomické (dublování vyšetření) a málo efektivní. V případě, že hlavní nemocí je CHOPN, měl by být hlavním „decision maker“ pneumolog, což ovšem předpokládá, že by mělo jít o specialistu vzdělaného v mnoha oblastech medicíny, zahrnujících i nejčastěji se vyskytující komorbidity.
Možnosti ovlivnění QoL u pacientů s CHOPN
Přestože CHOPN je onemocněním s různě rychlou progresí, lze pro zlepšení QoL nemocných učinit mnohé. Hlavním cílem léčby nemocných s CHOPN dle GOLD 2014 je: zmírnit symptomy nemoci, zabránit zhoršování (progresi) nemoci, zlepšit fyzickou výkonnost a celkový zdravotní stav, zabránit budoucím exacerbacím, prodloužit přežití za použití léků a léčebných opatření bez nežádoucích účinků nebo s jejich minimem [22].
Nemocné s CHOPN ve fázi stabilizace onemocnění nejvíce obtěžuje dušnost, kašel, snížená výkonnost, deprese a existující komorbidity. V době akutní exacerbace se symptomy jednak vystupňují a jednak se přidají další, a navíc i po zvládnutí akutní fáze jsou exacerbace význačným faktorem přispívajícím k další progresi nemoci. V současnosti existují možnosti, jak ovlivnit symptomy i vývoj CHOPN (zabránit progresi CHOPN, či ji alespoň zpomalit) a udržet či zlepšit HRQoL nemocných jak farmakologicky, tak i nefarmakologicky. Nejprve se podívejme na možnosti zlepšit HRQoL u nemocných s CHOPN pomocí jednotlivých skupin léků.
Bronchodilatancia
ß2-sympatomimetika s krátkodobým účinkem
Léčba ß2-sympatomimetiky s krátkodobým účinkem (SABA) je v současnosti hodnocena jako doplňková („as needed”), v léčbě stabilní CHOPN se dává přednost dlouhodobě účinným přípravkům. Přesto máme k dispozici výsledky přehledu Sestiniho a kol. [23], který zahrnoval 13 randomizovaných kontrolovaných cross-over studií, z jejichž výsledků vyplynulo, že po dobu léčby SABA došlo k významnému zlepšení skóre každodenní dušnosti v porovnání s placebem. Jediná studie, která hodnotila HRQoL, prokázala při užívání SABA významné zlepšení skóre v doméně dušnosti a únavy [24].
ß2-sympatomimetika s prodlouženým účinkem
Při posuzování ß2-sympatomimetik s prodlouženým účinkem (LABA) salmeterolu a formoterolu bylo vedle jiných faktorů prokázáno i zlepšení HRQoL. Ve studii publikované v časopise Chest v roce 1999 [25] bylo prokázáno, že salmeterol má ve srovnání s placebem a ipratropiem lepší vliv na plicní funkce a ve srovnání s placebem salmeterol zlepšoval i HRQoL a zmírňoval dušnost. Při porovnání inhalačně podávaného formoterolu, ipratropia a placeba zvyšovala obě bronchodilatancia hodnotu FEV1, ale pouze formoterol zmírňoval potíže a zlepšoval QoL [26]. V metaanalýze LABA v léčbě CHOPN, do níž byly zařazeny i výše uvedené studie, však Appleton a kol. [27] zjistili jen malé zvýšení FEV1 a variabilní změny HRQoL a dušnosti.
Anticholinergika s krátkodobým účinkem
Liesker a kol. [28] zjistili při srovnání ipratropia a formoterolu s placebem významné zlepšení plicních funkcí a tolerance zátěže u nemocných s bronchodilatačními léky, ale neshledali významné zlepšení skóre dušnosti podle Borga (Borg dyspnea score). Účinky formoterolu, placeba a ipratropia srovnávali v delší studii také Wadbo a kol. [29]. Při porovnání s placebem zjistili, že aktivní léčba formoterolem i ipratropiem významně zlepšuje skóre denní dušnosti i spirometrické nálezy. Při léčbě ipratropiem se také oproti placebu zmírnil výskyt kašle během dne. Změna oproti vstupnímu celkovému skóre SGRQ nebyla mezi jednotlivými skupinami významně rozdílná, ale skóre v doméně pro symptomy bylo lepší při léčbě ipratropiem než při podávání formoterolu nebo placeba.
Inhalační kortikosteroidy
Ve studii ISOLDE (Inhaled Steroid in Obstructive Lung Disease in Europe) [30] se v průběhu jednoho roku neprokázal významný rozdíl v rychlosti poklesu FEV1 mezi pacienty léčenými inhalačním flutikasonem ve srovnání s nemocnými, kteří dostávali placebo. Dle výsledků studie došlo k progresivnímu zhoršování zdravotního stavu v obou skupinách nemocných. Při hodnocení HRQoL pomocí dotazníku SGRQ však u pacientů léčených flutikasonem docházelo ke zhoršování zdravotního stavu pomaleji (pokles o 2,0 jednotky za rok), zatímco nemocní ve skupině s placebem měli pokles vyšší (3,2 jednotky/rok). Přestože se jednalo o statisticky významné hodnoty (p = 0,004), rozdíl nedosáhl prahu minimální klinicky významné změny (4,0 jednotky) pro skóre SGRQ.
V několika následujících studiích prokázal např. Thompson u nemocných léčených flutikasonem vs. placebem významné snížení skóre dušnosti dle dotazníku CRQ (3,70 ± 0,18 vs. 3,47 ± 0,19, p = 0,03) [31].
Kombinovaná léčba
SABA a krátkodobě účinná anticholinergika
Randomizované, dvojitě slepé studie z několika center u nemocných se středně závažnou až těžkou CHOPN prokázaly, že kombinace inhalačního salbutamolu a ipratropia zvýšila FEV1 více než podávání každé z obou látek samostatně, ale neprokázaly, že by kombinovaná léčba v porovnání se samostatně podávanými látkami příznivěji ovlivňovala symptomy a QoL [32].
LABA a krátkodobě účinná anticholinergika
D’Urzo a kol. v randomizované, dvojitě slepé zkřížené studii [33] prokázali, že při kombinované léčbě formoterolem a ipratropiem se zlepšila postbronchodilatační FEV1 více než při podávání kombinace salbutamolu s ipratropiem. Při kombinované léčbě formoterolem a ipratropiem došlo ke zlepšení skóre hodnotícího symptomy, i když celková změna skóre SGRQ se významně nelišila od změny při kombinované léčbě salbutamolem a ipratropiem.
LABA a inhalační kortikosteroidy
V randomizované, placebem kontrolované studii (TRISTAN) srovnávali čtyři skupiny pacientů (s placebem, s léčbou samotným salmeterolem, samotným flutikasonem a s kombinací salmeterolu a flutikasonu) s ohledem na spirometrické ukazatele i na zdravotní stav nemocných. Každá aktivní terapie vedla ke zlepšení ventilačních funkcí, zlepšovala i zdravotní stav a mírnila symptomy. Při kombinované léčbě se po 12 měsících projevilo klinicky významné zlepšení skóre SGRQ [34]. Toto nebylo potvrzeno v následném systematickém přehledu provedeném Nanninim a spolupracovníky, kteří porovnávali účinky kombinace inhalačního kortikosteroidu (IKS) a LABA se samotným IKS. Přesvědčivé zlepšení QoL nebylo prokázáno ani při srovnání kombinované léčby se samotným LABA [35].
Velká studie TORCH (6112 účastníků, 3 roky trvání, 4 větve – salmeterol, flutikason propionát, placebo a kombinace salmeterol/flutikason propionát) měla za úkol prokázat snížení mortality u nemocných léčených kombinací IKS a LABA oproti placebu. Ačkoli se prokázalo snížení mortality o 17,5 % u nemocných léčených kombinací, rozdíl oproti placebu nedosáhl statistické významnosti (p = 0,052). Ve studii byl kromě jiného sledován i počet exacerbací a změny HRQoL u jednotlivých skupin. Roční výskyt exacerbací byl významně snížen (o 25 %) u nemocných s kombinovanou léčbou a činil 0,85 (95% CI: 0,80–0,90) versus 1,13 (95% CI: 1,07–1,20) u nemocných, kterým bylo podáváno placebo, p < 0,001. HRQoL měřená podle SGRQ se během tří let změnila následovně: u nemocných s placebem došlo ke zhoršení o 0,2 jednotky, léčba salmeterolem přinesla zlepšení o 0,8 jednotky a léčba flutikasonem o 1,8 jednotky; u nemocných dostávajících kombinaci salmeterol-flutikason došlo k nejvýraznějšímu zlepšení – o 3,0 jednotky. Zlepšení QoL u nemocných s kombinovanou léčbou bylo statisticky významné oproti všem ostatním skupinám, ale ani ve srovnání s nemocnými ve skupině s placebem nedosáhlo toto zlepšení hranice klinické významnosti 4 jednotek [36].
Anticholinergika s prodlouženým účinkem
Tiotropium je nejznámějším a nejdéle užívaným (10 let) dlouhodobě účinným anticholinergikem. Léčba tiotropiem snížila počet exacerbací onemocnění, zmírnila dušnost a také zlepšila HRQoL výrazněji, než se pozorovalo při léčbě ipratropiem [37]. V jiné randomizované, kontrolované, dvojitě slepé a dvojitě napodobené (dummy) studii léčba tiotropiem významně zlepšila skóre dušnosti a celkové skóre SGRQ v porovnání s placebem a salmeterolem [38]. Tashkin a Kesten [39] zjistili, že dlouhodobý pozitivní účinek tiotropia na zmírňování dušnosti a zlepšování QoL je nezávislý na iniciální odpovědi na léčbu.
Studie UPLIFT
V dobře známé čtyři roky trvající studii UPLIFT byli nemocní (n = 5993) randomizováni k léčbě tiotropiem vs. placebem, přičemž veškerou léčbu (kromě krátkodobého anticholinergika) mohli užívat tak, jak jim ji předepisoval jejich lékař. Hlavního cíle studie – prokázat zpomalení poklesu FEV1 u nemocných léčených tiotropiem oproti placebu – však nebylo dosaženo (40 ml/rok vs. 42 ml/rok), což ale nebránilo dalšímu zpracování velkého množství dat získaných v této studii [40].
Nemocní s tiotropiem měli oproti nemocným s placebem významně delší čas do vzniku akutní exacerbace (16,7 měsíce vs. 12,5 měsíc![Graf 3 Změny skóre SGRQ v průběhu studie UPLIFT; podle [40] – Tashkin, et al., 2008.](https://www.remedia.cz/photo-a-29721---.jpg) e) i do hospitalizace pro tuto komplikaci. Počet exacerbací byl u nemocných s tiotropiem snížen oproti nemocným s placebem o 14 % (p < 0,001).Kvalita života hodnocená pomocí dotazníku SGRQ byla u nemocných léčených tiotropiem po celou dobu významně lepší než u nemocných, jimž bylo podáváno placebo, rozdíl kolísal v rozmezí 2,3–3,3 jednotky, p < 0,001. V rameni s tiotropiem dosáhl klinicky významného zlepšení QoL dle SGRQ o 4 jednotky oproti vstupním hodnotám (baseline) vyšší počet nemocných, než tomu bylo v rameni s placebem; v prvním roce studie se jednalo o rozdíl 49 % vs. 41 %, po dvou letech studie to bylo 48 % vs. 39 %, po třech letech 46 % vs. 37 % a po čtyřech letech 45 % vs. 36 %, p < 0,001 pro všechna srovnání. Zhoršování skóre SGRQ bylo v průběhu celé studie v obou skupinách podobné, viz graf 3.
e) i do hospitalizace pro tuto komplikaci. Počet exacerbací byl u nemocných s tiotropiem snížen oproti nemocným s placebem o 14 % (p < 0,001).Kvalita života hodnocená pomocí dotazníku SGRQ byla u nemocných léčených tiotropiem po celou dobu významně lepší než u nemocných, jimž bylo podáváno placebo, rozdíl kolísal v rozmezí 2,3–3,3 jednotky, p < 0,001. V rameni s tiotropiem dosáhl klinicky významného zlepšení QoL dle SGRQ o 4 jednotky oproti vstupním hodnotám (baseline) vyšší počet nemocných, než tomu bylo v rameni s placebem; v prvním roce studie se jednalo o rozdíl 49 % vs. 41 %, po dvou letech studie to bylo 48 % vs. 39 %, po třech letech 46 % vs. 37 % a po čtyřech letech 45 % vs. 36 %, p < 0,001 pro všechna srovnání. Zhoršování skóre SGRQ bylo v průběhu celé studie v obou skupinách podobné, viz graf 3.
V roce 2010 byla publikována studie zaměřující se na hodnocení vývoje plicních funkcí, HRQoL, počtu exacerbací, délky přežití a nutnosti podání konkomitantní léčby u nemocných ve studii UPLIFT, kteří před zahájením studie nedostávali žádnou udržovací léčbu, byli tedy tzv. maintenance naive (MN). Jako záchrannou medikaci mohli užívat salbutamol dle potřeby [41]. V této analýze bylo studováno 810 MN nemocných, což představovalo 13,5 % ze všech 5993 účastníků studie UPLIFT.
Nemocní byli sledováni 4 roky, při každé návštěvě vyplňovali dotazník SGRQ (na začátku studie a pak každých 6 měsíců). Byl sledován počet exacerbací definovaných jako zhoršení zdravotního stavu trvající déle než 3 dny, provázené výskytem více než jednoho symptomu a vyžadující změnu léčby (antibiotika a/nebo kortikosteroidy systémově), a dále byly evidovány všechny léky, které byly účastníkům „nově” nasazeny během čtyř let studie. Jednalo se o theofyliny, LABA, IKS, LABA a IKS buď ve fixní kombinaci či samostatně. Z 810 MN pacientů bylo 403 léčeno tiotropiem a 407 dostávalo placebo.
Plicní funkce hodnocené dle prebronchodilatační FEV1, tzv. trough, byly již 30 dnů po zahájení studie o 99 ml vyšší u skupiny MN léčené tiotropiem ve srovnání se skupinou MN s placebem (p < 0,0001). Tento rozdíl byl významný po celou dobu sledování (p < 0,05) a rozdíl v hodnotách trough FEV1 kolísal mezi 99 ml až 160 ml. Celkově bylo na konci studie prebronchodilatační FEV1 u nemocných s tiotropiem vyšší v průměru o 134 ml. U této skupiny nemocných byl splněn původně plánovaný cíl prokázat zpomalení poklesu FEV1, který činil při léčbě tiotropiem 42 ml, zatímco při podávání placeba 53 ml, p = 0,026. Nemocní léčení tiotropiem zaznamenali během 4 let studie o 16 % nižší počet akutních exacerbací (AE) než nemocní s placebem (0,49 AE/rok vs. 0,58 AE/rok), rozdíl však nedosáhl statistické významnosti, p = 0,08. Podobně nedosáhl statistické významnosti rozdíl v mortalitě, která byla nižší při podávání tiotropia než placeba (10,9 % vs. 13,8 %, p = 0,14). Ve srovnání s placebem byla při léčbě tiotropiem významně nižší potřeba přidávat další léky indikované pro CHOPN (LABA nebo IKS a/nebo LABA/IKS), p < 0,01.
QoL sledovaná pomocí dotazníku SGRQ vyplňovaného každých šest měsíců byla významně lepší u nemocných léčených tiotropiem. Jednak bylo prokázáno pomalejší snižování QoL, kdy roční zhoršení skóre SGRQ u nich činilo +0,66 jednotky/rok, zatímco u nemocných s placebem dosahovalo toto skóre + 1,71 jednotky/rok (p = 0,0019), jednak během studie dosáhl rozdíl v HRQoL mezi oběma skupinami klinicky významné hodnoty 4,57 jednotky (podskupina MN pacientů). Když se detailně posoudily rozdíly v HRQoL dle SGRQ, zjistilo se, že k významnému zlepšení došlo v ukazateli vypovídajícím o dopadu nemoci na QoL a ve zvládání životních aktivit.
Závěrem autoři soudí, že podávání tiotropia nemocným bez předchozí udržovací léčby CHOPN dokázalo vedle akutního bronchodilatačního efektu zpomalit deterioraci plicních funkcí a oddálit či zmenšit přidání jiné udržovací léčby. Dalším významným poznatkem této subanalýzy je schopnost zpomalit udržovací léčbou tiotropiem zhoršování HRQoL, což vedlo již po půlroce k rozdílu 2,29 jednotky SGRQ oproti nemocným s placebem. Během dlouhodobého sledování se rozdíl v tomto ukazateli zvětšoval tak, že po 25,5 měsíce studie dosáhl klinicky významného rozdílu 4 jednotek, a dále, až do konce studie, zůstal nad touto hranicí.
Studie TIPHON
Tonnel a kol. v roce 2008 publikovali výsledky devítiměsíční studie TIPHON [42], ve které chtěli posoudit, jak tiotropium ovlivní HRQoL hodnocenou dle SGRQ. Do studie byli zařazeni nemocní s CHOPN starší 40 let s FEV1 < 70 % a > 20 %, FEV1/FVC < 70, s více než 10 balíčkoroky kouření. Nemocní nesměli užívat krátkodobě účinná anticholinergika a LABA, povoleny byly theofyliny, IKS, perorální kortikosteroidy (< 10 mg prednisonu) a jako záchranná medikace salbutamol. Nemocní byli kontrolováni na začátku studie a dále každé 3 měsíce. Vždy před provedením spirometrie vyplňovali dotazník SGRQ. Do skupiny s tiotropiem bylo randomizováno 266 nemocných, do skupiny s placebem 288 nemocných.
Po devíti měsících dosáhlo zlepšení SGRQ o 4 jednotky významně více nemocných léčených tiotropiem, než tomu bylo u nemocných ve skupině s placebem (59,1 % vs. 48,2 %, p = 0,029). U nemocných léčených tiotropiem došlo na konci studie k průměrnému zlepšení SGRQ oproti vstupním hodnotám o 8,50 jednotky, u nemocných s placebem o 4,32 jednotky, p = 0,001. Ke zlepšení QoL došlo ve všech třech „doménách“ SGRQ u nemocných s tiotropiem vs. s placebem (p < 0,05). Autoři rovněž prokázali, že HRQoL se více zlepšila u nemocných s těžšími formami CHOPN (FEV1 < 50 %), naopak neprokázali rozdíl v HRQoL mezi tiotropiem a placebem u nemocných léčených IKS. Spirometricky prokázané zlepšení plicních funkcí bylo významně lepší u nemocných s tiotropiem (p < 0,05), hodnoty ventilačního vyšetření nekorelovaly s HRQoL u obou skupin. Nemocní s tiotropiem měli významně méně exacerbací než nemocní s placebem (1,05 vs. 1,83, snížení o 43 %; p = 0,03). Autoři uzavírají, že tiotropium statisticky i klinicky významně zlepšuje HRQoL u nemocných s CHOPN měřenou pomocí SGRQ. Studie dále prokázala zlepšení plicních funkcí a snížení počtu exacerbací u nemocných léčených tímto dlouhodobě působícím anticholinergikem.
Studie SOSPES
I další studie provedená během šesti měsíců u souboru nemocných s CHOPN měla za úkol zjistit, jak ovlivní rutinní klinické použití tiotropia HRQoL. Studie s názvem SOSPES [43] byla provedena v zemích střední Evropy. Zúčastnili se jí nemocní starší 40 let s CHOPN stadia II–IV (dle GOLD 2006) s FEV1/FVC < 0,70 a s FEV1 < 80 % náležitých hodnot, kteří před zahájením studie neužívali tiotropium. Nemocní mohli používat souběžně s tiotropiem svoji zavedenou záchrannou i udržovací terapii. Studie se účastnilo 4854 pacientů, 89 % z nich bylo dle kritérií GOLD ve stadiu II a III, 75,1 % mělo jednu nebo více komorbidit. Během šesti měsíců léčby se nemocným zlepšilo skóre SGRQ o 21,7 jednotky (p < 0,0001), přičemž nejvíce se zlepšila doména symptomů – o 27,2 jednotky, následovaná doménou dopadu nemoci (o 22 jednotek) a nejméně se zlepšilo hodnocení aktivit (o 18,2 jednotky). Na úroveň zlepšení HRQoL neměl vliv kuřácký status (p = 0,2), ani existence či neexistence kardiálního onemocnění (p = 0,96); naopak věk tuto hodnotu ovlivňoval. K výraznějšímu zlepšení HRQoL došlo u nemocných mladších 65 let než u nemocných starších 65 let (–22,3 vs. –20,6 jednotky SGRQ, p = 0,002) a nemocných s těžšími formami CHOPN dle GOLD. Po šesti měsících užívání tiotropia společně s již dříve nasazenou léčbou CHOPN bylo prokázáno klinicky významné zlepšení HRQoL u 83,5 % všech sledovaných nemocných. Autoři soudí, že výše uvedené výsledky opravňují používat tiotropium jako lék první volby v udržovací léčbě stabilní CHOPN v kategoriích B, C a D dle GOLD 2011 [22].
Studie TIOSPIR
Vedle hlavního úkolu studie TIOSPIR [44]. jímž bylo posoudit mortalitu, měla tato studie za cíl stanovit, jak výskyt akutních exacerbací ovlivní podávání tiotropia inhalačními systémy Respimat® vs. HandiHaler®. Studie měla tři paralelní větve, ve kterých nemocní užívali tiotropium 18 μg jednou denně via HandiHaler®, tiotropium 5 μg jednou denně (2,5 μg × 2 inhalace) via Respimat® a tiotropium 2,5 μg jednou denně (1,25 μg × 2 inhalace) via Respimat®. Plánovaná doba studie byla odhadována na 2–3 roky a závisela na celkovém počtu úmrtí, který byl statisticky stanoven na 1266. Nemocní ve studii splňovali následující kritéria: zařazeni byli muži nebo ženy ve věku nad 40 let, s anamnesticky alespoň 10 balíčkoroky kouření, s klinickou diagnózou CHOPN s postbronchodilatačními hodnotami FEV1/FVC ≤ 0,70 a FEV1 ≤ 70 % náležitých hodnot (GOLD II–IV). Kromě studijní medikace byla povolena jakákoli léčba všech onemocnění s výjimkou jiných anticholinergních léků než studijních. Studie byla zahájena v květnu 2010 a ukončena v květnu 2013. Celkem 17 183 nemocných bylo randomizováno do jedné ze tří léčebných skupin, v každé bylo cca 5700 nemocných. Během studie nebyl pozorován rozdíl v počtu úmrtí mezi skupinami, zemřelo 7,7 % nemocných ve skupině s HandiHalerem® a s Respimatem® 2,5 μg a 7,4 % ve skupině Respimatem® 5 μg. Nevýznamně lepší byla větev Respimat® tiotropium 5 μg než HandiHaler® v oddálení střední doby do první exacerbace (756 dní vs. 719 dní), p = 0,42. Tři léčebné skupiny se nelišily ve výskytu velkých kardiovaskulárních příhod ani v počtu nově vzniklých arytmií. Autoři uzavírají, že tiotropium podané formou vlhké mlžiny Respimatem® nezvyšuje riziko úmrtí ani kardiálních nežádoucích účinků léčby, a tedy má stejně příznivý bezpečnostní profil a schopnost zabránit exacerbacím jako tiotropium 18 μg podané v práškové formě HandiHalerem®.
Nefarmakologické možnosti zlepšení HRQoL
Vedle výše uvedených farmakologických možností zpomalení progrese CHOPN, snížení intenzity symptomů a zlepšení HRQoL je nutno zmínit i neméně významnou složku léčby těchto nemocných, a tou je plicní rehabilitace v širokém slova smyslu. Existují studie prokazující, že pokud jsou nemocní s CHOPN zařazeni do rehabilitačního programu v době stability onemocnění, sníží se počet akutních exacerbací i počet nutných hospitalizací (až o 40 %) a o 50 % se zkrátí doba nutného pobytu v nemocnici při příští akutní exacerbaci [45, 46].
Metaanalýza 9 studií [47] hodnotících přínos rehabilitace 432 nemocných s CHOPN zahájené již v nemocnici nebo časně po propuštění přinesla následující výsledky. Plicní rehabilitace významně snížila počet akutních hospitalizací (pooled odds ratio 0,22; 95% CI: 0,08–0,58) i snížila mortalitu (odds ratio – OR 0,28; 95% CI: 0,10–0,84). Efekt plicní rehabilitace byl prokázán i při měření HRQoL, kdy zlepšení významně přesáhlo minimální klinickou hodnotu jak za pomoci dotazníku CRQ, tak pomocí SGRQ. Celkové skóre SGRQ se zlepšilo o 9,88 jednotky (95% CI: –14,40 až –5,37). Největšího zlepšení bylo dosaženo v doméně „dopadu nemoci“, a to o 13,94 jednotky (95% CI: –20,37 až –7,51) a ve zlepšení „limitace aktivit“ o 9,94 jednotky (95% CI: –15,98 až –3,89). Naopak symptomy nemoci byly rehabilitací zmírněny jen nevýznamně. Dále bylo prokázáno významné zlepšení výsledku 6MWT, přičemž rehabilitace neměla žádné nežádoucí účinky.
Dále bylo prokázáno, že k rychlejšímu zotavení (recovery) po akutní exacerbaci přispívá časná mobilizace nemocného, včasné zahájení rehabilitace i snížení zátěže hospitalismu (zbytečné prodlužování hospitalizace s nadbytečnými vyšetřeními, zbytečná dietní omezení, rutinní zavádění močových katétrů a podobně). Lékaři pečující o nemocné s CHOPN by měli brát v potaz i to, že přibližně 25 % těchto pacientů trpí depresemi, u nejtěžších stadií CHOPN je to až 57 % nemocných. Podle metaanalýzy zvyšují souběžně se vyskytující deprese a anxieta u nemocných s CHOPN riziko úmrtí (depression relative risk = 1,83; 95% CI: 1,00–3,36; anxiety relative risk = 1,27; 95% CI: 1,02–1,58) a zvyšují počty akutních exacerbací CHOPN o 31 % [48].
Další možností, jak zlepšit HRQoL, je zvyšování fyzické aktivity nemocných s CHOPN. Některé studie přinesly zajímavé výsledky; například bylo prokázáno, že fyzická aktivita přispívá k tomu, aby se i u kuřáků snížilo riziko vzniku CHOPN. Je rovněž prokázáno, že fyzická inaktivita sama přispívá k větší ztrátě plicních funkcí a že fyzická zátěž snižuje oxidativní stres, má protizánětlivé účinky a dokáže snížit frekvenci respiračních infekcí [49]. Dokonce samotná chůze může pozitivně ovlivnit HRQoL kvantifikovanou pomocí SGRQ a snižuje hladinu biomarkerů charakteristických pro kardiální postižení u nemocných se stabilní CHOPN [50].
K optimálnímu průběhu onemocnění přispívá i zabezpečení dobré výživy. CHOPN je často spojena s malnutricí, kterou trpí až 30–60 % hospitalizovaných pacientů a 10–45 % pacientů s CHOPN léčených ambulantně [51]. Podvyživení nemocní trpí častěji závažnější hyperinflací plic, mají nižší transfer faktor a zhoršenou toleranci fyzické zátěže ve srovnání s nemocnými se stejně závažným onemocněním, ale s vyšší tělesnou hmotností [52].
Samozřejmou součástí komplexní péče o nemocné s CHOPN je pomoc při ukončení kuřáctví. Podle některých studií až třetina nemocných se střední a středně těžkou CHOPN pokračuje v kuřáctví [53]. Kuřáci s CHOPN mají horší HRQoL a častější výskyt depresí ve srovnání s těmi, kteří s kouřením skončili, ačkoli je jejich stupeň onemocnění CHOPN stejně závažný. Existují studie prokazující, že ukončení kuřáctví dokázalo zlepšit HRQoL [54].
Ke zlepšení HRQoL přispívá i edukace nemocných, „motivační“ rozhovory a kurzy tzv. self-managementu nemoci [55]. Významným cílem je i zvýšení adherence nemocných k léčbě, která se dle WHO v rozvinutých zemích u chronicky nemocných pohybuje pouze kolem 50 % [50]. Informace ze studie TORCH prokázaly, že nemocní s horší HRQoL mají i častěji sníženou adherenci k inhalační léčbě. Nízká adherence k léčbě je spojena s vyšším rizikem vzniku exacerbací i s mortalitou [57]. Je tedy jasné, že v péči o nemocné je třeba věnovat dostatek času vysvětlení účinku léků, nácviku inhalačních technik a kontrole správného užívání léků.
Závěry
Z výše uvedeného přehledu vyplývají následující závěry:
- Lze očekávat další zvýšení počtu nemocných s CHOPN.
- V důsledku zlepšené léčby stabilní CHOPN i zvládnutí akutních exacerbací bude přibývat nemocných vyššího věku.
- HRQoL nemocných s CHOPN bude nabývat na významu a může se stát nejlepším (možná jediným) ukazatelem výsledku naší péče.
- Snížení počtu exacerbací, omezení symptomů nemoci a zlepšení tolerance fyzické zátěže jsou nejvýznamnějšími modulátory HRQoL u pacientů s CHOPN.
- V současnosti máme k dispozici jak farmakologické, tak nefarmakologické možnosti ovlivnění průběhu nemoci.
- Ze spektra uvedených léků prokázaly mnohé schopnost ovlivnit HRQoL, tiotropium prokázalo svoji účinnost v největším počtu studií s největším počtem pacientů.
- Tiotropium tak i po deseti letech zůstává „zlatým standardem“ pro paušální léčbu stabilizovaného onemocnění CHOPN v kategorii B, C a D a komparátorem nových léků či lékových kombinací.
- Farmakologické i nefarmakologické studie prokázaly, že zlepšení HRQoL nemocných s CHOPN není chimérou, ale dosažitelným reálným cílem.
Seznam použité literatury
- [1] Rifkin J. Evropský sen. Praha, Evropský literární klub, 2005.
- [2] The quality of life model. University Toronto, Canada, dostupné na http://www.utoronto.ca/qol/qol_model.htm (navštíveno 2. 5. 2014).
- [3] Heřmanová E. Kvalita života a její modely v současném sociálním výzkumu. Sociológia 2012; 44: 407–425.
- [4] Payne J. a kol. Kvalita života a zdraví. Praha, Triton, 2005, 629 s.
- [5] Jones PW. Issues Concerning Health-Related Quality of Life in COPD. Chest 1995; 107 (5 Suppl.): 187S–193S.
- [6] Salajka F. Hodnocení kvality života u nemocných s bronchiální obstrukcí. Praha, Grada, 2006, 146 s.
- [7] Linus HST, Varkey B. Zlepšování kvality života u pacientů s chronickou obstrukční plicní nemocí. Curr Opin Pulm Med 2004; 10: 120–127.
- [8] Jones PW, Quirk FH, Baveystock CM, et al. A self-complete measure of health status for chronic airflow limitation. The St. George’s Respiratory Questionnaire. Am Rev Respir Dis 1992; 145: 1321–1327.
- [9] Guyatt GH, Berman LB, Townsend M, et al. A measure of quality of life for clinical trials in chronic lung disease. Thorax 1987; 42: 773–778.
- [10] Pakhale S, Wood-Dauphinee S, Spahija J, et al. Combining Both Generic and Disease-Specific Properties: Development of the McGill COPD Quality of Life Questionnaire. J Chron Obstruct Pulmon Dis 2011; 8: 255–263.
- [11] Pakhale S, Wood-Dauphinee S, Spahija A, et al. Validation of a new questionnaire with generic and disease-specific qualities: The McGill COPD Quality of Life Questionnaire. Can Respir J 2012; 19: 367–372.
- [12] Hajiro T, Nishimura K, Tsukino M, et al. A comparison of the level of dyspnea vs disease severity in indicating the health-related quality of life of patients with COPD. Chest 1999; 116: 1632–1637.
- [13] Mahler DA, Harver A. A factor analysis of dyspnea ratings, respiratory muscle strength, and lung function in patients with chronic obstructive pulmonary disease. Am Rev Respir Dis 1992; 145: 467–470.
- [14] Agustí A, Soler JJ, Molina J, et al. Is The CAT Questionnaire Sensitive To Changes In Health Status In Patients With Severe COPD Exacerbations? COPD 2012; 9: 492–498.
- [15] World Health Organization. Global surveillance, Prevention and Control of Chronic Respiratory Diseases: A Comprehensive Approach. Geneva, Switzerland: World Health Organization; 2007. Available from: http://whqlibdoc.who.int/publications/2007/9789241563468_eng.pdf. Accessed March 23, 2013.
- [16] Lozano R, Naghavi M, Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012; 380: 2095–2128.
- [17] Vos T, Flaxman AD, Naghavi M, et al. Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990–2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012; 380: 2163–2196.
- [18] Almagro P, Salvadó M, Garcia-Vidal C, et al. Recent improvement in long-term survival after a COPD hospitalisation. Thorax 2010; 65: 298–302.
- [19] Barnett K, Mercer SW, Norbury M, et al. Epidemiology of multimorbidity and implications for health care, research, and medical education: a cross-sectional study. Lancet 2012; 380: 37–43.
- [20] Van Oostrom SH, Picavet HSJ, van Gelder BM, et al. Multimorbidity and comorbidity in the Dutch population – data from general practices. BMC Public Health 2012; 12: 715.
- [21] Almagro P, Castro A. Helping COPD patients change health behavior in order to improve their quality of life. Int J Chron Obstruct Pulmon Dis 2013; 8: 335–345.
- [22] The Global Strategy for Diagnosis, Management and Prevention of COPD, Update 2014, www.goldcopd.com
- [23] Sestini P, Renzoni E, Robinson S, et al. Short-acting beta 2 agonists for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2002: CD001495.
- [24] Guyatt GH, Townsend M, Keller JL, et al. Should study subjects see thein previous responses: data from a randomized control trial. J Clin Epidemiol 1989; 42: 913–920.
- [25] Mahler DA, Donohue JF, Barbee RA, et al. Efficacy of salmeterol xinafoate in the treatment of COPD. Chest 1999; 115: 957–965.
- [26] Dahl R, Greefhorst LA, Nowak D, et al. Inhaled formoterol dry powder versus ipratropium bromide in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001; 164: 778–784.
- [27] Appleton S, Poole P, Smith B, et al. Long-acting beta2-agonists for chronic obstructive pulmonary disease patients with poorly reversible airflow limitation. Cochrane Database Syst Rev 2002: CD001104.
- [28] Liesker JJ, Van De Velde V, Meysman M, et al. Effects of formoterol (Oxis Turbuhaler) and ipratropium on exercise capacity in patients with COPD. Respir Med 2002; 96: 559–566.
- [29] Wadbo M, Lofdahl CG, Larsson K, et al. Effects of formoterol and ipratropium bromide in COPD: a 3-month placebo-controlled study. Eur Respir J 2002; 20: 1138–1146.
- [30] Burge PS, Calverley PM, Jones PW, et al. Randomised, double blind, placebo controlled study of fluticasone propionate in patients with moderate to severe chronic obstructive pulmonary disease: the ISOLDE trial. BMJ 2000; 320: 1297–1303.
- [31] Thompson WH, Carvalho P, Souza JP, et al. Controlled trial of inhaled fluticasone propionate in moderate to severe COPD. Lung 2002; 180: 191–201.
- [32] The COMBIVENT Inhalation Solution Study Group: Routine nebulized ipratropium and albuterol together are better than either alone in COPD. Chest 1997; 112: 1514–1521.
- [33] D’Urzo AD, De Salvo MC, Ramirez-Rivera A, et al. In patients with COPD, treatment with a combination of formoterol and ipratropium is more effective than a combination of salbutamol and ipratropium: a 3-week, randomized, double-blind, within-patient. Multicenter Study. Chest 2001; 119: 1347–1356.
- [34] Calverley P, Pauwels R, Vestbo J, et al. Combined salmeterol and fluticasone in the treatment of chronic obstructive pulmonary disease: a randomised controlled trial. Lancet 2003; 361: 449–456.
- [35] Nannini L, Lasserson T, Poole P. Combined corticosteroid and long-acting beta-agonist in one inhaler for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2003; 4: CD003794.
- [36] Calverley PMA, Anderson JA, Celli B, et al., for the TORCH investigators: Efficacy of Salmeterol and Fluticasone Propionate on mortality in Chronic Obstructive Pulmonary Disease. N Engl J Med 2007; 356: 775–789.
- [37] Vincken W, van Noord JA, Greefhorst AP, et al. Improved health outcomes in patients with COPD during 1 year’s treatment with tiotropium. Eur Respir J 2002; 19: 209–216.
- [38] Brusasco V, Hodder R, Miravitlles M, et al. Health outcomes following treatment for six months with once daily tiotropium compared with twice daily salmeterol in patients with COPD. Thorax 2003; 58: 399–404.
- [39] Tashkin D, Kesten S. Long-term treatment benefits with tiotropium in COPD patients with and without short-term bronchodilator responses. Chest 2003; 123: 1441–1449.
- [40] Tashkin DP, Celli B, Senn S, et al.; for UPLIFT Study Investigators. A 4-year trial of tiotropium in chronic obstructive pulmonary disease. N Engl J Med 2008; 359: 1543–1554.
- [41] Troosters T, Celli B, Lystig T, et al., on behalf of the UPLIFT investigators. Tiotropium as a first maintenance drug in COPD: secondary analysis of the UPLIFT trial. Eur Respir J 2010; 36: 65–73.
- [42] Tonnel AB, Perez T, Grosbois JM, et al., on behalf of the TIPHON study group. Effect of tiotropium on health-related quality of life as a primary efficacy endpoint in COPD. Int J Chron Obstruct Pulmon Dis 2008: 3: 301–310.
- [43] Fležar M, Jahnz-Rózyk K, Enache G, et al. SOSPES, SPIRIVA® Observational Study measuring SGRQ in Routine Medical Practice in Central and Eastern European Region. Int J Chron Obstruct Pulmon Dis 2013: 8: 1–10.
- [44] Wise RA, Anzueto A, Cotton D, et al. Tiotropium Respimat Inhaler and the Risk of Death in COPD. N Engl J Med 2013. DOI: 10.1056/NEJMoa1303342.
- [45] Griffiths TL, Burr ML, Campbell IA, et al. Results at 1 year of outpatient multidisciplinary pulmonary rehabilitation: a randomised controlled trial. Lancet 2000; 355: 362–368.
- [46] Güell R, Casan P, Belda J, et al. Long-term effects of outpatient rehabilitation of COPD: a randomized trial. Chest 2000; 117: 976–983.
- [47] Puhan MA, Gimeno-Santos E, Scharplatz M, et al. Pulmonary rehabilitation following exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2011; 10: CD005305.
- [48] Atlantis E, Fahey P, Cochrane B, Smith S. Bidirectional associations between clinically relevant depression or anxiety and chronic obstructive pulmonary disease (COPD): a systematic review and meta-analysis. Chest 2013; 144: 766–777.
- [49] Hopkinson NS, Polkey MI. Does physical inactivity cause chronic obstructive pulmonary disease? Clin Sci 2010; 118: 565–572.
- [50] Jehn M, Schindler C, Meyer A, et al. Daily walking intensity as a predictor of quality of life in patients with chronic obstructive pulmonary disease. Med Sci Sports Exerc 2012; 44: 1212–1218.
- [51] Collins PF, Elia M, Stratton RJ. Nutritional support and functional capacity in chronic obstructive pulmonary disease: a systematic review and meta-analysis. Respirology 2013; 18: 616–629.
- [52] Ezzell L, Jensen GL. Malnutrition in chronic obstructive pulmonary disease. Am J Clin Nutr 2000; 72: 1415–1416.
- [53] Tashkin DP, Murray RP. Smoking cessation in chronic obstructive pulmonary disease. Respir Med 2009; 103: 963–974.
- [54] Papadopoulos G, Vardavas CI, Limperi M, et al. Smoking cessation can improve quality of life among COPD patients: validation of the clinical COPD questionnaire into Greek. BMC Pulm Med 2011; 11: 13.
- [55] Benzo R, Vickers K, Ernst D, et al. Development and feasibility of a self-management intervention for chronic obstructive pulmonary disease delivered with motivational interviewing strategies. J Cardiopulm Rehabil Prev 2013; 33: 113–123.
- [56] World Health Organization. Adherence to long-term therapies: evidence for action. Meeting report June 4–5, 2001. Geneva, Switzerland: World Health Organization; 2010. Available at: http://www.who.int/chp/knowledge/publications/adherence_full_report.pdf. Accessed March 24, 2013.
- [57] Vestbo J, Anderson JA, Calverley PM, et al. Adherence to inhaled therapy, mortality and hospital admission in COPD. Thorax 2009; 64: 939–943.