Změny v léčbě metastazujícího karcinomu prostaty
Souhrn:
Karcinom prostaty je druhým nejčastějším nádorovým onemocněním u mužů. Ve fázi metastatické choroby, u části původně radikálně léčených, se objeví vzdálené metastázy. Zlatým standardem terapie této skupiny je androgen deprivační léčba. Docetaxel je zlatým standardem léčby kastračně rezistentního onemocnění. V léčbě asymptomatického nebo mírně symptomatického kastračně rezistentního karcinomu prostaty před podáním docetaxelu v tzv. pre chemoindikaci se uplatňují abirateron a enzalutamid. V tzv. postchemoindikaci, po prvotním podání docetaxelu, jsou podávány abirateron, enzaluta-mid, cabazitaxel. Radium 223 lze použít jak v prechemoindikaci, tak v postchemoindikaci u symptomatického pacienta s kostními metastázami.
Key words: prostate cancer – metastatic castration resistant prostate cancer – abirateron – enzalutamide – 223radium – cabazitaxel.
Summary:
Prostate cancer is the second most common malignancy in men. Certain portion of patients, who underwent radical therapy at the beginning, proceeds to develop distant metastases. The gold standard of therapy in this group is represented by androgen deprivation therapy. Docetaxel, on the other hand, is a gold standard of therapy in castration resistant disease. The treatment of asymptomatic or mildly symptomatic castration resistant prostate cancer before the application of docetaxel consists of so called pre chemotherapy using abiraterone and enzalutamide. During post chemotherapy, i.e. after docetaxel application, abiraterone, enzalutamide, and cabazitaxel are given. Radium 223 can be used both in pre and post chemotherapy in symptomatic patients with bone metastases.
Úvod
Karcinom prostaty představuje druhé nejčastější nádorové onemocnění u mužů [1]. Lokalizovaná choroba může být s dlouhodobým úspěchem léčena radikálním chirurgickým výkonem nebo radioterapií samotnou, popř. v kombinaci s hormonální léčbou. Část pacientů přichází k lékaři již ve fázi metastatické choroby, u části původně radikálně léčených se objeví vzdálené metastázy. Zlatým standardem terapie této skupiny je androgen‑deprivační léčba (androgen deprivation therapy, ADT) zahrnující kastraci chemickou (agonisté a antagonisté hormonů uvolňujících gonadotropin, GnRH) nebo chirurgickou (orchiektomie). Účinnost kastrace lze očekávat po dobu 12–24 měsíců a nemoc přechází do kastračně rezistentní fáze. Ta je definována kastrační koncentrací testosteronu (< 50 ng/dl, resp. 1,7 nmol/l v séru), dále biochemickou progresí, kdy tři po sobě následující měření sérových koncentrací prostatického antigenu (prostate specific antigen, PSA) s odstupem minimálně jednoho týdne vykazují vzestup s hodnotou převyšující nejnižší hodnotu o 50 % a současně o více než 2 µg/l, nebo je prokázána radiologická progrese, kdy se objeví dvě nebo více nových kostních lézí prokazatelných na kostním scanu, nebo se zhorší ložiska měkkých tkání dle kritérií RECIST (Response Evaluation Criteria In Solid Tumors) pro hodnocení odpovědi solidních nádorů na léčbu [2].
Léčba metastazujícího kastračně rezistentního karcinomu prostaty (metastatic castration‑resistant prostate cancer, mCRPC) prošla od roku 2004 významnými změnami. Metastazující CRPC byl považován za onemocnění, kde léčba přináší pacientovi pouze zlepšení kvality života, např. ústupem bolesti, ale ne prodloužení přežití. Mitoxantron, který byl dlouhodobě aplikován v první linii léčby mCRPC, ovlivnil pouze symptomy choroby, ale neprodloužil takto léčeným život [3]. Po roce 2004 prokázala studie TAX 327 [4] jako prvá zřejmý úspěch chemoterapie u pacientů s metastazujícím kastračně rezistentním karcinomem prostaty léčených docetaxelem. Výsledky potvrdily nejlepší účinnost docetaxelu v třítýdenním intervalu podávání před mitoxantronem, a to v signifikantním prodloužení mediánu celkového přežití (19,2 měsíce vs. 16,3 měsíce; p = 0,004), v PSA odpovědi (45 % vs. 32 %; p < 0,001), v ústupu bolesti (35 % vs. 22 %; p = 0,01) a ve zlepšení kvality života (22 %
vs. 13 %; p = 0,009). Na základě tohoto úspěchu byl docetaxel v třítýdenním režimu doporučen jako standardní léčba pro mCRPC. Svoji pozici hlavního „stavebního kamene“ v terapii mCRPC si udržel dodnes. Podání chemoterapie se od kastračně rezistentní choroby posouvá do fáze kastračně senzitivního onemocnění. Účinnost docetaxelu byla ověřována studií CHAARTED [5], která sledovala přínos tohoto léčiva v kombinaci s ADT u pacientů s hormonálně senzitivním onemocněním, přínos léčby byl potvrzen pro tzv. high volume postižení. Tato definice zahrnovala přítomnost nikoli uzlinových, ale viscerálních metastáz do měkkých tkání jako špatného prognostického faktoru. Dále se definice zaměřila na kostní metastázy. Do kategorie „high volume“ byli zařazeni nemocní s více než třemi kostními ložisky v případě, že se alespoň jedna léze nacházela mimo žebra a pánev. Skupina léčených s extenzivním postižením měla o 17 měsíců delší celkové přežití v případě, že byla již v úvodu použita kombinace ADT a docetaxelu, ve srovnání se skupinou se samotnou ADT (49,2 měsíce vs. 32,2 měsíce; p < 0,001).
Ve fázi kastračně rezistentní choroby dnes rozlišujeme léčbu v prechemoindikaci, tj. před podáním docetaxelu, nebo v postchemoindikaci, kdy jsou všechny ostatní přípravky aplikovány až po léčbě docetaxelem.
Léčba kastračně rezistentního karcinomu prostaty v prechemoindikaci
Kladné výsledky klinických studií fáze III významně ovlivnily podání přípravků ARTA (AR‑axis‑targeted therapy), imunoterapie a radionuklidu v pre‑chemoindikaci (tab. 1).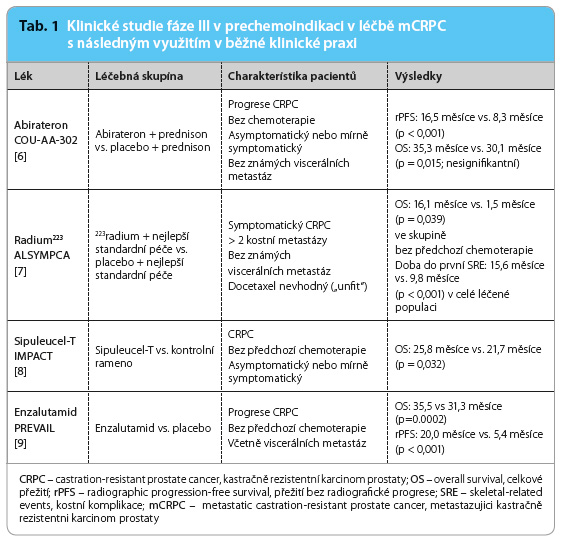
Jak postupovat v léčbě asymptomatického nebo mírně symptomatického kastračně rezistentního karcinomu prostaty před podáním docetaxelu v tzv. pre‑chemoindikaci? Abirateron v dávce 1 000 mg/den v kombinaci s prednisonem v dávce 10 mg/den (s pokračující androgenní blokádou) je variantou volby. Nutno si ale uvědomit, že pacienti s viscerálními metastázami byli z hodnoticí studie vyloučeni. U asymptomatických nemocných s metastatickým postižením jater nebo plic nemůžeme abirateron doporučit k léčebnému použití [6]. Naopak enzalutamid v dávce 160 mg/den prokázal účinnost také u pacientů s viscerálními metastázami. Jeho výhodou je, že není nutné současné podání kortikosteroidů. Za přínos lze považovat i jeho samotné užití, a to bez závislosti na jídle [9]. V „pre‑chemoindikaci“ u pacientů s kostním metastatickým postižením je možné použít také 223radium. To v současné době představuje důležitou léčebnou možnost pro pacienty se symptomatickým karcinomem prostaty s metastatickým kostním postižením. Studie ALSYMPCA [7] indikovala 223radium (223Ra) také pro pacienty, kterým vzhledem k přidruženým chorobám nebyl docetaxel podáván. Bez předchozího podání docetaxelu bylo ve studii 43 % léčených. V „pre‑chemoindikaci“ je 223Ra nyní doporučováno pro léčbu karcinomu prostaty u pacientů se symptomatickým metastatickým kostním postižením, bez přítomnosti viscerálních metastáz s uzlinovým postižením menším než 3 cm. Zejména výběr „správného“ pacienta je klíčový pro účinnost léku. Pacient, pro nějž je léčba vhodná, by měl mít alespoň dvě kostní metastázy ověřené scintigraficky 99mtechneciem (99mTc) – standardní vyšetřovací metodou pro stanovení metastatického kostního postižení. Jako alternativní metodu diagnostiky lze použít radiologická vyšetření (RTG, CT, MR) nebo 11Ccholinovou pozitronovou emisní tomografii/výpočetní tomografii (PET/CT, positron emission tomography/computed tomography). Kostní scan s 99mTc je vhodný rovněž po aplikaci 223Ra k ověření míst jeho kumulace. Léčbu 223Ra je vhodné začít již u nemocných s časnými symptomy [10].
Léčba kastračně rezistentního karcinomu prostaty v post‑chemoindikaci
Jaké máme terapeutické možnosti v případě, že pacienta primárně zaléčíme docetaxelem? Jako léčebné varianty můžeme využít přípravky s prokázanou účinností v tzv. post‑chemoindikaci (tab. 2).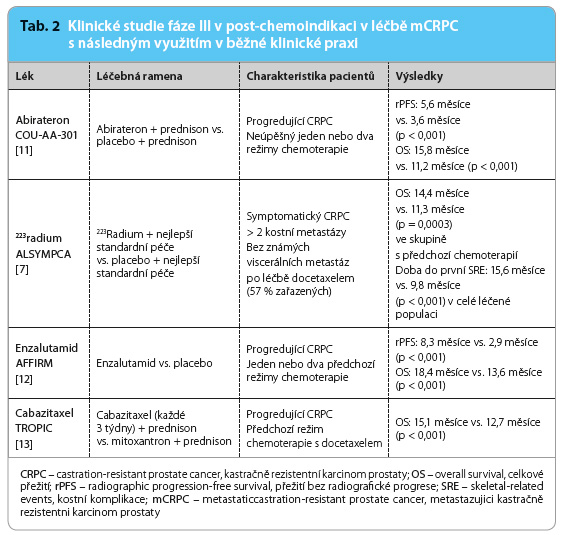
Jak můžeme postupovat v léčbě symptomatického kastračně rezistentního karcinomu prostaty po podání docetaxelu? Semisyntetický derivát taxanů cabazitaxel byl hodnocen ve studii fáze III TROPIC [13], která sledovala účinnost a bezpečnost podávání cabazitaxelu u mužů s metastazujícím kastračně rezistentním karcinomem prostaty předléčených docetaxelem. Pacienti léčení kombinací cabazitaxel/prednison měli signifikantně delší celkové přežití ve srovnání s režimem mitoxantron/prednison. Doba přežití bez progrese onemocnění (složeno z doby bez progrese tumoru, bez elevace PSA a progrese bolesti; nebo úmrtí), hodnocení odpovědi na léčbu podle kritérií RECIST a také hodnocení odpovědi sérové koncentrace PSA byly rovněž statisticky signifikantní ve prospěch ramene s cabazitaxelem. Cabazitaxel podávaný v dávce 25 mg/m2 každé tři týdny v kombinaci s prednisonem se stal významnou součástí léčby nemocných s mCRPC předléčených docetaxelem. Vzhledem k dobré účinnosti cabazitaxelu po předchozím podání docetaxelu byla ve studii fáze III FIRSTANA [14] testována možnost zařazení cabazitaxelu v léčebném algoritmu kastračně rezistentního karcinomu prostaty namísto docetaxelu. Výsledky byly publikovány na výročním mítinku ASCO (American Society of Clinical Oncology) 2016. V souhrnu lze konstatovat, že cabazitaxel v žádném z dávkovacích režimů (20 mg/m2 nebo 25 mg/m2) neprokázal signifikantní prodloužení přežití ve srovnání s docetaxelem u pacientů s kastračně rezistentním karcinomem prostaty nepředléčených chemoterapií. Doba do progrese onemocnění nebyla v žádném z ramen signifikantně delší. Nebyly zaznamenány žádné nové informace o bezpečnostním profilu mezi oběma taxany. U enzalutamidu v dávce 160 mg/den byl přínos v době přežití pozorován ve všech podskupinách pacientů zahrnujících rozdělení podle věku, podle kritéria ECOG Scale of Performance Status hodnotícího celkový stav pacienta a podle geografické polohy centra. Dobrá účinnost byla prokázána také u starších pacientů. Nemocní starší 65 let, kterých bylo ve studii 2,5krát více než pacientů mladších 65 let, přežívali v mediánu 18,4 měsíce po léčbě enzalutamidem. Doba jejich přežití se nelišila od doby přežití všech léčených v rameni s enzalutamidem. Při hodnocení sekundárních cílů byl prokázán přínos enzalutamidu oproti placebu z hlediska hodnocení poklesu koncentrací PSA, radiologicky měřitelných lézí, vzniku kostních komplikací i z hlediska hodnocení celkové kvality života. Signifikantně více pacientů léčených enzalutamidem dosáhlo zmírnění bolesti oproti placebové skupině (45 % vs. 7 %, p = 0,0079) [12]. Výsledky hodnocení abirateronu podávaného v dávce 1 000 mg/den v kombinaci s prednisonem v post‑chemoindikaci podpořily účinnost abirateronu ve všech cílových ukazatelích stanovených v úvodu studie ve srovnání s placebem. A to jak ve sledování odpovědi PSA (p < 0,001), tak v hodnocení objektivních odpovědí u pacientů s měřitelným onemocněním (p < 0,001) a také při srovnání doby do progrese hodnot PSA a mediánu přežití bez progrese na základě radiologického hodnocení. U 44 % ze skupiny nemocných léčených s algickým syndromem došlo při podávání abirateronu ke snížení bolesti ve srovnání s 27 % pacientů, u nichž došlo ke zmírnění bolesti při podávání placeba (p = 0,002). Bezpečnostní profil abirateronu je přijatelný [11].
V souladu s výsledky studie ALSYMPCA u 57 % pacientů předléčených docetaxelem [7] lze očekávat účinnost 223Ra rovněž u této skupiny nemocných. Podle závěrů registrační studie, která zahrnula skupinu pacientů s více než dvaceti metastázami ve skeletu, není předchozí léčba docetaxelem kontraindikací k podání 223Ra. V takovém případě je však nutné zhodnotit celkový stav pacienta, přidružené nemoci a předpokládanou délku života. U pacienta, jemuž je podáno všech šest doporučených dávek, je medián přežití 17,9 měsíce. V případě, že nemocný podstoupí pouze jednu až čtyři aplikace, se medián doby přežití významně zkracuje, pouze na 6,1 měsíce. Aplikace 223Ra není indikována u pacientů s viscerálními metastázami, které se vyskytují obvykle u 23–29 % nemocných po léčbě docetaxelem [7]. Pro léčbu radiofarmakem jsou tolerovatelné uzlinové metastázy do velikosti 3 cm. Z podání 223Ra jsou také vyloučeni nemocní v terminálním stadiu onemocnění (předpokládaná doba přežití kratší než tři měsíce), u kterých je doporučena pouze symptomatická léčba a podávání opioidů.
Kombinovaná nebo sekvenční léčba kastračně rezistentního karcinomu prostaty
Jaké máme možnosti kombinované léčby? Studie s léčbou kombinací např. 223Ra s jinými léky, jako jsou antiandrogeny, nebo s chemoterapií zaměřenou na přínos týkající se přežití, v současné době probíhají. Obdobná sledování se týkají také aktuálního podání hormonálních přípravků, popř. v kombinaci s chemoterapií. Rutinní použití kombinované léčby v současné době není indikováno. Upřednostňována je sekvenční léčba (tab. 3), která přináší možnosti významného ovlivnění přežití v souladu s dobrou kvalitou života. Jsou testovány možnosti tzv. třetí linie po ARTA a chemoterapii. Šestnáct retrospektivních analýz posuzuje účinnost druhé linie ARTA podané po předchozí aplikaci docetaxelu a ARTA. Enzalutamid by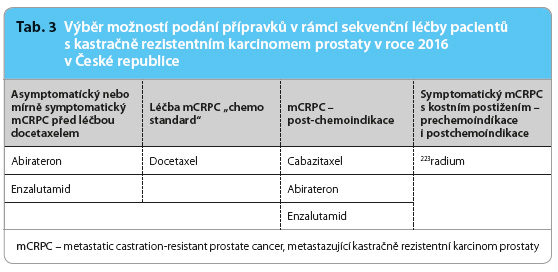 l nejčastěji podáván v režimu docetaxel, abirateron, enzalutamid. Medián doby do progrese (progression‑free survival, PFS) se pohyboval v rozmezí 2,8–4,9 měsíce, medián PFS v sekvenci docetaxel, enzalutamid, abirateron pak v rozmezí 2,7–3,5 měsíce. Optimální sekvence prozatím nebyla definována [15].
l nejčastěji podáván v režimu docetaxel, abirateron, enzalutamid. Medián doby do progrese (progression‑free survival, PFS) se pohyboval v rozmezí 2,8–4,9 měsíce, medián PFS v sekvenci docetaxel, enzalutamid, abirateron pak v rozmezí 2,7–3,5 měsíce. Optimální sekvence prozatím nebyla definována [15].
Prognostické faktory k určení léčebných možností kastračně rezistentního karcinomu prostaty
Metastazující kastračně rezistentní karcinom prostaty je velmi heterogenní onemocnění. V současné chvíli chybějí validované biomarkery pro identifikaci pacienta, zejména se špatnou prognózou, v obecném pohledu. Nemáme jasně stanoveno, který pacient bude rezistentní k chemoterapii a který k ARTA. Mezi prognostické faktory použitelné pro běžnou klinickou praxi můžeme zařadit délku odpovědi na předchozí ADT, Gleasonovo skóre, odpověď vyjádřenou sérovou koncentrací specifického prostatického antigenu. Zkoušejí se i výchozí koncentrace androgenů v séru nebo koncentrace chromograninu A (tab. 4) [15].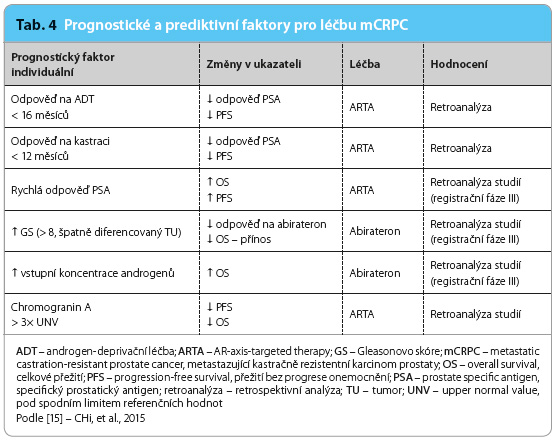
Ukazatele, které byly považovány za možné prognostické faktory pro dvouleté přežití po léčbě docetaxelem následovaným cabazitaxelem, ukazuje tab. 5 [16]. Subanalýza [17] studie TROPIC poukázala na to, že neutropenie 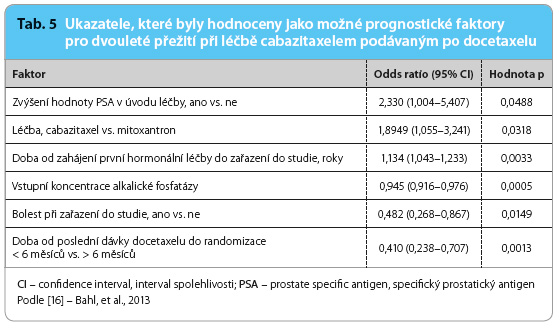 vyššího stupně než 3 měla pozitivní vliv nejen na celkové přežití a na délku doby do progrese onemocnění, ale také na pokles sérové koncentrace PSA. S ohledem na současné možnosti cytostatické léčby mCRPC by přítomnost neutropenie vyššího stupně a nízkého poměru počtu neutrofilů a lymfocytů v průběhu podávání cabazitaxelu mohla být spojena s lepší odpovědí na léčbu.
vyššího stupně než 3 měla pozitivní vliv nejen na celkové přežití a na délku doby do progrese onemocnění, ale také na pokles sérové koncentrace PSA. S ohledem na současné možnosti cytostatické léčby mCRPC by přítomnost neutropenie vyššího stupně a nízkého poměru počtu neutrofilů a lymfocytů v průběhu podávání cabazitaxelu mohla být spojena s lepší odpovědí na léčbu.
Závěr
Kvalitní léčba metastazujícího kastračně rezistentního karcinomu prostaty je v současné době možná jen v rámci mezioborové spolupráce. Tu představuje péče urologa, klinického onkologa, radioterapeuta a při metastatickém postižení kostí aktuálně také lékaře nukleární medicíny. Právě mezioborový tým má správně zhodnotit, pro kterého nemocného přináší konkrétní léčebná varianta zvolená z celé řady možností nejen prodloužení přežití, ale zejména dobrou kvalitu života.
Seznam použité literatury
- [1] Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidens and mortality wolrdwide: source, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136: E359–E386.
- [2] https://uroweb.org/guidelines/prostate cancer
- [3] Tannock IF, Osoba D, Stockler MRJ, et al. Chemotherapy with mitoxantrone plus prednisone or prednisone alone for symptomatic hormone -resistant prostate cancer: a Canadian randomized trial with palliative end points. J Clin Oncol 1996; 14: 1756–1764.
- [4] Tannock IF, de Wit R, Berrry WR, et al. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer. N Engl J Med 2004; 351: 1502–1512.
- [5] Sweeney Ch, Yu Hui Chen, Carducci M, et al. Chemohormonal therapy in metastatic hormone sensitive prostate cancer. N Engl J Med 2015; 373: 737–746.
- [6] Ryan CJ, Smith MR, de Bono JS, et al. Randomized phase 3 trial of abiraterone acetate in men with metastatic castration resistant prostate cancer and no prior chemotherapy. N Engl J Med 2013; 368: 138–148.
- [7] Parker C, Nilsson S, Heinrich D, et al. Alpha emitter radium 223 and survival in metastatic prostate cancer. N Engl J Med 2013; 369: 213–223.
- [8] Cha E, Fong L. Imunoterapie karcinomu prostaty: biologické a léčebné aspekty. JCO 2011; 3: 308–315.
- [9] Armstrong AJ, Tombal B, Sternberg, et al. Primary, secondary and quality of life endpoint results from PREVAIL, a phase 3 study of enzalutamide in men with metastatic castration resistant prostate cancer (mCRPC). J Clin Oncol 2014; 32: 5s.
- [10] Borso E, Boni G, Galli L, et al. Radium 223 dichloride: a multidisciplinary approach to metastatic castration resistant prostate cancer. J Multidiscip Healthc 2015; 8: 279–286.
- [11] Fizazi K, Scher HI, Molina A, et al. Abiraterone acetate for treatment of metastatic castration resistant prostate cancer: final overal survival analysis of the COU AA 301 randomised, double blind, placebo controlled phase 3 study. Lancet Oncol 2012; 13: 983–992.
- [12] Scher HI, et al. Increased survival with enzalutamide in prostate cancer after chemotherapy. N Engl J Med 2012; 367: 1187–1197.
- [13] De Bono JS, Oudard S, Ozguroglu M, et al. Cabazitaxel or mitoxantrone with prednisone in patients with metastatic castration resistant prostate cancer progressing after docetaxel treatment: a randomised open label trial. Lancet 2010; 376: 1147–1154.
- [14] Sartor AO, Oudard S, Sengelov L, et al. Cabazitaxel vs docetaxel in chemotherapy naive (CN) patients with metastatic castration resistant prostate cancer (mCRPC): A three arm phase III study (FIRSTANA). ASCO meeting 2016, Chicago, Abstract 5006.
- [15] Chi K, Hotte J, Joshua AM, et al. Treatment of mCRPC in the AR axis targeted therapy resistant state. Ann Oncol 2015; 26: 2044–2056.
- [16] Bahl A, Oudard S, Tombal S, et al. Impact of cabazitaxel on 2 year survival and palliation of tumor related pain in men with metastatic castration resistant prostate cancer treated in the TROPIC trial. Ann
- [17] Meisel A, von Felten S, Vogt RD, et al. Severe neutropenia during cabazitaxel treatment in associated with survival benefit in men with metastatic castration resistant prostate cancer (mCRPC): A post hoc analysis of the TROPIC phase III trial. Eur J Cancer 2016; 56: 93–100.