Abatacept v léčbě revmatoidní artritidy
Abatacept je molekula CTLA4 fúzovaná s částí Fc imunoglobulinu IgG1. Blokuje kostimulační signál mezi antigen prezentující buňkou a T lymfocytem a zabraňuje aktivaci, proliferaci, diferenciaci a přežívání T lymfocytů, čímž tlumí zánětlivý pochod u onemocnění, ve kterých T lymfocyty hrají důležitou úlohu, jako je např. revmatoidní artritida. Abatacept tak představuje nový typ léčby, jejíž podávání vede ke snížení aktivity nemoci, zlepšení kvality života a ke zpomalení RTG progrese onemocnění. Efekt se může objevit již po prvním podání látky, část pacientů vykazuje stálé postupné zlepšování i při dlouhodobém podávání. Bezpečnostní profil je velmi příznivý a léčivo je velmi dobře tolerováno. Abatacept je v ČR k dispozici pro pacienty, kteří mají aktivní revmatoidní artritidu navzdory tomu, že jsou léčeni léky modifikujícími průběh choroby, a u kterých selhala léčba alespoň jedním inhibitorem TNF.
Úvod
Biologická léčba revmatoidní artritidy (RA) a dalších zánětlivých onemocnění (ankylozující spondylitida, psoriatická artritida) znamenala poměrně zásadní změnu v léčebném přístupu k nemocným s těmito chorobami a řádově zlepšila úspěšnost terapie. Byla to především léčba cílená na blokádu TNF-a (tumor nekrotizující faktor a) monoklonálními protilátkami infliximabem a adalimumabem nebo solubilním receptorem etanerceptem, která v průběhu 90. let minulého století v klinických hodnoceních prokázala významný přínos a efektivitu [1–3]. Tato léčba se nyní stala poměrně běžným přístupem. Rutinní používání umožnilo analyzovat dlouhodobé efekty a dopady antiTNF terapie a ukázalo, že část nemocných nevykazuje dostatečnou odpověď či že se efekt sníží v průběhu léčby nebo se u pacientů vyvinou vedlejší nežádoucí reakce. Tak např. v klinickém hodnocení BeST, ve kterém dostávali nemocní s časnou RA infliximab a methotrexát, selhala antiTNF terapie u 25 % pacientů a nebyl splněn rigorózně kontrolovaný pokles aktivity ve skóre DAS44 (Disease Activity Score in 44 joints) pod 2,4 [4]. V případech dlouhodobých registrů jsou čísla ještě vyšší, např. ve skandinávské databázi selhala antiTNF léčba až u 30 % nemocných [5]. Část nemocných mění s úspěchem léčivo blokující TNF, i když se zdá, že první výměna je efektivnější než následující další [6]. Jak v běžné praxi asi skutečně vypadá osud nemocných s RA léčených inhibitory TNF, ukazuje prospektivní analýza britského registru 6739 nemocných [7]. Po 15 měsících ukončilo tuto terapii 35 % nemocných, z toho 12 % pro neúčinnost, 15 % pro nežádoucí účinky a zbytek z jiných důvodů. Překvapující bylo, že léčbu druhým inhibitorem TNF zahájilo jen 46 % těchto nemocných – 60 % z nich tvořili pacienti, kteří léčbu prvním inhibitorem TNF ukončili pro neúčinnost, a jen 35 % bylo těch, kteří ji ukončili pro vedlejší nežádoucí účinky. Po 15 měsících tedy zůstalo 1084 pacientů (16 % z původního počtu) neléčených biologickou léčbou. Kritéria pro antiTNF léčbu ve Velké Británii jsou poměrně striktní, tato léčba je indikována jen nemocným s vysoce aktivní chorobou. Znamená to, že u všech těchto 1084 nemocných selhává klasická terapie bazálními antirevmatiky a pacienti potřebují další stupeň léčby. V této indikaci se nyní nabízejí dvě odlišné možnosti. Jednou z nich je monoklonální protilátka proti CD20 molekule – rituximab, který vede k eliminaci B lymfocytů a vykazuje efekt na snížení aktivity RA a na zpomalení vývoje destruktivních změn hodnocených na RTG [8–10]. Druhá možnost je zaměřena na snížení aktivity imunitního systému blokádou kostimulačních dějů mezi imunokompetentními buňkami. V roce 2005 byl v USA a nyní v roce 2007 i v Evropě schválen a zaveden do léčby abatacept, který snižuje aktivitu revmatoidní artritidy a zpomaluje její radiologickou progresi. Tento článek se zabývá nejdůležitějšími údaji, jež se týkají abataceptu a jeho účinnosti a bezpečnosti.
Mechanismus účinku
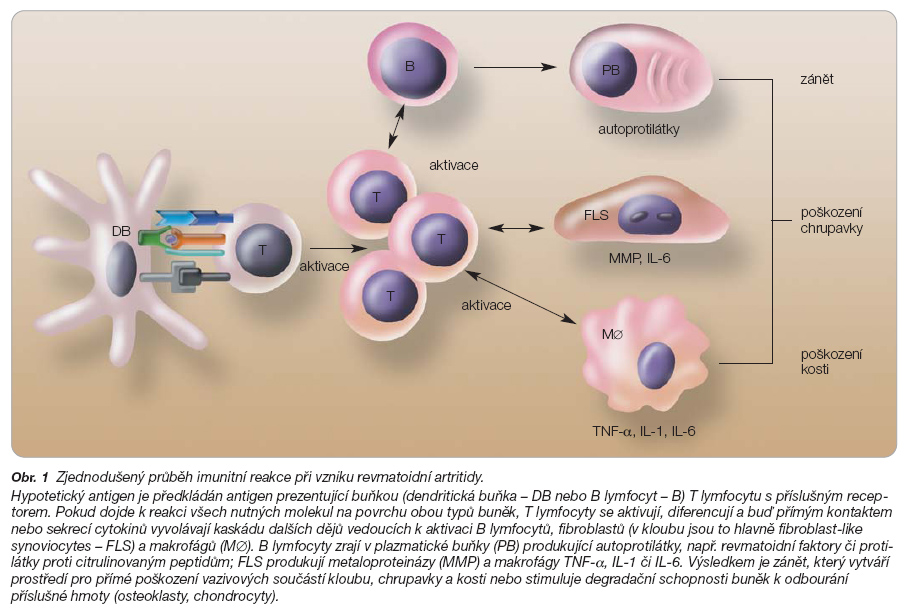
Revmatoidní artritida vzniká v důsledku špatně kontrolovaných imunitních dějů v kloubu a v periferních lymfoidních orgánech (obr. 1).
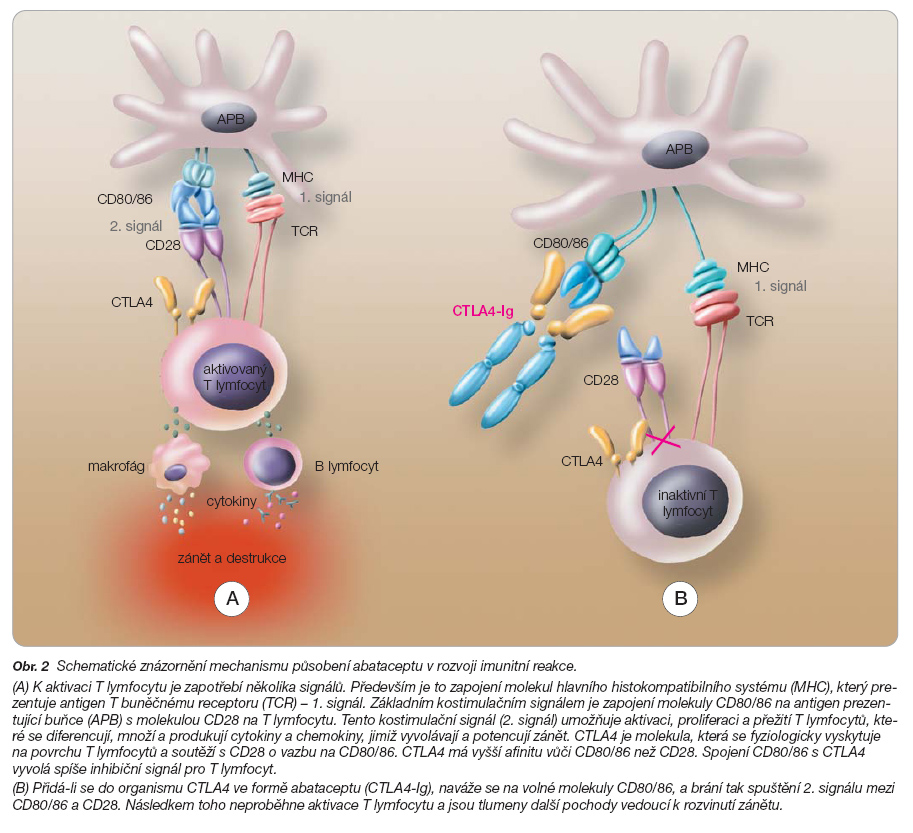
Abatacept je fúzovaný protein skládající se z extracelulární domény molekuly CTLA4 (cytotoxic T-lymphocyte-associated antigen-4) a z modifikované Fc části lidského IgG1 (CTLA4-Ig). Abatacept blokuje důležitý kostimulační signál mezi antigen prezentující buňkou a T lymfocytem, čímž zabraňuje aktivaci a proliferaci T lymfocytů a rozvoji imunitní reakce (obr. 2) [11].
T lymfocyty, a zejména stimulované Th1 lymfocyty, jsou dlouhodobě obviňovány z rozvoje a udržování zánětlivé reakce v revmatoidní tkáni. Úroveň zásahu abataceptu na tyto buňky je zde zcela jiná než úroveň zásahu antiTNF terapie či léčby cílené na B lymfocyty, a postihuje tedy jinou část patogenetického řetězce.
Farmakodynamika a farmakokinetika
V klinických hodnoceních léčby abataceptem při dávkování kolem 10 mg/kg docházelo k poklesu sérových hladin receptoru pro interleukin 2 (IL-2R), k poklesu sérových hladin interleukinu 6 (IL-6), revmatoidních faktorů, CRP, ke snížení koncentrace tkáňové metaloproteinázy 3 (MMP3) a TNF-a [12, 13].
Při dávkování 10 mg/kg bylo dosaženo ustáleného stavu do 60. dne léčby s průměrnou nejnižší hladinou 24 (1–66) mg/ml. U nemocných s RA nebyla nalezena akumulace abataceptu po opakovaných infuzích v dávce 10 mg/kg podané jednou měsíčně. Poločas abataceptu je u nemocných s RA 13,1 (8–25) dne [12, 13]. Populační farmakokinetické analýzy ukázaly, že existuje trend k poněkud vyššímu odstraňování abataceptu z organismu se stoupající tělesnou hmotností. Na hladiny abataceptu nemá vliv současné podávání methotrexátu, nesteroidních antirevmatik, glukokortikoidů a látek blokujících TNF.
Klinická hodnocení
Bylo provedeno několik randomizovaných, dvojitě slepých, placebem kontrolovaných klinických hodnocení u pacientů s aktivní RA, jež se zabývala účinností a bezpečností abataceptu u nemocných s nedostatečnou odpovědí na methotrexát [14–16] nebo u těch, kteří neodpovídali na léčbu antagonisty TNF [17]. Tato klinická hodnocení a výsledky několika dalších studií (souhrn viz [18]) popisují následující odstavce.
Klinická hodnocení fáze 2
První bylo pilotní dávkové hodnocení v dvojitě slepé, placebem kontrolované studii k určení bezpečnosti a předběžně i účinnosti u 214 nemocných s RA, kteří nevykazovali dostatečnou odpověď na alespoň jeden lék modifikující průběh choroby [19]. Pacienti dostali placebo nebo i.v. infuze abataceptu (0,5, 2,0, nebo 10 mg/kg) jako monoterapii ve dnech 1, 15, 29 a 57. Závěry hodnocení ukázaly velmi dobrou bezpečnost léčby a toleranci stejnou ve všech dávkovacích režimech. V den 85 byla odpověď (změna v příznacích a známkách) dle ACR20 (20% zlepšení v kritériích podle Americké koleje revmatologů) 23 %, 44 % a 53 % pro aktivní látku v jednotlivých dávkách a 31 % pro placebo.
Následovalo 12měsíční dvojitě slepé hodnocení fáze 2b u 339 nemocných, kteří trpěli aktivní RA navzdory podávanému methotrexátu [14, 15]. Hlavním účelem bylo srovnání dvou dávek abataceptu (2 mg/kg a 10 mg/kg) v kombinaci s methotrexátem a porovnání této léčby s placebem. Po 6 měsících bylo ACR20 42 % a 60 % v případě léčby abataceptem a 35 % při podávání placeba. Po 12 měsících bylo ACR20 při léčbě abataceptem v dávce 10 mg/kg významně vyšší než při podávání placeba (63 % vs. 36 %). Nemocní, kteří dostávali abatacept, vykazovali také klinicky i statisticky významné zlepšení v kvalitě života. Lepší výsledky byly dosaženy s dávkou 10 mg/kg abataceptu, a proto bylo toto dávkování použito ve všech dalších hodnoceních fáze 3.
Recentní klinické hodnocení fáze 2 porovnalo klinickou účinnost abataceptu (2 mg/kg) proti placebu u 121 pacientů s RA, u kterých nenastala dostatečná odpověď na léčbu etanerceptem a kteří v této terapii pokračovali [20]. Po 6 měsících byl zaznamenán jen marginální efekt kombinované terapie proti placebu (ACR20 48 % vs. 31 % a ACR50 26 % vs. 19 %), a ani zvýšení dávky abataceptu v další extenzi na 10 mg/kg nevedlo k významnějšímu zlepšení. Kombinace etanercept a abatacept však přinesla vyšší počet závažných nežádoucích účinků (16,5 % vs. 2,8 %), včetně těch infekčních (3,5 % vs. 0 %).
Klinická hodnocení fáze 3
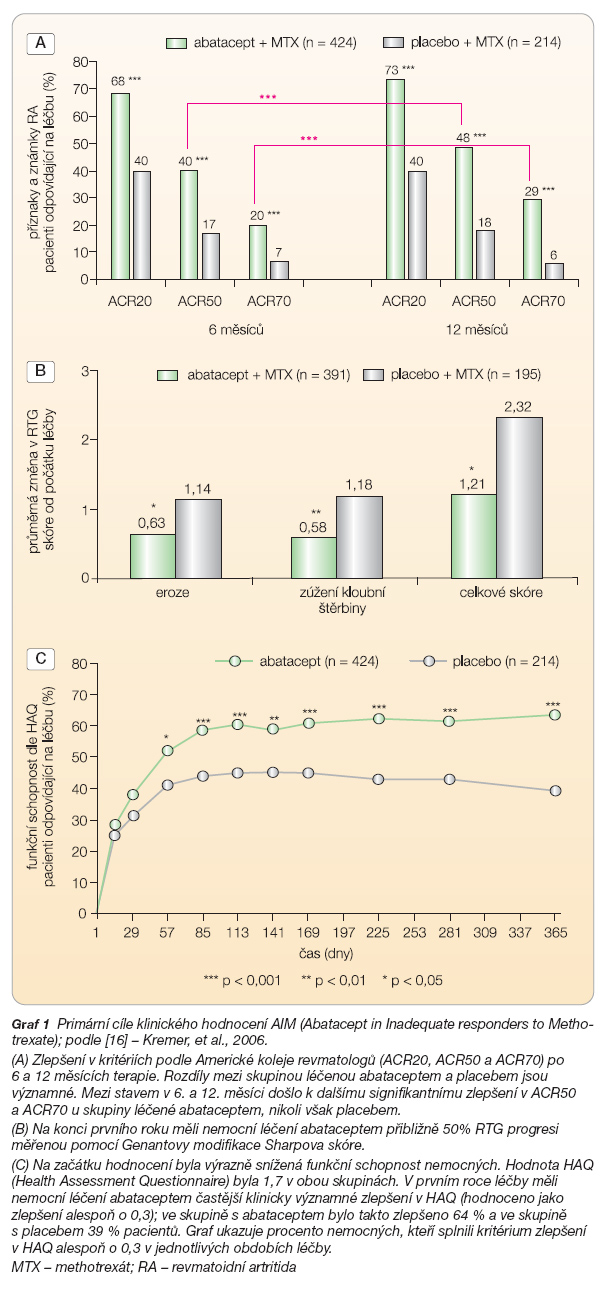
Základním klinickým hodnocením pro abatacept je jednoroční studie AIM (Abatacept in Inadequate responders to Metho-trexate) [16]. AIM bylo dvojitě slepé hodnocení u 652 nemocných s aktivní revmatoidní artritidou, kterou nemocní trpěli navzdory tomu, že byli léčeni methotrexátem. Podmínkou zařazení do studie byla značnáaktivita nemoci, bylo vyžadováno alespoň 10 oteklých a 12 bolestivých kloubů a průkaz laboratorní aktivity zvýšením CRP nad 1 mg/dl. Pacienti dostali abatacept v dávce cca 10 mg/kg (n = 433) ve dnech 1, 15 a 29, a dále každé 4 týdny po dobu 12 měsíců, nebo dostávali placebo (n = 219). Všichni pokračovali v léčbě methotrexátem. Tři primární hodnotící kritéria byla: změna v příznacích a známkách RA po 6 měsících (ACR20), zpomalení RTG progrese (Sharpovo skóre modifikované Genantem) a fyzická schopnost (HAQ – Health Assessment Questionnaire) po 1 roce léčby. Abatacept byl efektivnější než placebo ve všech těchto parametrech (graf 1 A–C).
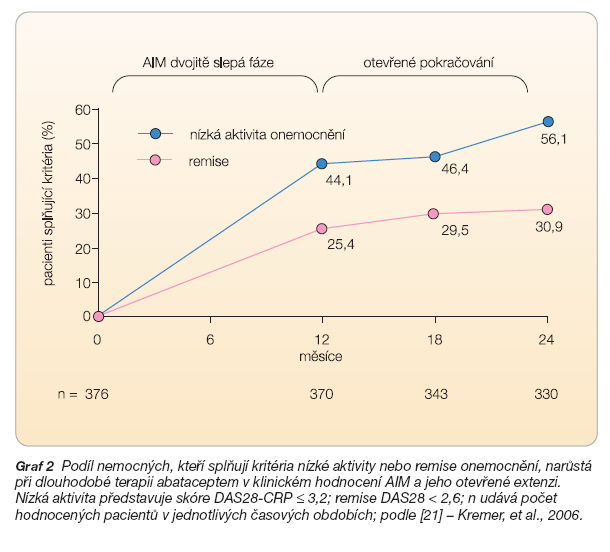
Mezi sekundární cíle patřilo také zlepšení v kvalitě života po jednom roce. Kvalita života byla měřena dotazníkem SF-36 a ve skupině s abataceptem stoupla ve fyzické komponentě dotazníku o 9,1, zatímco ve skupině s placebem pouze o 5,0 (p < 0,001) a v mentální komponentě to bylo o 6,9 a 4,7 (p < 0,05). Po prvním roce pokračovali pacienti v otevřeném hodnocení, všem byl přidán k metho-trexátu abatacept v dávce 10 mg/kg. Předběžná hodnocení ukazují na dobré udržení klinické odpovědi podle kritérií ACR, udržení zlepšení fyzického stavu a pomalejší RTG progresi. Ukazuje se zde také, že počet dobře odpovídajících nemocných na léčbu stoupá i během druhého roku [21] (graf 2)
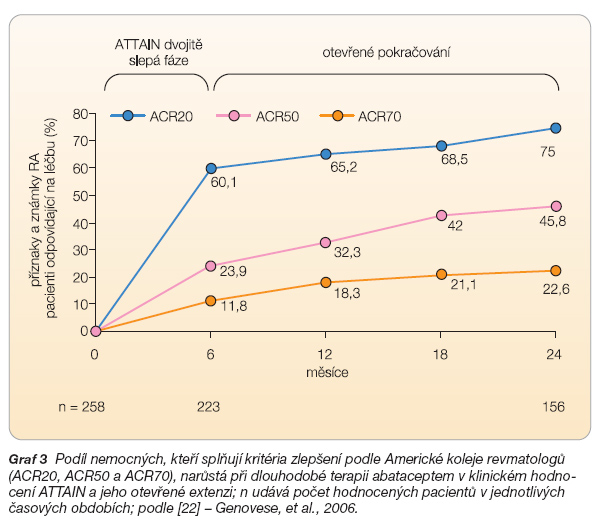
a tento trend je konzistentní ve všech klinických hodnoceních provedených s abataceptem (graf 3) [22].
Více než třetina nemocných léčených abataceptem, kteří měli po 6 měsících léčby nízkou aktivitu v Disease Activity Score 28 (DAS28 ≤ 3,2), dosáhla po roční léčbě remise (DAS28 < 2,6), zatímco v placebové skupině se takto nezlepšil žádný pacient [23]. Incidence nežádoucích účinků v klinickém hodnocení AIM byla přibližně stejná ve skupině s abataceptem jako ve skupině s placebem (87,3 % vs. 84 %).
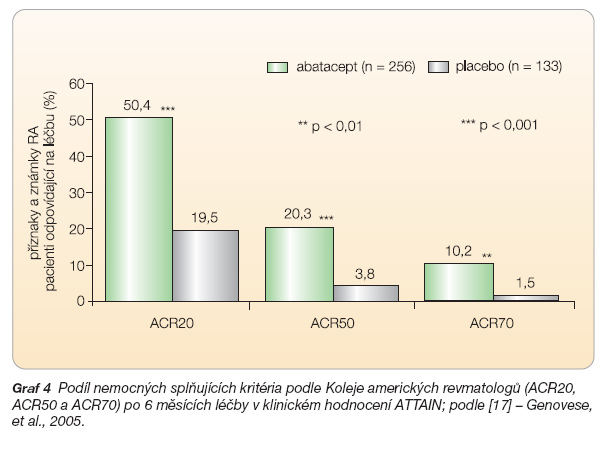
ATTAIN (Abatacept Trial in Treatment of Anti-TNF INadequate Responders) bylo 6měsíční dvojitě slepé hodnocení u 391 nemocných s aktivní RA s nedostatečnou odpovědí na léčbu blokátory TNF [17]. Pacienti dostávali abatacept (10 mg/kg, n = 258) nebo placebo (n = 133) do dne 141. Účastníci studie ukončili léčbu etanerceptem alespoň 28 dnů nebo infliximabem alespoň 60 dnů před zahájením podávání abataceptu a antiTNF léčba musela být podávána v minulosti alespoň po dobu 3 měsíců. Nemocní museli mít také stabilní léčbu některým z léků modifikujících průběh choroby – ve většině případů (75–82 %) pokračovali léčbou methotrexátem (v dávce kolem 15 mg týdně). Primární cíle byly dva – hodnocení ACR20 a hodnocení fyzických schopností (HAQ) po 6 měsících. Zlepšení po 6 měsících bylo významně větší pro nemocné léčené abataceptem (graf 4).
Podobně jako v hodnocení AIM bylo zlepšení v ACR20 patrné již po první infuzi. Fyzické schopnosti měřené indexem HAQ byly významně zlepšeny (o více než 0,3) u 47,3 % pacientů léčených abataceptem a u 23,3 % léčených placebem (p < 0,001). Abatacept také vedl ke statisticky významnému zlepšení ve všech aspektech kvality života měřené pomocí dotazníku SF-36 (Short Form 36). K předčasnému ukončení léčby z důvodů nežádoucích účinků došlo ve 3,5 % v případě abataceptu a ve 3,8 % u placeba, v případě závažných nežádoucích účinků to bylo 2,7 % a 1,5 %. Dlouhodobá otevřená extenze této studie ukazuje stoupající počet nemocných, kteří příznivě reagovali na abatacept (graf 3) [22].
Klinické hodnocení ASSURE (Abatacept Study of Safety in Use with other Rheumatoid arthritis thErapies) hodnotilo abatacept v dávkování 10 mg/kg u 1441 pacientů s aktivní RA, kteří nedostatečně reagovali na léčbu biologickými i nebiologickými léky modifikujícími průběh choroby [24]. Mezi biologickými léky byly zahrnuty infliximab, etanercept, adalimumab a anakinra a všechny biologické i nebiologické modifikující léky byly podávány v průběhu 12měsíčního hodnocení. Cílem této studie bylo především hodnocení bezpečnosti léčby. Pacienti byli randomizováni v poměru 2 : 1 do skupin s abataceptem a placebem. V obou těchto skupinách byly pozorovány podobné frekvence nežádoucích účinků (90 % a 87 %), závažných vedlejších nežádoucích účinků (13 % a 12 %) a ukončení z důvodů nežádoucích účinků (5 % a 4 %). Pět pacientů (0,5 %) ve skupině s abataceptem a 4 pacienti (0,8 %) ve skupině s placebem zemřeli během hodnocení. Vážné infekce byly častější ve skupině s abataceptem než s placebem (2,9 % vs. 1,9 %). Tento fakt byl způsoben především častější frekvencí vážných infekcí ve skupině léčené kombinací abatacept/biologická terapie (5,8 %) než ve skupině s kombinací abatacept/nebiologické léky (2,6 %). V malé podskupině pacientů, kteří dostávali abatacept současně s anakinrou, byly vážné infekce ještě častější (7,7 % vs. 0 %). Celkové hodnocení ukázalo, že závažné vedlejší nežádoucí účinky byly častější v podskupině s biologickou terapií (22,3 %) než v jiných podskupinách (11,7–12,5 %). Tento fakt je také jedním z nejsilnějších podkladů pro doporučení nepodávat abatacept současně s jinými biologickými léky.
Nová hodnocení léčby abataceptem
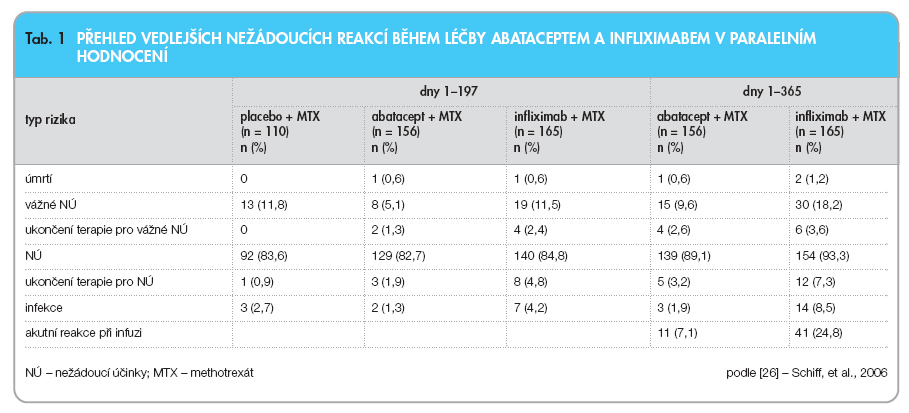
Abatacept byl také porovnáván s léčbou infliximabem. Agentura EMEA (European Medicines Agency) si vyžádala porovnání bezpečnosti těchto dvou způsobů léčby. Nešlo o přímé porovnání (head-to-head study), ale o 2 paralelní studie. Pacientům s RA, kteří nedostatečně reagovali na podávání methotrexátu, byl k této léčbě přidán abatacept v dávce 10 mg/kg v obvyklých časových intervalech (n = 156) nebo infliximab v doporučeném dávkování 3 mg/kg ve dnech 1, 15, 43 a 85, a dále pak každých 56 dnů (n = 165) anebo placebo (n = 110) [25, 26]. Po 6 měsících začal být podáván abatacept i nemocným z původní skupiny s placebem (tito pacienti nejsou zahrnuti do 12měsíční analýzy). Primárním cílem byla změna v aktivitě nemoci měřená pomocí skóre DAS28 po šestiměsíční léčbě. Pokles v DAS28 byl -2,53, -2,25 a -1,48 ve skupinách s abataceptem, infliximabem a placebem po 6 měsících (p < 0,001 pro aktivní léčbu vs. placebo), a -2,88 a -2,25 pro skupiny s abataceptem a infliximabem po jednom roce. Ve skupině s abataceptem byl registrován nižší počet závažných vedlejších nežádoucích účinků, včetně infekcí a infuzních reakcí, především při srovnání po jednom roce léčby (tab. 1).
Hodnocení studie ARRIVE fáze 3b týkající se bezpečnosti bylo otevřené a trvající 6 měsíců u nemocných, kteří dostali abatacept, jestliže u nich selhala antiTNF terapie [27]. Byly srovnány bezpečnostní údaje u 370 pacientů, kteří ukončili antiTNF léčbu více než 2 měsíce předtím, než začali užívat abatacept, s těmi (n = 472), kteří zahájili léčbu abataceptem hned po skončení antiTNF léčby. Pacienti měli značně aktivní onemocnění vyjádřené hodnotou 6,2 ve skóre DAS28. Po 6 měsících se obě skupiny nelišily v počtu nežádoucích účinků, ani závažných, v četnosti přerušení léčby, v počtu infekcí, neoplazmat či úmrtí. Z uvedeného sledování vyplývá, že léčba abataceptem může být zahájena prakticky okamžitě po skončení terapie léky blokujícími TNF.
Nežádoucí účinky a kontraindikace
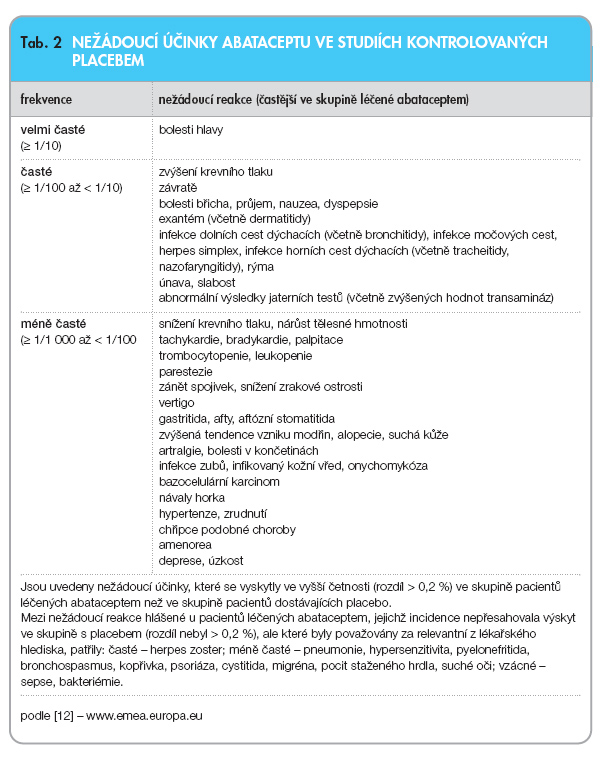
Posouzení rizik léčby na základě pěti dvojitě slepých klinických hodnocení, která zahrnují více než 2000 pacientů, ukázalo na bezpečnost a dobrou toleranci abataceptu, pokud je podáván s nebiologickými léky modifikujícími průběh choroby. V kontrolovaných klinických studiích s abataceptem byly nežádoucí reakce na lék hlášeny u 52,2 % pacientů léčených abataceptem a u 46,1 % pacientů dostávajících placebo. Mezi nejčastěji hlášené nežádoucí reakce (≥ 5 %) ve skupině pacientů léčených abataceptem patřily bolesti hlavy a nevolnost. V důsledku nežádoucích reakcí přerušilo léčbu 3,4 % pacientů ve skupině léčené abataceptem a 2,2 % ve skupině dostávající placebo.
Infekce a vážné infekce byly hlášeny u 23,2 % a 1,8 % pacientů léčených abataceptem a u 19,5 % a 1 % pacientů dostávajících placebo. Vážné infekce hlášené alespoň u jednoho pacienta léčeného abataceptem (0,05 % pacientů) byly: pneumonie, bronchitida, celulitida, akutní pyelonefritida, infekce močových cest, divertikulitida, intestinální absces, lokalizovaná infekce, kožní absces, muskuloskeletální infekce, sepse, empyém, hepatitida E a tuberkulóza. V zásadě nebyl při léčbě abataceptem pozorován zvýšený výskyt tuberkulózy, nicméně před zahájením léčby se doporučuje vyšetřit pacienty kvůli latentní tuberkulóze. Jako u jiné imunosupresivní terapie hrozí možnost reaktivace hepatitidy B, a proto je nutné před zahájením léčby abataceptem provést adekvátní vyšetření.
V klinických studiích kontrolovaných placebem byl výskyt malignit ve skupině s abataceptem 1,4 % a ve skupině s placebem 1,1 %. V dvojitě zaslepených a otevřených klinických studiích byly malignity hlášeny u 66 z 2688 pacientů léčených abataceptem v průběhu 4764 pacientoroků. Hlášené případy zahrnovaly 33 pacientů s nemelanomovým karcinomem kůže, 28 pacientů se solidním nádorem orgánů a 6 pacientů s hematologickými malignitami (4 s lymfomem a 2 s myelodysplastickými syndromy). Mezi nejčastěji hlášené solidní nádory orgánů patřila rakovina plic (11 případů). Typ a charakter malignit hlášených v průběhu otevřeného období studií byl podobný malignitám hlášeným při dvojitě zaslepených studiích. Počet pozorovaných malignit odpovídal počtu očekávanému v dané populaci pacientů s revmatoidní artritidou příslušného věku a pohlaví. Je zapotřebí zdůraznit skutečnost, že u RA je obecně znám zvýšený výskyt lymfomů, který souvisí se zánětlivou aktivitou onemocnění [28].
Akutní příhody související s infuzí byly častější u pacientů, jimž byl podáván abatacept (9,8 %), než u pacientů, jimž bylo podáváno placebo (6,7 %). Mezi nejčastější příhody hlášené ve skupině s abataceptem (1–2 %) patřily závratě, bolesti hlavy a hypertenze, méně časté byly hypotenze, zvýšení krevního tlaku, snížení krevního tlaku, dušnost, nauzea, zrudnutí, kopřivka, kašel, hypersenzitivita, svědění, vyrážka a dušnost. Většinou šlo o reakce mírné až středně závažné. K přerušení léčby v důsledku akutní reakce, která souvisela s infuzí, došlo u 0,4 % pacientů užívajících abatacept a u 0,2 % pacientů užívajících placebo.
Abatacept by měl být používán s opatrností rovněž u nemocných s chronickou obstrukční plicní nemocí (CHOPN), protože u těchto pacientů se častěji vyskytovaly respirační poruchy (10,8 % vs. 5,9 % u placeba). K vážné nežádoucí reakci došlo u pacientů s CHOPN, ve vyšším procentu ve skupině pacientů léčených abataceptem než ve skupině léčené placebem (5,4 % oproti 0 %); včetně exacerbace CHOPN [22].
Častější výskyt nežádoucích účinků a infekcí především při kombinaci abataceptu s biologickými léky byl zmíněn výše při popisu studie ASSURE [22].
Indikace a podávání abataceptu
Schválené indikace se poněkud liší mezi USA a Evropou. V USA bylo podávání abataceptu schváleno 23. prosince 2005 s indikací pro redukci známek a příznaků revmatoidní artritidy, indukci významné klinické odpovědi, zpomalení progrese strukturálního poškození a pro zlepšení fyzických funkcí u dospělých pacientů se středně až silně aktivní RA, kteří neodpovídali dostatečně na léčbu jedním či více léky modifikujícími průběh choroby, jako je methotrexát či antagonisté TNF. Abatacept může být použit samostatně nebo současně s léky modifikujícími průběh choroby jinými, než jsou antagonisté TNF. Vysloveně se uvádí, že lék by neměl být podáván dohromady s antagonisty TNF a není ani doporučen k současné léčbě s anakinrou.
V Evropě a v ČR je indikace podobná s tou výjimkou, že je požadováno předcházející selhání léčby alespoň jedním z léků blokujících TNF.
Abatacept je podáván formou 30minutové intravenózní infuze v dávkách 500 mg u pacientů s tělesnou hmotností < 60 kg, v dávce 750 mg při hmotnosti 60–100 kg a v dávce 1000 mg u nemocných s hmotností >100 kg. Podává se ve dnech 1, 15 a 29, dále pak každých 28 dní.
Indikace abataceptu podle EMEA (platí v ČR)
Abatacept je v kombinaci s methotrexátem indikován k léčbě střední až těžké aktivní revmatoidní artritidy u dospělých pacientů, kteří měli nedostatečnou odpověď nebo netolerovali jiné bazální antirevmatikum, včetně alespoň jednoho inhibitoru TNF. Při kombinované léčbě abataceptem a methotrexátem bylo prokázáno snížení progrese poškození kloubů a zlepšení fyzické funkce.
Závěr
Abatacept je v ČR k dispozici pro pacienty, kteří mají aktivní revmatoidní artritidu navzdory tomu, že jsou léčeni léky modifikujícími průběh choroby, a selhala u nich léčba alespoň jedním inhibitorem TNF. Abatacept představuje nový typ léčby, který cílí na spolupráci buněk na úrovni prezentace antigenu a snižuje aktivaci a diferenciaci T lymfocytů. Jeho podávání vede ke snížení aktivity nemoci, zlepšení v kvalitě života a zpomalení RTG progrese onemocnění. Efekt se objevuje celkem rychle, u části nemocných již po prvním podání. Část pacientů vykazuje stálé postupné zlepšování i při dlouhodobém podávání. Bezpečnostní profil je velmi příznivý a lék je velmi dobře tolerován.
Revmatoidní artritida je heterogenní onemocnění s variabilní účastí jednotlivých patogenetických mechanismů v individuálních případech a abatacept obohacuje terapeutickou paletu směrem ke specifickému postihnutí té patogenetické cesty, která může být u daného pacienta nejvýznamnější a kterou ostatní terapeutika buď neovlivňují, nebo ji ovlivňují v málo specifické míře. Představuje tak naději pro efektivní léčbu řady pacientů.
Seznam použité literatury
- [1] Lipsky PE, van der Heijde DMFM, St. Clair EW, et al. Infliximab and methotrexate in the treatment of rheumatoid arthritis. New Engl J Med 2000; 22: 1594–1602.
- [2] Bathon JM, Martin RW, Fleischman RM, et al. A comparison of etanercept and methotrexate in patients with early rheumatoid arthritis. New Engl J Med 2000; 22: 1586–1593.
- [3] Weinblatt ME, Keystone EC, Furst DE, et al. Adalimumab, a fully human anti-tumor necrosis factor alpha monoclonal antibody, for the treatment of rheumatoid arthritis in patients taking concomitant methotrexate: the ARMADA trial. Arthritis Rheum 2003; 48: 35–45.
- [4] van der Bijl AE, Goekoop-Ruiterman YPM, de Vries-Bouwstra JK, et al. Infliximab and methotrexate as introduction therapy in patients with early rheumatoid arthritis. Arthritis Rheum 2007; 56: 2129–2134.
- [5] van Vollenhoven RF, Askling J. Rheumatoid arthritis registries in Sweden. Clin Exp Rheumatol 2005; 23 (Suppl. 39): S195–200.
- [6] Gomez-Reino JJ, Carmona L; BIOBADASER Group. Switching TNF antagonists in patients with chronic arthritis: an observational study of 488 patients over a four-year period. Arthritis Res Ther 2006; 8: R29.
- [7] Hyrich KL, Lunt M, Watson KD, et al; British Society for Rheumatology Biologics Register. Outcomes after switching from one anti-tumor necrosis factor alpha agent to a second anti-tumor necrosis factor alpha agent in patients with rheumatoid arthritis: results from a large UK national cohort study. Arthritis Rheum 2007; 56: 13–20.
- [8] Edwards JCW, Szczepanski L, Szechinski J, et al. The efficacy of B-cell-targeted therapy with rituximab in patients with rheumatoid arthritis. N Engl J Med 2004; 350: 2572–2581.
- [9] Emery P, Fleischmann R, Filipowicz-Sosnowska A, et al. The efficacy and safety of rituximab in patients with active rheumatoid arthritis despite methotrexate treatment. Results of a phase IIb randomized, double-blind, placebo-controlled, dose-ranging trial. Arthritis Rheum 2006; 54: 1390–1400.
- [10] Cohen SB, Emery P, Greenwald MW, et al. Rituximab for rheumatoid arthritis refractory to anti-tumor necrosis factor therapy: Results of a multicenter, randomized, double-blind, placebo-controlled, phase III trial evaluating primary efficacy and safety at twenty-four weeks. Arthritis Rheum 2006; 54: 2793–806.
- [11] Linsley PS, Brady W, Urnes M, et al. CTLA-4 is a second receptor for the B cell activation antigen B7. J Exp Med 1991; 174: 561–569.
- [12] Bristol-Myers Squibb. ORENCIA. Product information. www.emea.europa.eu.
- [13] Bristol-Myers Squibb. Orencia (abatacept) prescribing information. www.orencia.com.
- [14] Kremer JM, Westhovens R, Leon M, et al. Treatment of rheumatoid arthritis by selective inhibition of T-cell activation with fusion protein CTLA4Ig. N Engl J Med 2003; 349: 1907–1915.
- [15] Kremer JM, Dougados M, Emery P, et al. Treatment of rheumatoid arthritis with the selective costimulation modulator abatacept: twelve month results of a phase IIb, double-blind, randomized, placebo-controlled trial. Arthritis Rheum 2005; 52: 2263–2271.
- [16] Kremer J, Genant H, Moreland L, et al. Effects of abatacept in patients with methotrexate-resistant active rheumatoid arthritis: a randomized trial. Ann Intern Med 2006; 144: 865–876.
- [17] Genovese MC, Becker J-C, Schiff M, et al. Abatacept for rheumatoid arthritis refractory to tumor necrosis factor a inhibition. N Engl J Med 2005; 353: 1114–1123.
- [18] Lundquist L. Abatacept: a novel therapy approved for the treatment of patients with rheumatoid arthritis. Adv Ther 2007; 24: 333–345.
- [19] Moreland LW, Alten R, Van den Bosch F, et al. Costimulatory blockade in patients with rheumatoid arthritis: a pilot, dose-finding, double-blind, placebo-controlled clinical trial evaluating CTLA-4Ig and LEA29Y eighty-five days after the first infusion. Arthritis Rheum 2002; 46: 1470–1479.
- [20] Weinblatt M, Schiff M, Goldman A, et al. Selective co-stimulation modulation using abatacept in patients with active rheumatoid arthritis while receiving etanercept: a randomized clinical trial. Ann Rheum Dis 2007; 66: 228–234.
- [21] Kremer J, Westhovens R, Russell A. Long-term efficacy of abatacept through 2 years of treatment in rheumatoid arthritis patients in the AIM trial. Arthritis Rheum 2006; 54 (Suppl.): S247.
- [22] Genovese MC, Schiff M, Luggen M, et al. Sustained efficacy and safety through 2 years in patients with rheumatoid arthritis (RA) in the long-term extension of the ATTAIN trial. Arthritis Rheum 2006; 54 (Suppl.): S244.
- [23] Dougados M, Emery P, Westhovens R, et al. Abatacept provides increasing improvements in clinical measures of disease activity over time: results from the AIM trial. Ann Rheum Dis 2007; 66 (Suppl. II): 429.
- [24] Weinblatt M, Combe B, Covucci A, et al. Safety of the selective costimulation modulator abatacept in rheumatoid arthritis patients receiving background biologic and nonbiologic disease-modifying antirheumatic drugs: A one-year randomized, placebo-controlled study. Arthritis Rheum 2006; 54: 2807–2816.
- [25] Dougados M, Keiserman M, Codding C, et al. Efficacy of abatacept or infliximab in rheumatoid arthritis patients with an inadequate response to methotrexate: results from a 1-year double-blind, randomised, placebo-controlled trial. Ann Rheum Dis 2007; 66 (Suppl. II): 88.
- [26] Schiff M, Keiserman M, Codding C, et al. The efficacy and safety of abatacept or infliximab in RA patients with an inadequate response to MTX: results from a 1-year double-blind, randomized, placebo-controlled trial. Arthritis Rheum 2006; 54 (Suppl.): L43.
- [27] Schiff M, Pritchard C, Teng J, et al. The safety of abatacept in patients with active rheumatoid arthritis and an inadequate response to anti-TNF therapy: results from the ARRIVE trial. Ann Rheum Dis 2007; 66 (Suppl. II): 89.
- [28] Baecklund E, Iliadou A, Askling J, et al. Association of chronic inflammation, not its treatment, with increased lymphoma risk in rheumatoid arthritis. Arthritis Rheum 2006; 54: 692–701.