Adalimumab v léčbě uveitid
Key words: non‑infection uveitis, intraocular inflammation, immunosuppression, biologic agents.
Úvod
Uveitida neboli nitrooční zánět je zrak ohrožující onemocnění. Může se jednat o izolované oční postižení nebo může být uveitida spojena se systémovým onemocněním. Incidence uveitidy je 17–52 případů na 100 000 obyvatel/rok a je zodpovědná za 5–10 % slepoty ve vyspělých zemích [1–4]. Základem léčby jsou v případě neinfekční uveitidy kortikoidy. Pro jejich časté nežádoucí účinky se stále více uplatňují tzv. kortikoidy šetřící léky, mezi které patří kromě imunosupresiv i látky ze skupiny antagonistů prozánětlivého cytokinu tumor nekrotizujícího faktoru alfa (TNFα) [5,6]. Tumor nekrotizující faktor alfa hraje klíčovou úlohu v patogenezi nitroočního zánětu, pacienti s uveitidou mají zvýšené koncentrace TNFα v nitrooční tekutině i v séru [7]. Adalimumab je rekombinantní humánní monoklonální protilátka ze skupiny anti TNFα a je indikován u závažných případů neinfekční uveitidy. Adalimumab je schválen pro léčbu neinfekční uveitidy intermediální, zadní a panuveitidy u dospělých a u neinfekční chronické přední uveitidy u dětí.
Klinické hodnocení
Účinnost a bezpečnost léčby adalimumabem byla prokázána ve dvou multicentrických, randomizovaných, placebem kontrolovaných, dvojitě zaslepených studiích u aktivní (VISUAL I) i neaktivní (VISUAL II) neinfekční intermediální a zadní uveitidy a panuveitidy dospělých [8]. Adalimumab významně snížil riziko selhání léčby o 50 % (VISUAL I), resp. o 43 % (VISUAL II) v porovnání s placebem. U pacientů s aktivní uveitidou léčba adalimumabem signifikantně snížila aktivitu uveitidy, což bylo hodnoceno na základě buněčné reakce v přední komoře, zkalení sklivce, hodnoty nejlépe korigované zrakové ostrosti a vývoje nových zánětlivých lézí na fundu. U pacientů s inaktivní uveitidou léčba adalimumabem vedla k signifikantnímu snížení poklesu nejlépe korigované zrakové ostrosti. V ostatních parametrech (buněčná reakce v přední komoře, zkalení sklivce, vznik nových zánětlivých lézí na fundu) nebylo dosaženo statistické významnosti oproti placebu.
Výhodná je kombinace adalimumabu s imunosupresivy, která vedle konkomitantního účinku také snižuje tvorbu protilátek proti adalimumabu. Ramanan a kol. [9] prokázali vyšší účinnost léčby v kombinaci s metotrexátem u pacientů s juvenilní idiopatickou artritidou.
Účinky
Adalimumab patří do skupiny anti TNFα – antagonistů TNFα, na který se vážou s vysokou afinitou. Tumor nekrotizující faktor alfa je zodpovědný za přímou zánětlivou odpověď v mnoha tkáních u autoimunitních onemocnění. Adalimumab po navázání na TNFα neutralizuje jeho biologickou funkci blokováním interakce s p55 a p75 TNF receptorů na povrchu buněk.
Adalimumab rovněž moduluje biologickou odpověď, která je indukována nebo regulována TNFα, včetně změn koncentrací adhezních molekul zodpovědných za migraci leukocytů (ELAM 1, VCAM 1 a ICAM 1).
V porovnání s výchozím stavem dochází účinkem adalimumabu k rychlému poklesu hodnot ukazatelů akutní fáze zánětu (C reaktivní protein [CRP] a sedimentace erytrocytů [FW]) a sérových cytokinů (IL 6).
Po jednorázovém subkutánním podání dávky 40 mg adalimumabu bylo vrcholových sérových koncentrací dosaženo zhruba za pět dní po jeho podání. Po subkutánním podání adalimumabu v dávce 40 mg jednou za dva týdny u dospělých pacientů s revmatoidní artritidou byly průměrné ustálené minimální sérové koncentrace přibližně 5 µg/ml (bez současného podávání metotrexátu) a 8–9 µg/ml (se současně podávaným metotrexátem). U dospělých pacientů s neinfekční uveitidou byly protilátky proti adalimumabu identifikovány u 4,8 % pacientů léčených adalimumabem. Vyšší hodnoty protilátek jsou asociovány s vyšší aktivitou onemocnění [10].
Indikace
Adalimumab je indikován v oftalmologii k léčbě neinfekční uveitidy intermediální, zadní a panuveitidy u dospělých a k léčbě neinfekční chronické přední uveitidy u dětí ve věku od dvou let. V jiných specializacích je schválen pro léčbu revmatoidní artritidy u dospělých, u polyartikulární juvenilní idiopatické artritidy, entezopatické artritidy, psoriatické artritidy, ankylozující spondylitidy, axiální spondylartritidy bez radiologického průkazu, u psoriázy, hydradenitis suppurativa, Crohnovy choroby či ulcerózní kolitidy.
Použití adalimumabu je v oftalmologii rezervováno pro léčbu pacientů, kteří reagují nedostatečně na konvenční léčbu, konvenční léčbu netolerují nebo je u nich kontraindikována.
Specifika podávání
Adalimumab se aplikuje subkutánně, u dospělých je úvodní dávka 80 mg, po týdnu 40 mg a dále 40 mg každé 2 týdny. U dětí jsou dobré zkušenosti s dávkováním 20 mg do tělesné hmotnosti 30 kg, u dětí s hmotností blízko 30 kg se s výhodou podává 40 mg. Vyšší dávka je účinnější a také je spojena s nižší tvorbou protilátek. V indikovaných případech se adalimumab podává jednou týdně.
Klinické odpovědi na léčbu je dosaženo obvykle během 12 týdnů léčby. V případě, že nedojde k odpovědi během této doby, je nutné zvážit pokračování léčby.
Léčbu adalimumabem lze zahájit v kombinaci s kortikoidy a/nebo s jinými nebiologickými imunosupresivními látkami, nejčastěji v kombinaci s metotrexátem. Dávku současně podávaných kortikoidů je možno v souladu s klinickými studiemi začít snižovat dva týdny po zahájení léčby adalimumabem.
Před zahájením terapie adalimumabem se stejně jako u jiné biologické léčby doporučuje komplexní interní vyšetření a základní krevní odběry. Je nutné vyloučit infekční onemocnění včetně tuberkulózy (RTG plic a QuantiFERON test) a hepatitidy B a C. U intermediální uveitidy je doporučeno neurologické vyšetření a magnetická rezonance (MR) mozku k vyloučení demyelinizačního onemocnění, které může být s touto uveitidou asociováno. Jednou za rok jsou zhodnoceny přínosy a rizika u pokračující dlouhodobé biologické léčby.
Kontraindikací podání adalimumabu je aktivní tuberkulóza nebo jiná závažná infekce, dále středně těžké až těžké srdeční selhání, maligní onemocnění, demyelinizační onemocnění, lupus erythematodes, hypersenzitivita na léčivou látku nebo na kteroukoliv pomocnou látku. Během léčby není povoleno očkování živými vakcínami. Doporučuje se vyčkat minimálně čtyři týdny po očkování a teprve pak zahájit biologickou léčbu. Pokud byl adalimumab aplikován v těhotenství, pak by se mělo u novorozence očkování zahájit nejdříve pět měsíců po narození. Před plánovanou celkovou operací nebo při výskytu závažné infekce se podávání přípravku přeruší. Před oční operací se adalimumab obvykle nevysazuje, operace se plánuje přibližně sedmý den po aplikaci, případně lze v období kolem operace interval mezi injekcemi prodloužit. V těhotenství a během kojení se podání adalimumabu nedoporučuje.
Nežádoucí účinky
Podobně jako u ostatních léků ze skupiny anti TNFα jsou z nežádoucích účinků popisovány infekce, malignity, srdeční selhání, demyelinizační onemocnění či lupus like syndrom. Nejčastěji hlášenými nežádoucími účinky jsou infekce (nazofaryngitida, sinusitida a infekce horních cest dýchacích), reakce v místě injekčního vpichu (erytém, svědění, krvácení, bolest nebo otoky), bolesti hlavy a muskuloskeletální bolesti. Riziko infekce je vyšší u pacientů starších 65 let.
Kazuistika
Čtyřiatřicetiletá žena se
dostavila na oční vyšetření pro náhodně zjištěný
pokles vizu levého oka (vizus pravého oka 1,0, vizus levého oka
0,25). Přední segment levého oka byl klidný, pouze ojediněle
buňky v přední komoře, sklivec byl vláknitě zkalený,
terč zrakového nervu prosáklý, v makule přítomný edém,
v periferii sítnice infiltráty podél cév (obr. 1A–D zobrazuje nález zdravého oka
a postiženého oka, a to před léčbou a po zahájení
léčby). Byla stanovena diagnóza intraokulární neuritida
a vaskulitida levého oka. Pacientka se s ničím neléčila,
žádné zdravotní obtíže neudávala. Byla vyloučena infekční
etiologie (borrelióza, lues, bartonelóza, tuberkulóza [QuantiFERON
test] negativní), na ultrazvuku břicha se zobrazila cysta
ledviny, ostatní vyšetření byla v normě (MR mozku a krční
páteře, rentgen plic, ultrazvuk extrakraniálních tepen,
dermatologické, endokrinologické, otorinolaryngologické
vyšetření, krevní odběry včetně
imunologických).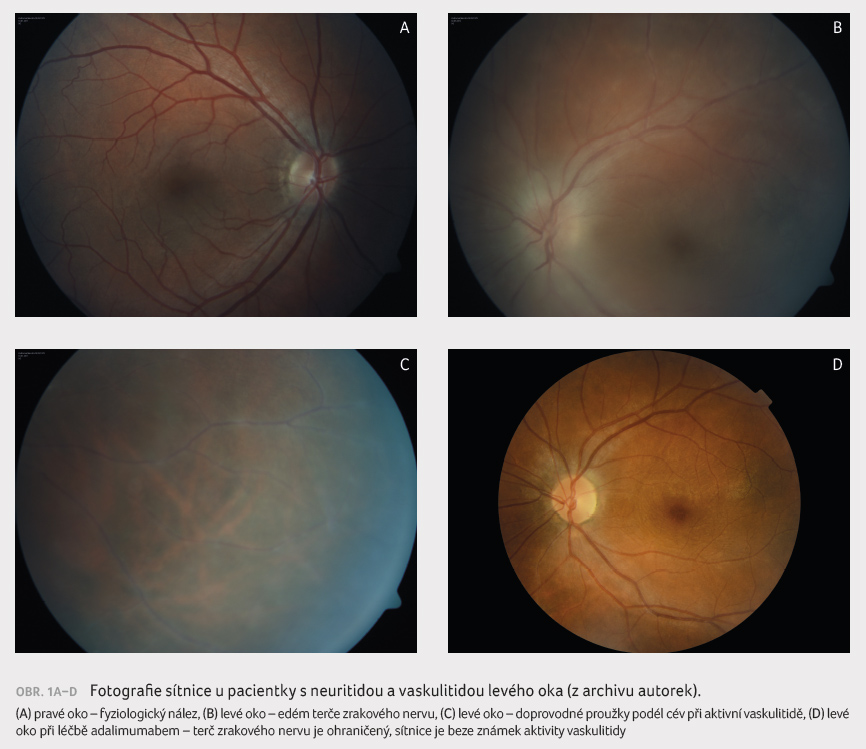
Byla zahájena léčba prednisonem v dávce 0,5 mg/kg, pro relapsy zánětu na očním pozadí byl postupně přidán azathioprin 2,5 mg/kg a dále cyklosporin 2,5 mg/kg. Za následující čtyři roky, kdy oční nález setrvával bez projevů výraznější aktivity zánětu, bylo postupně ukončeno podávání azathioprinu. V této fázi byla pacientka zařazena do klinické studie s adalimumabem týkající se pacientů s inaktivní uveitidou. Po zahájení léčby adalimumabem byl postupně vysazen také prednison. Při léčbě kombinací adalimumabu a cyklosporinu je u pacientky oční nález poslední tři roky v remisi, vizus levého oka je dlouhodobě 1,0. Pacientka je jednou ročně vyšetřena internistou a pneumologem.
Závěr
V oftalmologii je efekt léčby přípravky ze skupiny anti TNFα u neinfekčních uveitid dokumentován řadou kazuistik, v retrospektivních i prospektivních klinických studiích. Jednoznačný přínos léčby adalimumabem je využíván u zrak ohrožujících uveitid, zejména u Behçetovy choroby, uveitidy asociované s juvenilní idiopatickou artritidou, u birdshot choroidopatie či při zrak ohrožujícím průběhu intermediální uveitidy po vyloučení roztroušené sklerózy mozkomíšní. Nové léky jsou pro pacienty s neinfekční uveitidou nadějí na zlepšení či stabilizaci zrakových funkcí a tím významně přispívají ke zvýšení kvality života.
Seznam použité literatury
- [2] Gritz DC, Wong IG. Incidence and prevalence of uveitis in northern California; the Northern California Epidemiology of Uveitis Study. Ophthalmology 2004; 111: 491–500.
- [3] Nussenblatt RB. The natural history of uveitis. Int Ophthalmol 1990; 14: 303–308.
- [4] Durrani OM, Tehrani NN, Marr JE, et al. Degree, duration, and causes of visual loss in uveitis. Br J Ophthalmol 2004; 88: 1159–1162.
- [5] Squires H, Poku E, Bermejo I, et al. A systemic review and economic evaluation of adalimumab and dexamethasone for treating non‑infectious intermediate uveitis, posterior uveitis or panuveitis in adults. Health Technol Assess 2017; 21: 1–170.
- [6] Jaffe GJ, Dick AD, Brézin AP, et al. Adalimumab in Patients with Active Noninfectious Uveitis. N Engl J Med 2016; 375: 932–943.
- [7] Santos Lacomba M, Marcos Martin C, Gallardo Galera JM, et al. Aqueous humor and serum tumor necrosis factor‑alpha in clinical uveitis. Ophthalmic Res 2001; 33: 251–255.
- [8] Sheppard J, Joshi A, Betts KA, et al. Effect of Adalimumab on Visual Functioning in Patients With Noninfectious Intermediate Uveitis, Posterior Uveitis, and Panuveitis in the VISUAL‑1 and VISUAL‑2 Trials. JAMA Ophthalmol 2017; 135: 511–518.
- [9] Ramanan AV, Dick AD, Beresford MW. Adalimumab for Uveitis in Juvenile Idiopathic Arthritis. N Engl J Med 2017; 377: 789–790.
- [10] Leinonen ST, Aalto K, Kotaniemi KM, Kivelä TT. Anti‑adalimumab antibodies in juvenile idiopathic arthritis‑related uveitis. Clin Exp Rheumatol 2017; 35: 1043–1046.