Dasatinib
Léčba chronické myeloidní leukemie (CML) se za posledních 10 let významně změnila. Velký zlom v terapii CML představoval objev imatinibu, inhibitoru BCR-ABL tyrozinkinázy. Nicméně i přes účinnost imatinibu stále zůstává skupina pacientů s CML, kteří jsou vůči léčbě imatinibem rezistentní nebo tuto léčbu netolerují. Právě u těchto nemocných může být indikována léčba dasatinibem (dříve BMS-354825), inhibitorem BCR-ABL, Src a dalších kináz, který byl nově uveden na trh. Dasatinib dokáže navodit u pacientů v chronické fázi CML, kteří jsou rezistentní vůči imatinibu, 87 % kompletních hematologických remisí a 28 % kompletních cytogenetických remisí. U nemocných v chronické fázi CML, kteří netolerují imatinib, navodí dokonce 97 % kompletních hematologických a 64 % kompletních cytogenetických remisí. Dasatinib je účinný i v léčbě nemocných s akcelerovanou CML, s CML v blastické fázi a u pacientů s Ph pozitivní akutní lymfoblastickou leukemií.
Úvod
Léčba chronické myeloidní leukemie (CML) se od počátku 21. století dramaticky proměnila. Do široké klinické praxe se dostal tyrozinkinázový inhibitor imatinib (dříve STI571), léčivo, které blokuje funkci proteinu, jenž je produktem fúzního genu BCR-ABL. Tento gen je podstatou CML a vzniká reciproční translokací t(9;22) [1]. Léčba imatinibem významně snížila počet nemocných s CML, u nichž je indikována alogenní transplantace krvetvorby. Podle studie IRIS (International Randomized Study of Interferon and STI571), provedené u 1106 nemocných s nově diagnostikovanou CML v chronické fázi a srovnávající imatinib s interferonem a a cytarabinem v nízkých dávkách, dokáže imatinib v monoterapii u pacientů s CML navodit kompletní cytogenetickou remisi (úplné vymizení fúzního genu BCR-ABL při cytogenetickém vyšetření kostní dřeně) u 76,2 % nemocných po 18 měsících léčby. Podle této studie dále během 18 měsíců užívání imatinibu nedojde k progresi onemocnění u 96,7 % pacientů [2]. Jak dokazují poslední analýzy studie IRIS, zásadní význam má dosažení co nejlepší léčebné odpovědi [3–5]. Ve studii IRIS byl chimérický gen BCR-ABL kvantifikován jako poměr BCR-ABL/BCR. Hodnotil se pokles této hodnoty, přičemž pokles na desetinu byl hodnocen jako snížení o jeden log. Při kompletní cytogenetické odpovědi bylo dosaženo redukce BCR-ABL/BCR nejméně o 3 log u 57 % nemocných léčených imatinibem, ale jen u 24 % nemocných léčených kombinovanou terapií interferonem a cytarabinem. Vzhledem k tomu, že při kombinované terapii se kompletní cytogenetické odpovědi dosahovalo u pacientů méně často, byly výsledky této redukce BCR-ABL/BCR pro všechny nemocné daleko rozdílnější: 39 % pro imatinib a 2 % pro kombinovanou terapii. U nemocných, kteří dosáhli po 18 měsících terapie kompletní cytogenetické odpovědi a redukce BCR-ABL/BCR alespoň o 3 log, byla pravděpodobnost přežití bez progrese po 60 měsících 100 %. Nemocní, kteří sice dosáhli kompletní cytogenetické remise, ale ne tak hluboké redukce BCR-ABL/ BCR, měli pravděpodobnost přežití bez progrese 98 % a pacienti bez kompletní cytogenetické remise jen 87 %.
O účinnosti imatinibu v léčbě CML bylo několikrát referováno i v české odborné literatuře [6–8]. I přes vysokou účinnost imatinibu u CML existuje skupina nemocných, kteří jsou vůči imatinibu rezistentní nebo jej netolerují a u nichž je léčba neúčinná. Jde často o nemocné v pokročilých stadiích nemoci. Právě tito pacienti by mohli mít prospěch z léčby novými inhibitory BCR-ABL a dalších kináz, k nimž patří dasatinib [9–11].
BCR-ABL a rezistence k léčbě imatinibem
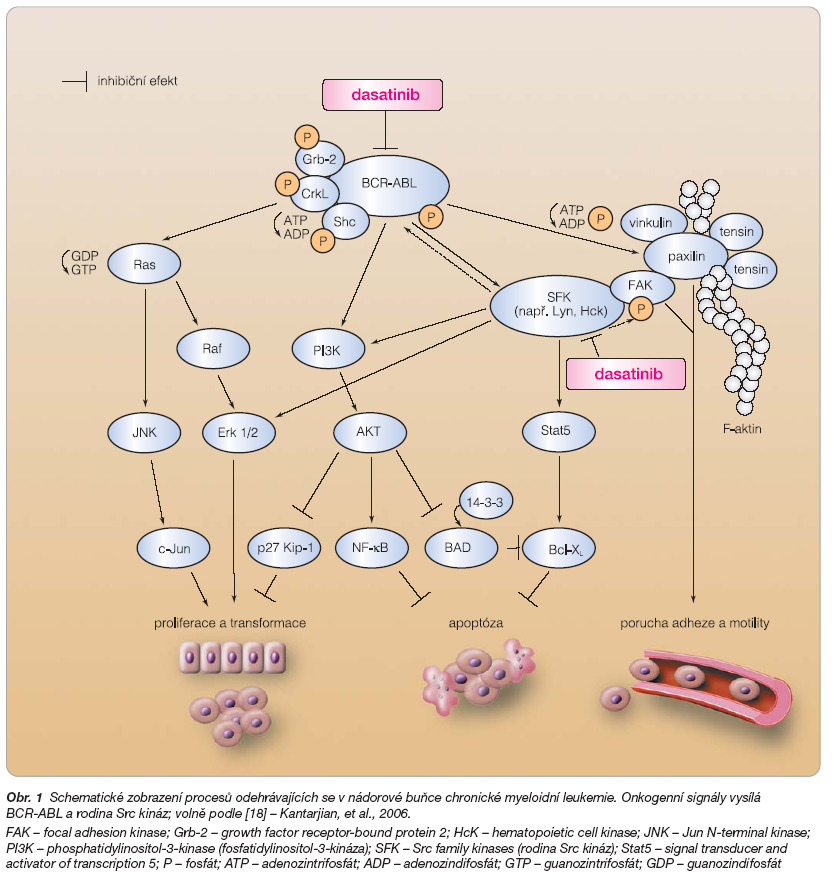
V roce 1960 objevili Nowell a Hungerford u pacientů s CML chromozomální změnu, kterou označili 22q- a nazvali drobným chromozomem 22 (dnes označovanou podle místa objevu jako Filadelfský chromozom, Ph) [12]. Podstatou vzniku Filadelfského chromozomu je translokace 9;22 popsaná roku 1973 [13]. V 80. letech 20. století bylo zjištěno, že t(9;22) vede ke vzniku fúzního genu BCR-ABL [14]. Tento gen představuje podstatu vzniku CML. Signál z BCR-ABL proteinu, který je produktem fúzního genu BCR-ABL a vede k rozvoji CML, se dostává do buněčného jádra několika cestami, které zjednodušeně ukazuje obr. 1.
Imatinib funguje jako kompetitivní inhibitor vazby ATP na ABL kinázu BCR-ABL proteinu. Imatinib je ve velmi těsném vztahu právě s kinázovou doménou, kontakt je s více než 21 aminokyselinovými zbytky. Z těchto podrobných poznatků molekulární úrovně [15, 16] vyplývají některé zásadní informace, které mají vztah k vysvětlení rezistence k imatinibu. P smyčka BCR-ABL (ATP vázací smyčka) je velmi flexibilní a normálně objímá fosfát ATP. Po vazbě imatinibu na BCR-ABL se její struktura změní a je upevněna vodíkovými můstky na tyrozin (Y) 253 a asparagin (N) 322. Pro správnou vazbu imatinibu je klíčový threonin (T) 315. Imatinib se váže na BCR-ABL kinázu v její neaktivní konformaci, při níž A smyčka (activation loop), regulatorní element, není fosforylována a uzavírá katalytické centrum kinázy. V otevřené aktivní podobě se imatinib vázat nemůže. To je také zásadní pro velmi specifickou a selektivní vazbu imatinibu na ABL kinázu. V otevřené podobě mají totiž různé tyrozinkinázy podobnou strukturu. Pro stabilizaci BCR/ABL v autoinhibované pozici, v níž se imatinib může navázat, je klíčová pozice methioninu 351.
Rezistence vůči imatinibu je komplexní fenomén. Existuje primární rezistence neboli refrakterita a sekundární rezistence (relaps), která se vyvine po předchozí léčebné odpovědi. Rezistence může být dále rozdělena na hematologickou, cytogenetickou a molekulární [17].
U různých linií rezistentních buněk nebo na zvířecích modelech byly popsány různé mechanismy jejího vzniku:
– mutace v kinázové doméně BCR-ABL;
– větší exprese BCR-ABL proteinu po amplifikaci BCR-ABL genu;
– zvýšená exprese MDR1 (multidrug resistance gene, gen mnohočetné rezistence k lékům) a zvýšený export imatinibu z buněk;
– zvýšené koncentrace AAG v plazmě (a1-kyselý glykoprotein, bílkovina, která může vázat imatinib);
– vyšší exprese proteinů tepelného šoku stabilizujících BCR-ABL;
– aktivace BCR-ABL nezávislých signálních drah, např. příslušníky rodiny Src kináz [15, 18].
Pravděpodobně nejvýznamnějším mechanismem vzniku rezistence je mutace v kinázové doméně BCR-ABL (mutace v P smyčce, mutace T315, mutace M351, mutace v A smyčce a další). Hochhaus a kol. [19] nalezli u 7 z 55 rezistentních pacientů nárůst exprese BCR-ABL pomocí PCR (polymerázové řetězové reakce), u 2 ze 32 pacientů genomickou amplifikaci BCR-ABL pomocí FISH (fluorescenční in situ hybridizace), další přídavné chromozomální abnormality u 19 ze 36 pacientů a mutace u 23 ze 66 pacientů. Možnosti vyšetřování rezistence k imatinibu u nás shrnula nedávno Naušová a kol. [20]. V poslední době se ale hodně hovoří i o aktivaci signálních drah nezávislých na BCR-ABL, např. o rodině Src kináz. Tyto kinázy mají asi rozhodující vliv v pozdějších stadiích choroby, fungují „nad" a „pod" drahami BCR-ABL a jsou na BCR-ABL nezávislé (viz obr. 1).
Dasatinib
Dasatinib (BMS-354825) je látka jiné struktury než imatinib. Jde o derivát aminopyrimidinu, chemicky N-(2-chlor-6-methyl-fenyl)-2-(6-(4-(2-hydroxyethyl)-piperazin-1-yl)-2-methylpyrimidin-4-4-ylamino)thiazol-5-karboxamid (C22H26N7ClO2S). Má molekulovou hmotnost 488,01 [21]. Také o této látce už padla zmínka v české medicínské literatuře [22].
Dasatinib inhibuje především Src kinázy, o jejichž roli v progresi CML jsme se již zmínili. Vzhledem ke strukturální podobě Src kináz a ABL kinázy se dasatinib také váže na BCR-ABL. Patří tedy mezi duální Src/ABL kinázové inhibitory. Kromě těchto dvou kináz ještě ovlivňuje c-kit, Ephrin receptor kinázu a PDGF-b (platelet derived growth factor-b, růstový faktor z destiček-b). Dasatinib inhibuje BCR-ABL in vitro 325krát silněji než imatinib a 16krát silněji něž nilotinib, další z tyrozinkinázových inhibitorů [23]. Dasatinib se také podstatně odlišuje od imatinibu tím, že se může vázat na BCR-ABL i v aktivní konformaci [24]. Jiná vazba dasatinibu na BCR-ABL, než je u imatinibu, také umožňuje deaktivovat i mnohé mutantní formy BCR-ABL, na něž imatinib nepůsobí. Dasatinib navíc není ovlivněn činností MDR1. Dnes jsou již k dispozici přesné údaje ukazující na molekulární úrovni vazbu dasatinibu na BCR-ABL a rozdíly v této vazbě oproti imatinibu, které vysvětlují, proč dasatinib dokáže inhibovat i většinu mutantů [25]. Hlavní přínos dasatinibu oproti imatinibu by tedy měl spočívat právě v možnosti ovlivnit mutantní formy BCR-ABL a v blokování Src kináz. Z testů in vitro vyplynulo, že jedinou mutací, která je rezistentní k účinkům dasatinibu, je T315I [23]. Z klinické praxe ale začíná vyplývat, že existuje více mutací, které způsobují rezistenci vůči dasatinibu (další mutace na pozici 315 a 317, mutace E255K, F486S) [26, 27]. Dasatinib se po perorálním požití váže z 96 % na plazmatické proteiny. Je významně distribuován do extravaskulárního prostoru, metabolizuje se v játrech cestou enzymu CYP3A4 a z 85 % se vylučuje žlučí a ze 4 % ledvinami. Jeho poločas v plazmě kolísá od 1,3 do 5 hodin.
Historie dasatinibu
Studium nejrůznějších tyrozinkinázových inhibitorů začalo v 90. letech 20. století [28, 29]. Imatinib, derivát fenylaminopyrimidinu, tak nebyl ani zdaleka první poznaný inhibitor. Dasatinib, původně označovaný BMS-354825, dostal svůj generický název po pracovníkovi laboratoří společnosti Bristol-Myers-Squibb, který se podílel na jeho objevu a jehož jméno je Jagabandhu Das [30]. Toto léčivo zaznamenalo raketový vzestup. Od podání preparátu prvnímu pacientovi k jeho registraci ve Spojených státech a v Evropě uplynuly pouhé 3 roky. Prvnímu pacientovi byl dasatinib podán v roce 2003. O rok později už byly na sjezdu Americké hematologické společnosti zveřejněny výsledky studie fáze I, za další rok studie fáze II. Registrační řízení proběhlo ve Spojených státech a v Evropě koncem roku 2006 a v současné době už lze dasatinib podávat mimo klinické studie i nemocným v České republice [30].
Dávkování, nežádoucí účinky a kontraindikace
Optimální dávkování dasatinibu se ještě hledá, i když už nabývá jasnějších obrysů. U pacientů v pokročilejších stadiích CML, tedy v akceleraci onemocnění nebo v blastickém zvratu, a u pacientů s Ph pozitivní akutní lymfoblastickou leukemií (Ph+ ALL) by měla být terapie dasatinibem zahájena v dávce 140 mg 1krát denně. Ukazuje se, že toto dávkování s sebou přináší méně nežádoucích účinků než dávkování 70 mg 2krát denně. Zůstává otázkou, zda u pacientů v chronické fázi by nestačilo zahájení léčby dávkou 100 mg denně [31]. V případě, že léčba dasatinibem nepřináší navození remise onemocnění a nemocní nemají po jeho podání závažné nežádoucí účinky, je možné denní dávku zvýšit až na 200 mg. Dasatinib by měl být podáván dlouhodobě, pokud jej nemocný toleruje a nedochází k progresi onemocnění.
Dosud poznané nežádoucí účinky léčby dasatinibem se částečně podobají nežádoucím účinkům, které provázejí léčbu imatinibem, nicméně některé jsou výraznější. Z nežádoucích účinků si zaslouží největší pozornost tři: myelosuprese, retence tekutin s pohrudničními výpotky a kardiotoxicita.
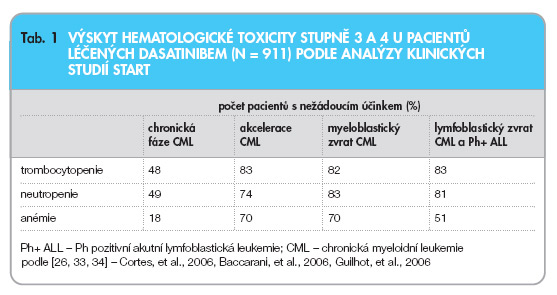
Myelosuprese je při léčbě dasatinibem velmi častá, zejména u nemocných s pokročilým onemocněním (tab. 1).
V případě, že při léčbě dasatinibem dojde u pacientů v chronické fázi CML k poklesu absolutního počtu neutrofilních granulocytů v periferní krvi pod hranici 0,5 x 109/l a/nebo trombocytů pod hranici 50 x 109/l, mělo by být jeho podávání přerušeno do vzestupu těchto hodnot nad 1 x 109/l v případě neutrofilů a nad 50 x 109/l v případě trombocytů. Při každém dalším poklesu by měla být dávka léčiva redukována zhruba o 20 %. U pacientů v akceleraci CML nebo v blastické fázi nemoci platí to samé, jen počet trombocytů, při němž se léčba dasatinibem přerušuje, je pod hranicí 10 x 109/l a počet trombocytů, při němž se podávání dasatinibu opět zahajuje, je vyšší než 20 x 109/l.
Pleurální výpotky jsou překvapivě poměrně častým nežádoucím účinkem terapie dasatinibem. Podle posledních zpráv se vyskytují u 7–30 % nemocných léčených tímto preparátem. Pleurální výpotky stupně 3 a 4 postihují 4 % nemocných. Fluidothorax při léčbě dasatinibem je pravděpodobně způsoben tím, že některé z kináz, jež dasatinib blokuje, se nacházejí ve vyšší míře v pohrudnici. Léčba pleurálních výpotků způsobených dasatinibem spočívá v přerušení jeho podávání a v aplikaci diuretik a steroidů [32].
Dasatinib může u některých nemocných prodloužit QT interval na EKG. Léčba dasatinibem by neměla být zahajována u nemocných, kteří mají hodnotu QTc přesahující 450 ms. Během léčby dasatinibem by měly být důsledně kontrolovány plazmatické hladiny iontů.
Obecně platí, že podávání dasatinibu by mělo být přerušeno vždy při toxicitě stupně 3 a 4. Jedinými absolutními kontraindikacemi podávání dasatinibu jsou hypersenzitivita na tuto látku a těhotenství. Větší pozornost by měla být věnována i nemocným s poruchami funkce jater, u nichž hodnoty ALT (alaninaminotransferáza) a AST (aspartátaminotransferáza) přesahují dvojnásobek normy. Dasatinib by také neměl být podáván pacientům, kteří užívají léčiva inhibující enzym CYP3A4, k nimž patří ketokonazol, itrakonazol, erythromycin, klarithromycin, astemizol, terfenadin nebo cisaprid. Některá léčiva, jako například dexamethason nebo karbamazepin, naopak odbourávání dasatinibu urychlují. Omeprazol, blokátory histaminových receptorů H2 a antacida snižují jeho absorpci [26, 33–35].
Dosavadní klinické zkušenosti
Základní indikací dasatinibu v současné době je CML a Ph+ ALL rezistentní k předchozí terapii nebo je indikován u nemocných, kteří léčbu první volby netolerují. Dasatinib byl již testován v řadě studií fáze I a II. Výsledky některých z nich byly publikovány in extenso, jiné zatím jen ve formě abstrakt [18]. Základním cílem těchto studií bylo hodnocení účinnosti a tolerance léčby dasatinibem u pokročilých fází CML a hledání jeho optimálního dávkování (viz výše).
Dasatinib v léčbě CML
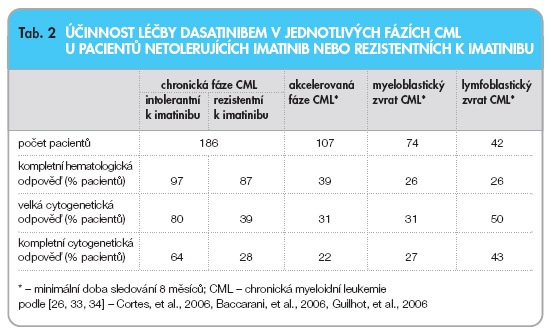
U pacientů v chronické fázi CML bylo s dasatinibem provedeno už několik studií. Výsledky první z nich (fáze I) publikoval Talpaz a kol. [35]. Podle této studie navodil dasatinib kompletní hematologickou remisi u 37 ze 40 nemocných v chronické fázi CML, kteří netolerovali léčbu imatinibem nebo byli rezistentní k imatinibu. Velké cytogenetické remise dosáhlo 18 ze 40 nemocných a 14 ze 40 nemocných dosáhlo kompletní cytogenetické remise.
U 186 pacientů v chronické fázi CML předléčených imatinibem, kteří byli rezistentní k léčbě imatinibem nebo tuto léčbu netolerovali, byla provedena otevřená jednoramenná multicentrická studie START-C s dasatinibem podávaným v dávce 70 mg 2krát denně. Střední doba podávání dasatinibu byla 8,3 měsíců. Za tuto dobu dosáhlo hematologické remise 97 % pacientů netolerujících imatinib a 87 % pacientů rezistentních k léčbě imatinibem. Kompletní cytogenetické remise dosáhlo 64 % pacientů netolerujících imatinib a 28 % pacientů rezistentních k léčbě imatinibem [33]. Viz tab. 2.
Další studie fáze II s dasatinibem, která stále probíhá, je studie CA180–034 [31]. Tato studie porovnávala podávání dasatinibu u pacientů s CML, kteří netolerovali imatinib nebo byli rezistentní k léčbě imatinibem. Dasatinib byl pacientům podán v jedné nebo dvou denních dávkách, celková denní dávka léčiva byla 100 mg nebo 140 mg. Do studie bylo randomizováno 670 nemocných. Po 3 měsících terapie byl počet kompletních hematologických odpovědí 80 % a velkých cytogenetických remisí 37 %. Tato studie naznačuje, že dasatinib je lépe tolerován při podání 1krát denně.
Otevřená randomizovaná nekomparativní multicentrická studie CA180–017 START-R, do níž byli zařazeni pacienti s CML v chronické fázi onemocnění rezistentní k léčbě standardními dávkami imatinibu, srovnávala u těchto nemocných účinnost léčby dasatinibem s léčbou imatinibem podávanou ve vyšších dávkách. První výsledky studie u souboru 150 randomizovaných pacientů ukazují lepší hematologickou odpověď (92 % vs. 82 %) i lepší velkou cytogenetickou odpověď (48 % vs. 33 %) po léčbě dasatinibem [36].
U pacientů s CML se dasatinib ukázal účinný dokonce i po selhání léčby imatinibem i nilotinibem [35].
V případě akcelerované fáze CML u pacientů rezistentních k léčbě imatinibem nebo netolerujících tuto léčbu je účinnost dasatinibu následující: léčivo podle Guilhota a kol. [34] může navodit 39 % kompletních hematologických remisí, 31 % velkých cytogenetických remisí a 22 % kompletních cytogenetických remisí. Studie neprokázala účinnost dasatinibu v léčbě pacientů s mutací BCR-ABL T315I. Základní výsledky analýzy Guilhota a kol. představuje tab. 2. Podle výsledků studie fáze II studie START-A, které byly předneseny v roce 2006 na sjezdu Americké hematologické společnosti, navozuje dasatinib u pacientů v akcelerované fázi CML 45 % kompletních hematologických remisí, 39 % velkých cytogenetických remisí a 32 % kompletních cytogenetických remisí [37].
Koncem roku 2006 byly zveřejněny detailní výsledky studie týkající se léčby dasatinibem u pacientů s CML v blastické krizi [26]. Tato studie uskutečněná se 116 nemocnými s lymfoblastickým nebo myeloblastickým zvratem CML (rezistentními k imatinibu nebo netolerujícími tuto léčbu) ukázala, že dasatinib v monoterapii je schopen navodit kompletní hematologickou remisi u 26 % nemocných jak s lymfoblastickým, tak s myeloblastickým zvratem CML. U pacientů s lymfoblastickým zvratem CML bylo dosaženo více kompletních cytogenetických remisí než u pacientů se zvratem myeloblastickým (43 % vs. 27 %), nicméně doba přežití nemocných bez progrese byla významně delší u pacientů se zvratem myeloblastickým. Tato studie také ukázala, že dasatinib nebyl účinný u pacientů s mutacemi BCR-ABL T315I, E255K a F486S. Výsledky studie jsou uvedeny v tab. 2.
Studie fáze II START-B, týkající se pacientů v blastické krizi CML, která byla uveřejněna na sjezdu Americké hematologické společnosti v roce 2006, ukázala, že léčba dasatinibem může navodit 34 % velkých hematologických remisí, 38 % velkých cytogenetických remisí a 31 % kompletních cytogenetických remisí [38].
Podáváním dasatinibu pacientům v pokročilých stadiích CML (akcelerace a blastické zvraty) se zabývala i studie CA180–035, jejíž dosavadní výsledky ukazují, že lék u těchto nemocných může navodit 35 % velkých hematologických remisí, 33 % velkých cytogenetických remisí a 23 % kompletních cytogenetických remisí [39].
Účinnost dasatinibu v léčbě pacientů v jednotlivých fázích CML shrnuje tab. 2.
Dasatinib v léčbě Ph+ ALL
Výsledky terapie dasatinibem v monoterapii u pacientů s Ph+ ALL korespondují s výsledky terapie pacientů v lymfoblastickém zvratu CML. Lze počítat s navozením až 70 % hematologických remisí a 30 % kompletních cytogenetických remisí. Medián trvání těchto remisí je ale krátký [35].
Dasatinib je již také testován i v dalších indikacích, nejen u CML a Ph+ ALL, viz např. [40].
Závěr
Dasatinib je účinný v terapii pacientů s CML, u nichž selhala léčba imatinibem. V současnosti je podávání dasatinibu indikováno právě u nemocných rezistentních k léčbě imatinibem nebo netolerujících tuto léčbu.
Seznam použité literatury
- [1] Goldman JM, Melo JV. Chronic myeloid leukemia – advances in biology and new approaches to treatment. N Engl J Med 2003; 349: 1451–1464.
- [2] O´Brien SG, Guilhot F, Larson RA, et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med 2003; 348: 994–1004.
- [3] Druker BJ, Guilhot F, O´Brien SG, et al. Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med 2006; 355: 2408–2417.
- [4] Guilhot F, Roy L, Guilhot J, et al. Retrospective comparison of imatinib versus interferon plus cytarabine for chronic myelogenous leukemia patients in chronic phase. Blood 2005; 106: Abstract 165.
- [5] Hughes TP, Kaeda J, Branford S, et al. Frequency of major molecular response to imatinib of interferon alfa plus cytarabine in newly diagnosed chronic myeloid leukemia. N Engl J Med 2003; 349: 1423–1432.
- [6] Faber E. Imatinib. Farmakoterapie 2005; l: 233–238.
- [7] Faber E. Imatinib (Glivec®) v léčbě nemocných s akcelerovanou fází chronické myeloidní leukemie – první zkušenosti. Trendy v medicíně 2002; 4: 3–7.
- [8] Mayer J. Chronická myeloidní leukemie jako model moderní necytostatické léčby maligních chorob. Od Virchowa po STI571. Vnitř Lék 2002; 48: 45–49.
- [9] Baccarani M, Saglio G, Goldman J, et al. Evolving concepts in the management of chronic myeloid leukemia: recommendations from an expert panel on behalf of the European Leukemia Net Blood 2006; 108: 1809–1820.
- [10] Druker BJ, Sawyers CL, Kantarjian H, et al. Activity of a specific inhibitor of the BCR-ABL tyrosine kinase in the blast crisis of chronic myeloid leukemia and acute lymphoblastic leukemia with the Philadelphia chromosome. N Engl J Med 2001; 344: 1038–1042.
- [11] Kantarjian HM, Cortes J, O´Brien S, et al. Imatinib mesylate (STI 571) therapy for Philadelphia chromosome – positive chronic myelogenous leukemia in blast phase. Blood 2002; 99: 3547–3553.
- [12] Nowell PC, Hungerford DA. A minute chromosome in human chronic granulocytic leukemia. Science 1960; 132: 1497.
- [13] Rowley JD. A new consistent chromosomal abnormality in chronic myelogenous leukaemia identified by quinacrine fluorescence and Giemsa staining. Nature 1973; 243: 290–293.
- [14] Shtivelman E, Lifshitz B, Gale RP, Canaani E. Fused transcript of abl and bcr genes in chronic myelogenous leukemia. Nature 1985; 315: 550–554.
- [15] Deininger M, Buchdunger E, Druker BJ. The development of imatinib as a therapeutic agent for chronic myeloid leukemia. Blood 2005; 105: 2640–2653.
- [16] Schindler T, Bornmann W, Pellicena P, et al. Structural mechanism for STI-571 inhibition of abelson tyrosine kinase. Science 2000; 289: 1938–1942.
- [17] Hochhaus A, La Rosée P. Imatinib therapy in chronic myelogenous leukemia: strategies to avoid and overcome resistance. Leukemia 2004; 18: 1313–1321.
- [18] Kantarjian HM, Talpaz M, Giles F, et al. New insights into the pathophysiology of chronic myeloid leukemia and imatinib resistance. Ann Intern Med 2006; 145: 913–923.
- [19] Hochhaus A, Kreil S, Corbin AS, et al. Molecular and chromosomal mechanisms of resistance to imatinib (STI 571) therapy. Leukemia 2002; 16: 2190–2196.
- [20] Naušová J, Priwitzerová M, Jarošová M, et al. Chronická myeloidní leukemie – rezistence na imatinib mesylát (Glivec) – přehled literatury a vlastní zkušenosti. Čas Lék Čes 2006; 145: 377–382.
- [21] Lombardo LJ, Lee FY, Chen P, et al. Discovery of N-(2-chloro-6-methyl- phenyl)-2-(6-(4-(2-hydroxyethyl)-piperazin-1-yl)-2-methylpyrimidin-4-ylamino)thiazole-5-carboxamide (BMS-354825), a dual Src/Abl kinase inhibitor with potent antitumor activity in preclinical assays. J Med Chem 2004; 47: 6658–6661.
- [22] Faber E. Dasatinib. Farmakoterapie 2006; 2: 135–137.
- [23] O´Hare T, Walters DK, Stoftregen EP, et al. In vitro activity of Bcr-Abl inhibitors AMN107 and BMS-354825 against clinically relevant imatinib-resistant Abl kinase domain mutants. Cancer Res 2005; 65: 4500–4505.
- [24] Shah NP, Tran C, Lee FY, et al. Overriding imatinib resistance with a novel ABL kinase inhibitor. Science 2004; 305: 399–401.
- [25] Tokarski JS, Newitt JA, Chang CYJ, et al. The structure of dasatinib (BMS-354825) bound to activated ABL kinase domain elucidates its inhibitory activity against imatinib-resistant ABL mutants. Cancer Res 2006; 66: 5790–5797.
- [26] Cortes J, Rousselot P, Dong-Wook K, et al. Dasatinib induces complete hematologic and cytogenetic responses in patients with imatinib-resistant or -intolerant chronic myeloid leukemia in blast crisis. Blood 2006; Blood First Edition Paper, prepublished online, DOI 10.1182/blood-2006-09-046888.
- [27] Soverini S, Martineli G, Colarossi S, et al. Mutations at residues 315 and 317 in the ABL kinase domain are the main cause of resistance to dasatinib in Ph+ leukemia patients. Blood 2006; 108: Abstract 836.
- [28] Levitzki A, Gazit A. Tyrosine kinase inhibition: an approach to drug development. Science 1995; 267: 1782–1788.
- [29] Traxler P, Bold G, Buchdunger E, et al. Tyrosine kinase inhibitors: from rational design to clinical trials. Med Res Rev 2001; 105: 3–7.
- [30] Das J, Chen P, Norris D, et al. 2-aminothiazole as a novel kinase inhibitor template. Structure-activity relationship studies toward the discovery of N-(2-chloro-6-methylphenyl)-2-[6-[4-(2-hydroxyphenyl)-1-piperazinyl)]-2-methyl-4-pyrimidinylamino)]-1,3-thiazole-5-carboxamide (dasatinib, BMS-354825) as a potent pan-Src kinase inhibitor. J Med Chem 2006; 49: 6819–6832.
- [31] Hochhaus A, Kim DW, Rousselot, P, et al. Dasatinib (SPRYCEL®) 50 mg or 70 mg BID Versus 100 mg or 140 mg QD in Patients with Chronic Myeloid Leukemia in Chronic Phase (CML-CP) Resistant or Intolerant to Imatinib: Results of the CA180–034 Study. Blood 2006; 108: Abstract 166.
- [32] Quintas-Cardema A, Kantarjian HM, Munden R, et al. Pleural Effusion in Patients (pts) with Chronic Myelogenous Leukemia (CML) Treated with Dasatinib after Imatinib Failure. Blood 2006; 108: Abstract 2164.
- [33] Baccarani M, Kantarjian H, Apperley J, et al. Dasatinib (SPRYCEL®) induces durable cytogenetic responses in patients with CP-CML with resistance or intolerance to imatinib: updated results of the CA180–013 START-C phase II study. Blood 2006; 108: Abstract 164.
- [34] Guilhot F, Apperley J, Kim D-W, et al. Dasatinib induces significant hematologic and cytogenetic responses in patients with imatinib-resistant or – intolerant chronic myeloid leukemia in accelerated phase. Blood 2006; Blood First Edition Paper, prepublished online, DOI 10.1182/blood-2006-09-046839.
- [35] Talpaz M, Shah NP, Kantarjian H, et al. Dasatinib in imatinib-resistant Philadelphia chromosome-positive leukemias. N Engl J Med 2006; 354: 2531–2541.
- [36] Shah N, Pasquini R, Rousselot P, et al. Dasatinib (Sprycel) vs. escalated dose of imatinib in patients with chronic phase chronic myeloid leukemia resistant to imatinib: results of the CA180–017 START-R randomized study. Blood 2006; 108: Abstract 167.
- [37] Cortes J, Kim D-W, Guilhot F, et al. Dasatinib (SPRYCEL®) in Patients with Chronic Myelogenous Leukemia in Accelerated Phase that is Imatinib-resistant or -intolerant: Updated Results of the CA180–005 ´START-A´ Phase II Study. Blood 2006; 108: Abstract 2160.
- [38] Martinelli G, Hochhaus A, Coutre S, et al. Dasatinib (SPRYCEL®) Efficacy and Safety in Patients With Chronic Myelogenous Leukemia in Lymphoid or Myeloid Blast Phase with Imatinib Resistance or Intolerance. Blood 2006; 108: Abstract 745.
- [39] Kantarjian H, Ottmann O, Pasquini R, et al. Dasatinib (SPRYCEL®) 140 mg QD vs 70 mg BID in Advanced Phase CML (ABP-CML) or Ph(+) ALL Resistant or Intolerant to Imatinib – Results of the CA180–035 Study. Blood 2006; 108: Abstract 746.
- [40] ClinicalTrials.gov: www.clinicaltrials.gov.