Gefitinib
Inhibitory tyrozinkinázy receptoru pro epidermální růstový faktor jsou preparáty s odlišným mechanismem inhibice růstu zhoubných nádorů, než jakým fungují cytostatika. Gefitinib je prvním perorálně podávaným inhibitorem EGFR, který byl uveden na trh. V květnu roku 2003 získal povolení FDA na základě frekvence léčebných odpovědí u pacientů s nemalobuněčným bronchogenním karcinomem rezistentním k chemoterapii platinovými deriváty a docetaxelem.
Farmakologické údaje o gefitinibu
Gefitinib – (4-(3-chloro-4-fluoroanilino)-7-methoxy-6-(3-morpholinopropoxy)chinazolin – je jednou z nově vyvinutých malých molekul schopných blokovat signalizační kaskádu epidermálního růstového faktoru na úrovni tyrozinkinázové domény. Tato blokáda může mít u řady solidních nádorů za následek zpomalení růstu či dokonce ústup nádoru.
Farmakologické vlastnosti
Lék patří do skupiny selektivních inhibitorů receptoru epidermálního růstového faktoru. Gefitinib se podává ústy v jedné denní dávce, nejvyšší plazmatické koncentrace se dosahuje za 3 až 7 hodin po podání.
Poměr koncentrací gefitinibu v nádoru a plazmě 8 hodin po podání je 11 : 1. Průměrný distribuční objem gefitinibu je v ustáleném stavu 1 400 litrů, což je dokladem jeho rozsáhlé distribuce do tkání. Jeho vazba na bílkoviny krevní plazmy je přibližně 90%. Gefitinib je in vitro metabolizován oxidačně, převážně izoenzymem CYP3A4. Jeho hlavním metabolitem je O-desmethyl gefitinib, jehož účinek na inhibici buněčného růstu stimulovaného EGFR je čtrnáctkrát nižší než účinek mateřské substance. Jeho střední terminální poločas vylučování je 41 hodin, jen 10 % dávky se vylučuje nezměněno. Exkrece gefitinibu a jeho metabolitů probíhá převážně stolicí, jen asi 4 % podané dávky se vylučují ledvinami ve formě jak původní substance, tak i metabolitů.
Preklinické a klinické údaje, bezpečnost
U potkanů bylo pozorováno snížení plodnosti, u králíků snížení hmotnosti plodu. Při podávání potkanům v době březosti a porodu bylo pozorováno snížení přežívání mláďat (vždy se jednalo o dávky 20 mg/kg/den). Gefitinib se u kojících potkaních samic hromadí v mléce.
Krysy, kterým byl gefitinib podáván, měly při vyšetřeních na konci života zvýšenou incidenci benigních jaterních tumorů a hemangiosarkomů mezenterických lymfatických uzlin. Žádný z těchto nálezů nebyl příčinou úmrtí živočichů.
Účinnost rozdílně vysokých dávek gefitinibu byla předmětem klinických studií II. fáze IDEAL 1 a IDEAL 2. Nemocní dostávali buďto 250 mg/den jakožto nejnižší účinnou dávku gefitinibu, nebo 500 mg/den jakožto nejvyšší denní dávku, kterou tolerovala většina pacientů.
Primární cíle zahrnovaly objektivní odpověď nádoru a bezpečnost léčby u IDEAL 1 a objektivní odpověď nádoru a stupeň zlepšení příznaků u IDEAL 2.
Druhotné cíle představovaly kontrolu onemocnění a zlepšení příznaků u IDEAL 1 a kontrolu onemocnění a bezpečnosti u IDEAL 2. Nemocní zařazení do obou studií byli po předchozí onkologické léčbě, ve studii IDEAL 1 prodělali nejméně 1 nebo 2 předchozí chemoterapie s obsahem platinových derivátů, ve studii IDEAL 2 byli zařazeni nemocní, kteří prodělali 2 nebo více režimů chemoterapie, které obsahovaly platinové deriváty a docetaxel. Většina nemocných v obou studiích měla histologicky prokázané adenokarcinomy a většinou měli nemocní stav výkonnosti 0 nebo 1. Frekvence léčebných odpovědí ve studii IDEAL 1 byla 18,4 % a ve studii IDEAL 2 11,8 %, odpovídající frekvence kontroly onemocnění (stabilizace + regrese choroby) byly v obou studiích 54,4 % a 42,2 %. Léčebné odpovědi měly medián trvání 13 měsíců ve studii IDEAL 1 a 7 měsíců ve studii IDEAL 2. Frekvence zmírnění obtíží v obou studiích při použití nižší dávky byla 40,3 % a 43,1 %, přičemž největší zlepšení bylo zaznamenáno u plicních symptomů. U nemocných, kde bylo zaznamenáno zmírnění obtíží, bylo pozorováno i významné prodloužení života. Úleva od symptomů pozorovaná v obou studiích byla rychlá, střední doba do jejího zjištění byla 8–10 dní. Jednoleté přežití nemocných v obou studiích bylo 35 a 29 %, odpovídající mediány přežití pak 7,6 a 6,5 měsíce. Jako optimální biologická dávka se ukázalo 250 mg denně, dávky vyšší nezajistily lepší účinnost, zato ale byly příčinou častějších a závažnějších nežádoucích účinků.
Kombinace gefitinibu s chemoterapií, jejichž účinnost sledovaly studie INTACT 1 a INTACT 2, neprokázaly zlepšené přežití nemocných léčených kombinacemi chemoterapie a gefitinibu.
Gefitinib se podává ústy, u bronchogenního karcinomu v dávce 250 mg denně, u karcinomů hlavy a krku v dávce 500 mg denně. K častým nežádoucím účinkům patří kožní reakce, akneiformní exantém, průjmy a nauzea, časté jsou i oční příznaky – konjunktivitida a blefaritida, většinou CTC stupně 1, abnormální asymptomatické zvýšení hladiny transamináz, dále zvracení, anorexie, stomatitida, dehydratace, poruchy nehtů, alopecie a astenie, všechny tyto nežádoucí účinky jsou téměř vždy jen mírného stupně. K méně častým nežádoucím účinkům patří eroze rohovky, závažný může být intersticiální zánět plic, častěji však pozorovaný v japonské populaci, a vzestup INR s eventuálními krvácivými příhodami u některých nemocných léčených warfarinem. Opatrnosti je třeba u nemocných se snížením kreatininové clearance pod 20 ml/min a u nemocných se závažným poškozením funkce jater, zvláštní opatrnosti je zapotřebí u nemocných trpících současně chorobami plicního intersticia. Gefitinib by se neměl podávat v těhotenství, u dětí nebo mladistvých, kojící matky musí při léčbě gefitinibem přerušit kojení. Z lékových interakcí je třeba zvláště sledovat nemocné léčené warfarinem (riziko zvýšení INR, resp. krvácivých projevů), léky zvyšující pH žaludeční sliznice (snížení koncentrace gefitinibu v plazmě a snížení jeho účinnosti). Induktory CYP450 (rifampicin) či induktory CYP3A4 (phenytoin, carbamazepin, barbituráty, třezalka tečkovaná), mohou snižovat koncentraci gefitinibu v plazmě a tím jeho účinnost. Inhibitory CYP3A4 (itraconazol, erythromycin, clarithromycin, inhibitory proteáz) mohou metabolismus gefitinibu snižovat, a tím zvýšit jeho plazmatickou koncentraci i riziko jeho toxických projevů.
Preparát s gefitinibem není ještě v současnosti v České republice registrován, jeho účinnost i tolerance byly však prověřeny v rámci programu časného přístupu u více než 1 000 nemocných karcinomy plic. K prediktorům jeho účinnosti patří tyto klinické faktory: ženské pohlaví, z typů adenokarcinomy a bronchioloalveolární karcinomy, převažující papilární podtypy nádoru, nekuřáci či mírní kuřáci, nemocní s dobrou kvalitou života. K pozitivním prediktorům příznivé odpovědi rovněž patří i vznik kožního exantému v průběhu léčby. V poslední době byly objeveny důkazy o tom, že k prediktivním faktorům léčebné odpovědi patří i průkaz mutací tyrozinkinázové domény genu pro EGFR (exony 18–23), průkaz exprese EGFR v nádorové tkáni, zvýšený počet kopií chromozomu 7 a také amplifikace genu pro EGFR v nádorových buňkách. I když jsou známy výše uvedené prediktivní faktory a ještě některé další (Her3 exprese, e-cadherin, Her pozitivita), existují i nemocní, kteří mají z léčby gefitinibem profit, i když se u nich některé z těchto predikčních faktorů nepodaří prokázat.
V prosinci roku 2004 byly oznámeny výsledky studie ISEL (Iressa Survival Evaluation in Lung Cancer), že podávání gefitinibu nevedlo k významnému prodloužení života nemocných v porovnání s placebem (5,6 měsíce proti 5,1 měsíce gefitinib-placebo) ani u nemocných s adenokarcinomy (mediány přežití 6,3 proti 5,4 měsíce). Další data ze studie ISEL byla prezentována na fóru Annual Meeting of the American Association of Cancer Research. Léčba gefitinibem vede k prodlouženému přežití v podskupinách nemocných asijského původu a u nekuřáků. V současné době došlo k pozastavení registračního procesu přípravků s gefitinibem v zemích Evropské unie kvůli výsledkům studie ISEL.
V současnosti je intenzivně studována problematika genetických prediktorů účinnosti gefitinibu. Přítomnost mutací genu pro EGFR v nádorové tkáni častěji zjišťovaná právě u Asiatů a u nekuřáků především v adenokarcinomech je prediktorem příznivé léčebné odpovědi. Většina současných prací včetně našich zkušeností však nedokládá statisticky významné prodloužení života u gefitinibem léčených nositelů mutací.
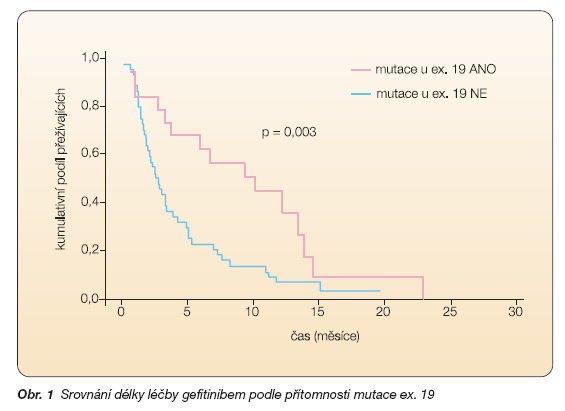
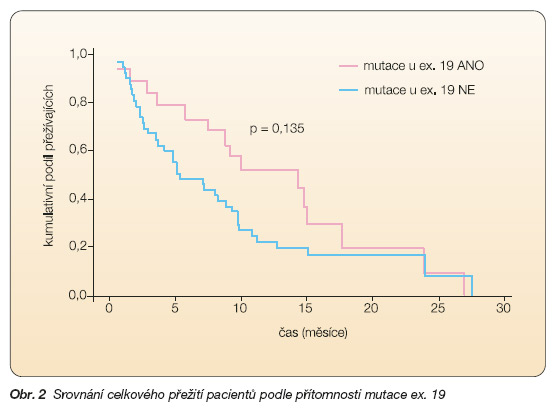
Naše výsledky, které jsme prezentovali na Kongresu Evropské respirační společnosti v Kodani v roce 2005, potvrzují význam přítomnosti EGFR mutací u nemocných s adenokarcinomy pro frekvenci léčebných odpovědí, nikoli však pro délku přežití těchto pacientů (obr. 1, obr. 2, tab. 1).
Závěr
Prediktorem prodloužení života nemocných s NSCLC navozeného gefitinibem je zřejmě zmnožení kopií genu pro EGFR, zatímco přítomnost mutací a zvýšená exprese proteinů EGFR jsou ukazateli pro remisi nemoci a pro prodloužení intervalu do progrese nádoru. Otázkou rovněž zůstává dávkování gefitinibu, jehož současně doporučená dávka představuje cca 1/3 dávky maximálně tolerované.
V současnosti FDA limituje podávání gefitinibu pro nemocné, kteří mají nebo v minulosti měli benefit z jeho podávání, a pro nemocné tzv. non-Investigational New Drug (IND) clinical trials, které byly povoleny před 17. červnem 2005.
V současnosti tedy v České republice trvá možnost podávání gefitinibu v rámci programu časného přístupu u vybraných nemocných s pokročilými nemalobuněčnými karcinomy plic a karcinomy hlavy a krku. Podávání léku je prozatím omezeno na vybraná centra a přínos této terapie se průběžně vyhodnocuje.
Seznam použité literatury
- [1] Comis RL. The Current Situation: Erlotinib (Tarceva) and Gefitinib (Iressa) in Non-Small Cell Lung Cancer. The Oncologist 2005; 10: 467–470.
- [2] Fukuoka M, Yano S, Giaccone G, et al. Multi-Institutional Randomized Phase II Trial of Gefitinib for Previously Treated Patients With Advanced Non-Small-Cell Lung Cancer. J Clin Oncol 2003; 21: 2237–2246.
- [3] Ganti AK, Potti A. Epidermal growth factor inhibition in solid tumours. Expert Opin Biol Ther 2005; 5 (9): 1165–1171.
- [4] Lynch TJ, Daphne MD, Bell W, et al. Activating Mutations in the Epidermal Growth Factor Receptor Underlying Responsiveness of Non-Small-Cell Lung Cancer to Gefitinib. N Engl J Med 2004; 350: 21.
- [5] Paez JG, Jänne PA, Lee JC, et al. EGFR Mutations in Lung Cancer: Correlation with Clinical Response to Gefitinib Therapy. Sciencexpress/www.sciencexpress.org/29 April 2004/ 10.1126/science.1099314.
- [6] Pešek M, Teřl M, Krákorová G. Gefitinib – zkušenosti s biologicky cílenou terapií nemalobuněčného karcinomu plic. Stud Pneumol Phthiseol 2004; 64: 117–123.
- [7] Pešek M, Benešová M, Teřl M, Brůha F, Muken-šnabl P, Minárik M. Evaluation of EGFR mutations and ERCC2 polymorphisms treatment of non-small cell lung cancer. Přednáška – Kongres Evropské respirační společnosti, Dánsko, Kodaň 17. – 21. 9. 2005.
- [8] Pfister DG, Johnson DH, Azzoli ChG, et al. American Society of Clinical Oncology Treatment of Unresectable Non-Small-Cell Lung Cancer Guideline: Update 2003. J Clin Oncol 2004; 22: 330–353.
- [9] Shah NT, Kris MG, Pao W, Tyson LB, et al. Practical Management of Patients With Non-Small-Cell Lung Cancer Treated With Gefitinib. J Clin Oncol 2005; 165–174.
- [10] Skřičková J, Babičková L. Ovlivnění receptoru pro epidermální růstový faktor – nová perspektiva v léčbě nemalobuněčného bronchogenního karcinomu. Stud Pneumol Phthiseol 2004; 64: 111–116.
- [11] Vansteenkiste JF. Gefitinib (Iressa): a novel treatment for non-small cell lung cancer. Expert Rev Anticancer Ther 2004; 4 (1): 5–17.