Infekční komplikace při léčbě roztroušené sklerózy
Souhrn:
Imunomodulační a imunosupresivní léčba roztroušené sklerózy doznala v posledních letech výrazného rozmachu se zavedením nových přípravků ovlivňujících průběh onemocnění. Další nové léky se v krátké době uplatní v klinické praxi. Terapie moderními léčivými přípravky však s sebou přináší některé nežádoucí účinky, mezi něž patří i výskyt infekčních komplikací. Individuální stratifikace infekčních rizik a jejich minimalizace patří nedílně k moderní léčbě, která by měla být efektivní, ale zároveň i bezpečná. Pravidelné klinické kontroly, monitorace krevního obrazu a některých zánětlivých markerů pomáhají předcházet možným komplikacím, z nichž některé mohou být fatální.
Key words: multiple sclerosis – disease‑modifying drugs – infection complications – progressive multifocal leukoencephalopathy – pharmacovigilance.
Summary:
Immunomodulatory and immunosuppressive treatment of multiple sclerosis has gone through major developments in recent years with the introduction of new disease‑modifying drugs. Other new drugs will be introduced into clinical practice shortly. However, the therapy with modern medicinal products is associated with some adverse effects, including infection complications. Individual stratification of infection risks and their minimalization is an integral part of modern therapy that should be efficacious as well as safe. Regular clinical check‑ups, monitoring of blood and some inflammatory markers may prevent possible complications, some of which may be fatal.
Úvod
Roztroušená skleróza (RS) je imunitně zprostředkované onemocnění centrálního nervového systému (CNS) s podílem neurodegenerace [1]. Je nejčastějším invalidizujícím neurologickým onemocněním osob mladšího a středního věku, jež snižuje kvalitu života [2]. V posledních letech byla do léčebné praxe uvedena nová léčiva, která jsou sice efektivnější, ale přinášejí větší riziko výskytu nežádoucích účinků, mezi něž patří infekční komplikace [3‒5].
Mechanismy účinku léčiv používaných v terapii RS se velmi liší, což vede ke specifickým infekčním nežádoucím příhodám. U některých z nich lze na základě jejich účinku predikovat infekční riziko. Například léčba dimetylfumarátem (DMF) bývá spojena s dlouhodobou leukopenií a lymfopenií, zatímco léčba natalizumabem mění funkci lymfocytů tím, že snižuje počet lymfocytů infiltrujících CNS, což vede k poklesu imunitního dohledu. Správné vyhodnocení rizika konkrétní infekce spojené s léčbou může významně přispět k farmakovigilanci. Přestože míra rizika infekcí je vždy individuální, některé kontrolované studie identifikovaly míru závažnosti těchto komplikací, jejichž výskyt se pohybuje v rozmezí 0,2‒2,6 % [6]. Následující přehled informuje o nejčastějších infekčních komplikacích provázejících používání přípravků k léčbě relapsů a ovlivňujících průběh onemocnění (disease modifying therapy, DMT) s klinickými důsledky a možnostmi, jak těmto stavům předcházet.
Léčba ovlivňující průběh relapsů
U 70–80 % pacientů probíhá RS pod obrazem relabující remitující formy onemocnění (RR RS). Relaps je charakterizován manifestací nové neurologické symptomatologie trvající déle než 24 hodin s nepřítomností subfebrilií nebo infekce. První příznak onemocnění s mono či multifokální symptomatologií a s odpovídajícím nálezem na magnetické rezonanci (MR) mozku, ev. krční míchy se označuje jako klinicky izolovaný syndrom (clinically isolated syndrome, CIS) [7]. Akutní relapsy jsou obvykle léčeny pulzními vysokými dávkami kortikosteroidů (KS). Pokud jsou relapsy refrakterní na léčbu KS, mohou být léčeny výměnnou plazmaferézou (VPF), ev. imunoadsorpcí. Protizánětlivý účinek této léčby potlačuje akutní zánět a urychluje rekonvalescenci [8,9].
Kortikosteroidy
Léky první volby jsou KS (metylprednisolon), které se podávají v pulzních dávkách, nejčastěji 3–5 g během 3–5 dnů [10]. U sekundárně nebo primárně progresivní formy RS (SP RS, PP RS) se někdy podávají pulzy KS každý měsíc nebo každé tři měsíce v indikaci off label [11]. Kortikosteroidy mají pleiotropní efekt, omezují aktivitu velké řady zánětlivých mediátorů a omezují prostup imunokompetentních buněk přes hematoencefalickou bariéru. Dlouhodobé kontinuální podávání KS v nízkých dávkách, které bylo spojeno s bakteriálními, virovými, mykotickými a parazitárními infekcemi, se nyní již používá minimálně [12]. Souvislost mezi léčbou pulzními vysokými dávkami KS a závažnými infekčními komplikacemi je méně jasná. Na rozdíl od kontinuální léčby se u opakované pulzní terapie ani při velmi vysokých dávkách KS nezvyšuje náchylnost k vývoji bakteriálních nebo mykotických infekcí. Mohou se však manifestovat závažné virové infekce způsobené virem varicella zoster (VZV) nebo herpes simplex (HSV). Aplikace pulzních dávek KS není vhodná během virové infekce nebo bezprostředně po očkování. V individuálních situacích je vhodné rutinně testovat potenciálně maskované infekce během léčby [13].
Plazmaferéza
Výměnná plazmaferéza mechanicky eliminuje z krevního oběhu autoprotilátky, cytokiny a imunitní komplexy. Používá se 5–7 cyklů s výměnou 1,5 l plazmatického objemu. Jde o léčbu s potřebou invazivního vstupu s rizikem infekce centrálním žilním katétrem [14].
Autoři několika malých studií referovali při léčbě VPF infekční komplikace [15]. Ve větších studiích bylo hlášeno 0,5–3,3 % katétrových infekcí u pacientů s jinými neurologickými chorobami [16]. Na druhé straně v kohortě 335 pacientů s 2 502 cykly VPF, z nichž více než 90 % mělo neurologické onemocnění, nebyly referovány žádné infekční komplikace [17].
Dlouhodobá terapie léky ovlivňujícími průběh onemocnění
Tato skupina léčiv tlumí aktivitu RS modulací zánětlivých pochodů a normalizuje patologickou imunitní odpověď. Cílem je snížit počet relapsů a progresi onemocnění ovlivněním disability.
Interferon beta
Mechanismus účinku interferonu beta
(IFNβ) je komplexní. Podporuje produkci protizánětlivých
cytokinů, snižuje aktivaci T lymfocytů prostřednictvím
vazby na
interferonový receptor, zvyšuje aktivitu
T supresorových lymfocytů, moduluje expresi hlavního
histokompatibilního komplexu (major histocompatibility complex,
MHC), redukuje prostup zánětlivých buněk přes hematoencefalickou
bariéru, moduluje kostimulační molekuly na antigen
prezentujících buňkách, blokuje aktivitu matrixové
metaloproteinázy a chemokinů, indukuje genetickou transkripci,
což vyvolává antivirové, antimikrobiální, antiproliferační
a imunomodulační účinky [18]. Podává se IFNβ 1a
intramuskulárně jednou týdně v dávce 30 μg, nebo třikrát
týdně subkutánní injekcí v dávce 22 µg nebo 44 µg.
Interferon beta 1b se podává subkutánní injekcí v dávce
250 µg každý druhý den.
Předregistrační studie fáze III, které vedly k zavedení IFNβ do léčebné praxe, neprokázaly zvýšené riziko infekčních komplikací [19‒21]. Rovněž více než dvacetileté zkušenosti z reálné léčebné praxe neprokázaly zvýšenou prevalenci specifických infekcí, i když se lze občas setkat s přechodnou leukopenií. Vzácnější nežádoucí reakcí jsou lokální infekce v místě vpichu (nekrózy a abscesy). Ani nedávno registrovaný pegylovaný IFNβ 1a není spojen se zvýšeným rizikem infekcí [22,23]. Tyto okolnosti lze vysvětlit nejspíše signálním antivirovým účinkem interferonů 1. typu, které působí protektivně, při dysregulaci těchto mechanismů dochází naopak ke zvýšenému riziku virových neuroinfekcí [24].
Glatiramer acetát
Glatiramer acetát (GA) je syntetický polymer indikovaný jako lék první volby u pacientů s CIS nebo trpících RR RS. Mění cytokinový fenotyp z prozánětlivého Th1 na protizánětlivý Th2 s pomocí dendritických buněk. Prostřednictvím transkripčního faktoru Foxp3 aktivuje transformaci konvenčních CD4+ CD25‒ T lymfocytů na regulační CD4+ CD25+ T lymfocyty. Vykazuje i neuroprotektivní efekt [25‒27]. Původní dávkování bylo 20 mg podkožně jednou denně. Analýza celkové expozice GA v klinických studiích (10 017 pacientoroků, nemocní léčení až 23,1 roku) neprokázala závažné infekční komplikace [28]. Na základě výsledků studie GALA byla zavedena léčba GA v dávce 40 mg aplikované podkožně 3× týdně, při níž nebyly rovněž prokázány žádné závažné infekce [29]. Během léčby není nutné sledovat žádné specifické laboratorní parametry, ačkoliv v klinické praxi je obvyklé sledovat minimálně krevní obraz.
Teriflunomid
Teriflunomid je aktivním metabolitem leflunomidu, selektivně a reverzibilně inhibuje mitochondriální enzym dihydroorotát dehydrogenázu. Tento enzym je důležitý pro de novo syntézu pyrimidinu potřebného pro rychle se dělící T a B lymfocyty. Neovlivňuje dělící se buňky nebo buňky v klidovém stavu [30].
V placebem kontrolované studii TEMSO byl teriflunomid v dávce 7 mg i 14 mg dobře tolerovaný, závažné nežádoucí účinky postihly minimum pacientů. Výskyt infekcí byl podobný ve všech ramenech studie (placebo 2,2 %, teriflunomid v dávce 7 mg 1,6 % a v dávce 14 mg 2,5 %). Ve skupině s vyšší léčebnou dávkou se u tří subjektů vyskytla pyelonefritida, což vedlo v jednom případě k ukončení jeho podávání [31]. Během studie TOWER byly pozorovány mírné, ale i těžké infekční komplikace ve všech ramenech (placebo, teriflunomid v dávce 7 mg a 14 mg). Jeden pacient zemřel na sepsi indukovanou klebsielou. Kromě toho byly zaznamenány dva případy oportunní infekce. Pacient v placebové skupině měl hepatitidu B a cytomegalovou infekci, další pacient ve skupině léčené teriflunomidem v dávce 14 mg onemocněl intestinální tuberkulózou. V obou případech nebyla infekce dávána do souvislosti s léčbou [32]. Dlouhodobější data neprokázala významně vyšší riziko infekcí u léčených subjektů. Mezi závažné nežádoucí účinky patřily případy apendicitidy, bronchitidy a pneumonie. Nebyly popsány oportunní infekce nebo progresivní multifokální leukoencefalopatie (PML) [33]. Sporadické případy infekcí horních cest dýchacích se vyskytovaly i během studie TOPIC, která ověřila efekt teriflunomidu rovněž u CIS [34].
Ke snížení rizika infekčních komplikací pacientů léčených teriflunomidem vede doporučení spočívající v měsíční monitoraci krevního obrazu prvních šest měsíců léčby a dále každé tři měsíce. Podle studie TOWER by měla být terapie přerušena, klesne li počet neutrofilů pod hodnotu 1,0 × 109/l.
Dimetylfumarát
Fumarát je přirozeně se vyskytující molekula, která se účastní aerobní oxidace sacharidů, lipidů a proteinů v Krebsově cyklu. Dimetylfumarát je v tenkém střevě přeměněn na monometylfumarát (MMF), který je aktivním metabolitem. Předpokládá se současný protizánětlivý a neuroprotektivní mechanismus daný aktivací nukleárního faktoru Nrf2 (nuclear factor erythroid 2 related factor 2). Protizánětlivý efekt je dán ovlivněním poměru prozánětlivých Th1/Th17 lymfocytů směrem k protizánětlivému fenotypu, kde hrají hlavní roli Th2 lymfocyty. Tím dochází k útlumu produkce prozánětlivých cytokinů, ke snížení aktivace makrofágů, mikroglií a astrocytů. Zároveň dochází ke stabilizaci hematoencefalické bariéry, a tím ke snížení infiltrace CNS imunitními buňkami. Neuroprotektivní účinek DMF je dán ochranou proti oxidativnímu stresu. Aktivací Nrf2 dochází k transkripci genů, které kódují antioxidanty a cytoprotektivní proteiny. Jedním z hlavních antioxidantů kódovaných Nrf2 je buněčný glutation, který vychytává volné radikály. Dochází tak k podpoře neuroprotekce během oxidativního stresu, který doprovází zánět a zároveň se podílí na vzniku neurodegenerativních procesů [35].
Placebem kontrolovaná studie DEFINE sledovala účinnost DMF ve dvou režimech, 240 mg 2× denně nebo 3× denně proti placebu. Výskyt infekcí byl ve všech skupinách srovnatelný (64 % a 68 % vs. 65 %). Šlo většinou o infekce horních cest dýchacích nebo močových cest. Závažné infekce byly zaznamenány ve 2 % případů ve všech skupinách [5].
Ve studii CONFIRM byl srovnáván efekt DMF ve stejném režimu jako u předchozí studie proti placebu nebo GA. Nežádoucí infekční komplikace byly pozorovány u 56 % pacientů užívajících DMF ve srovnání s 50 % u obou komparátorů. Stejně jako u studie DEFINE šlo o infekce horních cest dýchacích, močové infekce, bronchitidu a gastroenteritidu. V žádné skupině nebyla zjištěna infekce označená jako závažná [36].
V obou studiích klesl počet lymfocytů u pacientů léčených DMF o 30 % během prvního roku léčby zejména v důsledku poklesu počtu CD8+ lymfocytů, následně byly počty lymfocytů stabilní. Lymfopenie se považuje za jeden z významných rizikových faktorů pro rozvoj PML [37]. Absolutní počet lymfocytů nižší než 0,5 × 109 byl pozorován u přibližně 6 % pacientů léčených DMF [38]. V roce 2015 byl publikován první případ PML u pacienta léčeného DMF ve studii DEFINE. Do roku 2017 byly publikovány další čtyři případy PML v kauzální souvislosti s terapií DMF. Nebyly prokázány jiné rizikové faktory než přítomnost protilátek proti JCV (John Cunningham virus), např. předchozí imunosupresivní léčba apod. [39]. Na základě případových zpráv Evropská léková agentura nedávno aktualizovala doporučení pro minimalizaci rizika PML souvisejícího s léčbou DMF. Před zahájením terapie je nutné mít k dispozici výchozí vyšetření MR a vyšetření počtu bílých krvinek, včetně počtu lymfocytů. Zhodnocení krevního obrazu by mělo být opakováno každé tři měsíce. Pokud počet lymfocytů poklesne pod hodnotu 0,5 × 109 buněk po dobu delší než šest měsíců, měl by být poměr rizika a prospěchu léčby přehodnocen [40].
Fingolimod
Fingolimod je modulátor sfingosin 1 fosfátu (S1P). Blokuje výstup lymfocytů, zejména subpopulace CCR7+, CD4+, naivních a centrálních paměťových T lymfocytů z lymfatických uzlin, reverzibilně redistribuuje lymfocyty při zachování jejich funkce, způsobuje retenci lymfatických buněk v sekundární lymfatické tkáni, omezuje naivním a paměťovým T lymfocytům přechod do CNS, může podporovat neuroprotektivní účinky vazbou na neurální a gliové buňky, moduluje remyelinizaci a zvyšuje migraci astrocytů [41].
Studie fáze III vedoucí k registraci fingolimodu prokázaly podobný výskyt infekčních komplikací ve srovnání fingolimodu podávaného v dávce 0,5 mg denně proti placebu nebo proti aktivnímu komparátoru [4,42]. V rámci studie TRANSFORMS byla jejich četnost 51 % u léčené skupiny proti 53 % u placeba, u studie FREEDOMS byl zachycen výskyt u 59 % proti 53 % u aktivního komparátoru, ale byl pozorován vyšší výskyt infekcí dolních cest dýchacích u subjektů léčených fingolimodem. Byly pozorovány závažnější infekce v 1,6 % případů při podávání fingolimodu v dávce 0,5 mg denně a ve 2,6 % při podání 1,25 mg fingolimodu denně proti placebové skupině, s incidencí 1,9 % s dvěma případy fatální infekce (jeden případ HSV encefalitidy a další VZV infekce u pacientů léčených fingolimodem v dávce 1,25 mg denně). Integrovaná bezpečnostní analýza více než 3 500 pacientů s RS zahrnutých ve studiích neodhalila zvýšené riziko infekčních onemocnění, včetně závažných infekcí způsobených virem HSV u pacientů léčených fingolimodem ve srovnání s placebem [43]. Výskyt VZV infekcí u subjektů léčených dávkou 0,5 mg fingolimodu denně byl 7 na 1 000 pacientoroků v postmarketingové fázi studie a 11 na 1 000 pacientoroků (proti 6 na 1 000 pacientoroků v placebové skupině) v jiné integrované analýze studií fáze II a III a v nekontrolované extenzi studií [44].
Na základě těchto skutečností je doporučeno před zahájením léčby testovat nemocné na přítomnost protilátek proti VZV, u séronegativních jedinců je nutné očkování proti varicele [45]. Nicméně i u séropozitivních pacientů byly popsány sporadické případy s HSV asociovanou encefalitidou [46]. Během reálné klinické praxe byly patrné projevy jiných neuroinfekcí v souvislosti s léčbou fingolimodem. Šlo např. o případy kryptokokové infekce mozku a kůže. Předpokládá se reaktivace latentní infekce vlivem léčby fingolimodem [47,48].
První tři případy PML během léčby fingolimodem, z nichž dva pacienti byli předtím léčeni IFNβ 1, jeden kortikoidy a další mesalazinem pro ulcerativní kolitidu, byly hlášeny v letech 2013–2015. Do září 2016 bylo referováno dalších devět případů pravděpodobné nebo definitivní PML, z nichž někteří pacienti byli předtím léčeni natalizumabem. U některých nemocných došlo ke snížení absolutního počtu lymfocytů. Riziko bylo stanoveno na 0,056/1 000 pacientů (95% CI [interval spolehlivosti] 0,026–0,106). V rámci bezpečnostních kritérií by mělo být provedeno vyšetření krevního obrazu na začátku léčby, po dvou a čtyřech týdnech a následně každých 3‒6 měsíců během terapie. V případě trvalého poklesu absolutního počtu lymfocytů pod hodnotu 0,2 × 109 buněk by léčba měla být přerušena, dokud hodnoty nedosáhnou počtu 0,6 × 109/l buněk [49].
Natalizumab
Natalizumab je humanizovaná monoklonální protilátka namířená vůči α4 integrinu, v důsledku čehož dochází k omezené interakci s adhezní molekulou VCAM 1. Je snížena migrace leukocytů z krevního oběhu do CNS přes hematoencefalickou bariéru, snižuje se aktivita T lymfocytů a NK buněk, indukuje se apoptóza [50]. Studie fáze III, které vedly ke schválení natalizumabu do léčebné praxe (AFFIRM a SENTINEL), demonstrovaly zvýšený výskyt chřipky, infekce horních cest dýchacích a infekce močových cest u léčených pacientů. Bylo referováno o výskytu sporadických případů kryptosporidiálního průjmu, kryptokokové meningitidy a fatální herpetické encefalitidy [3,51‒53]. Během studie AFFIRM 3,2 % pacientů léčených natalizumabem a 2,6 % dostávajících placebo vykazovalo závažné infekce, v aktivní větvi byly popsány čtyři případy pneumonie a pět případů uroinfekcí, ostatní infekce referované jako závažné představovaly celulitida, gastroenteritida, infekční mononukleóza, osteomyelitida, sinusitida, tonzilitida, apendicitida a infekce nejasné etiologie.
 Závažné infekce byly hlášeny
i u studie SENTINEL, v jejímž rámci byly dokonce
referovány první dva případy PML. Důsledkem bylo přechodné
stažení natalizumabu z léčebné praxe. Dalším případem
PML v souvislosti s podáváním natalizumabu byla léčba
Crohnovy choroby [54]. Silné důkazy svědčí o tom, že
riziko rozvoje PML u pacientů, kteří jsou léčeni
natalizumabem, stoupá, pokud jsou přítomny protilátky proti JCV,
pokud nemocní užívali v minulosti imusupresiva a pokud
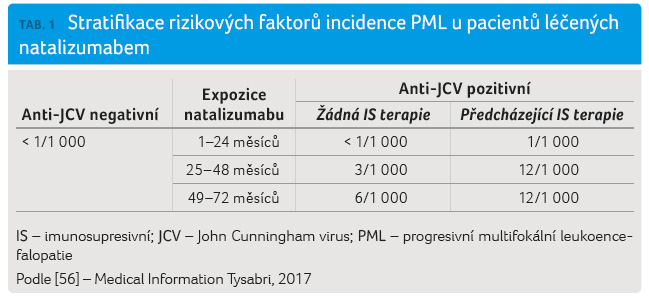
jsou léčeni více než dva roky [55]. Stratifikace rizika PML je
uvedena v tabulce 1.
Z grafu 1 je
patrné riziko PML u nemocných léčených natalizumabem
v závislosti na délce terapie (data pocházejí z června
2017). Ke dni 31. května 2017 bylo celosvětově
léčeno natalizumabem přibližně 170 900 pacientů,
incidence PML k tomuto datu byla 4,21/1 000 pacientů.
Ke dni 6. června 2017 bylo potvrzeno
731 případů PML (728 léčených pro RS), zemřelo 23 %
pacientů, u nichž se vyvinulo toto onemocnění [56]. Žádná
jednoznačně účinná antivirová terapie neexistuje. Recentní
italská studie nepotvrdila původní předpoklad účinnosti VPF
[57]. Určitou nadějí je několik popsaných případů dobrého
léčebného efektu maraviroku – antagonisty chemokinového
koreceptoru typu 5 (CCR5) [58]. Častou komplikací PML je
rozvoj imunitního nekonstitučního zánětlivého syndromu [59].
Pacienti indikovaní k léčbě natalizumabem musejí podepsat
informovaný souhlas s výčtem všech léčebných rizik.
Probíhá klinický i laboratorní monitoring, zejména kontroly
krevního obrazu. Každý neobvyklý klinický projev RS (kognitivní
porucha, neobvyklé projevy chování, retrochiazmatická porucha
vizu, hemiparéza, záchvatovité projevy apod.) je podezřelý
z rozvoje PML [60]. Diagnóza PML se verifikuje nálezem kopií
DNA JCV v mozkomíšním moku a MR nálezem, který se liší
od typických lézí u RS [61,62]. U rizikových
pacientů (J
Závažné infekce byly hlášeny
i u studie SENTINEL, v jejímž rámci byly dokonce
referovány první dva případy PML. Důsledkem bylo přechodné
stažení natalizumabu z léčebné praxe. Dalším případem
PML v souvislosti s podáváním natalizumabu byla léčba
Crohnovy choroby [54]. Silné důkazy svědčí o tom, že
riziko rozvoje PML u pacientů, kteří jsou léčeni
natalizumabem, stoupá, pokud jsou přítomny protilátky proti JCV,
pokud nemocní užívali v minulosti imusupresiva a pokud
jsou léčeni více než dva roky [55]. Stratifikace rizika PML je
uvedena v tabulce 1.
Z grafu 1 je
patrné riziko PML u nemocných léčených natalizumabem
v závislosti na délce terapie (data pocházejí z června
2017). Ke dni 31. května 2017 bylo celosvětově
léčeno natalizumabem přibližně 170 900 pacientů,
incidence PML k tomuto datu byla 4,21/1 000 pacientů.
Ke dni 6. června 2017 bylo potvrzeno
731 případů PML (728 léčených pro RS), zemřelo 23 %
pacientů, u nichž se vyvinulo toto onemocnění [56]. Žádná
jednoznačně účinná antivirová terapie neexistuje. Recentní
italská studie nepotvrdila původní předpoklad účinnosti VPF
[57]. Určitou nadějí je několik popsaných případů dobrého
léčebného efektu maraviroku – antagonisty chemokinového
koreceptoru typu 5 (CCR5) [58]. Častou komplikací PML je
rozvoj imunitního nekonstitučního zánětlivého syndromu [59].
Pacienti indikovaní k léčbě natalizumabem musejí podepsat
informovaný souhlas s výčtem všech léčebných rizik.
Probíhá klinický i laboratorní monitoring, zejména kontroly
krevního obrazu. Každý neobvyklý klinický projev RS (kognitivní
porucha, neobvyklé projevy chování, retrochiazmatická porucha
vizu, hemiparéza, záchvatovité projevy apod.) je podezřelý
z rozvoje PML [60]. Diagnóza PML se verifikuje nálezem kopií
DNA JCV v mozkomíšním moku a MR nálezem, který se liší
od typických lézí u RS [61,62]. U rizikových
pacientů (J![GRAF 1 riziko vzniku progresivní multifokální leukoencefalopatie u pacientů léčených natalizumabem v závislosti na délce terapie; podle [56] – Tysabri, 2017.](https://www.remedia.cz/photo-a-31375---.jpg) CV pozitivních po dvou letech terapie) je nutné
provádět MR vyšetření mozku ve zkráceném protokolu
v intervalu 3–4 měsíců. Na rozvoj PML je třeba myslet
minimálně šest měsíců po ukončení léčby, kdy je třeba
věnovat pacientům zvýšenou pozornost včetně kontrol MR mozku
[63].
CV pozitivních po dvou letech terapie) je nutné
provádět MR vyšetření mozku ve zkráceném protokolu
v intervalu 3–4 měsíců. Na rozvoj PML je třeba myslet
minimálně šest měsíců po ukončení léčby, kdy je třeba
věnovat pacientům zvýšenou pozornost včetně kontrol MR mozku
[63].
Alemtuzumab
Alemtuzumab je humanizovaná monoklonální protilátka proti povrchovému znaku CD52, snižuje počet T i B lymfocytů. Dochází k přeprogramování adaptivní imunity s podporou vývoje populace regulačních buněk [64]. Účinnost alemtuzumabu byla ověřena v několika studiích. Šlo o studii fáze II CAMMS223 a její extenzi a o dvě studie fáze III: CARE MS I a CARE MS II. Ve všech těchto studiích byl aktivním komparátorem IFNβ 1a [65‒68]. Alemtuzumab se v indikaci RS podává v ročních cyklech, s pěti infuzemi v prvním roce a se třemi infuzemi o 12 měsíců později v dávce 12 mg/den. Pokud trvá aktivita onemocnění i nadále, provádí se tzv. retreatment vždy po dalších 12 měsících.
Častější výskyt infekčních komplikací se projevil ve studii CAMMS223 u 66,7 % léčených proti 46,7 % subjektů s aktivním komparátorem, v extenzi studie CAMMS223 u 72,2 % proti 50,4 %, ve studii CARE MS I u 67 % proti 45 % a v CARE MS II u 77 % proti 66 %. Většina infekcí byla klasifikována jako lehké až střední. Závažné infekce se v kontrolovaných klinických studiích s RS objevily u 2,7 % pacientů léčených alemtuzumabem ve srovnání s 1 % pacientů léčených IFNβ 1a. Závažné infekce ve skupině léčené alemtuzumabem byly následující: apendicitida, gastroenteritida, pneumonie, herpes zoster a zubní infekce. Závažné infekce způsobené VZV včetně primární varicely a reaktivace VZV se u pacientů léčených alemtuzumabem objevovaly častěji (0,3 %) ve srovnání s léčbou IFNβ 1a (0 %). U pacientek léčených biologickou terapií byla rovněž hlášena cervikální infekce způsobená lidskými papilomaviry (HPV) včetně cervikální dysplazie (2 %). U pacientek se doporučuje jednou ročně provádět testování HPV. U pacientů léčených alemtuzumabem i aktivním komparátorem byla v kontrolovaných klinických studiích hlášena tuberkulóza. U 0,3 % pacientů léčených alemtuzumabem byla hlášena aktivní a latentní tuberkulóza (nejčastěji v endemických oblastech). Alemtuzumab nebyl podáván souběžně s imunosupresivní terapií nebo v návaznosti na ni vzhledem k rizikům těžkých infekcí. Před zahájením podávání alemtuzumabu je vhodné zvážit zhodnocení stavu pacientů s vysokým rizikem infekce hepatitidy B (HBV) nebo hepatitidy C (HCV). Zvýšený výskyt herpetických infekcí během studií CARE MS vedl k zavedení profylaktické léčby acyklovirem (minimálně 4 týdny po infuzi alemtuzumabu) ‒ toto opatření významně snižuje počet infekcí [69]. Kromě toho byly popsány jednotlivé případy spirochetální gingivitidy, pyogenního granulomu, kandidózy jícnu, tuberkulózní a listeriové meningitidy, což si vynutilo zavedení dietních opatření k zabránění konzumaci rizikových potravin, např. nepasterizovaného sýra [70]. Dosud nebyly hlášeny případy progresivní PML. Extenze studie CAMMS223 prokázala klesající výskyt infekcí s každým dalším cyklem léčby. Výskyt infekcí byl po léčbě alemtuzumabem nejvyšší a poté klesal (první rok 59,9 %, druhý rok 55,1 %, třetí rok 48,2 %, čtvrtý rok 46 %). Infekce byly i nadále většinou mírné nebo středně závažné, přičemž žádné nevedly k ukončení léčby nebo k přerušení studie [71]. Vzhledem k hluboké a dlouhodobé lymfopenii po podání alemtuzumabu byla četnost oportunních nebo závažných infekcí nečekaně nízká. Tento fakt může souviset s relativním zachováním vrozené imunitní odpovědi, ale i s méně výraznou deplecí lymfocytů v primárních a sekundárních lymfatických tkáních [72]. U pacientů užívajících alemtuzumab je doporučen laboratorní monitoring vzhledem k riziku autoimunní hemolýzy, imunitní trombocytopenie, glomerulonefritidy a poruch štítné žlázy v kontextu rizika infekčních komplikací. V případě nevysvětlitelného kožního exantému, subfebrilie, bolestí hlavy by pacienti měli kontaktovat ošetřujícího lékaře.
Léčiva s očekávaným zavedením do léčebné praxe v ČR
Kladribin
Kladribin (2 chlor 2’deoxy β d adenosin), známý také jako 2 CdA, deoxyadenosinový analog se substitucí atomu vodíku s chlorem na pozici 2 purinové báze. Tato substituce vede ke zvýšené odolnosti proti degradaci adenosin deaminázou, enzymem, který metabolizuje a vylučuje přirozeně se vyskytující deoxynukleosidy. Kladribin vstupuje do buňky prostřednictvím nukleosidových transportních proteinů. Uvnitř buňky se aktivuje třemi postupnými fosforylacemi, z nichž první je katalyzována enzymem deoxycytidinkináza. Aktivovaný kladribin může být inaktivován defosforylací enzymem 5’ nukleotidáza (5’ NTáza). Ve srovnání s jinými buňkami mají lymfocyty vysokou aktivitu deoxycytidinkinázy a nízkou aktivitu 5’ NTázy, a proto akumulují vyšší koncentrace fosforylované molekuly, která se zachycuje uvnitř buňky, což vede k přednostní akumulaci fosforylovaného nebo aktivovaného kladribinu [73].
Během fáze III klinických studií (CLARITY a ORACLE) byly sledovány v rámci nežádoucích účinků i infekční komplikace [74,75]. Infekce se vyskytovaly u 48,3 % pacientů léčených kladribinem a u 42,5 % pacientů s placebem. Herpes zoster se manifestoval u 2,3 % léčených kladribinem, žádný případ se nevyskytl v placebové skupině. Ve studii ORACLE byl výskyt lehčích či středně těžkých infekcí v obou větvích léčených pacientů jen o málo vyšší než v placebové skupině.
Ocrelizumab
V patogenezi RS hrají významnou roli B lymfocyty, jež byly prokázány v ektopických germinálních centrech v meningách a přispívají ke kortikální demyelinizaci a neurodegeneraci. Ocrelizumab je humanizovaná monoklonální protilátka selektivně namířená proti znaku CD20, který je exprimován na povrchu zralých a paměťových B lymfocytů, nikoliv na lymfoidních kmenových a plazmatických buňkách [76].
Ocrelizumab byl podroben klinickým testům jak v indikaci RR RS, tak PP RS (studie fáze III OPERA I a OPERA II a studie ORATORIO). Studie OPERA I a OPERA II byly dvě identická hodnocení porovnávající zkoumané léčivo v dávce 600 mg každých 24 týdnů proti IFNβ 1a, studie ORATORIO byla kontrolována placebem. Infekce byly hlášeny v prvních dvou studiích u 56,9 % pacientů (ve skupině léčené ocrelizumabem) a v 54,3 % ve skupině s aktivním komparátorem. K nejčastějším infekcím patřily v obou skupinách infekce horních cest dýchacích, nazofaryngitida a infekce močových cest. U pacientů léčených ocrelizumabem bylo více infekcí horních cest dýchacích (15,2 % vs. 10,5 %), u placebové skupiny bylo více infekcí močových cest (11,6 % vs. 12,1 %). U 5,9 % pacientů léčených ocrelizumabem se vyskytla herpetická infekce, u subjektů s aktivním komparátorem se objevila ve 3,4 % případů. Během studií nebyla hlášena žádná oportunní infekce [77]. Ve studii ORATORIO bylo u skupiny léčené ocrelizumabem hlášeno 71,4 % infekcí proti 69,9 % ve skupině s placebem. Nejčastěji šlo o nazofaryngitidu (22,6 % vs. 27,2 %), močovou infekci (19,8 % vs. 22,6 %) a chřipku (11,5 % vs. 8,8 %). Výskyt závažnějších infekcí byl podobný v obou skupinách (6,2 % vs. 5,9 %). Herpetické infekce se vyskytly v 7,7 % u ocrelizumabu, u placeba u 3,3 % pacientů [78].
Daklizumab
Daklizumab je humanizovaná monoklonální protilátka proti α podjednotce (CD25) receptoru pro interleukin 2. Výsledkem je kromě jiného posílení funkce regulačních NK buněk CD56 bright [79].
Efekt daklizumabu byl ověřen ve studiích fáze II CHOICE a SELECT (srovnání dvou dávek daklizumabu ‒ 2 mg/kg každé 2 týdny, nebo daklizumab 1 mg/kg každé 4 týdny proti placebu) a fáze III DECIDE (srovnání daklizumabu s IFNβ 1a) [80‒82]. Ve všech studiích výskyt infekčních komplikací vzrostl, nikoliv však dramaticky. Závažné infekce hlášené u studie CHOICE (2 %) zahrnovaly apendicitidu, gastroenteritidu, sinusitidu, močové infekce, cytomegalovou a yersiniovou infekci. Vyskytlo se jedno úmrtí následkem komplikací abscesu v musculus psoas. Ve studii DECIDE se vyskytly infekce u 65 % pacientů ve skupině s léčbou daklizumabem a u 67 % subjektů ze skupiny s aktivním komparátorem. K vážnějším infekcím došlo u 4 % pacientů léčených daklizumabem a u 2 % s IFNβ 1a, šlo o infekce močových cest, apendicitidu, celulitidu a virové infekce. Výskyt herpetických infekcí se u obou skupin výrazně nelišil (8 % a 7 %). Nebyla pozorována žádná oportunní infekce.
Závěr a doporučení pro praxi
Jedním z nejčastějších
nežádoucích účinků léčby RS jsou infekce, jak je patrné
z klinických studií, ale i z reálné klinické
praxe. Nejnižší riziko vzniku těchto komplikací je při podávání
GA a IFNβ. Podávání natalizumabu, jiných monoklonálních
protilátek, DMF, fingolimodu a teriflunomidu je provázeno
vyšším rizikem. Některá data svědčí o tom, že riziko
výskytu infekcí stoupá s délkou léčby.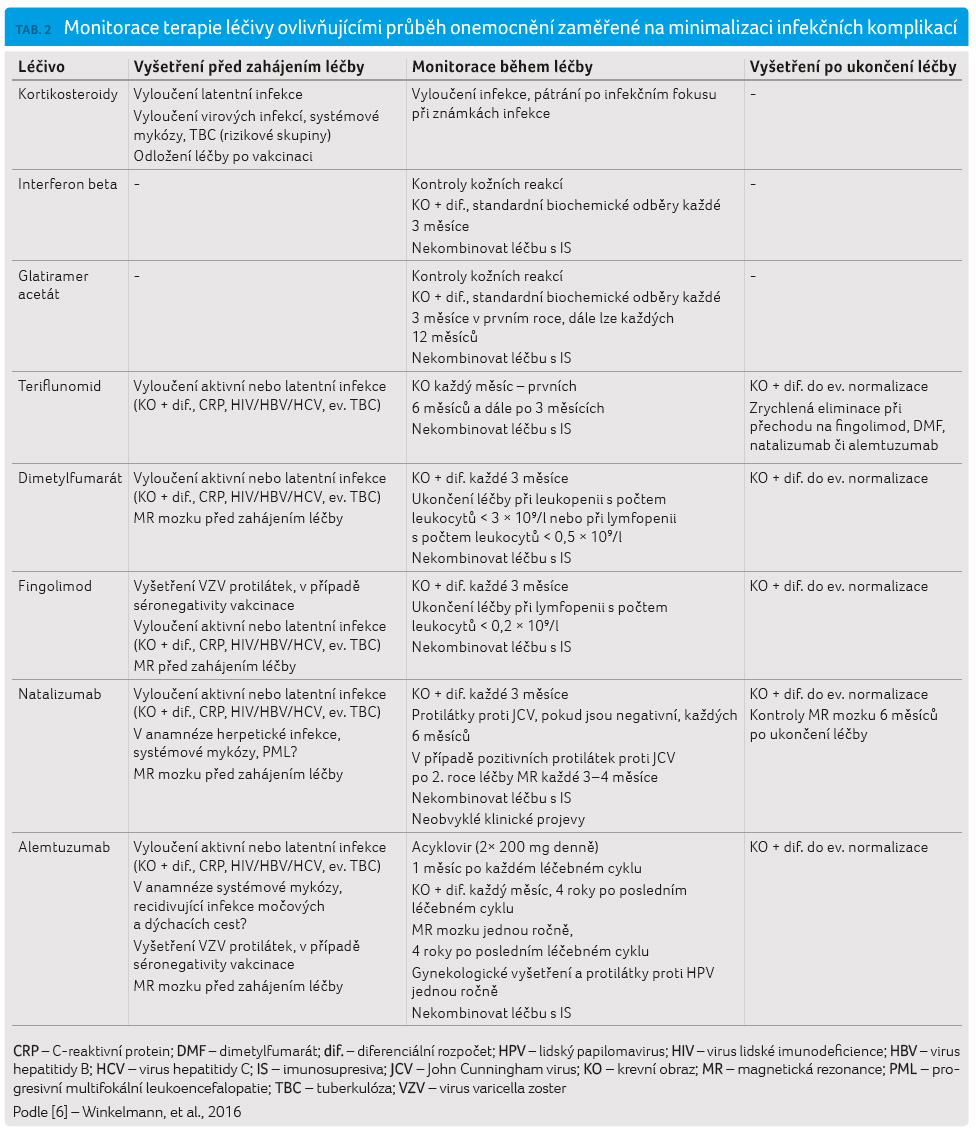
Při zahájení léčby konkrétním přípravkem či v průběhu terapie, nebo dokonce při jejím ukončení, je nutné vzít v úvahu možnost infekčních komplikací, z nichž některé (např. PML) mohou být fatální. V anamnéze je třeba zhodnotit, zda některé komorbidity riziko infekcí nezvyšují, zda pacient nepochází z exponovaného prostředí či zda má odpovídající protilátkový profil. V některých případech je nutná vhodná vakcinace. Možnosti minimalizace infekčního rizika u přípravků podávaných při léčbě RS jsou uvedeny v tabulce 2. Vývoj nových léčiv musí brát v úvahu nejen jejich účinnost, ale i bezpečnost, zejména s ohledem na riziko infekčních komplikací. Zásadní význam pro získání dalších informací má sběr dat v registrech, které sledují výskyt nežádoucích příhod v reálné klinické praxi.
Seznam použité literatury
- [1] Lassmann H. Pathology and disease mechanisms in different stages of multiple sclerosis. J Neurol Sci 2013; 333: 1–4.
- [2] Jongen PJ. Health‑Related Quality of Life in Patients with Multiple Sclerosis: Impact of Disease‑Modifying Drugs. CNS Drugs 2017; 31: 585–602.
- [3] Polman CH, O’Connor PW, Havrdova E, et al. A randomized, placebo‑controlled trial of natalizumab for relapsing multiple sclerosis. N Engl J Med 2006; 354: 899–910.
- [4] Kappos L, Radue EM, O’Connor P, et al. FREEDOMS Study Group. A placebo‑controlled trial of oral fingolimod in relapsing multiple sclerosis. N Engl J Med 2010; 362: 387–401.
- [5] Gold R, Kappos L, Arnold D, et al. Placebo‑controlled phase 3 study of oral BG‑12 for relapsing multiple sclerosis. N Engl J Med 2012; 367: 1098–1107.
- [6] Winkelmann A, Loebermann M, Reisinger EC, et al. Disease‑modifying therapies and infectious risks in multiple sclerosis. Nat Rev Neurol 2016; 12: 217–233.
- [7] Gelfand JM. Multiple sclerosis: diagnosis, differential diagnosis, and clinical presentation. Handb Clin Neurol 2014; 122: 269–290.
- [8] Keegan M, König F, McClelland R, et al. Relation between humoral pathological changes in multiple sclerosis and response to therapeutic plasma exchange. Lancet 2005; 366: 579–582.
- [9] Faissner S, Nikolayczik J, Chan A. Plasmapheresis and immunoadsorption in patients with steroid refractory multiple sclerosis relapses. J Neurol 2016; 6: 1092–1098.
- [10] Stoppe M, Busch M, Krizek L, et al. Outcome of MS relapses in the era of disease‑modifying therapy. BMC Neurol 2017; 17: 151.
- [11] Pirko I, Rodriguez M. Pulsed intravenous methylprednisolone therapy in progressive multiple sclerosis: need for a controlled trial. Arch Neurol 2004; 61: 1148–1149.
- [12] Klein NC, Go CH, Cunha BA. Infections associated with steroid use. Infect Dis Clin North Am 2001; 15: 423–432.
- [13] Stahn C, Lowenberg M, Hommes DW, et al. Molecular mechanisms of glucocorticoid action and selective glucocorticoid receptor agonists. Mol Cell Endocrinol 2007; 275: 71–78.
- [14] Lehmann HC, Hartung HP, Hetzel GR, et al. Plasma exchange in neuroimmunological disorders: Part 1: Rationale and treatment of inflammatory central nervous system disorders. Arch Neurol 2006; 63: 930–935.
- [15] Keegan M, König F, McClelland R, et al. Relation between humoral pathological changes in multiple sclerosis and response to therapeutic plasma exchange. Lancet 2005; 366: 579–582.
- [16] Vucic S, Davies L. Safety of plasmapheresis in the treatment of neurological disease. Aust N Z J Med 1998; 28: 301–305.
- [17] Yeh JH, Chen WH, Chiu HC, et al. Complications of double‑filtration plasmapheresis. Transfusion 2004; 44: 1621–1625.
- [18] Kieseier BC. The mechanism of action of interferon‑β in relapsing multiple sclerosis. CNS Drugs 2011; 25: 491–502.
- [19] The IFNB Multiple Sclerosis Study Group [No authors listed]. Interferon beta‑1b is effective in relapsing‑remitting multiple sclerosis I. Clinical results of a multicenter, randomized, double‑blind, placebo‑controlled trial. Neurology 1993; 43: 655–661.
- [20] Study Group [No authors listed]. Randomised double‑blind placebo‑controlled study of interferon beta‑1a in relapsing/remitting multiple sclerosis. PRISMS (Prevention of Relapses and Disability by Interferon beta‑1a Subcutaneously in Multiple Sclerosis). Lancet 1998; 352: 1498–1504.
- [21] Jacobs LD, Cookfair DL, Rudick RA, et al. The Multiple Sclerosis Collaborative Research Group (MSCRG). Intramuscular interferon beta‑1a for disease progression in relapsing multiple sclerosis. Ann Neurol 1996; 39: 285–294.
- [22] Calabresi PA, Kieseier BC, Arnold DL, et al. ADVANCE Study Investigators. Pegylated interferon β‑1a for relapsing‑remitting multiple sclerosis (ADVANCE): a randomised, phase 3, double‑blind study. Lancet Neurol 2014; 13: 657–665.
- [23] Kieseier BC, Arnold DL, Balcer LJ, et al. Peginterferon beta‑1a in multiple sclerosis: 2‑year results from ADVANCE. Mult Scler 2015; 21: 1025–1035.
- [24] McGlasson S, Jury A, Jackson A, et al. Type I interferon dysregulation and neurological disease. Nat Rev Neurol 2015; 11: 515–523.
- [25] Ziemssen T, Kumpfel T, Klinkert WE, et al. Glatiramer acetate‑specific T‑helper 1‑ and 2‑type cell lines produce BDNF: implications for multiple sclerosis therapy. Brain 2002; 125: 2381–2391.
- [26] Hong J, Li N, Zhang X, et al. Induction of CD4+CD25+ regulatory T cells by copolymer‑I through activation of transcription factor Foxp3. Proc Natl Acad Sci 2005; 102: 6449–6454.
- [27] Johnson KP, Brooks BR, Cohen JA, et al. The Copolymer 1 Multiple Sclerosis Study Group. Copolymer 1 reduces relapse rate and improves disability in relapsing‑remitting multiple sclerosis: results of a phase III multicenter, double‑blind placebo‑controlled trial. Neurology 1995; 45: 1268–1276.
- [28] Ziemssen T, Ashtamker N, Rubinchick S, et al. Long‑term safety and tolerability of glatiramer acetate 20 mg/ml in the treatment of relapsing forms of multiple sclerosis. Expert Opin Drug Saf 2017; 16: 247–255.
- [29] Khan O, Rieckmann P, Boyko A, et al. Three times weekly glatiramer acetate in relapsing‑remitting multiple sclerosis. Ann Neurol 2013; 73: 705–713.
- [30] Bar‑Or A, Pachner A, Menguy‑Vacheron F, et al. Teriflunomide and its mechanism of action in multiple sclerosis. Drugs 2014; 74: 659–674.
- [31] O’Connor P, Wolinsky JS, Confavreux C, et al. Randomized trial of oral teriflunomide for relapsing multiple sclerosis. N Engl J Med 2011; 365: 1293–1303.
- [32] Confavreux C, O’Connor P, Comi G, et al. TOWER Trial Group. Oral teriflunomide for patients with relapsing multiple sclerosis (TOWER): a randomised, double‑blind, placebo‑controlled, phase 3 trial. Lancet Neurol 2014; 13: 247–256.
- [33] Confavreux C, Li DK, Freedman MS, et al. Teriflunomide Multiple Sclerosis Trial Group. Long‑term follow‑up of a phase 2 study of oral teriflunomide in relapsing multiple sclerosis: safety and efficacy results up to 8.5 years. Mult Scler 2012; 18: 1278–1289.
- [34] Miller AE, Wolinsky JS, Kappos L, et al. TOPIC Study Group. Oral teriflunomide for patients with a first clinical episode suggestive of multiple sclerosis (TOPIC): a randomised, double‑blind, placebo‑controlled, phase 3 trial. Lancet Neurol 2014; 13: 977–986.
- [35] Linker RA, Gold R. Dimethyl fumarate for treatment of multiple sclerosis: mechanism of action, effectiveness, and side effects. Curr Neurol Neurosci Rep 2013; 13: 394.
- [36] Fox RJ, Miller DH, Phillips JT. Placebo‑controlled phase 3 study of oral BG‑12 or glatiramer in multiple sclerosis. N Engl J Med 2012; 367: 1087–1097.
- [37] Khatri BO, Garland J, Berger J, et al. The effect of dimethyl fumarate (Tecfidera™) on lymphocyte counts: A potential contributor to progressive multifocal leukoencephalopathy risk. Mult Scler Relat Disord 2015; 4: 377–379.
- [38] Spencer CM, Crabtree‑Hartman EC, Lehmann‑Horn K, et al. Reduction of CD8(+) T lymphocytes in multiple sclerosis patients treated with dimethyl fumarate. Neurol Neuroimmunol Neuroinflamm 2015; 2: e76.
- [39] Rosenkranz T, Novas M, Terborg C, et al. PML in a patient with lymphocytopenia treated with dimethyl fumarate. N Engl J Med 2015; 372: 1476–1478.
- [40] Updated recommendations to minimise the risk of the rare brain infection PML with Tecfidera. EMA [23. 10. 2015]. Dostupné na: http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/news/2015/10/news_detail_002423.jsp&mid=WC0b01ac058004d5c1
- [41] Subei AM, Cohen JA. Sphingosine 1‑phosphate receptor modulators in multiple sclerosis. CNS Drugs 2015; 29: 565–575.
- [42] Cohen JA, Barkhof F, Comi G, et al. TRANSFORMS Study Group. Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. N Engl J Med 2010; 362: 402–415.
- [43] Kappos L, Cohen J, Collins W, et al. Fingolimod in relapsing multiple sclerosis: An integrated analysis of safety findings. Mult Scler Relat Disord 2014; 3: 494–504.
- [44] Arvin AM, Wolinsky JS, Kappos L, et al. Varicella‑zoster virus infections in patients treated with fingolimod: risk assessment and consensus recommendations for management. JAMA Neurol 2015; 72: 31–39.
- [45] Winkelmann A, Loebermann M, Reisinger EC, et al. Fingolimod treatment for multiple sclerosis patients. What do we do with varicella? Ann Neurol 2011; 70: 673–674.
- [46] Issa NP, Hentati A. VZV encephalitis that developed in an immunized patient during fingolimod therapy. Neurology 2015; 84: 99–100.
- [47] Achtnichts L, Obreja O, Conen A, et al. Cryptococcal Meningoencephalitis in a Patient With Multiple Sclerosis Treated With Fingolimod. JAMA Neurol 2015; 72: 1203–1205.
- [48] Grebenciucova E, Reder AT, Bernard JT, et al. Immunologic mechanisms of fingolimod and the role of immunosenescence in the risk of cryptococcal infection: A case report and review of literature. Mult Scler Relat Disord 2016; 9: 158–162.
- [49] Yoshii F, Moriya Y, Ohnuki T, et al. Neurological safety of fingolimod: An updated review. Clin Exper Neuroimmunol, Jun 2017. doi: 10.1111/cen3.12397
- [50] Hoepner R, Faissner S, Salmen A, et al. Efficacy and side effects of natalizumab therapy in patients with multiple sclerosis. J Cent Nerv Syst Dis 2014; 6: 41–49.
- [51] Rudick RA, Stuart WH, Calabresi PA, et al.; SENTINEL Investigators. Natalizumab plus interferon beta‑1a for relapsing multiple sclerosis. N Engl J Med 2006; 354: 911–923.
- [52] Valenzuela RM, Pula JH, Garwacki D, et al. Cryptococcal meningitis in a multiple sclerosis patient taking natalizumab. J Neurol Sci 2014; 340: 109–111.
- [53] Kwiatkowski A, Gallois J, Bilbault N, et al. Herpes encephalitis during natalizumab treatment in multiple sclerosis. Mult Scler 2012; 18: 909–911.
- [54] Van Assche G, Van Ranst M, Sciot R, et al. Progressive multifocal leukoencephalopathy after natalizumab therapy for Crohn’s disease. N Engl J Med 2005; 353: 362–368.
- [55] Schwab N, Schneider‑Hohendorf T, Melzer N, et al. Natalizumab‑associated PML: Challenges with incidence, resulting risk, and risk stratification. Neurology 2017; 88: 1197–1205.
- [56] Tysabri® (natalizumab). PML in Patients Receiving TYSABRI (USA TYSABRI PML Update). Dostupné na: https://medinfo.biogen.com/secure/download?doc=workspace%3A%2F%2FSpacesStore%2Fded9df8f‑d785‑444a‑ae89‑888bef72aa7e&type=pmldoc&path=null&dpath=null&mimeType=null
- [57] Landi D, De Rossi N, Zagaglia S, et al. Italian PML study group. No evidence of beneficial effects of plasmapheresis in natalizumab‑associated PML. Neurology 2017; 88: 1144–1152.
- [58] Bsteh G, Auer M, Iglseder S, et al. Severe early natalizumab‑associated PML in MS: Effective control of PML‑IRIS with maraviroc. Neurol Neuroimmunol Neuroinflamm 2017; 4: e323.
- [59] Massey TH, Smith R, Sadiq S, et al. Rescue of severe brain and cervical cord IRIS by restarting natalizumab in a pregnant MS patient. Neurology 2017; 88: 711–713.
- [60] Dong‑Si T, Gheuens S, Gangadharan A, et al. Predictors of survival and functional outcomes in natalizumab‑associated progressive multifocal leukoencephalopathy. J Neurovirol 2015; 21: 637–644.
- [61] Giovannelli I, Ciccone N, Vaggelli G, et al. Utility of droplet digital PCR for the quantitative detection of polyomavirus JC in clinical samples. J Clin Virol 2016; 82: 70–75.
- [62] Wattjes MP, Barkhof F. Diagnosis of natalizumab‑associated progressive multifocal leukoencephalopathy using MRI. Curr Opin Neurol 2014; 27: 260–270.
- [63] Fine AJ, Sorbello A, Kortepeter C, et al. Progressive multifocal leukoencephalopathy after natalizumab discontinuation. Ann Neurol 2014; 75: 108–115.
- [64] Wiendl H, Kieseier B. Multiple sclerosis: reprogramming the immune repertoire with alemtuzumab in MS. Nat Rev Neurol 2013; 9: 125–126.
- [65] CAMMS223 Trial Investigators, Coles AJ, Compston DA, Selmaj KW, et al. Alemtuzumab vs. interferon beta‑1a in early multiple sclerosis. Lancet 2012; 380: 1819–1828.
- [66] Coles AJ, Fox E, Vladic A, et al. Alemtuzumab more effective than interferon β‑1a at 5‑year follow‑up of CAMMS223 clinical trial. Neurology 2012; 78: 1069–1078.
- [67] Cohen JA, Coles AJ, Arnold DL, et al. CARE‑MS I investigators. Alemtuzumab versus interferon beta 1a as first‑line treatment for patients with relapsing‑remitting multiple sclerosis: a randomised controlled phase 3 trial. Lancet 20; 380: 1819–1828.
- [68] Coles AJ, Twyman CL, Arnold DL, et al. CARE‑MS II investigators. Alemtuzumab for patients with relapsing multiple sclerosis after disease‑modifying therapy: a randomised controlled phase 3 trial. Lancet 2012; 380: 1829–1839.
- [69] Wray S, Arnold DL, Cohen J, et al. Infection risk reduced with acyclovir prophylaxis after alemtuzumab. In Proceedings of the Annual Meeting of the Consortium of Multiple Sclerosis Centers (CMSC), Orlando, FL, USA, 27–30 May 2013.
- [70] Hradílek P, Hon P. Listeriová meningitida po aplikaci alemtuzumabu pro relaps‑remitentní sclerosis multiplex. Neurol praxi 2017; 18: 196–200.
- [71] Ruck T, Bittner S, Wiendl H, et al. Alemtuzumab in Multiple Sclerosis: Mechanism of Action and Beyond. Int J Mol Sci 2015; 16: 16414–16439.
- [72] Hu Y, Turner MJ, Shields J, et al. Investigation of the mechanism of action of alemtuzumab in a human CD52 transgenic mouse model. Immunology 2009; 12: 260–270.
- [73] Schreiber K, Sörensen PS. Cladribine in the treatment of multiple sclerosis. Clin Invest 2011; 1: 317–326.
- [74] Cook S, Vermersch P, Comi G, et al. CLARITY Study Group. Safety and tolerability of cladribine tablets in multiple sclerosis: the CLARITY (CLAdRIbine Tablets treating multiple sclerosis orallY) study. Mult Scler 2011; 17: 578–593.
- [75] Leist TP, Comi G, Cree BA, et al. Oral cladribine for early MS (ORACLE MS) Study Group. Effect of oral cladribine on time to conversion to clinically definite multiple sclerosis in patients with a first demyelinating event (ORACLE MS): a phase 3 randomised trial. Lancet Neurol 2014; 13: 257–267.
- [76] Milo R. Therapeutic strategies targeting B‑cells in multiple sclerosis. Autoimmun Rev 2016; 15: 714–718.
- [77] Hauser SL, Bar‑Or A, Comi G, et al. OPERA I and OPERA II Clinical Investigators. Ocrelizumab versus Interferon Beta‑1a in Relapsing Multiple Sclerosis. N Engl J Med 2017; 376: 221–234.
- [78] Montalban X, Hauser SL, Kappos L, et al. ORATORIO Clinical Ocrelizumab versus Placebo in Primary Progressive Multiple Sclerosis. N Engl J Med 2017; 376: 209–220.
- [79] Preiningerova JL, Vachova M. Daclizumab high‑yield process in the treatment of relapsing‑remitting multiple sclerosis. Ther Adv Neurol Disord 2017; 10: 67–75.
- [80] Wynn D, Kaufman M, Montalban X, et al. Daclizumab in active relapsing multiple sclerosis (CHOICE study): a phase II, randomised, double‑blind, placebo controlled, add‑on trial with interferon beta. Lancet Neurol 2010; 9: 381–390.
- [81] Gold R, Giovannoni G, Selmaj K, et al. SELECT study investigators. Daclizumab high‑yield process in relapsing‑remitting multiple sclerosis (SELECT): a randomised, double‑blind, placebo‑controlled trial. Lancet 2013; 381: 2167–2175.
- [82] Kappos L, Wiendl H, Selmaj K, et al. Daclizumab HYP versus Interferon Beta‑1a in Relapsing Multiple Sclerosis. N Engl J Med 2015; 373: 1418–1428.