Inhibitory JAK v léčbě pacientů s revmatoidní artritidou – zkušenosti z reálné klinické praxe
Letošní kongres Evropské ligy proti revmatismu (European League Against Rheumatism, EULAR) – EULAR 2020, který se měl konat ve Frankfurtu nad Mohanem, přivítal své účastníky na virtuální platformě. V důsledku pandemie COVID‑19 došlo v organizaci mnoha hromadných profesních setkání k přechodu na e‑verzi s cílem zajistit setkání odborné veřejnosti, prezentaci nejnovějších poznatků a diskusi přes internet. Od 3. června 2020 měla odborná veřejnost zajímající se o aktuální vývoj v oblasti revmatologie možnost sledovat virtuální kongres. Vědecký program e‑kongresu sestavený špičkovými odborníky z celého světa přinesl zajímavé přednášky. Sympozium společnosti Pfizer se zaměřilo na léčbu inhibitory JAK (Janusovy kinázy) u pacientů s revmatoidní artritidou (RA).
Doktorka Anja Strangfeld (German Rheumatism Research Centre, Berlín, Německo), vedoucí německého registru biologických léčiv pro revmatoidní artritidu RABBIT, v úvodním vystoupení zdůraznila jedinečnost každého pacienta a jeho individuální potřeby, na které je třeba při volbě terapie pamatovat. Randomizované klinické studie poskytují důležité informace o účinnosti léčiva a jeho bezpečnostním profilu, data z reálného prostředí přinášejí údaje od skutečných pacientů z ordinace, jejichž charakteristiky jsou více heterogenní a každý pacient má svá specifika. Tyto poznatky společně pomáhají formovat doporučení a léčebná rozhodnutí pro klinickou praxi. Cílem je identifikovat nejvhodnější léčebné možnosti k dosažení remise, kdy je onemocnění pod kontrolou a poměr přínosů a rizik je pro pacienta přijatelný.
Doktor Axel Finckh (Geneva University Hospital, Ženeva, Švýcarsko) se ve své prezentaci věnoval právě hodnotě dat z reálného prostředí. Evropská léková agentura je definuje jako rutinně sbíraná data týkající se zdravotního stavu pacienta nebo poskytované zdravotní péče, která přinášejí evidenci o léčivu mimo randomizované klinické studie (Cave, et al., Clin Pharm Ther 2019). Data z reálného prostředí ukazují, jak se léčivo chová v klinické praxi, nesoutěží s daty z randomizovaných klinických hodnocení, ale doplňují je. Tyto údaje pomáhají zhodnotit dále profil léčiva z hlediska přínosů a rizik, rozšiřují poznatky z klinických studií a přinášejí komplexní pohled na léčivo v klinické praxi.
Evidence z reálného prostředí představuje důvěryhodný zdroj informací; k získání relevantní informace a plnému využití potenciálu těchto dat je nicméně třeba stále zlepšovat používané analytické metody (Katkade, et al., J Multidiscip Health 2018). Informace mohou být sbírány prospektivně nebo retrospektivně. Mezi základní zdroje dat z reálného prostředí patří registry RA (německý RABBIT, švýcarský SCQM, britský BSRBR, pro Evropu JAKPOT, australský OPAL QUMI a americký Corrona Registry) a tzv. hlášená data v klinické praxi (zdravotnické databáze MarketScan, Medicare, Optum).
Klinické studie představují prostředí sledující léčbu za přísně kontrolovaných podmínek u selektované populace pacientů. Na základě výsledků je pak přípravek schválen pro použití. Data z reálného prostředí sledují použití přípravku po schválení u rozmanitější populace a za rozličných podmínek (přítomné komorbidity, různá historie léčby aj.) a de facto potvrzují u širší populace v klinické praxi závěry, které prokázaly randomizované klinické studie u vybrané populace.
Doktor Finckh zdůraznil, že síla dat z reálného prostředí spočívá právě v různorodosti sledované populace, ve sledování léčby v průběhu reálných rozhodovacích procesů, v získání detailnější informace za delší časové období a v neposlední řadě ve srovnání s ostatními léčivy, které není v rámci randomizovaných klinických studií možné. Také pacienti v reálném prostředí nejsou stoprocentně compliantní. Registry a tzv. hlášená data poskytují informace od velkého množství pacientů.
Limitací dat z reálného prostředí je náchylnost k bias – nižší standardizace dat, skupiny pacientů nemusejí být srovnatelné, geograficky se může lišit úroveň péče i léčebné postupy, sběr dat nemusí být dostatečný (chybějící, chybná data) apod. Ke zlepšení standardizace dat se užívají statistické metody, jako je například metoda propensity score matching nebo propensity score trimming.
Doktor Finckh připomněl, jak informace z reálného prostředí ovlivnily přístupy v reálné praxi. Metotrexát, který je považován za zlatý standard v léčbě pacientů s RA, neprokázal v randomizovaných klinických studiích superioritu oproti konvenčním syntetickým antirevmatickým lékům (csDMARDs), nicméně data z registrů prokázala u metotrexátu oproti jiným csDMARDs přínos v mnohem lepší perzistenci v léčbě. Data z registrů také napomohla identifikovat asociaci léčby zaměřené proti tumor nekrotizujícímu faktoru (anti TNF) s vyšším rizikem oportunních infekcí (zejména tuberkulózy) a odhalit zvýšený výskyt závažných infekcí, na který randomizované klinické studie neupozornily. Evidence z reálného prostředí rovněž upozornily na asociaci vysoké aktivity RA a zvýšeného kardiovaskulárního rizika a výskytu lymfomů a podpořily koncept léčby k cíli (treat to target). Tyto poznatky z každodenní praxe u rozmanité populace pacientů jsou velmi důležité zejména u nově zaváděných lékových skupin.
Doktor Paul Bird (University of New South Wales, Sydney, Austrálie) navázal svým sdělením, které se zabývalo účinností inhibitorů JAK u pacientů s RA léčených v reálném prostředí a perzistencí těchto nemocných.
Data z randomizovaných klinických studií ukazují, že inhibitory JAK jsou u pacientů s RA přinejmenším stejně účinné jako inhibitory TNF. Klinické hodnocení ORAL Strategy (Fleischmann, et al., Lancet 2017) potvrdilo non inferioritu tofacitinibu oproti adalimumabu v kombinované léčbě s metotrexátem. Tofacitinib byl prvním schváleným inhibitorem JAK pro léčbu pacientů s RA, proto také většina dostupných dat z reálného prostředí, která se týkají účinnosti inhibitorů JAK a perzistence v léčbě, je dostupná právě u tofacitinibu. Pro další schválené inhibitory JAK (baricitinib, upadacitinib) je zatím k dispozici méně informací. Například italská observační multicentrická studie (Guidelli, et al.) s baricitinibem prokázala u 150 pacientů dobrou účinnost na snížení aktivity nemoci po 12 a 24 týdnech sledování a příznivou snášenlivost léčby.
Pro tofacitinib jsou dostupná data
mnohem robustnější. Recentně publikovaná kohortová studie
OPAL QUMI (Bird, et al., Clin Rheumatol 2020), která využila
data pacientů z australského registru, retrospektivně
hodnotila účinnost to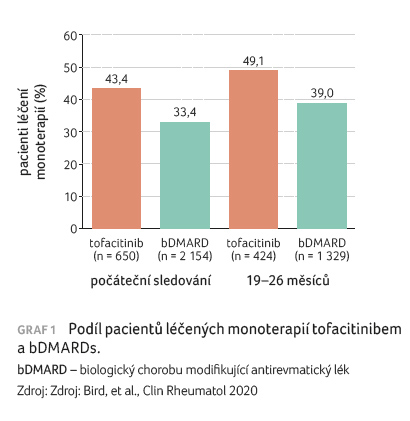 facitinibu u pacientů s RA a jejich
perzistenci v léčbě. Do sledování (květen 2015 − září
2018) byli zahrnuti pacienti, kteří zahájili léčbu tofacitinibem
nebo biologickými chorobu modifikujícími antirevmatickými léky
(bDMARDs) a pokračovali v léčbě minimálně 12 měsíců.
Pacienti mohli být současně léčeni csDMARDs. Ve skupině
léčené tofacitinibem bylo zahrnuto 650 pacientů, ve skupině
s bDMARDs 1 300 pacientů. Aktivita nemoci byla hodnocena
pomocí indexů DAS28 (ESR) (Disease Activity Score, hodnoceno
u 28 kloubů a pomocí sedimentace erytrocytů), CDAI
(Clinical Disease Activity Index) a SDAI (Simplified Disease
Activity Index). Oproti jiným bDMARDs byl tofacitinib užíván jako
monoterapie u vyššího podílu sledovaných (43,4 % vs.
33,4 %) a tendence k monoterapii se v průběhu
sledování ještě zvětšila (graf 1); podíl pacientů léčených monoterapií se zvýšil
v obou skupinách (49,1 % vs. 39,0 %). Osmnáctiměsíční
sledování prokázalo u obou skupin srovnatelný podíl
pacientů, kteří dosáhli remise (graf 2) a srovnatelné perzistence.
facitinibu u pacientů s RA a jejich
perzistenci v léčbě. Do sledování (květen 2015 − září
2018) byli zahrnuti pacienti, kteří zahájili léčbu tofacitinibem
nebo biologickými chorobu modifikujícími antirevmatickými léky
(bDMARDs) a pokračovali v léčbě minimálně 12 měsíců.
Pacienti mohli být současně léčeni csDMARDs. Ve skupině
léčené tofacitinibem bylo zahrnuto 650 pacientů, ve skupině
s bDMARDs 1 300 pacientů. Aktivita nemoci byla hodnocena
pomocí indexů DAS28 (ESR) (Disease Activity Score, hodnoceno
u 28 kloubů a pomocí sedimentace erytrocytů), CDAI
(Clinical Disease Activity Index) a SDAI (Simplified Disease
Activity Index). Oproti jiným bDMARDs byl tofacitinib užíván jako
monoterapie u vyššího podílu sledovaných (43,4 % vs.
33,4 %) a tendence k monoterapii se v průběhu
sledování ještě zvětšila (graf 1); podíl pacientů léčených monoterapií se zvýšil
v obou skupinách (49,1 % vs. 39,0 %). Osmnáctiměsíční
sledování prokázalo u obou skupin srovnatelný podíl
pacientů, kteří dosáhli remise (graf 2) a srovnatelné perzistence.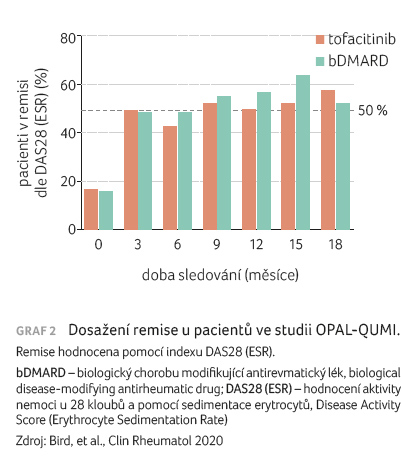
Dalším klinickým hodnocením
z reálné klinické praxe (Finckh, et al., RMD Open 2020) je
studie, která použila data pacientů ze švýcarského
observačního registru SCQM (Swiss Clinical Quality Management in
Rheumatic Diseases). Studie porovnávala u pacientů s RA
léčbu tofacitinibem (n = 793), anti TNF léčbu
(n = 1 847), mezi nimi adalimumab, etanercept, golimumab,
certolizumab nebo infliximab, a terapii přípravky s jiným
mechanismem účinku (n = 1 338), kde byly zahrnuty
abatacept, sarilumab a tocilizumab. Současně mohly, ale
nemusely být podávány csDMARDs. Průměrný věk pacientů se
pohyboval mezi 50 a 60 lety, převažovaly ženy. Mezi skupinami
na počátku sledování bylo možné zaznamenat určité
rozdíly; pacienti užívající anti TNF léčbu byli mladší,
s kratší dobou trvání onemocnění a konkomitantní
léčba metotrexátem u nich byla pravděpodobnější. Výsledky
sledování ukázaly (graf 3),
že perzistence při anti TNF léčbě byla oproti léčbě
tofacitinibem výrazně nižší (poměr rizik [HR] 1,29; 95%
interval spolehlivosti [CI] 1,14–1,47) a konkomitantní léčba
csDMARDs nezlepšila adjustovanou perzistenci v léčbě
tofacitinibem ani biologiky s jiným mechanismem účinku.
Naopak u anti TNF léčby byla perzistence nejnižší při
monoterapii. Nejčastějším důvodem pro přerušení terapie byla
její neúčinnost; při léčbě tofacitinibem však byl počet
jejích přerušení o polovinu nižší než při anti TNF
léčbě. Pro nežádoucí příhody byla léčba častěji
přerušována u tofacitinibu ve srovnání s anti TNF
léčbou nebo terapií přípravky s jiným mechanismem účinku.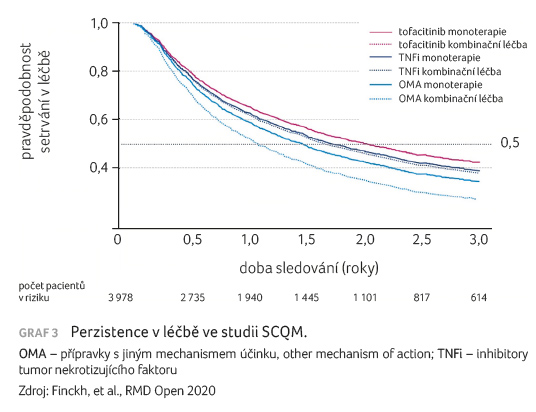
Doktor Bird shrnul své sdělení vyjádřením, že jak ukazují data z reálné klinické praxe, inhibitory JAK jsou v managementu léčby RA stejně účinné jako inhibitory TNF. Data z registrů ukazují, že četnost dosažení remise je při léčbě tofacitinibem a jinými biologiky srovnatelná (OPAL QUMI) a že v porovnání s anti TNF léčbou je riziko přerušení léčby u tofacitinibu nižší (SCQM). U tofacitinibu byla zaznamenána obdobná perzistence v léčbě při monoterapii i při konkomitantním podávání csDMARDs, stejně tak tomu bylo u biologik s jiným mechanismem účinku. U anti TNF léčby byla naopak monoterapie spojena s nejnižší perzistencí.
Poslední řečník – doktor Joel Kremer (Albany Medical College, Albany, New York, USA) – se věnoval bezpečnosti léčby inhibitory JAK u pacientů s RA a dokladům v reálné praxi. V úvodu připomněl, že bezpečnost inhibitorů JAK demonstrovaly ve velkém rozsahu randomizované klinické studie a smyslem dat z reálného prostředí je potvrdit tyto závěry a zaměřit se případně na specifické nežádoucí příhody u dané lékové skupiny a na sledování u rozmanité populace pacientů.
Bezpečnost a účinnost tofacitinibu u pacientů se středně závažnou a závažnou RA hodnotil rozsáhlý klinický program ORAL. Na pacienty nedostatečně odpovídající na léčbu metotrexátem se zaměřily studie ORAL Standard, ORAL Scan, ORAL Strategy, ORAL Shift a ORAL Surveillance, která dosud probíhá. Léčbu tofacitinibem u pacientů s RA nedostatečně odpovídajících na csDMARD hodnotily studie ORAL Solo a ORAL Sync a pacienty nedostatečně odpovídající na bDMARD sledovala studie ORAL Step. Studie doložily obdobný bezpečnostní profil s dalšími bDMARDs s výjimkou rizika vzniku herpes zoster a probíhající studie ORAL Surveillance upozornila na potenciální riziko žilního tromboembolismu.. Při terapii inhibitory JAK byl zaznamenán vyšší výskyt těchto nežádoucích příhod a patrně se jedná o tzv. class effect. Dle recentních terapeutických doporučení EULAR by proto měly být inhibitory JAK u pacientů se zvýšeným rizikem tromboembolických příhod používány s opatrností.
Za klíčové zdroje informací z reálného prostředí pro léčbu tofacitinibem označil doktor Kremer americký registr US Corrona RA Registry (v USA je tofacitinib schválen pro použití již od roku 2012) a zdravotnické databáze (MarketScan, Medicare, Optum).
Ve svém sdělení se doktor Kremer dále zaměřil na jednotlivé nežádoucí příhody vyžadující zvláštní pozornost. Mezi nimi můžeme jmenovat závažné infekce, oportunní infekce, TBC, velké kardiovaskulární příhody (MACE), malignity, nemelanomové nádory kůže, lymfomy, perforace trávicího traktu, plicní embolii nebo hlubokou žilní trombózu.
Data z reálného prostředí shromažďuje rozsáhlý registr Corrona, který byl založen již v roce 2001. Představuje největší prospektivní kohortovou studii pacientů s RA, shromažďuje data od lékařů i pacientů. Na výskyt MACE, malignit a závažných infekcí u pacientů s RA, kteří zahájili léčbu tofacitinibem nebo bDMARD společně s konkomitantní léčbou csDMARDs nebo bez ní, se zaměřilo pětileté sledování (v letech 2012–2017). Tofacitinibem bylo léčeno celkem 1 117 pacientů, bDMARDs 5 542 pacientů. Věkově byla populace srovnatelná, z hlediska pohlaví tvořily většinu ženy. Dosažení remise dle CDAI bylo v obou skupinách srovnatelné. Co se týče incidence závažných infekcí a infekce herpes zoster analyzovaných statisticky (propensity score matching, propensity score trimming), byl výskyt závažných infekcí v obou skupinách srovnatelný, výskyt herpes zoster byl při léčbě tofacitinibem vyšší (Kremer, et al., EULAR 2019). Další informace o výskytu závažných infekcí (vyžadujících hospitalizaci) poskytla analýza dat ze zdravotnických databází ve Spojených státech amerických (Medicare, Optum a MarketScan), která zahrnula 6 278 pacientů, u nichž byla zahájena léčba tofacitinibem, a 124 440 pacientů, kteří započali léčbu bDMARDs (Pawar, et al., Lancet Rheumatol 2020). V databázi Medicare byl průměrný věk sledovaných 72 let, v databázi Optum 52 let a v MediScan 54 let. Výsledky ukázaly, že při léčbě tofacitinibem je výskyt závažných infekcí srovnatelný jako při léčbě bDMARDs, s výjimkou etanerceptu, kde byl zaznamenán významně nižší výskyt závažných infekcí. Výskyt herpes zoster byl zhruba dvojnásobně vyšší při léčbě tofacitinibem oproti jiným bDMARDs. Tyto závěry jsou v souladu s výsledky randomizovaných klinických studií i s analýzou dat z registru Coronna. Při analýze dat podle věku pacientů ve všech léčebných skupinách byl vyšší výskyt závažných infekcí zaznamenán u pacientů starších 65 let. Při srovnání tofacitinibu a dalších bDMARDs nebyl ve výskytu závažných infekcí u mladších i starších pacientů ve všech léčebných skupinách byl pozorován rozdíl s výjimkou etanerceptu a tocilizumabu; zde bylo riziko závažných infekcí u starších nemocných statisticky významně nižší, a naopak u pacientů mladších 65 let bylo riziko závažných infekcí vyšší u infliximabu a tocilizumabu.
Kardiovaskulární bezpečnost léčby tofacitinibem hodnocená pomocí incidence MACE byla v randomizovaných klinických studiích srovnatelná s bDMARDs. Stejné závěry přinesla data z registru Coronna.
Co se týče výskytu hluboké žilní trombózy a plicní embolie, nepotvrdily dokončené randomizované klinické studie při srovnání s léčbou adalimumabem a metotrexátem zýšené riziko (Mease, et al., EULAR 2018). Doktor Kremer dále představil dosud probíhající studii ORAL Surveillance, která sleduje u 4 000 pacientů ve věku 50 a více let se středně závažnou nebo závažnou RA a s jedním nebo více rizikovými kardiovaskulárními faktory výskyt MACE a malignit (kromě nemelanomových nádorů kůže). Pacienti s nedostatečnou odpovědí na léčbu metotrexátem byli randomizováni v poměru 1 : 1 : 1 k podávání tofacitinibu v dávce 5 mg dvakrát denně nebo 10 mg dvakrát denně (v této dávce není v EU přípravek schválen pro léčbu RA) nebo k subkutánnímu podávání adalimumabu v dávce 40 mg každé dva týdny nebo etanerceptu 50 mg týdně. Vždy v kombinaci s metotrexátem. Toto otevřené klinické hodnocení typu event driven vyžaduje minimálně 1 500 pacientů sledovaných po dobu tří let. Podávání tofacitinibu v dávce 10 mg dvakrát denně bylo ukončeno a pacienti byli převedeni na dávku 5 mg dvakrát denně z důvodu vyššího výskytu plicní embolie a vyšší celkové mortality v této větvi oproti nižší dávce tofacitinibu i ve srovnání s inhibitory TNF. Studie ORAL Surveillance zatím nebyla ukončena, konečné výsledky jsou teprve očekávány.
Podle dat registru Coronna, který sleduje tofacitinib ve schválených dávkách 5 mg dvakrát denně nebo 11 mg podávaných jednou denně, je výskyt plicní embolie, hluboké žilní trombózy i žilního tromboembolismu při léčbě tofacitinibem srovnatelný s bDMARDs (Kremer, et al., EULAR 2019). Další výsledky přinesla analýza dat z databází Medicare a MarketScan (Desai, et al., Arthritits Rheumatol 2019), která sledovala riziko žilního tromboembolismu u pacientů s RA léčených tofacitinibem (n = 2 905) vs. bDMARDs (n = 48 255). Průměrný věk pacientů v databázi Medicare byl 71 let a v MarketScan 50 let. Na základě dat z obou databází ani při následné poolované analýze nebyly při porovnání anti TNF léčby a tofacitinibu zjištěny žádné signifikantní rozdíly ve výskytu žilního tromboembolismu.
Další sledovanou oblastí je incidence malignit a nemelanomových nádorů kůže. V rozsáhlém klinickém programu ORAL byl jejich výskyt při léčbě tofacitinibem srovnatelný s terapií bDMARDs, ke stejným závěrům dospěla analýza dat registru Coronna.
Mortalitu pacientů v závislosti na dávce tofacitinibu hodnotila integrovaná bezpečnostní analýza (Cohen, et al., American College of Rheumatology, Chicago 2018), která zahrnula data z dokončených randomizovaných klinických studií fáze I−III včetně dlouhodobých extenzí. Její závěry prokázaly srovnatelnou mortalitu pro všechny dávky tofacitinibu (hodnoceny všechny dávky dohromady, dávka 5 mg dvakrát denně a dávka 10 mg dvakrát denně). Ad hoc analýza ORAL Surveillance zaznamenala vyšší mortalitu u pacientů léčených tofacitinibem v dávce 10 mg dvakrát denně při srovnání s anti TNF léčbou, hlavními příčinami byly kardiovaskulární příhody, infekce a malignity. Data z reálného prostředí (registr Coronna) doložila srovnatelnou incidenci úmrtí mezi pacienty léčenými tofacitinibem a bDMARDs (Kremer, et al., Arthritis Rheumatol 2019).
Doktor Kremer shrnul prezentované výsledky. Randomizované klinické studie upozornily na zvýšené riziko herpes zoster u pacientů léčených inhibitory JAK a jako nezanedbatelné bylo identifikováno riziko žilního tromboembolismu, které bylo zavzato Evropskou lékovou agenturou do preskripčních informací. Evidence reálné klinické praxe doplnila následně poznatky; z hlediska nežádoucích příhod vyžadujících zvláštní pozornost je léčba tofacitinibem srovnatelná s bDMARDs s výjimkou vyššího rizika herpes zoster. Co se týče žilního tromboembolismu, registr Corrona ani analýza dat zdravotnických databází nezaznamenaly při terapii tofacitinibem zvýšené riziko oproti bDMARDs. Dle dat z reálné klinické praxe není u pacientů léčených tofacitinibem signifikantně vyšší ani riziko závažných infekcí, a to bez ohledu na věk.
Doktorka Anja Strangfeld v závěru shrnula klíčové body sympozia. Data z reálného prostředí poskytují potřebné informace o účinnosti a bezpečnosti léčby a jedinečné informace o terapii ve specifických klinických situacích, jež klinické studie nemohou poskytnout. To je z hlediska personalizované medicíny, která činí léčebná rozhodnutí mnohdy obtížnými, velmi přínosné. Tofacitinib je inhibitorem JAK s největším objemem dat z reálného prostředí, která doplňují poznatky z randomizovaných klinických studií. Výsledky sledování reálné klinické praxe přinesly shodná data o účinnosti tofacitinibu demonstrované v randomizovaných klinických studiích a bezpečnostní data u rozmanitých kohort pacientů doplnila zjištěné poznatky.
Redakčně zpracovala PharmDr. Kateřina Viktorová