Invazivní meningokoková onemocnění a novinky v úhradě očkování od 1. ledna 2022
Souhrn:
Siráková L, Smetana J, Chlíbek R, Chmelař J, Šmahel P, Rumlarová Š. Invazivní meningokoková onemocnění a novinky v úhradě očkování od 1. ledna 2022. Remedia 2022; 32: 68–72.
Invazivní meningokokové onemocnění (IMO) patří mezi velmi závažná infekční onemocnění vyvolaná bakterií Neisseria meningitidis, zkráceně meningokokem, a to nejčastěji séroskupinami A, B, C, W, Y. I přes včasné zahájení léčby dosahuje smrtnosti 8–15 % a k úmrtí může dojít za 24–48 hodin od objevení se prvních příznaků. Přenáší se kapénkami od manifestně nemocného jedince, ale i od asymptomatického nosiče. Klinickou formou onemocnění je meningokoková sepse, meningokoková meningitida či jejich smíšená forma. Častý bývá perakutní průběh s náhlým začátkem z pocitu plného zdraví. Incidence IMO je nejvyšší u dětí od narození do věku 11 měsíců a od jednoho do čtyř let, dále u adolescentů a mladých dospělých ve věku 15–24 let. I v případě vyléčení hrozí trvalé následky, jakými jsou např. amputace, mentální retardace nebo hluchota. Nejvýznamnější a nejúčinnější ochranou proti IMO zůstává očkování, a to zejména malých dětí a adolescentů. Vakcinováni by měli být i cestovatelé a tzv. rizikové osoby. Novinkou od ledna 2022 je hrazené očkování proti onemocnění vyvolanému meningokokem séroskupiny B, bude‑li očkování zahájeno první dávkou do dovršení 12. měsíce věku dítěte nebo v období od dovršeného 14. do dovršeného 15. roku věku adolescentů a očkování proti onemocnění vyvolanému séroskupinami A, C, W, Y, pokud bude provedeno v období od jednoho do dvou let věku kojence, a rovněž u adolescentů ve věkovém období od 14 do 15 let. Tím se očekává nárůst proočkovanosti zejména v nejohroženějších věkových skupinách a pokles rizika onemocnění v proočkované populaci.
Summary:
Sirakova L, Smetana J, Chlibek R, Chmelar J, Smahel P, Rumlarova S. Invasive meningococcal disease and updates in the vaccine reimbursement since January 1, 2022. Remedia 2022; 32: 68–72.
Invasive meningococcal disease (IMD) is a severe infectious disease caused by Neisseria meningitidis, abbreviated to meningococcus, most commonly by serogroups A, B, C, W, and Y. Despite early treatment, the death rate is 8−15%, and death can occur 24−48 hours after the first symptoms appear. It is transmitted by droplets from a manifestly ill individual but also an asymptomatic carrier. The clinical form of the disease is meningococcal sepsis, meningococcal meningitis or their mixed form. A peracute course with a sudden start from a sense of full health is common. The incidence of IMD is highest among children from birth to 11 months and from one to four years of age, as well as adolescents and young adults aged 15−24 years. Even if cured, there is a risk of permanent effects such as amputations, mental retardation or deafness. Vaccination, particularly of young children and adolescents, remains the most important and effective protection against the onset of IMD. Travellers and so‑called at‑risk people should also be vaccinated. New from January 2022 is reimbursed vaccination against meningococcal serogroup B disease if the vaccination is started with the first dose by the age of 12 months or between the age of 14 and the age of 15 years in adolescents. In addition, vaccination against the disease caused by serogroups A, C, W, and Y is now reimbursed if carried out between one and two years of the infant's age and in adolescents between 14 and 15 years of age. The newly reimbursed vaccinations are expected to increase vaccination coverage, especially in the most vulnerable age groups and decrease disease distribution in the pro‑vaccination population.
Key words: invasive meningococcal disease, vaccination, Meningococcus, serogroup A, B, C, W, Y
Úvod
Invazivní meningokokové onemocnění (IMO) se díky častému fulminantnímu průběhu s vysokou smrtností a možným výskytem trvalých následků u přeživších stále řadí mezi velmi závažné infekční choroby. Původcem je gramnegativní diplokok Neisseria meningitidis [1,2]. K nákaze dochází po těsném kontaktu s manifestně nemocným jedincem, většinou však s asymptomatickým nosičem. Ve většině případů se pak nemoc projeví jako meningokoková sepse, meningokoková meningitida či jejich smíšená forma [3]. Incidence IMO je nejvyšší u dětí ve věku 0–11 měsíců a od jednoho do čtyř let, dále u adolescentů a mladých dospělých ve věku 15–24 let [2,4,5]. K úmrtí může dojít i přes včasně zahájenou léčbu do 24–48 hodin od prvních příznaků onemocnění. Smrtnost se průměrně udává 10 % [6] a nepředstavuje jediné riziko. Vyléčení jedinci mohou utrpět amputace končetin, smyslové poruchy (zejména hluchotu) či mentální retardaci [2]. V posledních letech je zaznamenáván pokles nemocnosti IMO pravděpodobně související s rozšiřujícími se možnostmi očkování i s opatřeními přijatými kvůli šíření pandemie COVID 19. Právě vakcinace zůstává největší smysluplnou prevencí.
Etiologie, patogeneze,
asymptomatické nosičství
Meningokok Neisseria meningitidis je opouzdřený patogen, nesporulující, kultivačně velmi náročný, citlivý na vnější vlivy prostředí (jako je vyschnutí či dezinfekce). Na základě antigenních rozdílů polysacharidu bakteriálního pouzdra se u meningokoků rozeznává 13 různých sérologických skupin označovaných jako A, B, C, D, 29E, H, I, K, L, W, X, Y a Z. Život ohrožující IMO je nejčastěji způsobeno skupinami A, B, C, W, X a Y. Podle nekapsulárních antigenů buněčné stěny (proteinových a lipopolysacharidových) lze určit ještě sérotyp a subtyp. U některých kmenů není možné sérotyp ani subtyp určit, takové kmeny se pak označují jako netypovatelné (NT) a nesubtypovatelné (NST) [7]. V posledních letech se k typizaci stále více využívají molekulární techniky založené na polymerázové řetězové reakci (polymerase chain reaction, PCR) a následném sekvenování kyseliny deoxyribonukleové (DNA) [8]. V ČR provádí molekulární typizaci Národní referenční laboratoř (NRL) Státního zdravotního ústavu pro meningokokové nákazy [2]. Adheziny, polysacharidy pouzdra a endotoxiny patří mezi nejdůležitější faktory virulence [3]. Endotoxiny uvolňované do krevního řečiště výrazně ovlivňují samotný průběh onemocnění. Rychle aktivují zánětlivou a koagulační kaskádu, čímž se dá vysvětlit velký sklon k diseminované intravaskulární koagulaci (DIC) [1]. Po kolonizaci nosohltanu meningokokem obvykle nedochází ke klinickým projevům onemocnění. Může se však rozvinout asymptomatické nosičství, které přetrvává průměrně 9,6 měsíce a při jehož vzniku hraje podstatnou roli věk [2]. Vrcholu dosahuje v 19 letech. Ojediněle se primární nákaza projeví jako nekomplikovaná faryngitida.
Klinický obraz, terapie
Inkubační doba meningokokových onemocnění se pohybuje od jednoho do osmi dnů. Nákaza se přenáší kapénkami vzdušnou cestou nebo slinami. Převážná část onemocnění vykazuje sezonní charakter s maximem výskytu v zimním a jarním období [1]. Pro onemocnění je typický náhlý začátek z pocitu plného zdraví. Zpočátku jsou obtíže nespecifické, pacient bývá febrilní, stěžuje si na bolesti hlavy, svalů a kloubů, nevolnosti, zvracení. Rozvíjejí se pozitivní známky meningeálního dráždění s různým stupněm poruchy vědomí. Meningokokovou meningitidu nelze klinicky odlišit od ostatních purulentních meningitid. Pokud bakterie proniknou do krevního řečiště, putují k cílovým orgánům, které poškozují, mnohdy fatálně. U většiny pacientů se nemoc manifestuje jako meningokoková sepse, meningokoková meningitida či jejich smíšená forma [3].
Meningokoková sepse postihující přibližně čtvrtinu pacientů je nejzávažnější a neléčená dosahuje smrtnosti až 80 %. I přes adekvátně zahájenou léčbu umírá až 25 % pacientů [1,5,6]. Další čtvrtinu případů tvoří meningokoková meningitida, jejíž smrtnost je v klinické praxi v důsledku meningokokcemie obvykle vyšší než literárně udávaná 2–3 % [10]. Zhruba polovinu případů tvoří smíšená forma onemocnění, léčené případy dosahují letality 10 %. Při pomýšlení na IMO je iniciální diagnostika klinická (vychází z anamnézy a fyzikálního vyšetření pacienta). Poměrně brzy se objevují petechie, jejichž rozlišení od jiných exantémů pomocí tzv. sklíčkové metody je podstatné. Krvácivé projevy jsou většinou daleko nápadnější u sepse. Exantém pod sklem vymizí či bledne, zatímco petechie přetrvávají. Další progrese do sepse s příznaky zahrnujícími tachykardii, tachypnoi a hypotenzi bývá bez adekvátní pomoci rychlá. Neléčený pacient může zemřít během několika hodin na důsledek septického šoku. O zhoršování celkového stavu svědčí zvětšování sufuzí až do tzv. fulminantní purpury, krvácení z míst předchozích vpichů a spontánní krvácení z kůže a sliznic. Příčinou úmrtí bývá multiorgánové selhání a u části pacientů myokarditida [1].
Meningokok vyvolává kromě život ohrožujících invazivních forem též neinvazivní formy onemocnění. Patří mezi ně zmíněná faryngitida, dále bronchitida či pneumonie. Existují i vzácnější projevy onemocnění, např. meningokoková purulentní artritida, perikarditida či pleuritida, konjunktivitida a uretritida. Různá vnímavost jedinců k meningokokové infekci může být částečně vysvětlena polymorfismy genů pro různé složky imunitního sytému (TNF, IL 1, komplement a dalších) [2]. U pacientů s poruchou komplementu (např. u deficitu terminálních složek C5–C9) vzniká vyšší vnímavost ke vzniku IMO a invazivní bakteriální onemocnění u nich může probíhat opakovaně [11]. Průběh onemocnění bývá často atypický, což ztěžuje i oddaluje určení správné diagnózy. Některé kmeny meningokoků jsou geneticky predisponovány k vysoké invazivitě. Označují se jako hypervirulentní [2].
Při podezření na IMO je nutné včasné zajištění základních vitálních funkcí a hlavně rychlé podání antibiotik (do jedné hodiny od suspekce), ideálně už v přednemocniční péči. Následuje transport pacienta na specializované pracoviště. Pokud je to možné, odebírají se hemokultury a krev pro PCR diagnostiku ještě před podáním první dávky antibiotik. Realizace odběrů však nesmí vést k odkládání léčby. Nezbytná je lumbální punkce s odběrem likvoru, popř. punkce výpotků k průkazu infekčního agens. Standardně se provádějí kultivace a PCR vyšetření, latexová aglutinační reakce a mikroskopické vyšetření. Likvor bývá u meningokokových meningitid zkalený, purulentní, v buněčném zastoupení převažují polymorfonukleáry v řádech tisíců, zvýšeny jsou hodnoty bílkoviny i laktátu, naopak sníženy jsou koncentrace glukózy. U smíšených forem onemocnění však může být likvor čirý s buněčným nálezem napodobujícím aseptickou meningitidu. Vstupní laboratorní nález má až u poloviny pacientů charakter spíše tzv. virové než bakteriální infekce, tedy nízké hodnoty C reaktivního proteinu (CRP) i prokalcitoninu, což může být poměrně zavádějící. Vyplývá to z perakutního průběhu, kdy se zánětlivé markery ještě nestihly vytvořit.
Lékem volby jsou cefalosporiny 3. generace, které lze podat dospělým i dětem. Dle citlivosti meningokoků zjištěné mikrobiologem lze použít i penicilin G. Alternativou zůstává chloramfenikol, jeho podání v této indikaci je však zcela výjimečné. Délka léčby je zpravidla 7–10 dnů, vyplývá ze závažnosti stavu pacienta. Diagnóza IMO musí být potvrzena průkazem N. meningitidis z materiálu, který je za normálních podmínek sterilní. Prostý kultivační nález bakterie v nosohltanu může být projevem pouhého nosičství. Asymptomatickým nosičům není doporučeno podávat antibiotika. Profylakticky se antibiotika podávají osobám, které byly v těsném kontaktu s pacientem s IMO. Jako lék volby lze použít fenoxymetylpenicilin, při alergii pak makrolid nebo cefalosporin 1. nebo 2. generace. U osob starších 16 let je alternativou perorální ciprofloxacin 500 mg v jedné dávce. Pacient po prodělaném IMO je následně dispenzarizován až do odeznění případných zdravotních následků nebo do jejich stabilizace.
Epidemiologie invazivních
meningokokových onemocnění
Meningokoková onemocnění postihují ročně 500 tisíc až 1,2 milionu lidí, vyskytují se celosvětově [12]. Oblastí s dlouhodobě nejvyšším výskytem IMO je tzv. africký pás meningitidy v subsaharské Africe. Riziko vyššího výskytu IMO představuje také pouť do Mekky, neboť se zde scházejí lidé z celého světa. Incidence IMO v Evropě je v posledních letech 0,6 případu na 100 tisíc obyvatel s nejvíce případy hlášenými v Litvě, Irsku, Velké Británii a na Maltě [13]. V posledních letech nemocnost IMO klesá, což může souviset s rozšiřujícími se možnostmi očkování a v letech 2020–2021 i s opatřeními přijatými kvůli šíření pandemie COVID 19.
V České republice byl v roce
1993 zaveden program surveillance IMO s informacemi o počtu
onemocnění v jednotlivých letech včetně molekulární
charakteristiky meningokoků. Výsledné údaje vznikají propojením
rutinně hlášených epidemiologických dat (EPIDAT/ISIN) s daty
NRL pro meningokokové nákazy. Incidence IMO v ČR odpovídá
evropskému průměru a v letech 2010–2020 se pohybovala
v rozmezí 0,4–0,8 případu na 100 tisíc obyvatel
[14,15]. V roce 2020 byl kvůli opatřením proti
šíření onemocnění COVID 19 zaznamenán výrazný pokles
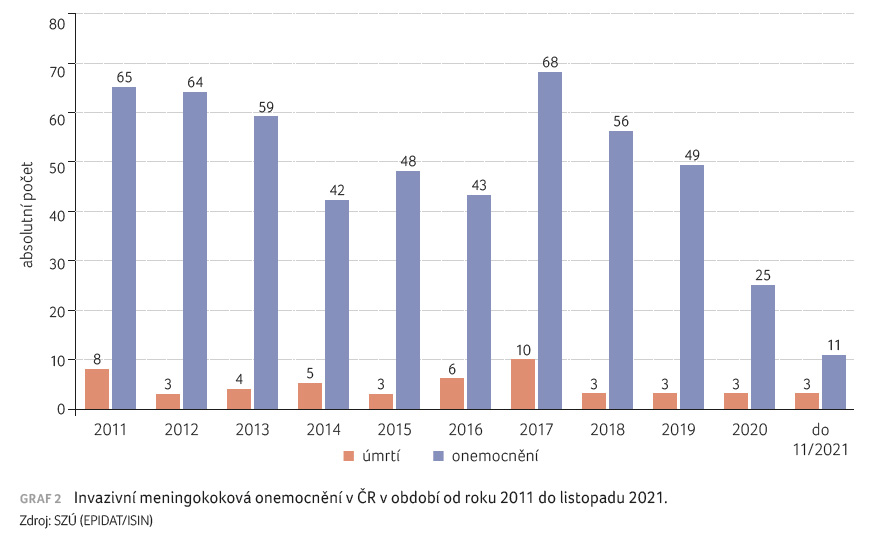
počtu IMO oproti roku 2019. Hlášeno bylo 25 případů oproti 49
případům v předcházejícím roce [15]. Letalita v roce
2020 stoupla ve srovnání s rokem 2019 z 6,1 %
na 12 %, v roce 2020 skončily tři případy úmrtím
[15].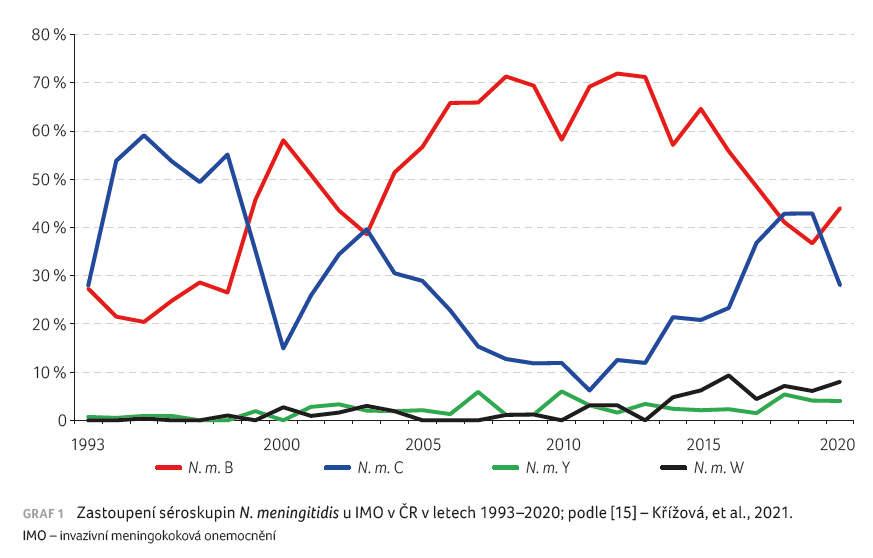
Během let se mění podíl jednotlivých séroskupin na celkovém počtu onemocnění, a to jak u nás, tak v jiných zemích. Obvykle to reflektuje zvolenou vakcinační strategii daného státu. Séroskupiny N. meningitidis v případě IMO v ČR v letech 1993–2020 znázorňuje graf 1. Dle dostupných dat lze konstatovat, že od roku 1993 se v ČR střídají období, kdy převažuje séroskupina B nebo C. V roce 2020 byla většina onemocnění způsobena séroskupinami B, C a W [15]. Ve srovnání s rokem 2019 došlo v roce 2020 k mírnému nárůstu zastoupení onemocnění způsobených séroskupinou B (na 44 % z 36,7 %) [15]. Podíl onemocnění způsobených séroskupinou C ve srovnání s předchozím rokem klesl ze 42,9 % na 28 % [15]. Onemocnění způsobená séroskupinou Y zůstávají víceméně na stejných hodnotách. Přes nízký podíl séroskupin W a Y způsobují tyto skupiny nejvyšší smrtnost ze všech meningokoků.
V roce 2021 pokračoval pokles výskytu závažných onemocnění způsobených N. meningitidis, Streptococcus pneumoniae a Haemophilus influenzae v souvislosti s opatřeními proti šíření onemocnění COVID 19. Vyplývá to z výsledků mezinárodní studie IRIS (Invasive Respiratory Infection Surveillance), jejíhož programu se účastní i ČR. Do listopadu 2021 bylo v ČR zjištěno celkem 11 případů IMO (zdroj SZÚ). Po uvolnění restriktivních opatření se očekává vzestup počtu případů IMO. Dlouhodobé sledování nemocnosti ve vybraných věkových skupinách ukazuje, že séroskupina B stabilně způsobuje nejvyšší nemocnost v nejmladší věkové kategorii 0–11 měsíců. Toto zjištění podporuje vakcinační strategii očkovat vakcínou MenB již v prvním půlroce života. Nejvyšším rizikem vzniku IMO jsou ohroženy malé děti ve věku do jednoho roku, adolescenti a mladí dospělí, osoby s chronickým onemocněním v tzv. rizikových skupinách, osoby pobývající ve velkých kolektivech, vybrané kategorie zdravotnických pracovníků a cestovatelé do zemí s vysokým výskytem IMO. Vrchol incidence IMO je v ČR u pacientů ve věku kolem pěti měsíců.
Určování séroskupin meningokoků má
význam nejen pro sledování epidemiologické situace, ale může
být využito i pro hodnocení klinického průběhu onemocnění
[11]. Séroskupina B je geneticky značně nehomogenní a IMO
probíhá ve většině případů jako meningitida.
U séroskupiny C převažuje v posledních letech v řadě
zemí hypervirulentní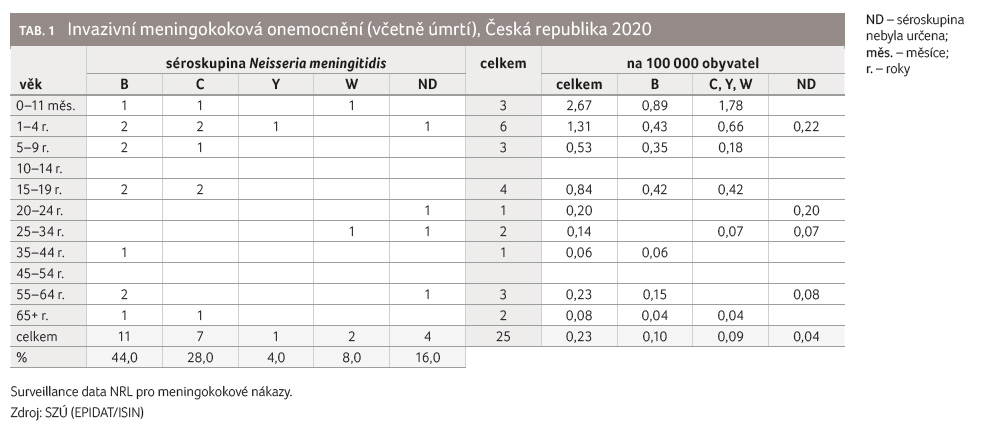 klonální komplex cc11, který způsobuje
septický průběh IMO s vysokou smrtností. U séroskupiny
Y převažuje hypervirulentní klonální komplex cc23 s atypickým
průběhem IMO, často pod klinickým obrazem pneumonie, rovněž
s vysokou smrtností. U séroskupiny W převažuje
hypervirulentní klonální komplex cc11, často jeho tzv.
UK modifikace, také s atypickým průběhem IMO, často
s gastrointestinálními příznaky a s vysokou
smrtností [11,
klonální komplex cc11, který způsobuje
septický průběh IMO s vysokou smrtností. U séroskupiny
Y převažuje hypervirulentní klonální komplex cc23 s atypickým
průběhem IMO, často pod klinickým obrazem pneumonie, rovněž
s vysokou smrtností. U séroskupiny W převažuje
hypervirulentní klonální komplex cc11, často jeho tzv.
UK modifikace, také s atypickým průběhem IMO, často
s gastrointestinálními příznaky a s vysokou
smrtností [11,
16,17]. V ČR je u séroskupiny Y podobně jako v jiných zemích nejčastěji zjišťován hypervirulentní komplex cc23. U séroskupiny W není v ČR v posledních deseti letech – na rozdíl od jiných zemí – zjišťován hypervirulentní komplex cc11,
ale je doložen tzv. český klon označovaný cc865 a ST 3342 [11,18]. IMO v ČR v roce 2020 včetně úmrtí jsou znázorněna v tabulce 1. Výskyt onemocnění a úmrtí na IMO v ČR od roku 2011 až do listopadu 2021 znázorňuje graf 2.
Vakcinace
Nejvýznamnější a nejúčinnější ochranou před vznikem IMO je vakcinace. Evropská léková agentura (EMA) schválila k použití a v ČR jsou k dispozici tři konjugované tetravalentní vakcíny obsahující antigeny čtyř séroskupin meningokoka – A, C, W, Y (Nimenrix, Menveo a od roku 2021 MenQuadfi) – a dvě rekombinantní vakcíny obsahující antigeny meningokoka séroskupiny B (Bexsero a Trumenba). U vakcín MenA,C,W,Y (Nimenrix a Menveo) byla prokázána ochrana nejen proti IMO způsobenému těmito čtyřmi séroskupinami, ale i proti nosičství meningokoků těchto séroskupin. Oproti tomu u vakcín MenB nebyl dle dostupných studií tento efekt na nosičství meningokoků jednoznačně prokázán, ačkoliv se předpokládá.
Všechny tyto vakcíny jsou účinné, bezpečné a jsou určeny k očkování dětí i dospělých. Při očkování zůstává hlavní strategií zajistit komplexní a dlouhotrvající ochranu od co nejčasnějšího věku s vědomím, že IMO postihuje převážně malé děti do jednoho roku a adolescenty. Je doporučeno aplikovat vakcíny MenA,C,W,Y a MenB buď simultánně, nebo v jakémkoliv intervalu mezi jednotlivými vakcínami. Pokud je to nezbytně nutné, očkování v týž den není vyloučeno, avšak pro minimalizování nežádoucích reakcí po očkování je nutné podat každou vakcínu do jiného aplikačního místa.
Očkování proti IMO je doporučeno
zahájit vakcínami Nimenrix a Bexsero již
v kojeneckém období ve věku od šesti týdnů
a od dvou měsíců, aplikace první dávky se
upřednostňuje v prvním půlroce života s ohledem
na nejvyšší riziko vzniku IMO. Toto schéma se netýká
vakcín Menquadfi, Menveo a Trumenba, které lze aplikovat až
ve věku od 12 měsíců, resp. od dvou a od 10
let. Dalšími věkovými kategoriemi, kdy se očkování doporučuje,
jsou děti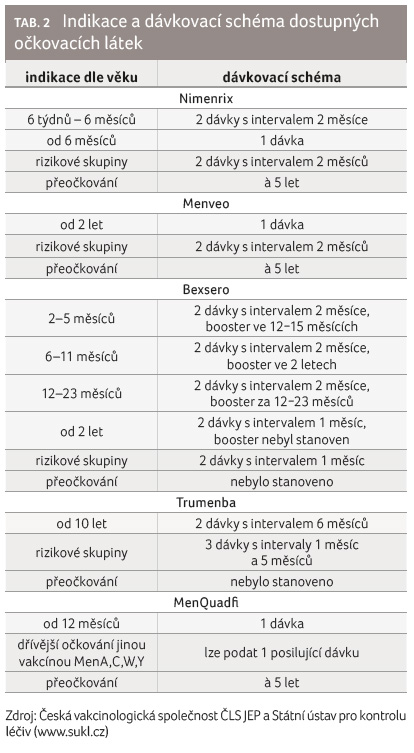 od jednoho do čtyř let, adolescenti a mladí
dospělí ve věku 13–25 let s upřednostněním
vakcinace ve věku 13–15 let [19]. Bez ohledu na věk
je očkování doporučeno tzv. rizikovým skupinám. Jde o jedince
s porušenou či zaniklou funkcí sleziny
(hyposplenismem/asplenismem), po autologní či alogenní
transplantaci kmenových hemopoetických buněk, s prokázaným
či předpokládaným imunodeficitem, s deficitem terminálního
komplementu, po prodělané bakteriální meningokokové
meningitidě a septikemii a před zahájením léčby
ekulizumabem [19]. Bez ohledu na věk by měli být očkováni
také cestovatelé navštěvující země s hyperendemickým
nebo epidemickým výskytem meningokokových onemocnění, osoby
v profesionálním riziku IMO (zdravotnický personál pečující
o pacienty s IMO, laboratorní pracovníci pracující
s původci IMO) a osoby v ohnisku nákazy IMO [19].
Stručná vakcinační schémata jsou znázorněna v tabulce 2.
od jednoho do čtyř let, adolescenti a mladí
dospělí ve věku 13–25 let s upřednostněním
vakcinace ve věku 13–15 let [19]. Bez ohledu na věk
je očkování doporučeno tzv. rizikovým skupinám. Jde o jedince
s porušenou či zaniklou funkcí sleziny
(hyposplenismem/asplenismem), po autologní či alogenní
transplantaci kmenových hemopoetických buněk, s prokázaným
či předpokládaným imunodeficitem, s deficitem terminálního
komplementu, po prodělané bakteriální meningokokové
meningitidě a septikemii a před zahájením léčby
ekulizumabem [19]. Bez ohledu na věk by měli být očkováni
také cestovatelé navštěvující země s hyperendemickým
nebo epidemickým výskytem meningokokových onemocnění, osoby
v profesionálním riziku IMO (zdravotnický personál pečující
o pacienty s IMO, laboratorní pracovníci pracující
s původci IMO) a osoby v ohnisku nákazy IMO [19].
Stručná vakcinační schémata jsou znázorněna v tabulce 2.
Novinky v očkování proti IMO
platné od 1. ledna 2022
Až doposud bylo hrazeno očkování proti IMO tzv. rizikovým skupinám bez ohledu na věk, což zůstává beze změny [19]. Od 1. května 2020 bylo hrazeno očkování proti onemocnění způsobenému meningokokem séroskupiny B, bylo li očkování zahájeno do dovršení šestého měsíce věku dítěte, a proti onemocnění vyvolanému séroskupinami A, C, W, Y, bylo li očkování provedeno jednou dávkou ve druhém roce života [19]. V září 2021 byla schválena novela zákona 48/1997 Sb., o veřejném zdravotním pojištění, kdy nově s platností od 1. ledna 2022 je hrazeno očkování proti onemocnění způsobenému meningokokem séroskupiny B, bude li očkování zahájeno první dávkou do dovršení 12. měsíce věku dítěte nebo v období od dovršeného 14. do dovršeného 15. roku věku adolescentů. U očkování vakcínou MenA,C,W,Y je nově očkování hrazeno, pokud dojde k jeho provedení v období od jednoho do dvou let věku kojence a rovněž u adolescentů ve věkovém období od 14 do 15 let. K hrazenému očkování může dojít i po uplynutí těchto časových lhůt, pakliže došlo k odkladu aplikace jedné nebo více dávek vakcíny ze zdravotních důvodů pojištěnce.
Závěr
Invazivní meningokokové onemocnění představuje největší nebezpečí pro nejmladší věkové kategorie dětí a pro adolescenty. Neznamená to však, že se nákaza vyhýbá jedincům vyššího věku, obzvláště pohybují li se v uzavřených kolektivech. Ty tvoří riziko mimo jiné i pro nárůst nosičství meningokoků. Nejúčinnější ochranou v boji proti meningokokovým onemocněním je očkování, které by mělo být zahájeno co možná nejdříve – již v kojeneckém věku a nepochybně u adolescentů. S přijetím novinek v úhradě očkování pro některé věkové skupiny od ledna letošního roku se ČR stane první evropskou zemí s hrazeným očkováním adolescentů. V tomto věkovém období se proočkovanost pohybuje pouze kolem 30 % a i povědomí o meningokokových nákazách a nebezpečí s nimi spojeném je nízké. Pediatři očekávají vyšší zájem o očkování a s tím se předpokládá zvýšení proočkovanosti proti IMO. Snaha o co největší ochranu dětí a dospívajících proti tomuto nebezpečnému onemocnění je na prvním místě a v zájmu lékařů i rodičů.
Seznam použité literatury
- [1] Pellantová V. Menigokoková onemocnění a jejich prevence. Med praxi 2016; 13: 226–228.
- [2] Pavelka J, Homola L. Invazivní meningokoková onemocnění. Pediatr praxi 2017; 18: 150–154.
- [3] Rožnovský L. Meningokokové infekce. In: Beneš J a kol. Infekční lékařství. Praha: Galén 2009; 219–223.
- [4] Dwilow R, Fanell S. Invasive Meningococcal Disease in the 21st. century‑an update for the clinician. Curr Neurol Neurosci Rep 2015; 15: 2.
- [5] Vuocolo S, Balmer P, Gruber WC, et al. Vaccination strategies for the prevention of meningococcal disease. Hum Vaccin Immunother 2018; 14: 1203–1215.
- [6] Plíšek S, Chlíbek R, Kosina P, et al. Invazivní meningokoková onemocnění. Interní Med 2011; 13: 391–393.
- [7] Bronská E. Diagnostika invazivního meningokokového onemocnění metodou PCR. Disertační práce. Praha, 2006.
- [8] Jolley K, Kalmusova A, Feil E, et al. Carried meningococci in the Czech Republic: a diverse recombining population. J Clin Microbiol 2000; 38: 4492–4498.
- [9] Chlíbek R, Šošovičková R, Polcarová P. Současný postup a strategie při očkování proti invazivním meningokokovým onemocněním. Vakcinologie 2018; 12: 122–128.
- [10] WHO. News. Facts sheets. Meningococcal meningitis. Dostupné na: http.//who.int./news‑room/fact‑sheets/detail/meningococcal‑meningitis
- [11] Křížová P. Invazivní meningokokové onemocnění – atypické klinické průběhy a poruchy komplementu. Med praxi 2020; 17: 317–320.
- [12] Chang Q, Tzeng YL, Stephens DS. Meningococcal disease: changes in epidemiology and prevention. Clin Epidemiol 2012; 4: 237–245.
- [13] ECDC. Invasive meningococcal disease. Annual epidemiologic reports for 2016. Dostupné na: https://ecdc.europa.eu/sites/portal/files/documents/AER_fir_2016_invasive‑meningococcal‑disease‑1.pdf
- [14] Křížová P, Musílek M, Okonji Z, et al. Invazivní meningokokové onemocnění v České republice v roce 2019. Zprávy CEM (SZÚ, Praha) 2020; 29: 105–114.
- [15] Křížová P, Musílek M, Okonji Z, et al. Invazivní meningokokové onemocnění v České republice v roce 2020. Zprávy CEM (SZÚ, Praha) 2021; 30: 51–60.
- [16] Ladhani SN, Beebeejaun K, Lucidarme J, et al. Increase in endemic Neisseria meningitidis capsular group W sequence type 11 complex associated with severe invasive disease in England and Wales. Cln Infect Dis 2015; 60: 578–585.
- [17] Lucidarme J, Scott KJ, Ure R, et al. An international invasive meningococcal disease outbreak due to a novel and rapidly expanding serogroup W strain, Scotland and Sweden, July to August 2015. Euro Surveill 2016; 21: pii30395.
- [18] Honskus M, Okonji Z, Musilek M, et al. Whole genome sequencing of Neisseria meningitidis W isolates from the Czech Republic recovered in 1984–2017. PLoS One 2018; 13: e0199652.
- [19] Doporučení České vakcinologické společnosti ČLS JEP pro očkování proti invazivním meningokokovým onemocněním. Dostupné na: https://www.vakcinace.eu/doporuceni‑a‑stanoviska.