Jak je to s progresí u roztroušené sklerózy, mění odborníci názor?
Švédský Stockholm hostil 11.–13. září 2019 účastníky 35. kongresu ECTRIMS (European Committee for Treatment and Research in Multiple Sclerosis). Sympozium společnosti Novartis formou panelové diskuse přizvaných odborníků nenechalo přítomné na pochybách, jak se pohled na roztroušenou sklerózu (RS) s rozvojem znalostí o patofyziologii a s novými poznatky z klinických hodnocení mění. Profesor Sten Fredrikson (Karolinska University Hospital, Stockholm), profesorka Eva Kubala Havrdová (MS centrum při VFN, Praha), profesor Bruce A. Cree (UCSF Medical Center, San Francisco) a profesor Gavin Giovannoni (Queen Mary University of London, Londýn) se zaměřili na progresi u RS.
Roztroušená skleróza je závažné onemocnění charakterizované
chronickým zánětem centrální nervové soustavy (CNS). V čase progreduje,
vede k demyelinizaci a difuzní neurodegeneraci. Pacienta postihuje
jak fyzicky, tak psychicky a výrazně ovlivňuje jeho soběstačnost
a kvalitu života. Včasná intervence hraje ve vývoji nemoci
a v prognóze zásadní roli. Průběh nemoci může být značně variabilní.
U většiny pacientů je diagnostikována relabující‑remitující
forma RS (RR-RS). Ataky (relapsy) nemoci jsou následovány kompletním nebo
částečným zotavením (remisí). V průběhu onemocnění většina nemocných
(u neléčených zhruba za 10–15 let [1]) postupně přejde
do sekundárně progresivní fáze (SP-RS), kdy se nestřídá období zhoršení
a remise, ale dochází k progresivnímu zhoršování neurologického
deficitu s postižením nervových funkcí a kumulací disability (obr. 1) [2].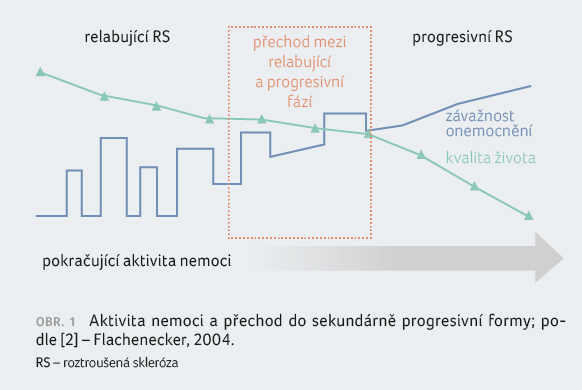
Zhruba 15 %
nemocných postihuje progresivní průběh již od počátku, zde mluvíme
o primárně progresivní formě (PP-RS). Nejsou přítomny relapsy, dochází
k pozvolnému nárůstu neurologického postižení. Není zcela jasné, zda se
jedná o samostatnou formu RS, nebo zda ji lze přiřadit k SP-RS [1].
Co řídí progresi
Pozornost sympozia byla soustředěna právě na otázky,
které patologické procesy řídí progresi, kdy progrese vlastně začíná a jak
je možné ji identifikovat. S lepším porozuměním patofyziologii je možné
vysledovat probíhající děje a také ovlivnit možné výstupy.
Profesorka Eva Kubala Havrdová (MS centrum při Neurologické klinice VFN, Praha) předstoupila před auditorium s výzvou přehodnotit vymezení progrese u RS. Připomněla dosavadní pohled na dvě fáze onemocnění; časná fáze RS charakterizovaná zejména zánětlivým procesem s porušením hematoencefalické bariéry a přestupem T a B buněk do CNS s tvorbou nových lézí. V progresivním stadiu onemocnění pak pomalé zvětšování již existujících lézí, přetrvávající zánět, extenzivní demyelinizace a difuzní postižení šedé hmoty. Patologické procesy jsou zde kompartmentalizované za hematoencefalickou bariérou s nižším pronikáním imunitních buněk do CNS. Charakteristický pro časnou fázi byl zánět, pro pozdní neurodegenerace, přes určité přetrvávající zánětlivé procesy za hematoencefalickou bariérou. Kvalita života je s rostoucí disabilitou výrazně ovlivněna.
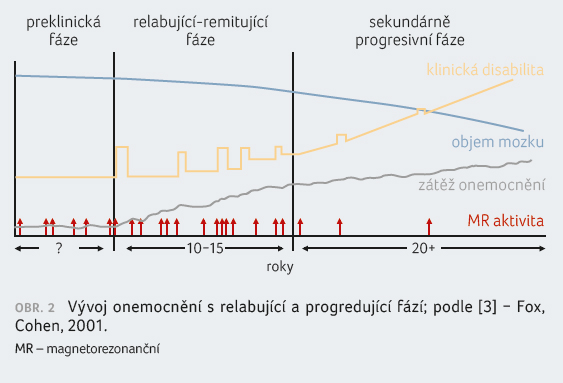
Patologie RR-RS a SP-RS se liší, je možné je klinicky odlišit a z nálezů na magnetické rezonanci (MR) mnohé vyčíst (obr. 2) [3]. Zobrazovací techniky hrají v managementu RS významnou roli [4]. Magnetorezonanční zobrazení je zásadní při stanovení diagnózy, má prediktivní význam a lze díky němu sledovat odpověď na léčbu; přineslo a přináší nové poznatky o patofyziologii RS.
Přechod do sekundárně progresivní formy
Odborníci si kladou otázku, zda je v mozku možné
odhalit jakýsi „přepínač“, kdy dojde k přechodu do progresivní fáze,
a zda se jedná o jedno onemocnění. Za patologii asociovanou
s progresivní RS a dlouhodobým zhoršováním je považována akcelerovaná
atrofie mozku jako hlavní příčina ireverzibilní neurologické disability [1,5].
Profesorka Kubala Havrdová nastínila, že probíhající děje se liší zejména
kvantitou, nikoliv až tak kvalitou [1]. Již v čase stanovení diagnózy je
možné nalézt známky neurodegenerace [6], na druhou stranu je možné
po letech od počátku nemoci zaznamenat na okraji lézí zánět.
Tvorba černých děr a mozková atrofie jsou děje, které probíhají
od počátku onemocnění [1], a neurofilamenta, jejichž hodnoty
monitorujeme jako ukazatele zničených axonů, nejsou znakem pouze progresivní
formy onemocnění. Na rostoucím neurologickém postižení, které se
s progresí zvyšuje, se podílejí různé mechanismy. Za podstatu
onemocnění je považována imunitní reakce proti strukturám CNS (dysregulace B
a T buněk, aktivace mikroglií). Za další mechanismy neurodegenerace,
které mohou působit v součinnosti, jsou považovány tvorba reaktivních
sloučenin kyslíku a dusíku, poškození mitochondrií s poškozením
tvorby energie, intraaxonální akumulace Ca2+, aktivace
katabolických enzymů s proteolytickou degradací a jiné.
Prediktivní markery neurodegenerace
V době diagnózy je snaha rozeznat určité prediktivní
markery, které by napověděly, jaký vývoj onemocnění lze předpokládat
v delším časovém horizontu. Za znaky časné neurodegenerace lze
považovat vysoké hodnoty neurofilament, velký počet lézí, přítomnost černých
děr a akcelerovanou atrofii v čase stanovení diagnózy, neúplné
zotavení po první atace (reziduální příznaky) a také cerebelární a motorické
příznaky na počátku onemocnění.
Neurodegenerace je přítomna od počátku onemocnění [6],
se zánětem je asociována a vede k ireverzibilnímu poškození nervové
tkáně. Léčba, kterou máme k dispozici, působí preventivně, proto je tak
důležité ji zahájit včas, připomněla profesorka Kubala Havrdová. Nervová tkáň
má určité rezervy, které se u jednotlivců liší, a do určité míry
je schopna poškození kompenzovat, ale po překročení určitého prahu
poškození progreduje a je ireverzibilní. K rozpoznání přechodu RR-RS
do SP-RS je třeba nemocného pečlivě klinicky sledovat. Vedle objektivních
ukazatelů (počet lézí, stupeň disability podle hodnocení na škále Expanded
Disability Status Scale [EDSS], testy kognitivních funkcí aj.) je třeba si
všímat subjektivního vnímání nemoci a hodnocení kvality života. Pozornost
se obrací také k biomarkerům, jako jsou například již zmíněná
neurofilamenta.
Zánětlivé procesy vedou k demyelinizaci a axonální
ztrátě. Bylo prokázáno, že progrese je započata hned na začátku, probíhá
po celou dobu a je nezávislá na klinických relapsech [5].
Program EPIC si dal za cíl sledovat průběh RS u aktivně léčených
v dlouhodobém časovém horizontu [7]. Monitoroval vývoj disability
a její asociaci s klinickými a MR charakteristikami
zaznamenanými od počátku sledování (změny objemu mozku, vývoj EDSS, tvorba
nových lézí a míra aktivity nemoci během léčby i vliv případné
eskalace). Profesor Cree nastínil, že krátkodobý nárůst postižení (disability)
ve fázi RR-RS souvisí s relapsy, nicméně nevypovídá o dlouhodobém
zhoršení. Studie sledující relabující fázi onemocnění při snížení počtu relapsů
zaznamenávají redukci disability. Ve fázi SP-RS je disabilita důsledkem
nevratné neurodegenerace.
Tichá progrese
U pacientů splňujících kritéria RR-RS lze zaznamenat
určité trvalé zhoršování, tzv. tichou progresi. Dle stávající definice je SP-RS
klasifikována jako zhoršování disability nezávislé na relapsech
po dobu minimálně šesti měsíců, které navazuje na relabující formu
onemocnění. Klinicky je mnohdy obtížné tento přechod zachytit, potvrzení tohoto
přechodu je mnohdy opožděné. Recentní data [7] navíc ukazují, že tento proces
(progrese) probíhá již mnohem dříve. U více než 50 % pacientů s RR-RS je doložen
dlouhodobý nárůst disability bez ohledu na relapsy [7]. Nemocní
s RR-RS mají obvykle nízké hodnoty EDSS, pro diagnózu SP-RS je dle
recentní definice vyžadováno EDSS minimálně 4 [8]. Skóre EDSS je nelineární
a u pacientů s hodnotou EDSS < 3 se meziroční změny
projeví s menší pravděpodobností než u nemocných s EDSS
v rozmezí 3–6. Tento i řada dalších faktorů mohou přispět
k tomu, že probíhající neurodegenerativní proces již během RR-RS označený
jako tichá progrese zůstává nepovšimnut.
Dlouhodobé sledování v rámci programu EPIC ukazuje, že
přechod do SP-RS byl zaznamenán pouze v 10 % [7]. Při srovnání nemocných, u nichž se
rozvinula SP-RS, s pacienty s tichou progresí u RR-RS byly
u SP-RS zaznamenány vyšší počáteční skóre disability (EDSS), delší trvání
nemoci a skóre závažnosti (MMMS), jinak nebyly mezi skupinami zjištěny
rozdíly [7]. Tito pacienti mají shodné charakteristiky hodnocené zobrazovacími
metodami (objem T2 lézí, objem mozku a dalších struktur CNS i věk
nemocných), je pravděpodobné, že probíhající patologické procesy jsou obdobné.
Léčba schválená k redukci kumulace disability u SP-RS by tak mohla
být účinná i zde, u pacientů s tichou progresí, připustil
profesor Cree.
Říkáte, že jsem stabilní, ale horším se. Proč?
Odborníci se shodli na tom, že patologické procesy
začínají mnohem dříve, než jsou klinicky zachytitelné. Patologie není nijak ohraničená
a mnohdy je k jejímu léčebnému ovlivnění pozdě. Profesor Giovannoni
na kazuistice pacientky s radiologicky izolovaným syndromem,
u níž se během tří let sledování rozvinula RS, připomněl, že bychom neměli
na onemocnění pohlížet pouze klinickým pohledem, který se ukazuje
v patologických procesech jako opožděný a nedostatečný (obr. 3) [9].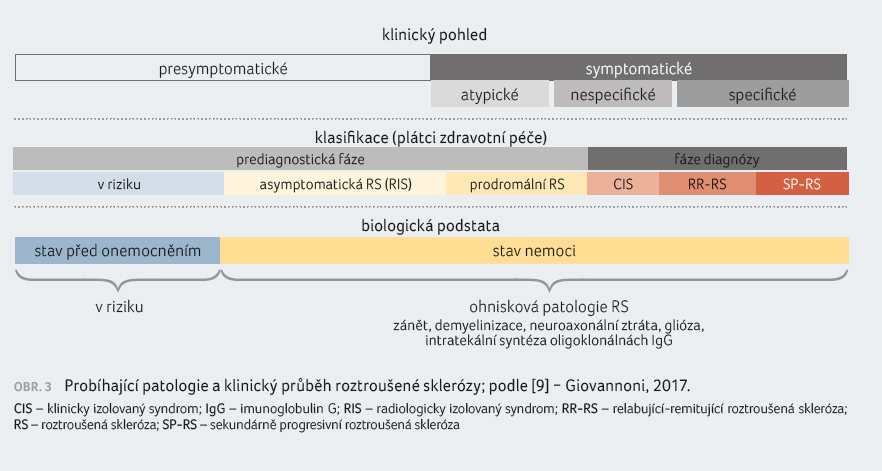
Profesor Giovannoni ze své profesní zkušenosti také
zdůraznil, že zhoršení nemoci zachycené lékařem (změna EDSS, markery progrese
na MR zobrazení, další biomarkery a funkční testy) se může významně
lišit od toho, jak onemocnění vnímá pacient. Poskytuje informaci
v určitém čase, změny zachycené nemocnými jsou často drobné, týkají se
jednotlivých příznaků (únava, bolest, poruchy nálady, vykonávání denních
aktivit, dysfunkce močového měchýře a GIT, změny kognice a mobility)
[10]. Roli hrají samozřejmě i emocionální aspekty. Tento stav
profesor Giovannoni trefně vystihl otázkou „Říkáte, že jsem stabilní, ale
horším se. Proč?“ Zdůraznil, že s pacientem je třeba vést otevřený dialog
a všímat si i nepatrných změn a známek progrese. Profesorka
Kubala Havrdová připomněla, že někteří pacienti se obávají změny/eskalace léčby
a o zhoršení si netroufají mluvit. Informace je potřeba sbírat
a následně se rozhodnout, jak s nimi naložit.
Lékaři stále hledají nové možnosti léčby. Sledování pacientů léčených natalizumabem ukázalo, že zhoršování symptomů a nárůst disability v období RR-RS souvisí asi ze 66 % s progresí nezávislou na relapsech (progression independent of relapse activity, PIRA) [11]. Zatím jedinou léčbu schválenou americkým Úřadem pro kontrolu potravin a léčiv (FDA) k terapii aktivní SP-RS představuje siponimod, který selektivně cílí na sfingosin‑1‑fosfátové receptory S1P1 a S1P5 a moduluje jejich aktivitu. Redukuje atrofii šedé hmoty, která je klíčová v progresi disability i kognitivního deficitu. Data ze studie EXPAND [12] a následné post hoc analýzy potvrzují signifikantní přínos siponimodu, zlepšení fyzických i kognitivních funkcí u nemocných se SP-RS. Preklinická data naznačují možné remyelinizační schopnosti siponimodu [13]. Čas ukáže, jak se bude dál vyvíjet léčba progresivních forem RS.
Redakčně zpracovala PharmDr. Kateřina Viktorová
Seznam použité literatury
- [1] Correale J, Marrodan M, Ysrraelit MC. Mechanisms of Neurodegeneration and Axonal Dysfunction in Progressive Multiple Sclerosis. Biomedicines 2019; 7: doi: 10.3390/biomedicines7010014.
- [2] Flachenecker P. Disease modifying drugs for the early treatment of multiple sclerosis. Expert Rev Neurother 2004; 4: 455−463.
- [3] Fox RJ, Cohen JA. Multiple sclerosis: the importance of early recognition and treatment. Cleve Clin J Med 2001; 68: 157–171.
- [4] Sicotte NL. Neuroimaging in multiple sclerosis: neurotherapeutic implications. Neurotherapeutics 2011; 8: 54−62.
- [5] University of California, San Francisco MS EPIC Team, Cree BAC1, Hollenbach JA, Bove R, et al. Silent progression in disease activity free relapsing multiple sclerosis. Ann Neurol 2019; 85: 653−666.
- [6] Novakova L, Axelsson M, Malmeström C, et al. Searching for neurodegeneration in multiple sclerosis at clinical onset: Diagnostic value of biomarkers. PLOS ONE 2018; 13: e0194828.
- [7] University of California, San Francisco MS EPIC Team:, Cree BA, Gourraud PA, Oksenberg JR, et al. Long term evolution of multiple sclerosis disability in the treatment era. Ann Neurol 2016; 80: 499−510.
- [8] Lorscheider J, Buzzard K, Jokubaitis V, et al. Defining secondary progressive multiple sclerosis. Brain 2016; 139: 2395–2405.
- [9] Giovannoni G. The neurodegenerative prodrome in multiple sclerosis. Lancet Neurol 2017; 16: 413−414.
- [10] Katz Sand I, Krieger S, Farrell C, Miller AE. Diagnostic uncertainty during the transition to secondary progressive multiple sclerosis. Mult Scler 2014; 20: 1654−1657.
- [11] Kappos L, Butzkueven H, Spelman T, et al on behalf of the TYSABRI Observational Program [TOP] Investigators. Real world data from over 10 years in the TYSABRI® Observa-tional Program: long term safety and effectiveness of natalizumab in relapsing remitting multiple sclerosis patients. ECTRIMS Online Library. Oct 11, 2018; 228751; P908.
- [12] Kappos L, Cree B, Fox R, et al. Siponimod versus placebo in secondary progressive multiple sclerosis (EXPAND): a double blind, randomized, phase 3 study. Lancet 2018; 391: 1263–1273.