Krizotinib – nový multikinázový inhibitor signálních drah pro léčbu vybraných nemocných s nemalobuněčným karcinomem plic
Krizotinib (PF-02341066) je novým léčivem schváleným v Evropské unii pro druhou a další linie léčby pacientů s nemalobuněčným karcinomem plic (NSCLC), v jejichž tkáních byla prokázána translokace genu anaplastické lymfomové kinázy (ALK). V poslední době byla jeho účinnost prokázána i u nemocných s NSCLC nesoucími přestavbu genu ROS1. Krizotinib je u selektovaných nemocných účinným a bezpečným lékem, cílové studie dokládají jeho přínos při vyhodnocení frekvence léčebných odpovědí, snížení příznaků nádorové nemoci, prodloužení časů do progrese i prodloužení života nemocných. Jde současně o léčivo s dobrým bezpečnostním profilem i dobrou snášenlivostí.
V roce 2004 byly objeveny v souvislosti s léčbou nemalobuněčného karcinomu plic (NSCLC) první, tzv. senzitivní mutace genu receptoru pro epidermální růstový faktor (EGFR). Tento objev Lynche a Paeze zahájil období cílené terapie tzv. nádorů závislých na onkogenech. V roce 2007 byl mezi adenokarcinomy plic prokázán fúzní gen EML4-ALK [1], který se vyskytuje asi u 5–7 % nemocných. Jeho přestavba, která způsobuje produkci onkogenních proteinů, vzniká při parametrické inverzi částí genů na krátkém raménku chromozomu 2.
Ke zjištění uvedených translokací se využívá řada metod; patří sem metody FISH (fluorescence in situ hybridizace), imunohistochemie a metody založené na polymerázové řetězové reakci [2]. V současnosti se v řadě zemí vyšetřování uvedených změn již řídí konsenzuálními doporučeními patologů a pneumologů [3, 4]. Obvykle jsou sledováni nemocní s adenokarcinomy, nemalobuněčnými karcinomy nespecifikovaného typu a nemocní s převahou složky adenokarcinomu v nádoru [5, 6].
Účinnost krizotinibu
Krizotinib (PF-02341066, obr. 1) je nízkomolekulární inhibitor tyrozinkináz s účinností na signální dráhy aktivované ALK (anaplastická lymfomová kináza), MET (receptor pro hepatocytární růstový faktor) [7] a ROS1. Původně byl vyvinut jako selektivní inhibitor c-MET. Jeho účinnost byla doložena na MET-dependentních modelech karcinomů. Při profilování selektivity této molekuly byla zjištěna srovnatelná senzitivita při inhibici ALK. Krizotinib účinně inhibuje její fosforylaci a indukuje apoptózu buněk anaplastického velkobuněčného lymfomu (obr. 2) [2, 8–10].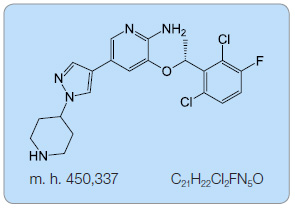
Podává se perorálně v dávce 250 mg 2krát denně, v případě závažnějších nežádoucích účinků je možné redukovat dávku na 200 mg podávaných 2krát denně, eventuálně až na 250 mg 1krát denně.
Klinická účinnost byla prokázána i u ALK-pozitivních lymfomů a sarkomů a u MET-pozitivních NSCLC a karcinomů jícnu, v poslední době i u NSCLC s přestavbou genu ROS [11]. Studie fáze I prokázala u NSCLC četnost léčebných odpovědí (ORR) 61 %, čas do progrese (PFS) 10 měsíců. Léčebná odpověď nezávisela na věku, pohlaví, stavu výkonnosti ani na linii, ve které byla léčba podána. Přežití po 6 a 12 měsících léčby činilo 90 % a 81 %.
Studie fáze II PROFILE 1005 prokázala velmi podobné výsledky [2]. Byly doloženy i příznivé účinky léčby na úlevu od bolesti, dušnosti, 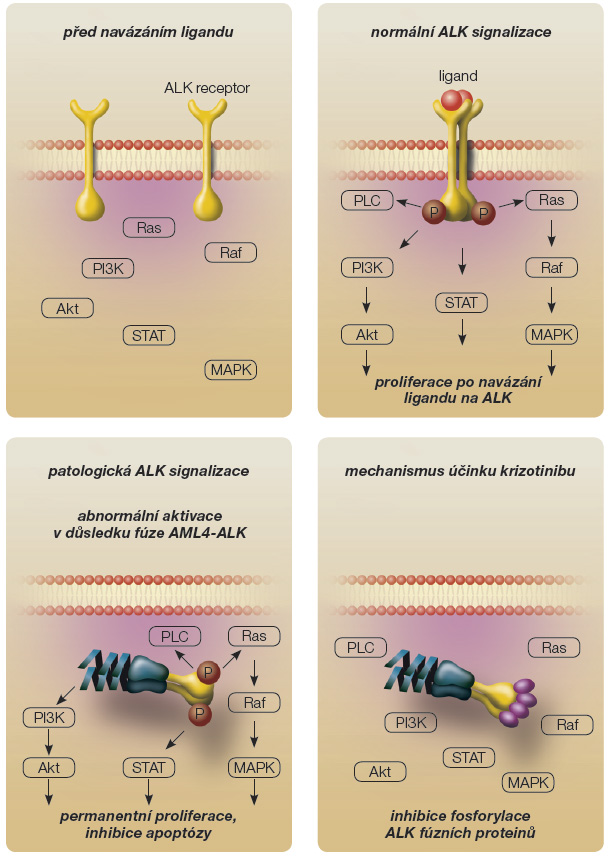 kašle a slabosti po 6 týdnech podávání krizotinibu. Ve studii PROFILE 1007 byla prokázána ve 2. linii léčby lepší účinnost krizotinibu v porovnání s chemoterapií pemetrexedem a docetaxelem u nemocných s translokací EML4-
kašle a slabosti po 6 týdnech podávání krizotinibu. Ve studii PROFILE 1007 byla prokázána ve 2. linii léčby lepší účinnost krizotinibu v porovnání s chemoterapií pemetrexedem a docetaxelem u nemocných s translokací EML4-
-ALK [12]. Při retrospektivním porovnání přežití nemocných léčených krizotinibem s neléčenými je zřejmé výrazné zlepšení přežití u léčených pacientů po jednom roce a dvou letech (70 % vs. 44 % a 55 % vs. 12 %; p = 0,004).
Také naše předběžné zkušenosti s krizotinibem dokládají dosažení klinických remisí a velmi dobrou toleranci léčby [13]. Krizotinib může být efektivně podáván i u nemocných s nízkou kvalitou života, dokonce i léčených řízenou ventilací. Popsané kazuistiky dokládají reverzibilitu i takto pokročilých stavů [14].
Farmakokinetika a metabolismus krizotinibu
Po perorálním podání jednorázové dávky dochází k dosažení maximální koncentrace v plazmě za 4–6 hodin. Rovnovážného stavu plazmatických koncentrací je obvykle dosaženo při podávání léku standardním způsobem, tedy 250 mg 2krát denně, v průběhu 15 dní. Krizotinib se při podání ústy vstřebává ze 43 % (v rozmezí 32–66 %), pokud je podán s jídlem obsahujícím velký podíl tuku, absorpce se snižuje o 14 %. Může být tedy užíván nalačno i s jídlem. Jeho distribuční objem je velký – 1772 l, metabolizován je v játrech pomocí cytochromu P450 CYP3A4/5. Plazmatický poločas při ukončení léčby je 42 hodin. Chemicky nezměněný krizotinib může být nalezen ve stolici a moči nemocných. Při dlouhodobém podávání dochází k autoinhibici CYP3A4, clearance krizotinibu činí při dosažení rovnovážného stavu 60 l/h [2, 8].
Interakce krizotinibu
Lékové interakce jsou součástí dokumentace ke schválení přípravku lékovými agenturami. Pozorována je bradykardie – pokles srdeční frekvence je závislý na podané dávce, při vzestupu plazmatické koncentrace krizotinibu o 100 mg/ml dojde k poklesu srdeční frekvence o 2,5 úderu za minutu. Krizotinib by neměl být podáván u nemocných s vrozeným QTc syndromem, i když u bradykardií vzniklých při jeho podávání nebylo prodloužení QTc intervalu pozorováno. Srdeční frekvenci je třeba bedlivě sledovat zvlášť u nemocných, kteří dostávají léky prodlužující QTc interval, jako jsou chinidin, ciprofloxacin a ziprasidon.
Krizotinib je nejen substrátem, ale i mírným inhibitorem CYP3A4, v důsledku toho může dojít až k 3,6násobnému zvýšení AUC perorálně podaného midazolamu. V kombinaci s krizotinibem by se neměly podávat silné inhibitory nebo induktory CYP3A4. Z inhibitorů se jedná především o makrolidová antibiotika, azolová antimykotika (ketokonazol, itrakonazol, vorikonazol), amentoflavon (Ginkgo biloba), proteázové inhibitory (ritonavir, indinavir, nelfinavir), antidepresiva (nefazodon), grapefruitovou šťávu.
Z induktorů jsou to antiepileptika (karbamazepin, fenytoin, oxkarbazepin), barbituráty, antibiotika (rifampicin a rifabutin), inhibitory reverzní transkriptázy (efavirenz, nevirapin), antidiabetika (pioglitazon, troglitazon), třezalka tečkovaná [2].
Při současném podávání krizotinibu s mírnými inhibitory CYP3A4, jako jsou diltiazem, verapamil a flukonazol, nebo se substráty CYP3A4, jako je triazolam, aripiprazol, cisaprid, ergotamin, je třeba monitorovat možné interakce či tato léčiva nepodávat.
Bezpečnost podávání krizotinibu
Podle dosavadních zkušeností jde o dobře tolerovaný lék. Ve studiích fáze I a II nebyly pozorovány fatální nežádoucí příhody ani výrazná specifická toxicita, nežádoucí účinky stupně 3 a 4 se rovněž vyskytly vzácně. Většina nežádoucích účinků (až 96 %) byla stupně 1 či 2. Jednalo se o mírné poruchy vidění, nauzeu, průjmy, zvracení či zácpu, sníženou chuť k jídlu, polykací obtíže, otoky končetin, slabost, závratě, neuropatie, kožní exantém, poruchy vnímání chutí a vzestup hladiny alaninaminotransferázy [3, 15].
Závažné nežádoucí účinky stupně 3 a 4 se vyskytovaly celkem u 1–5 % nemocných, jednalo se o stomatitidy, zácpu, slabost, dušnost, neuropatii, pneumonitidy, vzestupy hladin obou transamináz, neutropenii, lymfopenii a hypofosfatemii. Předpokládá se možná souvislost působení krizotinibu se vznikem renálních cyst, asymptomatické bradykardie a s poklesem hladiny testosteronu v krvi u mužů. Studie na krysách prokázaly, že krizotinib snižuje retinální adaptaci na tmu, ale nesnižuje schopnost dosáhnout adaptace na úplnou tmu. Někdy lze dosáhnout úpravy nežádoucích účinků krátkodobými „lékovými prázdninami”, příležitostně mohou být nežádoucí účinky důvodem k ukončení léčby krizotinibem [3].
Aktuálně se doporučuje sledovat především tyto možné nežádoucí účinky: hematologickou toxicitu, hepatotoxicitu, pneumonitidy a prodloužení QTc intervalu. V případech nežádoucích účinků definovaných kritérii National Cancer Institute (CTCAE, Common Terminology Criteria for Adverse Events) stupně 3 a 4 se doporučuje podávání krizotinibu přerušit a po úpravě nálezů léčbu znovu zahájit ve snížené dávce 200 mg 2krát denně.Objeví-li s opakovaně nežádoucí účinek stejného stupně, léčba se opět přeruší a po úpravě hodnot se podává v dávce 250 mg 1krát denně.
Rezistence na léčbu
Rezistenci na krizotinib pozorujeme buďto jako jev systémový, nebo jako výraz zřejmě nízkých hladin léku v cerebrospinální tekutině s projevem relapsu nemoci v mozku [16]. I když je lék zpočátku výrazně účinný, prakticky u všech léčených nemocných dojde dříve či později k progresi nádoru. Příčinou bývají tzv. rezistentní mutace C1156Y a L1196M, které byly popsány japonskými autory. Postupně byly nalezeny i další mutace (L1152R, G1269A, S1206Y, G1202R, AP26113, CH5424802, AS3062 a X396), které snižují aktivitu krizotinibu vůči tyrozinkináze.
In vitro lze vliv těchto mutací zablokovat tyrozinkinázovými inhibitory vyšší generace, klinické zkušenosti však v této oblasti nejsou zatím k dispozici. K příčinám sekundární rezistence na krizotinib mohou patřit i nově se objevivší, v původním vzorku nádoru nezjištěné další řídící mutace, jako jsou mutace EGFR, HER-2 či amplifikace KIT, nebo případně dojde k vymizení buněk nesoucích translokaci genu ALK jakožto pravděpodobný výsledek klonální selekce primárně rezistentních nádorových buněk. U některých nemocných byly popsány i nově nalezené mutace genu KRAS [2, 8].
K dalším léčebným možnostem, které přicházejí v úvahu při vzniku rezistence nádorové nemoci na krizotinib, patří u NSCLC pemetrexed [17] a ihibitory HSP90 (heat shock protein 90). Citlivost nádorových buněk s translokací genu ALK k peme-
trexedu může souviset s úrovní exprese na RNA thymidilátsyntetázy v daném nádoru [17, 18], je ovšem pozorována u nemocných, kteří ještě krizotinibem léčeni nebyli. U nemocných s rezistencí na krizotinib již příznivý účinek následně podaného pemetrexedu nebývá prokazován. Zatímco v případě rezistentních mutací genu pro EGFR (T790M) může přerušení léčby příslušným inhibitorem tyrozinkinázy vyvolat repopulaci nádoru původními buňkami nesoucími senzitivní mutace genu EGFR, rezistence ke krizotinibu po jeho vysazení obvykle neustupuje [2].
V současnosti byly vyvinuty a jsou testovány inhibitory ALK druhé generace [2, 9]. Inhibitor AP26113 má přibližně 10krát vyšší účinnost i selektivitu ve srovnání s krizotinibem. Působí i na nádorové buňky rezistentní vůči krizotinibu, in vitro brání na rozdíl od krizotinibu přerůstání rezistentních mutant. Jde o duální inhibitor ALK/EGFR schopný potlačit i růst buněk s EGFR-rezistentní mutací T790M. Dalším nadějným léčivem vyšší generace v nových fázích klinického zkoušení je AF802 (dříve CH542802), látka, která vyvolává ústup jak nádorových buněk nesoucích tzv. wild type ALK, tak i buněk s rezistentní ALK-mutací L1196M. Podobné údaje byly uveřejněny i u LDK378 a ASP3026 (retaspimycin, ganetespib).
Nové poznatky týkající se klinické účinnosti
Otterson a kol. [19] prezentovali na poslední konferenci Americké společnosti pro klinickou onkologii charakteristiky souboru nemocných NSCLC ALK-pozitivních, u kterých došlo při léčbě krizotinibem k progresi onemocnění. Vyhodnocení údajů souboru 146 nemocných ukázalo, že nejčastěji se vyskytujícími novými lézemi v jediném orgánu byly metastázy v mozku, v játrech [1], do kostí [2] a v ledvině [4]. Pokud byli tito nemocní léčeni krizotinibem dále po zjištění orgánové progrese, docházelo u poloviny z nich k další progresi pouze metastatické léze v příslušném metastázou postiženém orgánu (mozek nebo játra). Tyto výsledky nabízejí možnost použití lokální léčby metastáz souběžně s pokračováním léčby krizotinibem.
Kim a kol. [20] analyzovali soubor 439 nemocných, u 255 z nich bylo možno vyhodnotit kromě bezpečnosti podávané léčby i odpověď nádoru. ORR byla 53 %, pokud jde o statisticky významné a klinicky smysluplné zmírnění příznaků onemocnění, bylo toto konstatováno u celkové bolesti, bolesti na hrudi, kašle, dušnosti, nespavosti, únavy a celkové kvality života.
Shaw a kol. [21, 22] na téže konferenci prezentovali výsledky sledování klinické účinnosti krizotinibu u pokročilého NSCLC s přeskupením genu ROS1. Léčili 13 pacientů, hodnota ORR byla 54 %, míra kontroly onemocnění (DCR) v tomto souboru byla 85 %. Tato studie je prvním klinickým potvrzením přeskupení ROS1 jako molekulárního cíle terapie krizotinibem u karcinomu plic.
Nízké koncentrace v mozkomíšním moku bývají obvykle příčinou rozvoje metastatického postižení mozku v průběhu systémové léčby krizotinibem. V současné době jsou však známy již i první zkušenosti s vysokodávkovanou pulzní terapií podávanou jako kombinace krizotinibu s pemetrexedem [23].
Hodnocení účinnosti léčby při terapii inhibitory EGFR a ALK se dle klinických zkušeností liší od přístupu používaného při rozhodování o chemoterapii. Mírná progrese nálezu v jedné lokalizaci nebývá u nemocných léčených biologickou léčbou racionálním důvodem k ukončení této léčby. Její vysazení bývá za těchto okolností obvykle následováno rychlou celkovou progresí nádorové nemoci. Proto se u mírné progrese nádoru v jedné lokalizaci doporučuje spíše zvážit možnosti současné lokální terapie [24].
Závěr
Krizotinib je molekulárně cílené léčivo účinné a bezpečné u pacientů s NSCLC a některými dalšími nádory s translokacemi genu EML4-ALK a dalších partnerů genu ALK. Jako cíle pro jeho možné využití se nabízejí i karcinomy plic s přestavbou genu ROS1. Je rovněž předmětem výzkumu jako účinný inhibitor c-MET. V současnosti je již registrován pro léčbu NSCLC u pacientů již dříve léčených.
Seznam použité literatury
- [1] Soda M, Choi YL, Enomoto M, et al. Identification of the transforming EML4-ALK fusion gene in non-small cell lung cancer. Nature 2007; 448: 561–566.
- [2] Bowles DW, Weickhardt AJ, Doebele RC, et al. Crizotinib for the treatment of patients with advanced non-small cell lung cancer. Drugs Today 2012, 48: 271–282.
- [3] Hines M, Lyseng-Williamson KA, Curran MP. Crizotinib: a guide to its use in previously treated advanced anaplastic lymphoma kinase-positive non-small cell lung cancer in the EU. Drugs Ther Perspect 2013; 29: 64–68.
- [4] Marchetti A, Ardizzoni A, Papotti M, et al. Recommendations for the Analysis of ALK Gene Rearrangements in Non-Small-Cell Lung Cancer. A Consensus if the Italian Association of Medical Oncology and the Italian Society of Pathology and Cystopathology. J Thorac Oncol 2013; 8: 352–358.
- [5] Inamura K, Takeuchi K, Togashi Y, et al. EML4-ALK fusion is linked to histological characteristics in a subset of lung cancers. J Thorac Oncol 2008; 3: 13–17.
- [6] Wong DW, Leung EL, So KK, et al; University of Hong Kong Lung Cancer Study Group. The EML4-ALK fusion gene is involved in various histologic types of lung cancers from nonsmokers with wild-type EGFR and KRAS. Cancer 2009, 115: 1723–1733.
- [7] Ou Sai-Hong I, Kwak EL, Siwak-Tapp Ch, et al. Activity of Crizotinib (PF02341066), a Dual Mesenchymal-Epithelial Transition (MET) and Anaplastic Lymphoma Kinase (ALK) Inhibitor, in a Non-small Cell Lung Cancer Patient with De Novo MET Amplification. J Thorac Oncol 2011; 6: 942–946.
- [8] Forde PM, Rudin CM. Crizotinib in the treatment of non-small-cell lung cancer. Expert Opin Pharmacother 2012; 13: 1195–1201.
- [9] O´Briant CL, Wenger SD, Kim M, Thompson LA. Crizotinib: A New Treatment Option for ALK-Positive Non-Small Cell Lung Cancer. The Annals of Pharmacotherapy 2013; 47: 189–197.
- [10] Ou Sai-Hong I, Bartlett CH, Mino-Kenudson M, et al. Crizotinib for the Treatment of ALK-Rearranged Non-Small Cell Lung Cancer: A Success Story to Usher in the Second Decade of Molecular Targeted Therapy in Oncology. Oncologist 2012; 17: 1351–1375.
- [11] Bergethon K, Shaw AT, Ou Sai-Hong I, et al. Rearrangements Define a Unique Molecular Class of Lung Cancers. J Clin Oncol 2012; 30: 1–9.
- [12] Shaw AT, Kim DW, Nakagawa K, et al., on behalf of all PROFILE 1007 investigators: Phase III Study of Crizotinib vs Pemetrexed or Docetaxel Chemotherapy in Patients with Advanced ALK-Positive NSCLC Presented at the 37th ESMO Congress, Vienna, Austria, 2012, Abstract LBA1 PR.
- [13] Pešek M, Grossmann P, Mukenšnabl P, Minárik M. První zkušenosti s vyšetřováním zlomu genu ALK (anaplastické lymfomové kinázy) a s podáním crizotinibu u vybraných nemocných s nemalobuněčnými karcinomy plic (NSCLC). Stud Pneumol Phtiseol 2012; 72: 159–162.
- [14] Ahn HK, Jeon K, Yoo H, et al. Successful Treatment with Crizotinib in Mechanically Ventilated Patients wiht ALK Positive Non-Small-Cell Lung Cancer. J Thorac Oncol 2013; 8: 250–253.
- [15] Solomon B, Chiappori A, Lamb A, et al. Preliminary Characterization of Visual Events Reported by Patients Receiving Crizotinib for the Treatment of Advanced ALK-positive Non-small Cell Lung Cancer. ECCO-ESMO 2011, European Multidisciplinary Cancer Congress, Stockholm, Sweden, 23–27 July 2011, Abstract 3030.
- [16] Hideki K, Takahiro N, Kengo T, et al. ALK fusion gene positive lung cancer and 3 cases treated with an inhibitor for ALK kinase activity. Lung Cancer 2012; 75: 66–72.
- [17] Lee JO, Kim TM, Lee SH, et al. Anaplastic lymphoma kinase translocation: a predictive biomarker of pemetrexed in patients with non-small cell lung cancer. J Thorac Oncol 2011; 6: 1474–1480.
- [18] Camidge DR, Kono SA, Lu X, et al. Anaplastic lymphoma kinase gene rearrangements in non-small cell lung cancer are associated with prolonged progression-free survival on pemetrexed. J Thorac Oncol 2011; 6: 774–780.
- [19] Otterson GA, Riely GJ, Shaw AT, et al. Clinical characteristics of ALK+ NSCLC patients treated with crizotinib beyond disease progression: Potential implications for management. ASCO Annual Meeting 2012, J Clin Oncol 2012; 30 (suppl): Abstract 7600.
- [20] Kim DW, Blackhall F, Soria JC, et al. A Global Phase 2 Study Including Efficacy, Safety, and Patient-reported Outcomes with Crizotinib in Patients with ALK-positive Non-small Cell Lung Cancer. ECCO-ESMO 2011, European Multidisciplinary Cancer Congress, Stockholm, Sweden, 23–27 July 2011, Abstract 9084.
- [21] Shaw AT, Camidge DR, Engelman JS, et al. Clinical activity of crizotinib in advanced non-small cell lung cancer (NSCLC) harboring ROS1 gene rearrangement. J Clin Oncol 2012; 30 (suppl 15): 7508.
- [22] Shaw AT, Yeap BY, Mino-Kenudson M, et al. Clinical features and outcome of patients with non-small-cell lung cancer who harbor EML4-ALK. J Clin Oncol 2009; 27: 4247–4253.
- [23] Gandhi L, Drappatz J, Ramaiya NH, Otterson AG. High-Dose Pemetrexed in Combination with High-Dose Crizotinib for the Treatment of Refractory CNS Metastases in ALK-Rearranged Non–Small-Cell Lung Cancor. J Thorac Oncol 2013; 8: e3–e5.
- [24] Lee SM, King J. Managing non-small-cell lung cancer with acquired resistance to EGF receptor and ALK inhibitors. Lung Cancer Manage 2013; 2: 23–26.