Léčba 20% subkutánním imunoglobulinem
Souhrn:
Substituční léčba imunoglobuliny je standardním postupem v terapii protilátkových imunodeficiencí. S historií dlouhou více než půl století je tato léčba velmi dobře zavedena a představuje klasickou formu substituční léčby. Přesto se i v takto dlouhodobě zavedené praxi setkáváme s novými přístupy. Tento článek shrnuje zkušenosti s imunoglobulinovým přípravkem ve 20% koncentraci, který je určen k dlouhodobému domácímu subkutánnímu podávání. Kromě charakteristiky 20% imunoglobulinu jsou v článku diskutovány praktické aspekty subkutánní substituční léčby imunoglobuliny. Sdělení je doplněno struč-nými kasuistikami dospělého i dětského pacienta.
Key words: subcutaneous immunoglobulin – SCIG – 20% immunoglobulin – intravenous immunoglobulin – IVIG – replacement therapy – immunomodulatory indications.
Summary:
Replacement therapy with immunoglobulins is a standard part of management of immunoglobulin deficiencies. Having been used for more than half a century, this therapy is well established and represents a classical form of substitution treatment. Despite this long established practice, novel approaches are being tested. This article summarizes the experience with 20% immunoglobulin intended for long term subcutaneous application at home. Beside the characteristics of 20% immunoglobulin, practical aspects of subcutaneous immunoglobulin substitution are discussed. The text also contains brief case reports concerning one adult and one pediatric patient.
Úvod
Léčba imunoglobuliny je již dlouhodobě zavedenou léčebnou strategií, která je uplatňována v mnoha vymezených klinických situacích zahrnujících substituční podávání imunoglobulinů při stavech imunodeficience a využití jejich imunomodulačního působení u řady onemocnění charakterizovaných dysregulací imunitního systému. Indikační kritéria se zvláště v poslední době rozšiřují zejména o imunomodulační podání. Optimalizace léčby imunoglobuliny je složitá otázka, která se řeší celosvětově hlavně pro vysokou cenu těchto přípravků, strmě se zvyšující spotřebu a pro jejich specifické vlastnosti. Tato specifika vyplývají zejména z povahy imunoglobulinových přípravků, které jsou purifikovány z krevní plazmy. Jsou tedy z podstaty ohroženy limity, které přinášejí získávání dostatečného množství krevní plazmy a které se periodicky objevují a mohou vyústit v nedostatek těchto důležitých léčiv.
K racionálnímu používání imunoglobulinů je nutná mezinárodní koordinace, jež probíhá a opakovaně vydává konsensus doporučující strategii používání imunoglobulinů. Poslední konsensuální sdělení uvádí základní indikace k léčbě imunoglobuliny v preferenčním pořadí [1]. Na prvním místě jsou již dlouhodobě primární imunodeficience, v imunomodulační léčbě je prokázána účinnost u primární trombocytopenické purpury, u Guillainova‑Barréova syndromu a u Kawasakiho syndromu. Primární imunodeficience tedy dominují v indikacích léčby imunoglobuliny, neboť představují pro pacienty s poruchami tvorby protilátek základní léčebný přístup spočívající v substituci jejich chybějící protilátkové odpovědi. Problematika léčby imunoglobuliny u primárních imunodeficiencí byla uvedena na stránkách časopisu Remedia v loňském roce [2], problematika samotných primárních imunodeficiencí byla také v nedávné době shrnuta a publikována [3].
V tomto sdělení se soustředíme na představení jedné z novějších forem imunoglobulinové léčby – 20% lidského imunoglobulinu k subkutánní aplikaci. Subkutánní podání imunoglobulinů se v posledních letech stále výrazněji prosazuje právě v dlouhodobé substituční léčbě primárních imunodeficiencí. Jedná se do určité míry o obnovení původně historicky používané strategie z poloviny 20. století, z doby samotných počátků aplikace imunoglobulinových přípravků, kdy byly uskutečňovány první pilotní pokusy a rozbíhal se vývoj metod separace a purifikace imunoglobulinů z lidské plazmy [4–6]. V dalších desetiletích byly možnosti klinické aplikace imunoglobulinů omezeny na intramuskulární podávání takzvaného gamaglobulinu, který se využíval i v předpokládané prevenci infekčních onemocnění. Pro samotné substituční použití však byly možnosti intramuskulárního podávání omezené, nebylo možno dosáhnout zlepšení sérových koncentrací a podání bylo provázeno rizikem nežádoucích až závažných systémových reakcí. Vznik těchto reakcí byl spojen se stále nedostatečnými metodami purifikace a stabilizace imunoglobulinových přípravků, kromě jiného taktéž s postupnou tvorbou dimerů imunoglobulinu G (IgG) v průběhu skladování [7]. Další pokrok ve výrobě umožnil vývoj přípravků pro intravenózní aplikaci [8], které od osmdesátých let 20. století dominovaly na poli imunoglobulinové léčby. I přes velmi dobrou kvalitu přípravků a výbornou účinnost léčby s dobrým dosažením terapeutických hladin je tato aplikační forma stále zatížena určitým, i když minimálním rizikem nežádoucích reakcí systémového charakteru [2].
V devadesátých letech 20. století došlo k dalšímu posunu v metodách aplikace imunoglobulinů opětovným využitím subkutánní cesty, tentokrát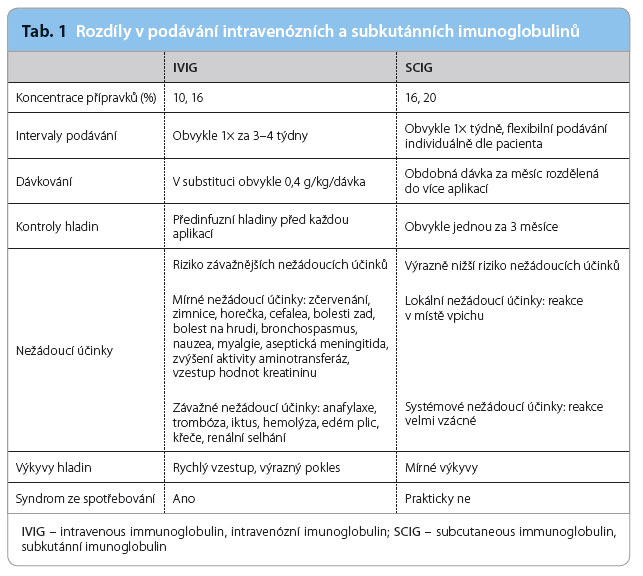 v systematickém podávání dostatečných dávek k zajištění substituční hladiny u imunodeficitních pacientů [9]. V této strategii se využívaly 16% imunoglobulinové přípravky stejně jako při původní intramuskulární aplikaci. Subkutánní forma se ukázala jako mimořádně bezpečná, s minimálním výskytem nežádoucích účinků a prakticky bez systémových komplikací [10,11]. Tyto první zkušenosti postupně vedly k vývoji přípravků určených primárně pro subkutánní použití, které zachovávají tradiční 16% koncentraci. Postupné velmi široké podávání této formy se velmi osvědčilo a je používáno prakticky v nezměněné podobě dodnes. Základní srovnání intravenózních a subkutánních imunoglobulinů uvádí tab. 1.
v systematickém podávání dostatečných dávek k zajištění substituční hladiny u imunodeficitních pacientů [9]. V této strategii se využívaly 16% imunoglobulinové přípravky stejně jako při původní intramuskulární aplikaci. Subkutánní forma se ukázala jako mimořádně bezpečná, s minimálním výskytem nežádoucích účinků a prakticky bez systémových komplikací [10,11]. Tyto první zkušenosti postupně vedly k vývoji přípravků určených primárně pro subkutánní použití, které zachovávají tradiční 16% koncentraci. Postupné velmi široké podávání této formy se velmi osvědčilo a je používáno prakticky v nezměněné podobě dodnes. Základní srovnání intravenózních a subkutánních imunoglobulinů uvádí tab. 1.
Další pokrok v technologii přípravy následně umožnil vývoj imunoglobulinového přípravku ve 20% koncentraci, s výhodou nižšího objemu určeného k aplikaci do omezeného subkutánního prostoru. Tato forma velmi elegantně využívá L‑prolin ke stabilizaci roztoku imunoglobulinů. L‑prolin zabraňuje agregaci a tvorbě dimerů v roztoku imunoglobulinů, čímž umožňuje dosažení zmíněné vyšší koncentrace [12]. Vývoj s využitím těchto nových možností stabilizace umožnil výrobu 20% imunoglobulinového přípravku, který nyní využíváme v klinické praxi.
Imunoglobulin ve 20% koncentraci
Jedná se o přípravek 20% lidského imunoglobulinu, který je stabilizován L‑prolinem a obsahuje vysoce čištěné polyklonální imunoglobuliny G (> 98 %) a pouze stopy imunoglobulinů A. V současné době je 20% imunoglobulin schválen v Evropě i v USA k substituční léčbě primárních imunodeficiencí a vybraných forem sekundárních imunodeficiencí (tab. 2). V nedávné době byla povolení lékových agentur v USA i v Evropě rozšířena i na takzvanou flexibilní aplikaci, kdy je možno dle individuálních potřeb pacienta podávat přípravek s četností od každodenní aplikace až po frekvenci jednou za dva týdny, s odpovídající úpravou jednotlivé dávky.
Přípravek 20% lidského imunoglobulinu je vyráběn klasickou technologií z plazmy nejméně 6 000 dárců komplexním procesem, který zahrnuje ethanolovou frakcionaci, precipitaci a výměnnou chromatografii. K dalšímu posílení bezpečnosti léčby 20% imunoglobulinem z hlediska přenosu infekčních onemocnění jsou navíc dárci testováni na spektrum virových onemocnění a do výroby jsou zařazeny následné kroky cílené na inaktivaci virů [13]. Stejná opatření včetně ultrafiltrace zabezpečují absenci prionů [13]. Dalším testováním se dále sleduje přítomnost prokoagulačních faktorů IX a XI, které musí být ve finálním produktu nedetekovatelné. Konečná podoba 20% imunoglobulinového přípravku je ve formě tekutiny, která byla testována na stabilitu s cílem dosáhnout bezpečného podání i při skladování při pokojové teplotě. Roztok se ukázal být stabilní i po skladování po dobu 30 měsíců, což je schválená exspirační doba 20% imunoglobulinu [12].
Vyvinutý přípravek byl podroben preklinickému i klinickému testování, přehled studií je uveden dále (tab. 3). Počáteční studie [14] prokázaly stabilitu 20% imunoglobulinu a možnost jeho skladování při pokojové teplotě, což je významný faktor pro použití přípravku v režimu domácí aplikace. Další studie prokázaly jeho bezpečnost [15,16]. Následovaly dvě  rozsáhlejší klinické studie v USA a v Evropě [16,17], které ukázaly na velmi dobrou stabilizaci hladin IgG, jež byly dokonce zvýšeny oproti předchozím aplikacím intravenózního imunoglobulinu (intravenous immunoglobulin, IVIG) ve stejné dávce. Dále tyto studie prokázaly klinickou účinnost 20% imunoglobulinu při sledování infekčních komplikací u pacientů s imunodeficitem. Studie z roku 2013 vedená Landersdorferem modelovala farmakokinetiku subkutánního imunoglobulinu při podávání 2× týdně a stala se podkladem pro režim flexibilního dávkování [18].
rozsáhlejší klinické studie v USA a v Evropě [16,17], které ukázaly na velmi dobrou stabilizaci hladin IgG, jež byly dokonce zvýšeny oproti předchozím aplikacím intravenózního imunoglobulinu (intravenous immunoglobulin, IVIG) ve stejné dávce. Dále tyto studie prokázaly klinickou účinnost 20% imunoglobulinu při sledování infekčních komplikací u pacientů s imunodeficitem. Studie z roku 2013 vedená Landersdorferem modelovala farmakokinetiku subkutánního imunoglobulinu při podávání 2× týdně a stala se podkladem pro režim flexibilního dávkování [18].
Klinické aspekty aplikace 20% imunoglobulinu
Subkutánní podání
Imunoglobulin ve 20% koncentraci se stejně jako všechny imunoglobulinové přípravky aplikuje do podkožního prostoru, odkud se vstřebává do lymfatického systému a dále do cirkulace [19]. Aplikuje se podkožní infuzí do určených míst, preferenčně na přední stranu břicha, s možnostmi aplikace i na přední plochy stehna, výjimečně do oblastí nad hýžděmi. Vzhledem ke své koncentraci je viskóznější než 16% přípravky obvykle užívané k subkutánní aplikaci. Rychlost podání je variabilní, v Souhrnu údajů o přípravku (Summary of Product Characteristics, SPC) je doporučena rychlost aplikace 15 ml/h do jednoho místa s možností zvýšení na 25 ml/h. Existují nicméně i literární údaje udávající vyšší rychlosti podání [19]. V případě indikace většího množství 20% imunoglobulinu je možné i simultánně využít více míst podkožního vstupu.
Dávkování
Dávkování přípravku vychází z doporučených substitučních dávek u protilátkových imunodeficiencí a je individuální. Dávkování určuje ošetřující lékař se zvážením všech okolností pro daného pacienta. V rozvaze je posuzována základní diagnóza, předchozí léčba, nové schéma léčby imunoglobuliny či přechod z předchozí léčby jinou formou či jiným, méně koncentrovaným přípravkem, klinický stav pacienta, schopnost udržet stabilní hladiny IgG v závislosti na dávce a další možné okolnosti. Rozvaha se doplňuje aktivním dialogem s pacientem a zpřesňuje praktické možnosti, intervaly podání, množství přípravku tolerované na jednu dávku a na jedno místo. Z dané rozvahy, která je velmi individuální a přesně stanovená pro konkrétního pacienta, potom vzejde rozpis léčby.
Nejčastější situace odráží převod z předchozí intravenózně aplikované léčby na subkutánní podání. Tato situace vyvolala řadu diskusí o dávkování subkutánního přípravku tak, aby byly zaručeny stabilní dostatečné hladiny IgG. Prvotní klinické studie, zejména z USA, doporučovaly zvýšení dávky subkutánního imunoglobulinu dokonce 1,5krát oproti předchozí dávce aplikované intravenózně [20]. Evropské studie však nutnost zvyšování dávky nepotvrdily, naopak dokonce při stejném dávkování jako u předchozí intravenózní léčby dokládaly zvýšení hladin IgG [17]. V naší vlastní praxi převádíme dávky nezměněné oproti intravenóznímu podávání. Celková měsíční dávka se potom dělí do jednotlivých dávek subkutánních, které odpovídají frekvenci aplikací u daného pacienta.
Pokud je subkutánní léčba zahajována u nového pacienta, je většinou třeba dosáhnout stabilní plánované hladiny IgG, což se děje častějším podáváním v počátku léčby. Počáteční dávky se pohybují v rozmezí 0,2–0,5 g/kg, rozděleně do několika dávek, které se aplikují v prvních týdnech 1–2× týdně, a po dosažení optimální hladiny IgG se již postupuje klasickým režimem.
Doporučená dávkování pro substituci u imunodeficitních stavů mají širší rozmezí, většinou udávané v rozpětí 0,4–0,8 g/kg/měsíc. I s těmito údaji je však třeba pracovat a upravit je podle potřeby každého pacienta. Tyto potřeby se řídí stabilitou dosažených hladin a klinickým stavem pacienta jakožto rozhodujícím kritériem. Hladiny IgG, které zaručí obranu před infekcemi, jsou u každého pacienta individuální a ovlivňují je jak dávky, tak frekvence podávání.
Frekvence podávání a flexibilní dávkování
Frekvence podávání je taktéž předmětem individuálního posouzení a záleží hlavně na klinickém stavu, stabilitě a výšce hladin IgG, na snášenlivosti léčby, na výskytu lokálních reakcí při aplikaci (tab. 1), a dále také na celkové situaci pacienta a na souladu léčby s jeho způsobem života. Frekvenci podávání ovlivňuje též zkušenost pacienta a epidemiologická situace.
Obvyklá frekvence podávání je po dosažení saturační hladiny či při nekomplikovaném převodu z intravenózní léčby jednou za týden. Ukazuje se však, že potřeby pacientů jsou velmi individuální co do výše dávky i její frekvence. I to vedlo k upřesnění režimu dávkování a k následnému rozhodnutí lékových agentur v USA i v Evropě o povolení tzv. flexibilního dávkování charakterizovaného širokým spektrem možností zahrnujících podávání denně až jednou za dva týdny.
Způsoby aplikace a doba podávání
Imunoglobuliny se do subkutánního prostoru dostávají pomalou podkožní infuzí. Tento způsob aplikace většinou vyžaduje speciální pumpy pro podkožní podání, které kontrolují rychlost podání a dávku přípravku. Diskutovaný přípravek využívá 20% koncentrace, která umožňuje zajištění požadované dávky imunoglobulinů aplikací menšího objemu.
Menší ob jemy je možné aplikovat i metodou nazývanou rapid‑push, podáváním pomalým přerušovaným tlakem z ruky (obr. 1). Tento způsob je v oblasti subkutánních imunoglobulinů výhodný právě pro aplikaci přípravku s vyšší koncentrací. Podávání pumpou a metodou rapid‑push bylo posuzováno ve srovnávací studii, kde byla metoda rapid‑push shledána jako plnohodnotná alternativa ke klasickému podávání pumpou [21]. V praxi je tato metoda pro své nízké nároky na vybavení a pro svoji flexibilitu pacienty často upřednostňována.
jemy je možné aplikovat i metodou nazývanou rapid‑push, podáváním pomalým přerušovaným tlakem z ruky (obr. 1). Tento způsob je v oblasti subkutánních imunoglobulinů výhodný právě pro aplikaci přípravku s vyšší koncentrací. Podávání pumpou a metodou rapid‑push bylo posuzováno ve srovnávací studii, kde byla metoda rapid‑push shledána jako plnohodnotná alternativa ke klasickému podávání pumpou [21]. V praxi je tato metoda pro své nízké nároky na vybavení a pro svoji flexibilitu pacienty často upřednostňována.
Způsob aplikace také ovlivňuje dobu podávání, která je různě dlouhá podle množství indikovaného přípravku, podle frekvence podávání, podle snášenlivosti lokálních reakcí a podle preferencí pacienta. Doba podávání pumpou a metodou rapid‑push se také liší. Stejně tak pacienti, kteří s léčbou začínají, aplikují pomaleji než pacienti zkušení. Průměrné doby trvání aplikace se pohybují kolem 15 minut, s velkým rozptylem podle okolností vyjmenovaných výše. Díky vyšší koncentraci 20% imunoglobulinu trvá jeho podání většinou kratší dobu než u jiných přípravků.
Domácí podávání
Imunoglobulin ve 20% koncentraci je určen k dlouhodobé substituci k domácímu podávání. K zacvičení pacienta či rodičů dětí s imunodeficitními onemocněními jsou vyvinuty postupy, které zajišťují specializované zdravotní sestry pracující ve stacionářích pro aplikace imunoglobulinových přípravků. Intenzita a délka období zaškolení v aplikační technice je opětovně velmi individuální a zahrnuje různý počet návštěv, prakti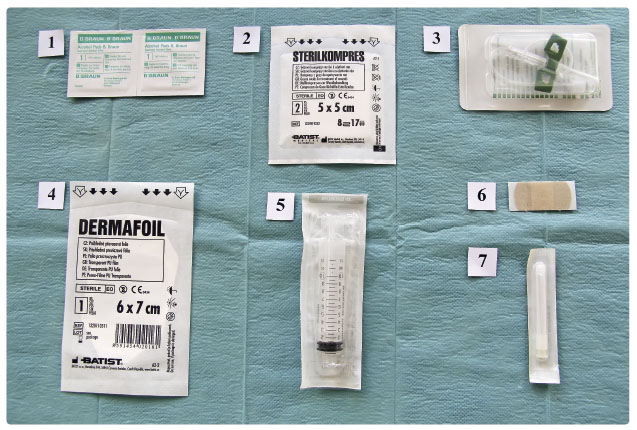 ckých ukázek a opakovaného cvičení. Jako pomoc pacientům jsou připraveny obrázky a videa ukazující sled potřebných kroků, postupy aplikace i potřebné vybavení (obr. 2).
ckých ukázek a opakovaného cvičení. Jako pomoc pacientům jsou připraveny obrázky a videa ukazující sled potřebných kroků, postupy aplikace i potřebné vybavení (obr. 2).
Kromě samotného podání musí pacient taktéž vést záznamy o vedení léčby, včetně uchovávání údajů o použité šarži přípravku a o průběhu aplikace. Pro případ nežádoucích účinků je pacient vybaven pohotovostní medikací – antihistaminikem a perorálním glukokortikoidem – a stav musí ihned konzultovat se svým ošetřujícím lékařem.
Monitorování léčby
Na rozdíl od intravenózní léčby imunoglobuliny, kdy byli pacienti automaticky sledováni při jejich většinou pravidelné měsíční aplikaci, přicházejí pacienti s domácí subkutánní léčbou na kontrolu méně často, většinou jednou za tři měsíce. Při návštěvě se kontroluje klinický stav pacienta, laboratorní hodnoty včetně předinfuzních hladin IgG a dále aspekty vyplývající z techniky aplikace. Před zavedením léčby imunoglobuliny se specificky vyšetřují hodnoty jaterních testů a odpovídajícími metodami přímého průkazu, které jsou nutné u pacientů s poruchami tvorby protilátek, se vyšetřuje přítomnost virů (především hepatitidy B, C a viru HIV). Ostatní sledování se řídí pravidly sledování pacientů s primární imunodeficiencí a záleží na přesné diagnostické jednotce a na aktuálním stavu pacienta [3].
Podávání v imunomodulační indikaci
Imunoglobulin ve 20% koncentraci je jako přípravek subkutánní imunoglobulinové léčby (subcutaneous immunoglobulin, SCIG) určen podle SPC k substituční léčbě imunodeficitních stavů (tab. 2). Jedná se nicméně o účinný imunoglobulinový přípravek, který je ve své intravenózní formě používán i v imunomodulačních indikacích především v léčbě pacientů s autoimunitními onemocněními. Postupně se tedy objevují i práce zkoumající možnosti použití subkutánních imunoglobulinů v imunomodulační indikaci. Srovnání 20% subkutánního imunoglobulinu s 10% intravenózním imunoglobulinem s identickou technologickou přípravou, na něž se zaměřila studie imunomodulačních účinků uskutečněná v podmínkách in vitro, neprokázalo mezi těmito formami rozdíly [22]. Postupně se začínají objevovat zprávy o použití subkutánních imunoglobulinů i u zánětlivých neuromuskulárních onemocnění, kde po vzoru léčby imunodeficiencí převádějí pacienty z intravenózních na subkutánní aplikace, což někdy dokonce umožňuje snížení dávky při udržení klinické účinnosti [23].
Kasuistika 1, dospělý pacient
Pacient, 27letý muž, byl na naše pracoviště odeslán k imunologickému vyšetření pro recidivující respirační infekty, které téměř vždy vyžadovaly antibiotickou léčbu. Zvýšená nemocnost u pacienta přetrvávala již několik let. Obtíže podobného charakteru nebyly zjištěny u žádného jiného člena rodiny, pacient negoval také výskyt autoimunitních či alergických onemocnění.
Při klinickém vyšetření byl u pacienta zjištěn zcela fyziologický nález. Provedli jsme komplexní imunologické vyšetření zahrnující parametry buněčné i protilátkové imunity. Zjistili jsme hypogamaglobulinemii ve všech třídách imunoglobulinů (IgG = 2,03 g/l, IgA < 0,07 g/l, IgM = 0,19 g/l), dále neprotektivní hodnoty specifických postvakcinačních protilátek (tetanus 0,15 IU/ml, Haemophilus influenzae 0,08 mg/l). Parametry buněčné imunity se nacházely v normě. Po vyloučení ostatních možných příčin hypogamaglobulinemie (poléková, při onemocnění ledvin, GIT, při malignitách atd.) jsme diagnózu uzavřeli jako běžný variabilní imunodeficit (common variable immunodeficiency, CVID).
Bylo indikováno podávání substituční imunoglobulinové léčby. Vzhledem k velmi nízkým sérovým koncentracím celkového IgG bylo nejprve zahájeno podávání intravenózních imunoglobulinových přípravků v dávce 0,3 g/kg, kdy po třech podáních v měsíčním intervalu bylo dosaženo sérové koncetrace celkového IgG vyšší než 3,5 g/l. Vzhledem k výhodám podkožního podání metodou rapid‑push jsme pacienta poté převedli na subkutánní léčbu přípravkem s 20% koncentrací imunoglobulinů. Dávkování bylo upraveno na 0,2 g/kg měsíčně rozdělených do 4 dávek v týdenním intervalu, s podáním 20 ml do jednoho aplikačního místa.
IgG bylo nejprve zahájeno podávání intravenózních imunoglobulinových přípravků v dávce 0,3 g/kg, kdy po třech podáních v měsíčním intervalu bylo dosaženo sérové koncetrace celkového IgG vyšší než 3,5 g/l. Vzhledem k výhodám podkožního podání metodou rapid‑push jsme pacienta poté převedli na subkutánní léčbu přípravkem s 20% koncentrací imunoglobulinů. Dávkování bylo upraveno na 0,2 g/kg měsíčně rozdělených do 4 dávek v týdenním intervalu, s podáním 20 ml do jednoho aplikačního místa.
Po zahájení substituce došlo u našeho pacienta k významnému snížení míry nemocnosti a k ústupu celkových projevů, jako je únava a nechutenství. I po převodu na subkutánní aplikaci a při zachování stejného poměru intravenózního a subkutánního imunoglobulinu přetrvávaly sérové koncentrace celkového IgG kolem 5 g/l (graf 1). Zavedenou léčbu pacient toleroval velmi dobře, bez rozvoje celkových či lokálních nežádoucích účinků.
Kasuistika 2, dětský pacient
Pacient, 13letý chlapec, je imunologicky sledován od půl roku věku kvůli opakovaným respiračním infektům, kterým dominovaly otitidy, dále v předškolním období i bronchitidy a posléze i opakované pneumonie. Ve čtyřech letech pacient podstoupil adenotomii – bez zlepšení stavu. Pro opakované infekce byl v místě bydliště léčen bakteriálními lyzáty, opětovně bez výrazného účinku. Alergie byla opakovaně laboratorně vyloučena, pro trvalé respirační obtíže byl však léčen i antihistaminiky a bronchodilatační terapií, bez výrazné změny stavu.
Vyšetření imunoglobulinů ukazovalo v prvních letech života nízké hodnoty, které se nicméně spontánně upravily a vedly tak k pracovní diagnóze přechodné hypogamaglobulinemie v dětství. O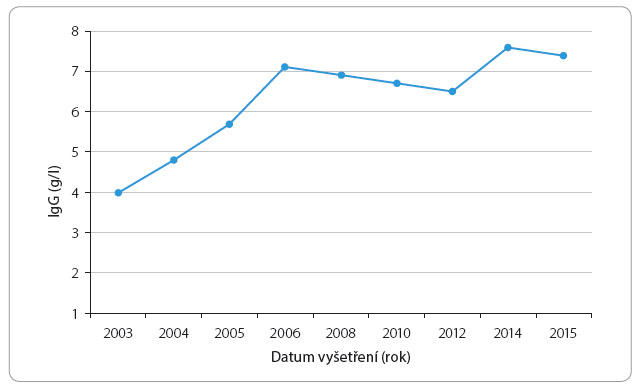 pakované respirační infekty však neustávaly, hodnoty imunoglobulinů se po dočasném zlepšení opětovně snížily, což vedlo k zavedení léčby 16% subkutánními imunoglobuliny v nízké dávce odpovídající jenom mírnému snížení hladin IgG. I přes tuto strategii se klinický stav chlapce nelepšil. V posledních dvou letech je pacientovi podáván 20% imunoglobulin v dávce 0,05 g/kg subkutánně jednou za 14 dní. Postupně dochází ke stabilizaci stavu pacienta jak z hlediska klinického, tak laboratorního. Léčba je velmi dobře tolerována, po zaučení je aplikována rodiči pacienta (graf 2).
pakované respirační infekty však neustávaly, hodnoty imunoglobulinů se po dočasném zlepšení opětovně snížily, což vedlo k zavedení léčby 16% subkutánními imunoglobuliny v nízké dávce odpovídající jenom mírnému snížení hladin IgG. I přes tuto strategii se klinický stav chlapce nelepšil. V posledních dvou letech je pacientovi podáván 20% imunoglobulin v dávce 0,05 g/kg subkutánně jednou za 14 dní. Postupně dochází ke stabilizaci stavu pacienta jak z hlediska klinického, tak laboratorního. Léčba je velmi dobře tolerována, po zaučení je aplikována rodiči pacienta (graf 2).
Po celou dobu léčby jsou u pacienta zjišťovány i snížené hodnoty IgM, hodnoty postvakcinačních protilátek kolísají, odpověď na léčbu je většinou vcelku dobrá, avšak titry protilátek, ačkoli dosahují normy, se pohybují při její dolní hranici; odpověď na některé vakcinace je nízká.
Původní diagnóza přechodná hypogamaglobulinemie v dětství je nyní upřesněna a pacient je veden s diagnózou rozvíjející se protilátková deficience (CVID).
Závěr
Imunoglobulin s 20% koncentrací určený pro subkutánní použití je jednou z forem substituční léčby protilátkových primárních imunodeficiencí. Přípravek je využíván v domácí léčbě aplikované metodou rapid‑push, eventuálně může být podáván pumpou. Literární údaje i popsané vlastní zkušenosti dokumentují výbornou účinnost, snášenlivost a bezpečnost léčby a dále dokládají výhodu vyšší koncentrace spojené s menším množstvím aplikovaného léčiva. Po schválení lékovými agenturami se nově naskytuje i možnost flexibilního dávkování upraveného individuálně pro daného pacienta. V současné době tvoří 20% imunoglobulin zavedenou formu substituční léčby pro pacienty s protilátkovými imunodeficiencemi.
Seznam použité literatury
- [1] Sewell WA, Kerr J, Behr Gross ME, Peter HH; Kreuth Ig Working Group. European consensus proposal for immunoglobulin therapies. Eur J Immunol. 2014; 44: 2207–2214.
- [2] Šedivá A. Imunoglobuliny v léčbě imunodeficiencí. Remedia 2014; 24: 163–167.
- [3] Šedivá A. Nové poznatky a pokroky v oblasti primárních imunodeficiencí. Postgrad Med 2015; 3: 294–303.
- [4] Bruton OC. Agammaglobulinaemia. Pediatrics 1952; 9: 722–728.
- [5] Asherson GL, Hill KE, Citron KM. Primary immunodeficiency syndromes. Thorax 1970; 25: 254–255.
- [6] Cohn EJ, Oncleym JL, Strong LE, et al. Chemical, clinical and immunological studies on the products of human plasma fractionation. I. The characterization of the protein fractions of human plasma. J Clin Invest 1944; 23: 417–432.
- [7] Tankersley DL. Dimer formation in immunoglobulin preparations and speculations on the mechanism of action of intravenous immune globulin in autoimmune diseases. Immunol Rev 1994; 139: 159–172.
- [8] Chapel H. Subcutaneous immunoglobulin replacement therapy: the European experience. Curr Opin Allergy Clin Immunol 2013; 13: 623–629.
- [9] Gardulf A, Hammarstrom L, Smith E. Home treatment of hypogammaglobulinaemia with subcutaneous gammaglobulin by rapid infusion. Lancet 1991; 338: 162–166.
- [10] Gardulf A, Andersen V, Bjorkander J, et al. Subcutaneous immunoglobulin replacement in patients with primary antibody deficiencies: safety and costs. Lancet 1995; 345: 365–369.
- [11] Sundin U, Nava S, Hammarstrom L. Induction of unresponsiveness against IgA in IgA deficient patients on subcutaneous immunoglobulin infusion therapy. Clin Exp Immunol 1998; 112: 341–346.
- [12] Bolli R, Woodtli K, Bärtschi M, et al. L Proline reduces IgG dimer content and enhances the stability of intravenous immunoglobulin (IVIG) solutions. Biologicals 2010; 38: 150–157.
- [13] Stucki M, Boschetti N, Schäfer W, et al. Investigations of prion and virus safety of a new liquid IVIG product. Biologicals 2008; 36: 239–247.
- [14] Maeder W, Lieby P, Sebald A, et al. Local tolerance and stability up to 24 months of a new 20% proline stabilized polyclonal immunoglobulin for subcutaneous adminis-tration. Biologicals 2011; 39: 43–49.
- [15] Borte M, Pac M, Serban M, et al. Efficacy and safety of Hizentra®, a new 20% immunoglobulin preparation for subcutaneous administration, in pediatric patients with primary immunodeficiency. J Clin Immunol 2011; 31: 752–761.
- [16] Hagan JB, Fasano MB, Spector S, et al. Efficacy and safety of a new 20% immunoglobulin preparation for subcutaneous administration, IgPro20, in patients with primary immunodeficiency. J Clin Immunol 2010; 30: 734–745.
- [17] Jolles S, Bernatowska E, de Gracia J, et al. Efficacy and safety of Hizentra® in patients with primary immunodeficiency after a dose equivalent switch from intravenous or subcutaneous replacement therapy. Clin Immunol 2011; 141: 90–102.
- [18] Landersdorfer CB, Bexon M, Edelman J, et al. Pharmacokinetic modeling and simulation of biweekly subcutaneous immunoglobulin dosing in primary immunodeficiency. Postgrad Med 2013; 125: 53–61.
- [19] Jolles S, Sleasman JW. Subcutaneous immunoglobulin replacement therapy with Hizentra, the first 20% SCIG preparation: a practical approach. Adv Ther 2011; 28: 521–533.
- [20] Wasserman R, Melamed I, Nelson RP Jr., et al. Pharmacokinetics of subcutaneous IgPro20 in patients with primary immunodeficiency. Clin Pharmacokinetics 2011; 50: 405–414.
- [21] Shapiro RS. Subcutaneous immunoglobulin therapy given by subcutaneous rapid push vs infusion pump: a retrospective analysis. Ann Allergy Asthma Immunol 2013; 111: 51–55.
- [22] Issekutz AC, Rowter D, Miescher S, Käsermann F. Intravenous IgG (IVIG) and subcutaneous IgG (SCIG) preparations have comparable inhibitory effect on T cell acti-vation, which is not dependent on IgG sialylation, monocytes or B cells. Clin Immunol 2015; 160: 123–132.
- [23] Hadden RD, Marreno F. Switch from intravenous to subcutaneous immunoglobulin in CIDP and MMN: improved tolerability and patient satisfaction. Ther Adv Neurol