Monoklonální protilátky v kardiologii – téma stále aktuálnější
Souhrn:
Hlavní doménou využití monoklonálních protilátek v léčbě je onkologie a revmatologie. Využití tohoto typu biologické léčby v kardiologii bylo omezeno prakticky na protilátky vázající digoxin při digitalisové intoxikaci a na inhibici agregace trombocytů blokádou vazebných receptorů IIb/IIIa abciximabem. V roce 2015 však přicházejí dvě nové skupiny léčiv – inhibitory proproteinové konvertázy subtilisin/kexin 9, hypolipidemika alirocumab či evolocumab a antidotum proti dabigatranu (přímému inhibitoru trombinu) – idarucizumab. Také v dalších oblastech kardiologie je možno očekávat příchod nových zajímavých léčiv na bázi monoklonálních protilátek.
Key words: monoclonal antibodies – muromonab CD3 – abciximab – digoxin immune Fab – alirocumab – evolocumab – idarucizumab – PCSK9 inhibitors.
Summary:
Monoclonal antibodies are mostly used in oncology and rheumatology. The use of this type of biological therapy in cardiology has been limited virtually to antibodies binding digoxin in digitalis intoxication and to inhibition of platelet aggregation by blocking the IIb/IIIa receptors with abciximab. In 2015, however, two novel classes of drugs have emerged: inhibitors of proprotein convertase subtilisin/kexin type 9, PCSK9, i.e. hypolipidemics alirocumab or evolocumab, and an antidote of dabigatran (direct thrombin inhibitor), i.e. idarucizumab. The emergence of novel interesting drugs based on monoclonal antibodies can be expected in other cardiology domains, too.
Použití protilátek v medicíně má sice dlouholetou tradici, před 125 lety byl užit k léčbě difterický anatoxin, nicméně na významnější využití jsme si museli celé století počkat. Prvá monoklonální protilátka (mAb) byla schválena ke klinickému použití u akutní rejekce transplantátu ledvin či srdce až v roce 1986. Podání muromonabu‑CD3, myší protilátky proti antigennímu komplexu CD3 na povrchu T‑buňky, aktivovalo apoptotickou destrukci těchto cytotoxických lymfocytů. Ačkoli „kardiologie“ stála u kolébky a o prvé využití se dělila s „nefrologií“, v dalších téměř třiceti letech byl zájem kardiologů o monoklonální protilátky spíše okrajový. Monoklonální protilátky proti digoxinu či trombocytárním receptorům IIb/IIIa rozhodně nezaznamenaly masové využití. Rozdíl vyniká zejména ve srovnání s onkologií, revmatologií, hematologií, imunologií, gastroenterologií či ve srovnání s dermatologií, kde tento typ biologické léčby již řadu let vévodí. Nicméně v roce 2015 nastává významný předěl, jsou zaváděny hned dvě velmi významné skupiny léčiv na bázi monoklonálních protilátek – inhibitory proproteinové konvertázy subtilisin/kexin 9 (PCSK9) alirocumab a evolocumab či antidotum proti antikoagulačnímu účinku dabigatranu idarucizumab. Vzhledem k těmto vítaným událostem je vhodné začlenit nové molekuly do stávajícího scénáře a shrnout výhody a úskalí používání těchto „biologik“.
Cesta, která vedla k zavedení monoklonálních protilátek do praxe, byla lemována hned čtyřmi Nobelovými cenami. Za využití tetanového a difterického antitoxinu byl tímto oceněním odměněn počátkem 20. století Emil Adolf von Behring a brzy po něm byla medaile udělena Paulu Ehrlichovi za „teorii postranních řetězců“ pro interakci protilátky s antigenem a formulování teorie „zámku a klíče“. O půlstoletí později pak cenu obdržel Linus Pauling za potvrzení této teorie. Poslední Nobelovu cenu pak získali v roce 1986 César Milstein a Georges Köhler za vývoj metody pro výrobu „vlastních“ monoklonálních protilátek. Cesta k nové kapitole ve farmakoterapii tak byla otevřena.
Princip a cíle léčby na podkladě monoklonálních protilátek
Proč je biologická léčba na bázi monoklonálních protilátek v popředí zájmu farmakologů, kliniků i farmaceutických společností? Důvod je jeden – mění se přístup k léčbě, můžeme cíleně inhibovat funkci přesně definované molekuly, konkrétní struktury či specifické buňky. Cílovými strukturami mohou být například regulátory metabolických a reparačních pochodů (cytokiny ze skupiny tumor necrosis factor [TNF], interleukinů, řady dalších růstových faktorů – sclerostin, ligand pro receptor aktivující jaderný faktor κB [receptor activator of nuclear factor kappa‑B ligand, RANKL] apod.), cílem mohou být enzymy, receptory, transportéry, iontové kanály, somatické buňky či bakteriální či virové antigeny. Specifickou oblastí je cílení účinku na podané léčivo, monoklonální protilátka pak působí jako antidotum. Vzhledem k obrovské plasticitě účinku protilátek jsou možnosti téměř nevyčerpatelné. Již nyní je k dispozici ke klinickému užívání či ve fázi hodnocení více než 500 různých molekul, či přesněji řečeno makromolekul s mimořádně vysokou terapeutickou specificitou. Právě přesný zásah do cílové struktury (antigenu) s ovlivněním právě jen tohoto cíle je hlavní předností léčby. Pochopitelně však, pokud daný antigen na povrchu buňky není přítomen (např. při velké dediferenciaci tumorózní buňky), léčba se míjí účinkem.
Imunoglobuliny (Ig) jsou produkovány B‑buňkami (plazmocyty) jako imunitní odpověď na různé noxy. V krvi pak buď cirkulují, či jsou vázány na membránu. Z pěti skupin imunoglobulinů jsou terapeuticky využívány jako monoklonální protilátky pouze IgG, které tvoří 80 % všech cirkulujících protilátek. Právě imunoglobuliny G zajišťují odpověď přesně cílenou na danou noxu v tzv. druhé fázi odpovědi organismu. Výhodou je také delší doba setrvání v organismu, pokud nedojde k navázání na antigen, jejich biologický poločas eliminace se pohybuje až ke třem týdnům. Tyto imunoglobuliny jsou jedinými, které procházejí placentární bariérou. Jsou schopny se vázat na Fc receptory polymorfonukleárních neutrofilů, monocytů a makrofágů a zprostředkovávají fagocytózu, inaktivaci a degradaci antigenu. Imunoglobuliny IgM zprostředkují rychlou aktivaci fagocytózy, na rozdíl od monovalentních IgG je však afinita k antigenu multivalentní. Imunoglobuliny IgD mají význam v maturaci B‑buněk, IgA jsou secernovány sliznicemi do sekretů, kde jsou zodpovědné za inhibici adheze bakterií a virů k buněčnému povrchu. Imunoglobuliny IgE jsou zodpovědné za alergické reakce, spouštějí degranulaci řady vazoaktivních a proteolytických látek z mastocytů a bazofilních leukocytů.
Struktura všech imunoglobulinů je obdobná, základní strukturu tvoří![Obr. 1 Struktura protilátek. Protilátky jsou proteiny, které jsou produkovány imunitním systémem jako obranná linie primárně proti infekcím a nemocem. Všechny protilátky mají podobnou strukturu, skládají se ze čtyř proteinů. Každá protilátka obsahuje dva těžké řetězce a dva lehké řetězce, které vzájemně váží kovalentní vazby. Variabilní konce těžkého a lehkého řetězce jsou u jednotlivých protilátek odlišné, díky tomu každá protilátka rozpoznává specifi cký antigen. Zbytek, který je u všech protilátek konstantní, zajišťuje další specifi cké funkce protilátky (vazbu na fagocytující buňky apod.); podle [4] – Lauren, Sompayrac, 2012.](https://www.remedia.cz/photo-a-30410---.jpg) dva těžké řetězce (≈ 400 aminokyselinový řetězec) a dva lehké řetězce (tvořené 110 aminokyselinami) vzájemně spojené kovalentními vazbami (obr. 1). Po funkční stránce je důležitější rozdělení na variabilní oblast sloužící k rozpoznání a k vazbě antigenu a na konstantní oblast, která je zodpovědná za vazbu k Fc receptorům fagocytujících buněk, za vazbu komplementu, za rozpoznání vlastními imunocyty či za přenos imunoglobulinu např. placentární bariérou. Variabilní část je specifická pro každou buněčnou linii a váže se na specifické místo antigenu – epitop. Jeden antigen pak mívá epitopů několik a je terčem imunoglobulinů pocházejících z více plazmocytů. Pokud protilátky pocházejí z více buněčných linií, mluvíme o polyklonálních protilátkách, naopak jedna linie je zdrojem protilátek monoklonálních. Konstantní část je společná všem imunoglobulinům dané třídy.
dva těžké řetězce (≈ 400 aminokyselinový řetězec) a dva lehké řetězce (tvořené 110 aminokyselinami) vzájemně spojené kovalentními vazbami (obr. 1). Po funkční stránce je důležitější rozdělení na variabilní oblast sloužící k rozpoznání a k vazbě antigenu a na konstantní oblast, která je zodpovědná za vazbu k Fc receptorům fagocytujících buněk, za vazbu komplementu, za rozpoznání vlastními imunocyty či za přenos imunoglobulinu např. placentární bariérou. Variabilní část je specifická pro každou buněčnou linii a váže se na specifické místo antigenu – epitop. Jeden antigen pak mívá epitopů několik a je terčem imunoglobulinů pocházejících z více plazmocytů. Pokud protilátky pocházejí z více buněčných linií, mluvíme o polyklonálních protilátkách, naopak jedna linie je zdrojem protilátek monoklonálních. Konstantní část je společná všem imunoglobulinům dané třídy.
Kompletní protilátky a fragmenty. Léčebně využíváme imunoglobuliny buď kompletní – tvořené všemi čtyřmi řetězci, či aplikujeme jen jejich fragmenty (Fab), např. monomery či dimery variabilní části řetězce. Kompletní protilátky setrvávají v cirkulaci déle a lépe zajišťují likvidaci antigenu. Fragmenty pak mají lepší dostupnost při podkožním podání, rychleji jsou degradovány a mají menší výrobní náklady. V situacích, kdy potřebujeme rychlý a krátkodobý účinek – např. u protilátek proti digoxinu či u antidota dabigatranu (idarucizumabu) –, mohou být fragmenty výhodnější. Výhodnou modifikací jsou bispecifické fragmenty mAb, kdy jsou vázány dvě variabilní oblasti – jeden se specificitou např. k CD3 antigenu cytotoxické T‑buňky a druhý k antigenu na povrchu buňky určené k eliminaci. Cíleně tak mohou být ničeny např. tumorózní buňky.
![Obr. 2 Typy monoklonálních protilátek. Vývoj monoklonálních protilátek zaznamenal čtyři fáze (čtyři generace). Prvé byly plně myší, bohužel monoklonální protilátky druhé a třetí generace obsahují jen menší část myší variabilní oblasti, naopak konstantní, imunologicky významnější je oblast lidská. Současné biotechnologické postupy umožňují produkovat plně lidské protilátky, které mají nejnižší alergizující potenciál, jejich další výhodou je dlouhodobá účinnost; podle [5] – Foltz, 2013.](https://www.remedia.cz/photo-a-30411---.jpg) Vývoj monoklonálních protilátek proběhl ve čtyřech generacích: od plně myších (eventuálně jiného nehumánního druhu) přes kombinované myší a lidské – tzv. chimérické protilátky s asi 30% podílem myšího Ig – či humanizované s pouze 5–10% podílem nehumánního antigenu až po plně lidské imunoglobuliny (obr. 2). Jednotlivé generace se významně liší zejména antigenicitou, která vzestupně klesá, či délkou účinku, která se prodlužuje. Trendem je užívání humánních monoklonálních protilátek.
Vývoj monoklonálních protilátek proběhl ve čtyřech generacích: od plně myších (eventuálně jiného nehumánního druhu) přes kombinované myší a lidské – tzv. chimérické protilátky s asi 30% podílem myšího Ig – či humanizované s pouze 5–10% podílem nehumánního antigenu až po plně lidské imunoglobuliny (obr. 2). Jednotlivé generace se významně liší zejména antigenicitou, která vzestupně klesá, či délkou účinku, která se prodlužuje. Trendem je užívání humánních monoklonálních protilátek.
Názvosloví je odvozeno od jednotlivých generací mAb: přípona je vždy stejná ‑mab, další specifikace předchozím morfémem určuje, o jaký typ se jedná. Konkrétně ‑u‑ je rezervováno pro humánní monoklonální protilátku (např. alirocumab), ‑zu‑ pro humanizovanou (např. idarucizumab), ‑xi‑ pro chimérickou (např. abciximab) a ‑o‑ pro myší, ‑a‑ pro krysí, ‑e‑ pro morčecí či ‑i‑ pro primátí imunoglobulin.
Farmakologické vlastnosti monoklonálních protilátek
Vzhledem k tomu, že – na rozdíl od „klasických“ léčiv s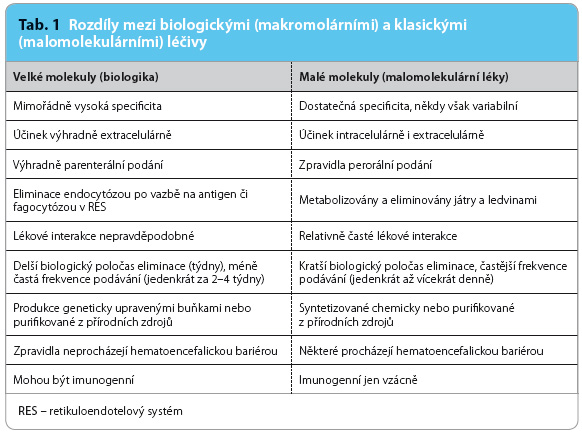 malými molekulami – jsou mAb tvořeny makromolekulou bílkoviny, farmakokinetické vlastnosti se u obou skupin významně liší (tab. 1).
malými molekulami – jsou mAb tvořeny makromolekulou bílkoviny, farmakokinetické vlastnosti se u obou skupin významně liší (tab. 1).
Aplikace je nutná zpravidla parenterálně. Nitrožilní podání má výhodu plné biologické dostupnosti a možností aplikace velkého množství léčiva. Naopak je zatíženo vyšším rizikem generalizované alergické reakce a je méně schůdné pro domácí léčbu. Podkožní podání je omezeno nižší biologickou dostupností pohybující se mezi 25 % až 95 %, lépe jsou absorbovány fragmenty protilátek, naopak neocenitelnou výhodou je schůdnost domácí autoaplikace a výhodou je i větší bezpečnost.
Eliminace monoklonálních protilátek je dvojího typu. Prvým je eliminace zprostředkovaná cílovou strukturou (antigenem), kdy po vazbě protilátky a antigenu dochází k eliminaci komplexu např. fagocytózou následovanou lysosomální degradací. Druhý typ, který není závislý na přítomnosti antigenu, využívá postupnou eliminaci buňkami RES (retikuloendotelového systému). Na delším setrvání humánních Ig v cirkulaci se podílí vazba na Fc receptor na povrchu buněk, která je chrání před rychlou eliminací.
Toxicita monoklonálních protilátek jako takových je nevelká, alergické reakce na humánní či humanizované protilátky se při srovnání s placebem vyskytují zřídka. V malém procentu se objevují lokální reakce typu pruritu, exantému apod. Daleko významnější jsou nežádoucí účinky vyplývající z farmakodynamického účinku, např. inhibice daného regulačního působku. Příkladem jsou protilátky proti TNFα či proti interleukinům, kdy je tangována obranyschopnost organismu. Vzhledem k tomu, že do farmakokinetiky mAb nejsou zapojeny transportní či metabolické systémy, je riziko lékových interakcí nízké.
Dostupné monoklonální protilátky v kardiologii
Ač prvá monoklonální protilátka užitá v klinické praxi – muromonab‑CD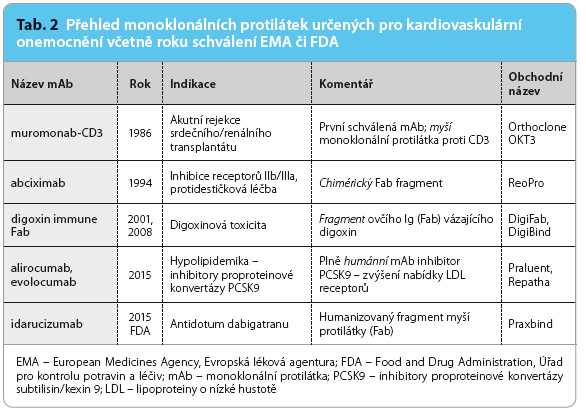 3 – byla indikována k léčbě akutní rejekce transplantátu srdce a ledvin – kardiologie byla v této oblasti dlouho „popelkou“. Léčba digoxinové intoxikace fragmenty ovčího imunoglobulinu (digoxin immune Fab) byla indikována vzácně. Blokáda trombocytárních vazebných receptorů IIb/IIIa chimérickými protilátkami v abciximabu zůstává prakticky omezena na komplikované koronární intervence (tab. 2).
3 – byla indikována k léčbě akutní rejekce transplantátu srdce a ledvin – kardiologie byla v této oblasti dlouho „popelkou“. Léčba digoxinové intoxikace fragmenty ovčího imunoglobulinu (digoxin immune Fab) byla indikována vzácně. Blokáda trombocytárních vazebných receptorů IIb/IIIa chimérickými protilátkami v abciximabu zůstává prakticky omezena na komplikované koronární intervence (tab. 2).
V roce 2015 se však situace mění – přichází skupina nových hypolipidemik, inhibitorů proproteinové konvertázy subtilisin/kexin 9 (inhibitorů PCSK9), která má potenciál pro široké uplatnění v prevenci aterotrombotických příhod. Druhé léčivo – antidotum dabigatranu idarucizumab – bude mít indikaci opět velmi omezenou.
Vzhledem k tomu, že dvě nové skupiny přicházejí v posledních měsících, respektive idarucizumab na schválení v EU ještě čeká, je vhodné se stručně zmínit o jejich vlastnostech.
Alirocumab a evolocumab – inhibitory proproteinové konvertázy subtilisin/kexin 9
Inhibitory PCSK9, respektive plným jménem inhibitory proproteinové konvertázy subtilisin/kexin 9, jsou velmi zajímavými hypolipidemiky. Zatímco statiny inhibovaly syntézu cholesterolu, ezetimib snižoval jeho absorpci a žlučové kyseliny vedly ke zvýšení katabolismu cholesterolu přesunem na žlučové kyseliny, inhibitory PCSK9 zvyšují hepatální vychytávání cholesterolu z lipoproteinů o nízké hustotě (low‑density lipoprotein, LDL) zvýšením nabídky LDL receptorů. Díky rozdílnému mechanismu jednotlivých strategií máme velký prostor pro vzájemné zesílení účinku při jejich kombinaci.
Receptor pro LDL se váže s apolipoproteinem B (apoB) a tak zprostředkuje endocytózu lipoproteinu LDL do buněk tkání, zejména do jater (obr. 3). Ve specializované organele – endosomu – dojde k oddělení lipoproteinu z vazby na receptor. Vlastní LDL receptor je opět využit a po provedení konformačních změn je umístěn zpět na buněčnou membránu, cyklus se opakuje 100krát až 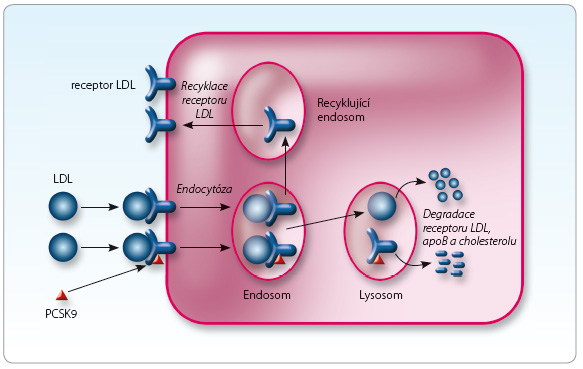 200krát. Lipidy a apoB z lipoproteinu LDL jsou degradovány a dále využity v buněčném metabolismu. Recyklace či degradace LDL receptoru je kontrolována regulačním proteinem PCSK9. Ten je produkován zejména játry v závislosti na koncentraci LDL cholesterolu. V regulaci se uplatňuje více faktorů, např. některé molekuly akutní fáze či glykemie. Jeho vazba na vlastní LDL receptor aktivuje degradaci receptoru proteolýzou, která probíhá na úrovni lysosomu. Katalytická aktivita PCSK9 (jako proteázy) se uplatní pouze v intramolekulární autokatalýze vlastní molekuly – proenzymu – na aktivní PCSK9, proto je enzym označován jako proproteinová konvertáza. Po uvolnění z hepatocytu a po aktivaci autokatalýzou se PCSK9 váže na okolní LDL receptory. Takto označené receptory již nerecirkulují, ale jsou degradovány. Tímto způsobem je regulována nabídka cholesterolu (vázaného v LDL). Pokles koncentrace cholesterolu, indukovaný například snížením jeho syntézy statinem, vede k uvolnění PCSK9, ke zvýšené degradaci LDL receptoru a ke sníženému hepatálnímu vychytávání LDL z cirkulace. Inhibice funkce PCSK9 monoklonálními protilátkami nebo snížením syntézy PCSK9 tak vede ke zvýšení nabídky LDL receptoru na buněčných membránách, ke zvýšení clearance lipoproteinu LDL a k poklesu koncentrace LDL cholesterolu.
200krát. Lipidy a apoB z lipoproteinu LDL jsou degradovány a dále využity v buněčném metabolismu. Recyklace či degradace LDL receptoru je kontrolována regulačním proteinem PCSK9. Ten je produkován zejména játry v závislosti na koncentraci LDL cholesterolu. V regulaci se uplatňuje více faktorů, např. některé molekuly akutní fáze či glykemie. Jeho vazba na vlastní LDL receptor aktivuje degradaci receptoru proteolýzou, která probíhá na úrovni lysosomu. Katalytická aktivita PCSK9 (jako proteázy) se uplatní pouze v intramolekulární autokatalýze vlastní molekuly – proenzymu – na aktivní PCSK9, proto je enzym označován jako proproteinová konvertáza. Po uvolnění z hepatocytu a po aktivaci autokatalýzou se PCSK9 váže na okolní LDL receptory. Takto označené receptory již nerecirkulují, ale jsou degradovány. Tímto způsobem je regulována nabídka cholesterolu (vázaného v LDL). Pokles koncentrace cholesterolu, indukovaný například snížením jeho syntézy statinem, vede k uvolnění PCSK9, ke zvýšené degradaci LDL receptoru a ke sníženému hepatálnímu vychytávání LDL z cirkulace. Inhibice funkce PCSK9 monoklonálními protilátkami nebo snížením syntézy PCSK9 tak vede ke zvýšení nabídky LDL receptoru na buněčných membránách, ke zvýšení clearance lipoproteinu LDL a k poklesu koncentrace LDL cholesterolu.
Dvě nová léčiva na podkladě monoklonálních protilátek proti konvertáze PCSK9 – alirocumab a evolocumab – byla již na základě příznivých výsledků 2. a 3. fáze klinického hodnocení schválena ke klinickému užívání. Jak přípona definuje, v obou případech se jedná o plně humánní kompletní protilátky. Je tak zajištěna vysoká specificita, nízká antigenicita a díky vazbě na Fc receptor též dlouhé přetrvávání imunoglobulinu v plazmě. Prespecifikované či post hoc analýzy studií, programu OSLER pro evolocumab a ODYSSEY pro alirocumab, shodně doložily aditivní, asi 60% snížení koncentrace LDL cholesterolu po přidání ke statinu spolu s asi 50% snížením výskytu aterotrombotických příhod v prvém roce léčby [1,2]. Léčba byla aplikována podkožní injekcí jedenkrát až dvakrát za čtyři týdny. Tolerance obou léčiv byla dobrá. V současné době probíhají rozsáhlé studie 3. fáze klinického hodnocení, jejich úlohou je prověřit účinnost a bezpečnost léčby při dlouhodobé aplikaci.
Idarucizumab – antidotum přímého perorálního inhibitoru trombinu dabigatranu
Druhým nově zaváděným léčivem na bázi monoklonální protilátky je antidotum dabigatranu – idarucizumab. Na rozdíl od předchozí skupiny se jedná o humanizovaný fragment myší protilátky (Fab). Tato forma protilátky je výhodná, není účelná prolongace účinku. Vzhledem k nutnosti rychlého nástupu účinku je idarucizumab aplikován nitrožilně. Idarucizumab v krvi velmi účinně váže dabigatran, jak volný, tak vázaný na trombin. Afinita dabigatranu k idarucizumabu je asi 350krát vyšší, než je jeho afinita k trombinu. Tím je zajištěn rychlý a dlouhodobý účinek bez rebound fenoménu.
Společnou nevýhodou přímých perorálních non‑vitamin K antikoagulancií (xabanů a gatranů) byla absence antidota. Zatímco u heparinu a jeho fragmentů bylo možno – při potřebě zrušit účinek – podat protamin a u warfarinu protrombinový komplex, nově užívaná antikoagulancia neměla dostupné antidotum. U dabigatranu je antidotum (idarucizumab) již připraveno. Klinické užití bylo recentně schváleno americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA), schválení regulační Evropskou lékovou agenturou (European Medicines Agency, EMA) se očekává v nejbližší době. Účinnost a bezpečnost byla dokumentována ve studii RE‑VERSE AD, která sledovala účinek idarucizumabu u 90 nemocných, u nichž bylo nutno ukončit působení dabigatranu především pro hemoragickou komplikaci [3]. U 98 % nemocných se závažným krvácením bylo doloženo velmi rychlé (řádově během minut) odeznění antikoagulačního účinku při sledování dilutovaného trombinového času. Postupně ustalo též krvácení. U nemocných, kteří byli léčeni pro potřebu chirurgické intervence, došlo k rychlé normalizaci hemostázy ve více než 90 % případů. Během sledování nebyl pozorován rebound fenomén, neobjevila se recidiva krvácení. Snášenlivost léčby byla výborná.
Shrneme‑li, pak biologická léčba na bázi monoklonálních protilátek se prosazuje též v kardiologii. Zatím však nehraje tak významnou úlohu jako v onkologii, revmatologii či v osteologii, nicméně v oblasti prevence aterotrombotických příhod u nemocných s dyslipidemií nedostatečně reagující na dostupná hypolipidemika se rýsuje významné uplatnění. Dalšími oblastmi, kde je možno očekávat přínos, je inhibice trombocytární hemostázy. Protilátky proti destičkovým receptorům, které zprostředkovávají adhezi ke kolagenu, přicházejí do fáze klinického hodnocení. Podobně se dá očekávat rozvoj nových diagnostických metod s využitím monoklonálních protilátek.
Seznam použité literatury
- [1] Robinson JG, Farnier M, Krempf M and ODYSSEY LONG TERM Investigators. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med 2015; 372: 1489–1499.
- [2] Sabatine MS, Giugliano RP, Wiviott SD and OSLER Investigators. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. N Engl J Med 2015; 372: 1500–1509.
- [3] Pollack CV Jr, Reilly PA, Eikelboom J, et al. Idarucizumab for Dabigatran Reversal. N Engl J Med 2015; 373: 511–520.
- [4] Lauren M, Sompayrac LM. How the Immune System Works, 4th Edition, New York: Wiley Blackwell, 2012.
- [5] Foltz IN, Karow M, Wasserman SM. Evolution and emergence of therapeutic monoclonal antibodies: what cardiologists need to know. Circulation 2013; 127: 2222–2230.