Nové léčebné cíle u roztroušené sklerózy
Za poslední desetiletí byly učiněny zásadní objevy, které přispěly k porozumění mechanismům, jež spouštějí a udržují patoimunologické děje při roztroušené skleróze (RS). Stále však existují nedořešené otázky. Známe periferní mechanismy a máme přípravky, které mírní zánětlivé změny prostřednictvím ovlivnění periferního imunitního systému. Současným trendem je, kromě jiného, prodloužení intervalu mezi léčebnými pulzy bez nutnosti podávat léky kontinuálně. Hovoří se také o indukční terapii vysoce účinnými přípravky u pacientů s vysokou aktivitou choroby a o případné včasné deeskalaci léčby na bezpečnější přípravky, a to dříve, než se objeví závažné nežádoucí účinky.
Průlom do léčby vysoce aktivní RS přinesly monoklonální protilátky (MoA), jejichž kvalita, a tím i účinnost a snášenlivost se zvyšují. Původní myší MoA ( momab) byly vysoce imunogenní – navozovaly produkci neutralizačních protilátek a bylo u nich vysoké riziko reakcí spojených s infuzí. Trend směřuje k plné humanizaci: po chimérických MoA ( ximab) se dostávají na trh humanizované ( zumab) až po plně humánní ( mumab). Už u chimérických MoA je imunogenicita značně redukována a tento trend pokračuje až k plně humánním. První MoA používaná u RS je natalizumab, který brání přestupu aktivovaných lymfocytů a protilátek proti neuronální tkáni přes hematoencefalickou bariéru. Další skupinou přípravků, jež se v terapii RS uplatňují, jsou původem hematoonkologické léky a opět se zvažuje u vysoce aktivní a refrakterní RS transplantace kmenových buněk.
Léčebné cíle
Pokrokem v terapii RS je i stanovení terapeutických cílů. V roce 2009 uveřejnila profesorka Eva Kubala Havrdová v The Lancet Neurology návrh kritéria „free of disease activity“, což znamená nepřítomnost relapsů, nepřítomnost progrese disability, žádné nové T2 a gadolinium enhancující léze. Později označil profesor Giovannoni tento koncept jako NEDA (no evidence of disease activity).
Současně stále uznávaný koncept NEDA 3 zahrnuje kritéria (Giovannoni, et al., 2015):
- bez průkazu klinické aktivity – bez relapsů,
- bez progrese disability (více než 1 bod na škále Expanded Disability Status Scale [EDSS] za 3–6 měsíců),
- bez průkazu aktivity na MR, žádné T2 ani gadolinium enhancující léze.
Profesor Kappos přišel v roce
2016 s konceptem NEDA 4
(obr. 1),
do něhož přiřadil další hledisko – úbytek mozkové
tkáně nižší než 0,4 % za rok, a naopak vyřadil
kritérium gadolinium enhancující léze (podle některých
doporučení by se gadolinium jako kontrastní látka mělo u RS
užívat s velkou opatrností kvůli možné akumulaci
v organismu).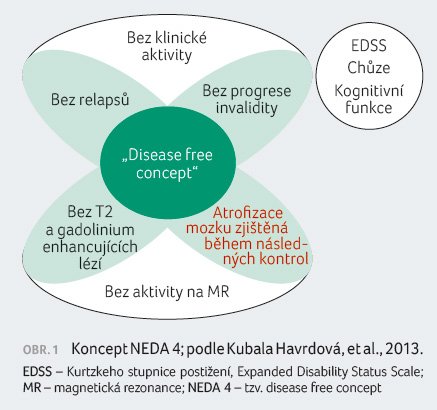 Otázkou k vyřešení zůstává přesnost
měření atrofizace, standardizace hodnocení a protokoly
provedení pro rutinní klinickou praxi.
Otázkou k vyřešení zůstává přesnost
měření atrofizace, standardizace hodnocení a protokoly
provedení pro rutinní klinickou praxi.
Kromě NEDA 3 a 4 se již do praxe pozvolna dostává kritérium „no evidence of progression or active disease“, NEPAD (s nástupem okrelizumabu).
Kritérium NEPAD zahrnuje:
- absenci klinické progrese,
- absenci zhoršení nálezu prokázanou zobrazovacími metodami,
- absenci progrese invalidizace podle T25FW (rychlost chůze na vzdálenost 25 stop),
- absenci zhoršení testu jemné motoriky.
Přehled přípravků dosahujících kritéria NEDA 3 po dvou letech při stávající léčbě ve studiích přináší tabulka 1. Vzhledem k různému uspořádání studií však nelze považovat procenta pacientů, kteří dosáhli NEDA 3, za validní údaj pro porovnání účinnosti jednotlivých přípravků.
Nové algoritmy léčby
S novými účinnými přípravky
se zvažují i další algoritmy podávání k docílení
NEDA nebo NEPAD. Zatí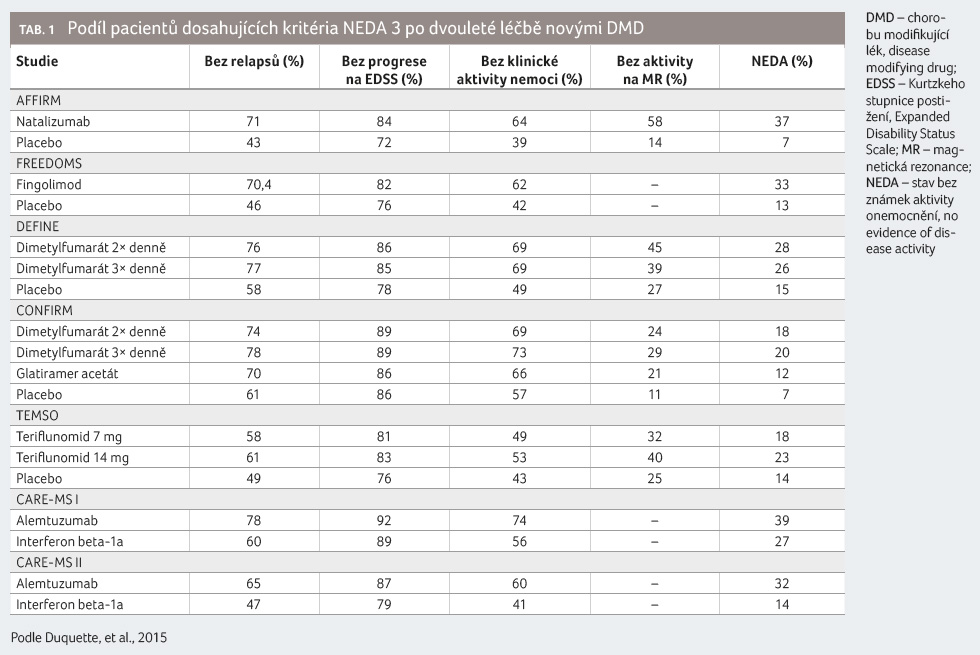 m nejde o rutinní postup, ale nové
doporučené postupy (z roku 2017, publikované 2018) zdůrazňují
včasnou a adekvátně agresivní terapii, přičemž při
klinických i paraklinických známkách vysoce aktivní RS lze
hned v úvodu terapie volit vysoce účinné léky.
Na mezinárodních setkáních neurologů byly zmiňovány tři
terapeutické postupy. Vždy je však nutné vyloučit rizika
(především přítomnost JCV [John Cunningham viru] v prevenci
progresivní multifokální leukoencefalopatie [PML], autoimunity,
maligní onemocnění a latentní infekci) a následně
i nemocného sledovat – viz dále.
m nejde o rutinní postup, ale nové
doporučené postupy (z roku 2017, publikované 2018) zdůrazňují
včasnou a adekvátně agresivní terapii, přičemž při
klinických i paraklinických známkách vysoce aktivní RS lze
hned v úvodu terapie volit vysoce účinné léky.
Na mezinárodních setkáních neurologů byly zmiňovány tři
terapeutické postupy. Vždy je však nutné vyloučit rizika
(především přítomnost JCV [John Cunningham viru] v prevenci
progresivní multifokální leukoencefalopatie [PML], autoimunity,
maligní onemocnění a latentní infekci) a následně
i nemocného sledovat – viz dále.
Eskalační terapie. Pokud léčebná odpověď na glatiramer acetát nebo na interferony není dostatečná, lze eskalovat na fingolimod, natalizumab, alemtuzumab, dimetylfumarát, teriflunomid, případně na perorální kladribin a okrelizumab.
Indukční pulzní rekonstrukční terapie (IRT) buď selektivní (okrelizumab, perorální kladribin), nebo neselektivní (alemtuzumab). Při kvalifikovaném a podloženém předpokladu vysoce aktivního onemocnění není nutné čekat na progresi při terapii léky základní linie, ale lze volit indukci útlumu aktivity vysoce účinnými přípravky, které v imunitním systému navodí dlouhodobé změny. Zatím nejsou přípravky pro IRT k dispozici tak dlouhou dobu, aby bylo možné bezpečně posoudit míru nutnosti případné reindukce/deeskalace k udržení efektu.
Chronická imunosuprese spočívá v pravidelném dlouhodobém podávání léků s imunosupresivním účinkem a imunomodulační léčba je založena na dlouhodobém ovlivnění imunitního systému. Při nedostatečném efektu lze přistoupit k eskalaci.
Způsob podání IRT (podle SPC jednotlivých přípravků)
Důležitým kritériem je spokojenost pacienta s léčbou, která má velký vliv na adherenci. Při indukční terapii žije nemocný mezi pulzy normálním životem, což oceňují zejména mladí pacienti. Rovněž je nutné s nemocnými probrat, jaké případné riziko jsou ochotni přijmout.
Alemtuzumab
První léčebný cyklus: 12 mg/den podávaných po dobu pěti po sobě jdoucích dnů (celková dávka 60 mg); druhý léčebný cyklus: 12 mg/den podávaných po dobu tří po sobě jdoucích dnů (celková dávka 36 mg) za 12 měsíců po prvním léčebném cyklu. V případě potřeby je možné zvážit další dva léčebné cykly – třetí nebo čtvrtý léčebný cyklus: 12 mg/den podávaných po dobu tří po sobě jdoucích dnů (celková dávka 36 mg) za nejméně 12 měsíců po předchozím léčebném cyklu u pacientů s aktivní RS definovanou klinickými nebo zobrazovacími metodami.
Perorální kladribin
Doporučená kumulativní dávka kladribinu je 3,5 mg/kg tělesné hmotnosti v průběhu dvou let, která je rozdělena do terapeutických pulzů s odstupem 12 měsíců (jeden léčebný pulz obnáší dávku 1,75 mg/kg za rok). Každý léčebný pulz zahrnuje dva týdny léčby, jeden na začátku prvního měsíce a jeden na začátku druhého měsíce příslušného léčebného roku. Každý léčebný týden zahrnuje čtyři nebo pět dnů, během nichž pacient dostane 10 mg nebo 20 mg (jednu nebo dvě tablety kladribinu) v jedné denní dávce v závislosti na tělesné hmotnosti.
Okrelizumab
Úvodní dávka 600 mg se podává jako dvě samostatné intravenózní infuze: první s dávkou 300 mg okrelizumabu následovaná po dvou týdnech druhou infuzí se 300 mg okrelizumabu. Následné dávky se poté podávají v podobě jednorázové intravenózní infuze s 600 mg okrelizumabu jednou za šest měsíců. První následná dávka 600 mg má být podána za šest měsíců po první infuzi s úvodní dávkou. Mezi každou dávkou okrelizumabu musí být zachován minimální interval pěti měsíců.
Monitoring nemocných
K vyloučení a k minimalizaci rizik je nutné pacienty i v dobrém klinickém stavu sledovat. Vyšetření MR jedenkrát za rok je zlatým standardem, u nových léků se sledují i další parametry (zpravidla hematologické), případně protilátky proti JCV a další ukazatele (uvedené v SPC konkrétního produktu).
Alemtuzumab
Bezpečnostní sledování pacientů se provádí od zahájení prvního léčebného cyklu až do uplynutí 48 měsíců po poslední infuzi druhého léčebného cyklu. Je li podáván další léčebný cyklus, třetí nebo čtvrtý, pokračuje následné sledování až do uplynutí 48 měsíců po poslední infuzi.
Perorální kladribin
Po dokončení dvou léčebných pulzů není nutná další léčba během třetího a čtvrtého roku. Opakované zahájení léčby po čtvrtém roce nebylo hodnoceno. Kritéria pro zahájení a pokračování léčby: počet lymfocytů musí být normální před zahájením léčby v prvním roce a minimálně 800 buněk/mm3 před zahájením léčby v roce druhém. Je li to nutné, může se léčebný pulz v druhém roce odložit až o šest měsíců, než se počet lymfocytů upraví. Jestliže je čas nutný k úpravě delší než šest měsíců, nemá se léčba kladribinem u pacienta opakovat.
Okrelizumab
U tohoto léčivého přípravku zatím nejsou k dispozici bezpečnostní data z reálné praxe, v dosavadních klinických studiích nebyly pozorovány nežádoucí účinky s výjimkou infuzních reakcí.
Rizika vysoce účinných léků
„Daní“ za efekt vysoce účinných moderních léčivých přípravků je vyšší riziko vážných infekcí, z nichž nejzávažnější jsou PML, herpetické meningoencefalitidy, kryptokokové meningitidy, listerióza, tuberkulóza, klebsielová sepse a další. Za nejzávažnější nežádoucí účinek je považována PML, která je vyvolána JCV. Pro snížení rizika výskytu PML jsou vypracována kritéria, jež umožní stratifikovat riziko PML.
U perorálního kladribinu a okrelizumabu zatím nemáme bezpečnostní data z reálné praxe a není možné se k riziku vážných nežádoucích účinků vyjádřit.
Univerzální přístup ke všem pacientům podle scénáře „therapy fits all“ je již překonán. V době, kdy máme možnost volby mezi mnoha chorobu modifikujícími léky, musíme vybírat takovou léčbu, která bude optimální pro konkrétního pacienta, pro aktivitu jeho choroby, jeho životní styl. Čekáme na výsledky „studií reálné praxe“, které nám přinesou další data o účinnosti a bezpečnosti nově vstupujících léčivých přípravků. Bezpečnostní riziko u mladých nemocných nelze přehlížet.
Redakčně zpracovala MUDr. Marta Šimůnková