Nové možnosti terapie chronického onemocnění ledvin – zaměřeno na inhibitory SGLT2
Souhrn:
Vachek J, Ciferská H, Tesař V, Oulehle K. Nové možnosti terapie chronického onemocnění ledvin – zaměřeno na inhibitory SGLT2. Remedia 2021; 31: 486–491.
Chronické onemocnění ledvin (chronic kidney disease, CKD) je chorobný stav se závažnými medicínskými a sociálními důsledky. Pokud není včas diagnostikováno a léčeno, je spojeno s enormní zátěží pro zdravotní systémy. Zároveň jde o nezávislý rizikový faktor úmrtnosti na kardiovaskulární choroby a ze všech příčin. Diabetické onemocnění ledvin se vyvíjí u 30–50 % diabetických pacientů a je hlavní příčinou konečného stadia onemocnění ledvin v západním světě. Základními postupy při léčbě onemocnění ledvin jsou striktní kontrola krevního tlaku a blokáda systému renin‑angiotenzin, nicméně ne u všech pacientů se daří dosáhnout cílových hodnot a u mnoha nemocných dochází k progresi CKD. Během posledních let máme k dispozici důkazy z robustních studií, které naznačují, že inhibitory sodíko‑glukózového kotransportéru 2 (SGLT2) vykazují silné nefroprotektivní vlastnosti. V klinických studiích u pacientů s diabetes mellitus 2. typu bylo prokázáno, že tato léčiva snižují albuminurii a proteinurii o 30–50 % a incidenci složených renálních cílových ukazatelů o 40–50 %. Inhibitory SGLT2 interferují s hlavním mechanismem proteinurické progrese CKD, tj. s glomerulární hypertenzí a hyperfiltrací. Tento přehled shrnuje současné důkazy z recentních studií o nefroprotektivních efektech inhibitorů SGLT2 a diskutuje o jejich postavení v každodenní klinické praxi. Současně je diskutována problematika recentně rozpoznané entity – non‑albuminurické varianty diabetického onemocnění ledvin (NADKD).
Summary:
Vachek J, Ciferska H, Tesar V, Oulehle K. New treatment options for chronic kidney disease – focused on SGLT2 inhibitors. Remedia 2021; 31: 486–491.
Chronic kidney disease (CKD) is a medical condition with serious medical and social consequences. If not diagnosed and treated early, it is associated with a significant burden on health systems. It is also an independent risk factor for cardiovascular and all‑cause mortality. Diabetic kidney disease develops in 30–50% of diabetic patients and is the leading cause of end‑stage renal disease in the western world. Strict blood pressure control and renin‑angiotensin system blockade are the mainstays of treatment for kidney disease, but not all patients achieve target values, and many patients progress to CKD. Over the past few years, we have evidence from robust studies suggesting that sodium‑glucose cotransporter‑2 (SGLT‑2) inhibitors have potent nephroprotective properties. In clinical trials in patients with type 2 diabetes mellitus, these agents have been shown to reduce albuminuria and proteinuria by 30–50% and the incidence of composite renal outcomes by 40–50%. SGLT‑2 inhibitors interfere with the major mechanism of proteinuric progression in CKD, i.e., glomerular hypertension and hyperfiltration. This review summarizes current evidence from recent studies on the nephroprotective effects of SGLT‑2 inhibitors and discusses their place in everyday clinical practice. Currently is discussed issue of a new recognized entity – non‑albuminuric diabetic kidney disease (NADKD).
Key words: chronic kidney disease, diabetic kidney disease, sodium‑glucose cotransporter‑2 inhibitors, SGLT‑2, non‑albuminuric diabetic kidney disease, NADKD
Chronické onemocnění ledvin
Chronické onemocnění
ledvin (chronic kidney disease, CKD) je v současnosti
definováno jako abnormalita ledvinné
struktury nebo funkce přítomná po více než tři měsíce
a mající vliv na zdraví (tab. 1). Kromě snížení
glomerulární filtrace (GF) pod 60 ml/min tedy naplní definici
CKD i přetrvávání patologického nálezu v moči či
patologie odhalená zobrazovacím vyšetřením. Rozdělení
do stadií podle GF má být doplněno o údaj o tíži
albuminurie, která představuje nejvýznamnější faktor
kardiovaskulárního rizika a také progrese CKD (tab. 2) [1].
Z údajů v tabulce 3 (tzv. heat map) lze odhadnout riziko další progrese onemocnění, které narůstá s poklesem GF a nárůstem hodnot albuminurie [2]. Incidence CKD se v Evropě odhaduje na 13,5/100 000 obyvatel/rok, přičemž se zvyšuje s věkem. Zvýšená albuminurie nad 30 mg/l je zjištěna přibližně u 11,5 % nemocných [1].
Mezi hlavní příčiny CKD patří
diabetické onemocnění ledvin
(diabetic kidney disease, DKD), arteriální hypertenze
(společně přes 50 % případů), glomerulopatie
(primární nebo sekundární), cystická onemocnění ledvin,
tubulointersticiální onemocnění,
obstrukce nebo dysfunkce močových cest [3,4].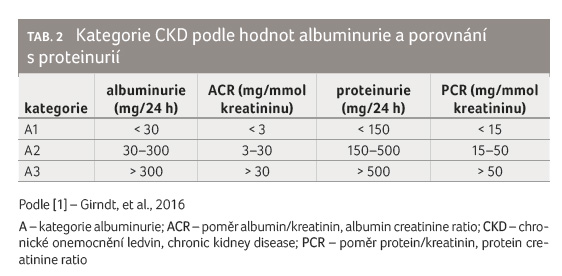
Za jeden z rozhodujících
mechanismů progrese CKD je považována
renální hyperfiltrace (vycházející z Brennerovy teorie),
která je spojena s různými klinickými stavy, včetně
prediabetu a diabetu, prehypertenze
a hypertenze a metabolického
syndromu, a rovněž s faktory
životního stylu, jako jsou obezita, kouření, nedostatek fyzické
aktivity, nižší kardiopulmonální zdatnost a zvýšená
zátěž kyselinami v potravě, zejména
v důsledku stravy západního typu (tj. zvýšený příjem
bílkovin ze živočišných zdrojů) [5,6].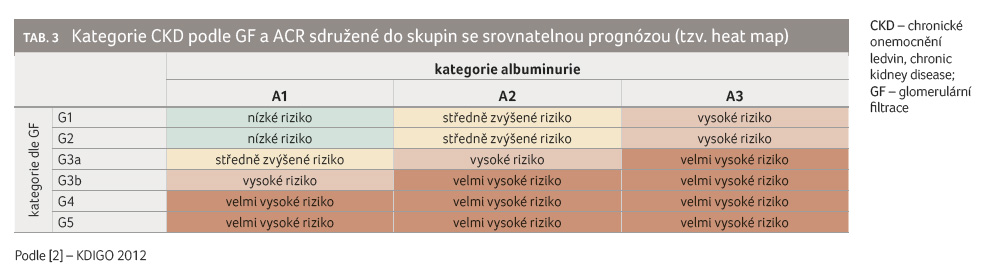
Role inhibitorů SGLT2
V posledních letech došlo v souvislosti s objevem inhibitorů sodíko glukózového kotransportéru 2 (sodium glucose cotransporter 2, SGLT2) k pokroku v poznání patofyziologie progresivního CKD a byla rozpoznána ústřední role hyperfiltrace v patogenezi některých nefropatií (zejména DKD a v souvislosti s obezitou). Obezitou podmíněná glomerulopatie a další adaptační nefropatie jsou tedy někdy nověji označovány jako hyperfiltrační nefropatie [7,8]. Nedávné klinické studie prokázaly, že inhibitory SGLT2 zmírňují glomerulární hypertenzi a mají renoprotektivní účinek [9].
Glomerulární hyperfiltrace je spojena s glomerulární a tubulární hypertrofií. Hyperfiltrace je způsobena především zvýšením glomerulárního kapilárního tlaku, který zesiluje napětí působící na struktury kapilární stěny. Zvýšený průtok ultrafiltrátu do Bowmanova prostoru navíc zvyšuje tlak na patní výběžky a povrch těla podocytů. To vede ke ztluštění glomerulární bazální membrány (GBM) a k hypertrofii podocytů. Protože schopnost podocytů růst je omezená, vzniká nesoulad mezi plochou GBM a plochou GBM pokrytou nožními výběžky, což vede k poškození podocytů, odloučení životaschopných podocytů, adhezi kapilár k parietálnímu epitelu, vzniku synechií a k segmentální skleróze. Mechanická zátěž působí také na distálnější struktury, což vede k dilataci glomerulárních a tubulárních močových prostor, ke zvýšené proximální tubulární reabsorpci sodíku hypertrofovanými epiteliálními buňkami a k aktivaci mediátorů vedoucích k tubulointersticiálnímu zánětu, hypoxii a fibróze [10].
Významným krokem vpřed byly přelomové studie s inhibitory renin angiotenzinového systému (RAS), které prokázaly, že tato léčba snižuje výskyt složeného cílového ukazatele v podobě významného poklesu odhadované glomerulární filtrace (estimated glomerular filtration rate, eGFR), riziko selhání ledvin s nutností náhrady funkce ledvin nebo úmrtí u albuminurických pacientů s CKD s diabetem i bez něj. Od té doby však bylo dosaženo jen velmi malého pokroku a nedávné analýzy z elektronických lékařských záznamů prokázaly neuspokojivě nízkou míru předepisování těchto terapií u osob s indikací k jejich použití [11]. Objev, že inhibitory SGLT2 snižují riziko progrese DKD ve studiích s primárními kardiologickými cílovými ukazateli, byl proto obrovským krokem vpřed a znamenal první novou terapeutickou skupinu pro DKD za téměř 20 let. V těchto studiích došlo ke zmírnění progrese CKD, včetně rizika významného poklesu eGFR nebo náhrady funkce ledvin. Tyto studie však nebyly primárně zaměřeny na renální cílové ukazatele a pouze třetina účastníků měla na počátku studie známky CKD [9,12].
Klinické studie s inhibitory SGLT2
Z tohoto důvodu zveřejnění studie CREDENCE (Evaluation of the Effects of Canagliflozin on Renal and Cardiovascular Outcomes in Participants With Diabetic Nephropathy) s kanagliflozinem v dubnu 2019 znamenalo výrazný posun k širšímu užití inhibitorů SGLT2 v terapii DKD. Do studie CREDENCE byli zařazeni pacienti s DKD, kteří měli eGFR 30−90 ml/min/1,73 m2 a poměr albuminu/kreatininu v moči (urine albumin to creatinine ratio, UACR) ≥ 300 mg/g. Kanagliflozin snížil o 30 % riziko výskytu primárního složeného cílového ukazatele definovaného zdvojnásobením hodnoty kreatininu, nutností zahájení náhrady funkce ledvin nebo úmrtím v důsledku selhání ledvin či kardiovaskulárního onemocnění. Důležité je, že riziko rozvoje konečného stadia onemocnění ledvin kleslo ve větvi s aktivní léčbou o 32 % a snížilo se rovněž riziko výskytu závažných nežádoucích kardiovaskulárních příhod a hospitalizací pro srdeční selhání. Ve světle těchto výsledků zůstalo otázkou, zda inhibitory SGLT2 mohou mít podobný přínos i u osob bez diabetu [13,14].
Použití inhibitorů SGLT2 za podmínek normoglykemie je předmětem velkého zájmu již více než pět let a hypotéza, že by tato léčba mohla snížit riziko onemocnění ledvin u osob bez diabetu, se opírá o několik důkazů. Efekty inhibitorů SGLT2 na hemodynamické funkce ledvin a albuminurii jsou zjevně nezávislé na poklesu glykemie − např. podání inhibitorů dipeptidyl peptidázy 4 vede k podobnému snížení glykemie a hodnoty glykovaného hemoglobinu (HbA1c), ale významný nefroprotektivní vliv u nich nebyl prokázán [15]. S poklesem eGFR na stupeň CKD 3a antidiabetický účinek inhibitorů SGLT2 oslabuje v důsledku klesající glykosurie, avšak vliv na snížení krevního tlaku, UACR a eGFR přetrvává. V následných analýzách ze studií CREDENCE a EMPA REG OUTCOME je přínos pro ledviny nezávislý na výchozí hodnotě HbA1c a změnách hodnot HbA1c v průběhu studií [16].
DAPA CKD byla mezinárodní multicentrická, randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie zahrnující 4 304 pacientů s CKD a eGFR v rozmezí 75–25 ml/min/1,73 m2 a UACR 200−5 000 mg/g s diabetem 2. typu nebo bez něj. Pacienti byli randomizováni k užívání dapagliflozinu v dávce 10 mg jednou denně nebo placeba navíc ke stabilním maximálním tolerovaným dávkám inhibitorů RAS. Složený primární cílový ukazatel zahrnoval trvalý ≥ 50% pokles eGFR, konečné selhání renální funkce a úmrtí z renálních či kardiovaskulárních příčin. Sekundární hodnocené cílové ukazatele zahrnovaly: 1) složený parametr trvalého ≥ 50% poklesu eGFR, konečného selhání renální funkce nebo renálního úmrtí; 2) složený parametr úmrtí z kardiovaskulárních příčin nebo hospitalizace pro srdeční selhání; nebo 3) úmrtí ze všech příčin. Průměrný věk účastníků studie DAPA CKD činil 62 let a 33 % tvořily ženy. Přibližně 68 % účastníků mělo diagnózu diabetes mellitus 2. typu, eGFR činila průměrně 43 ml/min/1,73 m2, UACR ≈949 mg/g, systolický krevní tlak 137 mm Hg a základní medikace zahrnovala inhibitory angiotenzin konvertujícího enzymu (ACE) nebo blokátory AT1 receptorů (ARB) u 97 % pacientů. U účastníků bez diabetu byla nejčastější příčinou CKD glomerulonefritida nebo ischemická/hypertenzní nefropatie. V době ukončení studie se vyskytlo 408 primárních cílových příhod s mediánem sledování 2,4 roku [17].
Ve studii DAPA CKD snížil dapagliflozin výskyt primárního cílového ukazatele o 39 %, což vedlo k počtu potřebnému k léčbě (number needed to treat, NNT) 19. U primárního cílového ukazatele nebyla zjištěna žádná statistická interakce podle kompenzace diabetes mellitus 2. typu, což potvrzuje, že přínos dapagliflozinu je nezávislý na stavu glykemie. Kromě toho bylo riziko ≥ 50% poklesu eGFR a dosažení konečného selhání renální funkce sníženo o 47 %, resp. 36 %. Složený parametr rizika úmrtí z kardiovaskulárních příčin nebo hospitalizace pro srdeční selhání byl snížen o 29 % a celková mortalita poklesla o 31 %. Ve studii DAPA CKD nebyly zaznamenány žádné nové bezpečnostní signály − zejména rizika zlomenin, amputací spojená s diabetickou ketoacidózou nebo se závažnými renálními příhodami. Navíc v této heterogenní skupině pacientů s diabetem a bez diabetu nedošlo ke zvýšení rizika rozvoje hypoglykemie. Souhrnně lze říci, že v této kohortě zahrnující pacienty s diabetem i bez diabetu (a také s nižší průměrnou eGFR ve srovnání s kohortou CREDENCE a s podobnou výchozí úrovní UACR) bylo riziko kardiorenálních cílových ukazatelů při použití dapagliflozinu významně sníženo [13,17].
Studie DAPA CKD dokazuje, že přínos inhibitorů SGLT2 pro ledviny je nezávislý na snižování hodnot glukózy. Tato pozorování v kohortě pacientů s CKD doplňují výsledky studií zaměřených na srdeční selhání DAPA HF a EMPEROR Reduced, které rovněž zahrnovaly osoby s diabetem i bez něj a prokázaly účinnost a bezpečnost u pacientů se srdečním selháním se sníženou ejekční frakcí levé komory. Výsledky těchto primárně kardiologických studií dále dosvědčují, že pro kardioprotektivní a renoprotektivní efekt inhibitorů SGLT2 není nutná existence hyperglykemie [12–15,17]. Dosud je známo, že účinky na GF jsou podobné bez ohledu na stav diabetu, což naznačuje, že intraglomerulární efekt související s natriurézou vedoucí k poklesu glomerulární hypertenze nezávisí na eventuální hyperglykemii. Je nezbytný následný výzkum dalších potenciálních nefroprotektivních mechanismů k objasnění, zda by tato léčba mohla být prospěšná i u pacientů s jinými onemocněními, například u příjemců transplantované ledviny a v souvislosti s diabetem 1. typu.
V blízké době lze očekávat výsledky další studie s renálními cílovými ukazateli. EMPA KIDNEY je mezinárodní randomizovaná, dvojitě zaslepená, placebem kontrolovaná klinická studie, jejímž cílem je vyhodnotit účinek empagliflozinu na klinicky relevantní výsledky: progresi onemocnění ledvin a riziko kardiovaskulární mortality. Primární cílový ukazatel je definován jako doba do první příhody buď kardiovaskulárního úmrtí, nebo progrese onemocnění ledvin definovaná jako konečné stadium onemocnění ledvin (potřeba náhrady funkce ledvin), trvalý pokles eGFR na < 10 ml/min/1,73 m2, úmrtí z renálních příčin nebo trvalý pokles eGFR o ≥ 40 % od randomizace. Studie EMPA KIDNEY zahrnula přibližně 6 000 osob s diagnostikovaným CKD s diabetem i bez diabetu, stejně jako s proteinurií i bez ní, kteří jsou léčeni buď empagliflozinem, nebo placebem navíc k současnému standardu péče.
Závěr
Klasická optimální léčba CKD zahrnuje kontrolu krevního tlaku, léčbu albuminurie inhibitory ACE nebo ARB, eliminaci expozice nefrotoxinům a redukci obezity, úpravu dávkování léků a snížení kardiovaskulárního rizika. Diabetes a hypertenze se etiologicky podílejí na více než polovině případů CKD a obezita přispívá k progresi renální dysfunkce. Ukázalo se, že nové antihyperglykemické léky, jako jsou inhibitory SGLT2, zpomalují pokles GF a jsou spojeny s dalším prospěchem v oblasti redukce hmotnosti, kardiovaskulárních a dalších ledvinných cílových ukazatelů.
Výsledky průlomové studie DAPA CKD ukazují, že dapagliflozin má příznivý vliv na funkci ledvin u pacientů s CKD s diabetem nebo bez něj, kteří již užívají maximální tolerované dávky inhibitorů ACE/ARB. Byly rovněž zaznamenány příznivé účinky na jinou než kardiovaskulární i na celkovou mortalitu. Výsledky byly konzistentní u pacientů se známým kardiovaskulárním onemocněním nebo s kardiovaskulárním onemocněním na počátku léčby i bez něj.
Přestože byly inhibitory SGLT2 zavedeny jako léky pro léčbu diabetes mellitus 2. typu, výsledky studie DAPA CKD a podobných klinických hodnocení svědčí pro jasný přínos v léčbě CKD. Tyto léky pravděpodobně změní praxi a budou mít významnou roli v budoucích doporučeních pro léčbu CKD. Studie CREDENCE prokázala podobný přínos u pacientů s CKD a diabetes mellitus 2. typu – studie DAPA CKD rozšiřuje přínos i na pacienty bez diabetu a s nižší GF. Podobné výsledky byly zaznamenány i u pacientů se srdečním selháním se sníženou ejekční frakcí levé komory, u nichž došlo k poklesu závažnosti akutních příhod pomocí léčby těmito přípravky, a to nezávisle na stavu diabetu.
Současně byla nedávno vyvinuta nová generace nesteroidních antagonistů mineralokortikoidních receptorů, která je díky selektivní inhibici méně často spojena s hyperkalemií, jež často limitovala možnosti jejich nasazení u pokročilejší CKD. Kromě toho budou brzy také pro české pacienty dostupné léky ke zmírnění kalemie. Bez ohledu na příčinu je CKD charakterizována sníženou regenerační schopností ledvin, mikrovaskulárním poškozením, oxidačním stresem a zánětem, což vede k fibróze a progresivní a nevratné ztrátě nefronů. Proto je nutný komplexní přístup zaměřený na různé rizikové faktory progrese CKD.
Non albuminurické diabetické onemocnění ledvin (non albuminuric diabetic kidney disease, NADKD) je spojeno především s makrovaskulárními, nikoliv mikrovaskulárními komplikacemi. Nemoc se častěji vyskytuje u pacientů s normoalbuminurickým diabetes mellitus 2. typu ve vyšším věku, s předchozím užíváním inhibitorů RAS a s dobrou kontrolou glykemií.
Non albuminurická varianta diabetického onemocnění ledvin (NADKD)
Již v devadesátých letech 20. století byly publikovány první studie, které zpochybnily tezi o progresi albuminurie jako obligátním prediktoru ztráty renální funkce u diabetu [18]. Přesto bylo donedávna DKD pojímáno jako stav, kdy dochází k lineární progresi od normo přes mikro k makroalbuminurii, přičemž tento poslední krok předchází úbytku GF [19]. V současné době však přibývá důkazů, které naznačují, že mnoho pacientů s diabetem 1. nebo 2. typu může progredovat do stadia renální insuficience i bez progrese albuminurie, a to rovněž při nefroprotektivní léčbě [19,20]. Tento průběh diabetického onemocnění se nyní označuje jako non albuminurická varianta diabetického onemocnění ledvin (NADKD). Pozorován je nejčastěji u pacientů s manifestací diabetes mellitus 2. typu ve vyšším věku léčených inhibitory RAS a je spojen s makrovaskulárními komplikacemi diabetu [20–24].
Ačkoliv pro diagnózu DKD není obvykle nutné provádět biopsii ledvin, několik bioptických studií prokázalo, že změny funkce ledvin souvisejí se specifickými histopatologickými nálezy u diabetu. Širší pochopení klinického průběhu DKD je proto zásadní pro zlepšení stratifikace rizika a umožnění včasných intervencí, které zabrání nepříznivým následkům [20–24].
Tomu odpovídají zkušenosti Kliniky nefrologie 1. LF UK a VFN v Praze, kde se provádí zdaleka největší počet biopsií vlastních ledvin v České republice. V posledních letech nejsou stále častěji výjimkou pacienti bez albuminurie, u nichž je provedena renální biopsie z indikace nejasné chronické renální insuficience (v situaci, kdy přichází v úvahu ještě jiná nefropatie než diabetické etiologie), a při morfologickém hodnocení je zjištěn obraz DKD.
Starší práce uváděly podobný pokles eGFR u NADKD a u fyziologických involučních změn v běžné populaci (přibližně 1 ml/min/rok), podle recentní práce je míra poklesu renálních funkcí stále vyšší než očekávaný pokles renálních funkcí související s věkem [25]. Studie dále ukazuje, že u účastníků, u nichž došlo k progresi do terminálního stadia onemocnění ledvin (eGFR < 15 ml/min/1,73 m2), se tak stalo téměř u každého pátého nemocného, aniž by došlo k přechodu do makroalbuminurie [25].
Uvedená studie významně přispěla k pochopení významu poklesu renálních funkcí u normoalbuminurické DKD, mechanistických studií je však stále málo. Je známo, že rezistence intrarenálních tepen, odhadovaná pomocí indexu rezistence renálního parenchymu, je zvýšena u většiny osob s diabetem 2. typu a se zhoršenou funkcí ledvin v podobném rozsahu bez ohledu na tíži albuminurie. Je tedy možné, že zvýšená intrarenální cévní rezistence přispívá k poklesu GF u všech osob s DKD a že se k ní následně přidávají jiné vlivy zapříčiňující další urychlení poklesu eGFR při zvýšené albuminurii [25–27].
Některé bioptické studie zahrnující osoby s diabetem 2. typu a s eGFR < 60 ml/min/1,73 m2 ukázaly, že osoby s normo nebo mikroalbuminurií mají méně typických morfologických znaků klasicky popisovaných u DKD spojených s proteinurií. Naopak klasické glomerulární strukturální změny, které jsou typické pro proteinurickou DKD, se zdají být běžným nálezem u osob s normoalbuminurií a diabetem 1. typu. Patologické příčiny a strukturální podstata poklesu renálních funkcí u nealbuminurické DKD tedy stále nejsou objasněny [20–24,26–27].
Výsledky studie Vistisena a kol. podporují představu, že patologický pokles GF není u normoalbuminurických osob neobvyklý, přičemž u některých dokonce progreduje do konečného stadia onemocnění ledvin [25]. Úprava rizikových faktorů jako dyslipidemie a hypertenze u pacientů s klesající GF v rámci normoalbuminurie může pomoci zpomalit pokles GF. Jako účinný přístup ke zpomalení progrese úbytku renálních funkcí u osob s diabetem, které jdou buď albuminurickou, nebo nealbuminurickou cestou k renální insuficienci, se ukazuje také používání inhibitorů SGLT2 [17,29].
Seznam použité literatury
- [1] Girndt M, Trocchi P, Scheidt‑Nave C, et al. The prevalence of renal failure − Results from the German Health Interview and Examination Survey for Adults, 2008–2011 (DEGS1). Dtsch Arztebl Int 2016; 113: 85–91.
- [2] Kidney Disease: Improving Global Outcomes (KDI‑GO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int 2013(Suppl 3): 1–150.
- [3] Dienemann T, Fujii N, Orlandi PK, et al. International Network of Chronic Kidney Disease cohort studies (iNET‑CKD): a global network of chronic kidney disease cohorts. BMC Nephrol 2016; 17: 121.
- [4] GBD 2017 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990−2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet 2018; 392: 1789−1858.
- [5] Brenner BM, Lawler EV, Mackenzie HS. The hyperfiltration theory: A paradigm shift in nephrology. Kidney Int 1996; 49: 1774–1777.
- [6] Cachat F, Combescure C, Cauderay M, et al. A systematic review of glomerular hyperfiltration assessment and definition in the medical literature. Clin J Am Soc Nephrol 2015; 10: 382–389.
- [7] Praga M. Synergy of low nephron number and obesity: a new focus on hyperfiltration nephropathy. Nephrol Dial Transplant 2005; 20: 2594–2597.
- [8] D’Agati VD, Chagnac A, de Vries AP, et al. Obesity‑related glomerulopathy: clinical and pathologic characteristics and pathogenesis. Nat Rev Nephrol 2016; 12: 453–471.
- [9] Provenzano M, Pelle MC, Zaffina I, et al. Sodium‑Glucose co‑transporter‑2 inhibitors and nephroprotection in diabetic patients: more than a challenge. Front Med (Lausanne) 2021; 8: 654557.
- [10] Pichler R, Afkarian M, Dieter BP, Tuttle KR. Immunity and inflammation in diabetic kidney disease: translating mechanisms to biomarkers and treatment targets. Am J Physiol Renal Physiol 2017; 312: F716−F731.
- [11] Griffin TP, OʼShea PM, Smyth A, et al. Burden of chronic kidney disease and rapid decline in renal function among adults attending a hospital‑based diabetes center in Northern Europe. BMJ Open Diab Res Care 2021; 9: e002125.
- [12] Toyama T, Neuen BL, Jun M, et al. Effect of SGLT2 inhibitors on cardiovascular, renal and safety outcomes in patients with type 2 diabetes mellitus and chronic kidney disease: A systematic review and meta‑analysis. Diabetes Obes Metab 2019; 21: 1237−1250.
- [13] Perkovic V, Jardine MJ, Neal B, et al., on behalf of the CREDENCE Trial Investigators. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med 2019; 380: 2295−2306.
- [14] Ingelfinger JR, Rosen CJ. Clinical Credence − SGLT2 Inhibitors, Diabetes, and Chronic Kidney Disease. N Engl J Med 2019; 380: 2371−2373.
- [15] Rosenstock J, Perkovic V, Johansen OE, et al. Effect of Linagliptin vs Placebo on Major Cardiovascular Events in Adults With Type 2 Diabetes and High Cardiovascular and Renal Risk: The CARMELINA Randomized Clinical Trial. JAMA 2019; 321: 69−79.
- [16] Fernandez‑Fernandez B, Sarafidis P, Kanbay M, et al. SGLT2 inhibitors for non‑diabetic kidney disease: drugs to treat CKD that also improve glycaemia. Clin Kidney J 2020; 13: 728–733.
- [17] Heerspink HJL, Stefánsson BV, Correa‑Rotter R, et al; DAPA‑CKD Trial Committees and Investigators. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med 2020; 383: 14361446.
- [18] Tsalamandris C, Allen TJ, Gilbert RE, et al. Progressive decline in renal function in diabetic patients with and without albuminuria. Diabetes 1994; 43: 649–655.
- [19] Macisaac RJ, Jerums G. Diabetic kidney disease with and without albuminuria. Curr Opin Nephrol Hypertens 2011; 20: 246–257.
- [20] Porrini E, Ruggenenti P, Mogensen CE, et al.; ERA‑EDTA diabesity working group. Non‑proteinuric pathways in loss of renal function in patients with type 2 diabetes. Lancet Diabetes Endocrinol 2015; 3: 382–391.
- [21] Yoshida Y, Kashiwabara K, Hirakawa Y, et al. Conditions, pathogenesis, and progression of diabetic kidney disease and early decliner in Japan. BMJ Open Diabetes Res Care 2002; 8: e000902.
- [22] Warren B, Rebholz CM, Sang Y, et al. Diabetes and trajectories of estimated glomerular filtration rate: a prospective cohort analysis of the atherosclerosis risk in communities study. Diabetes Care 2018; 41: 1646–1653.
- [23] Baba M, Shimbo T, Horio M, et al. Longitudinal study of the decline in renal function in healthy subjects. PLoS One 2015; 10: e0129036.
- [24] Yamanouchi M, Furuichi K, Hoshino J, et al. Nonproteinuric versus proteinuric phenotypes in diabetic kidney disease: a propensity score‑matched analysis of a nationwide, biopsy‑based cohort study. Diabetes Care 2019; 42: 891–902.
- [25] Vistisen D, Andersen GS, Hulman A, et al. Progressive decline in estimated glomerular filtration rate in patients with diabetes after moderate loss in kidney function – even without albuminuria. Diabetes Care 2019; 42: 1886–1894.
- [26] Dai Q, Chen N, Zeng L, et al. Clinical features of and risk factors for normoalbuminuric diabetic kidney disease in hospitalized patients with type 2 diabetes mellitus: a retrospective cross‑sectional study. BMC Endocr Disord 2021; 21: 104.
- [27] Maksoud AAA, Sharara SM, Nanda A, Khouzam RN. The renal resistive index as a new complementary tool to predict microvascular diabetic complications in children and adolescents: A groundbreaking finding. Ann Transl Med 2019; 7: 422.
- [28] Ohta Y, Fujii K, Arima H, et al. Increased renal resistive index in atherosclerosis and diabetic nephropathy assessed by Doppler sonography. J Hypertens 2005; 23: 1905‑1911.
- [29] Dumann E, Menne J. SGLT2‑Inhibitoren: Was gibt es Neues?. Nephrologe 2021; 16: 241–255.