Novinky v léčbě metastatického nemalobuněčného karcinomu plic
Souhrn:
Koubková L. Novinky v léčbě metastatického nemalobuněčného karcinomu plic. Remedia 2022; 32: 220–224.
U pacientů s metastatickým nemalobuněčným karcinomem plic (metastatic non‑small cell lung cancer, mNSCLC) došlo během posledního desetiletí k rozhodujícímu pokroku v léčbě. Přibývá možností terapie při prokázaných genetických aberacích, které nám predikují účinnost cílené léčby, a také zařazení imunoterapie do léčebné strategie mNSCLC buď v první, nebo ve druhé linii léčby vedlo u části pacientů k bezprecedentnímu prodloužení přežití.
Summary:
Koubkova L. News in the treatment of metastatic non‑small cell lung cancer. Remedia 2022; 32: 220–224.
Over the last decade, the treatment of patients with metastatic non‑small cell lung cancer (mNSCLC) has significantly progressed. The number of treatment options for proven genetic aberrations, which predict the effectiveness of targeted treatment, has increased. Both this and the inclusion of immunotherapy in the treatment strategy for mNSCLC in either the first or second line of treatment have led to an unprecedented prolongation of survival in some of these patients.
Key words: metastatic non‑small cell lung cancer, targeted therapy, lorlatinib, immunotherapy, pembrolizumab, cemiplimab, atezolizumab, nivolumab, ipilimumab
Cílená léčba
Nemalobuněčný karcinom plic (non small cell lung cancer, NSCLC) je geneticky velmi nehomogenní skupinou nádorů a pacienti se stejným morfologickým typem karcinomu mohou mít různé odpovědi na stejný protinádorový lék. S neustálým pokrokem v technologii biologické detekce se rozšiřují možnosti molekulární typizace lidského genomu, což umožňuje precizní a personalizovanou léčbu především neskvamózního NSCLC na základě zjištěných genetických změn. Tyto změny jsou prediktory účinnosti cílené léčby, která působí na nádorovou buňku na subcelulární úrovni s cílem ovlivnit signální dráhy u nádorů s těmito genetickými změnami. Ovlivněny jsou tak základní regulační funkce buněk – proliferace, diferenciace, migrace, angiogeneze či apoptóza.
Rozšiřující se možnosti cílené léčby NSCLC dokládají například doporučení americké společnosti National Comprehensive Cancer Network (NCCN) [1]. Ne všechny zde uvedené přípravky jsou však v současné době schváleny Evropskou lékovou agenturou (European Medicines Agency, EMA). Je proto nezbytné klást stále důraz na genetické testování nádorů. Především sekvenování nové generace (next generation sequencing, NGS) nám umožňuje identifikovat celou řadu genetických změn. V případě, že nemáme k dispozici dostatek nádorové tkáně, můžeme využít i tzv. tekuté biopsie k vyšetření cirkulující nádorové DNA (ctDNA).
Při léčbě inhibitory tyrozinkináz (TKI), které se v terapii tohoto karcinomu používají, vidíme obvykle rychlou a dlouhodobou léčebnou odpověď, musíme však počítat se vznikem rezistence a selháním léčby. K jejímu objasnění je vhodná rebiopsie a molekulární reanalýza, která v určitých případech umožní nasazení další cílené léčby.
Příkladem jednoho z těchto
léčebných přípravků je lorlatinib, vysoce účinný ALK
(anaplastická lymfomová kináza) TKI třetí generace, který
proniká do mozku, s celkovou a intrakraniální
aktivitou u pokročilého ALK+ NSCLC. V preklinických
studiích lorlatinib vykazoval značnou protinádorovou aktivitu
u myší s nádorovými xenografty exprimujícími protein
EML4 fúzovaný s ALK variantou 1, včetně ALK mutací L1196M,
G1269A, G1202R a I1171T. Dvě z těchto ALK mutací – G1202R
a I1171T – prokazatelně vedou k rezistenci
nádoru na alektinib, brigatinib, ceritinib a krizotinib
[2]. Na základě výsledků registrační studie B7461001
fáze I/II [3] byl lorlatinib nejdříve schválen k léčbě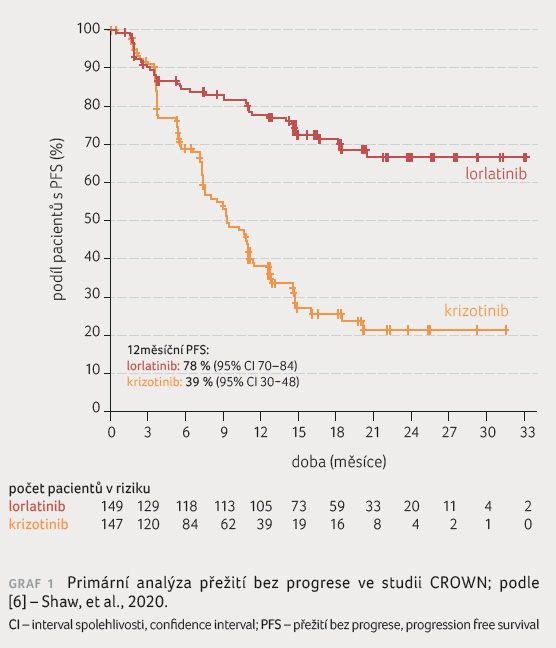 pacientů s ALK+ NSCLC, u nichž došlo k progresi
onemocnění po terapii alektinibem nebo ceritinibem jako první
léčbě ALK TKI nebo po terapii krizotinibem a nejméně
jedním dalším ALK TKI. Od 1. dubna 2022 je v této
indikaci schválena úhrada lorlatinibu z veřejného
zdravotního pojištění i v České republice. Následně
byl americkým Úřadem pro kontrolu potravin a léčiv (Food
and Drug Administration, FDA) a EMA schválen do první
linie léčby ALK+ NSCLC na základě výsledků studie
fáze III CROWN [4]. Na letošním výročním sjezdu
American Association for Cancer Research (AACR) v dubnu
byla publikována aktualizovaná data této studie [5]. Studie CROWN
porovnávala lorlatinib oproti krizotinibu v první linii léčby
ALK+ NSCLC. Celkem 296 pacientů (104 studijních míst; 23
zemí) bylo randomizováno v období od května 2017 do
února 2019. Primární cílový ukazatel přežití bez progrese
(progression free survival, PFS) byl splněn v první průběžné
analýze studie (medián sledování pro PFS činil 18,3 měsíce
u pacientů užívajících lorlatinib a 14,8 měsíce
u pacientů užívajících krizotinib). Mediánu PFS nebylo
dosaženo v rameni s lorlatinibem a činil 9,3 měsíce
(95% interval spolehlivosti [CI] 7,6–11,1 měsíce) pro rameno
s krizotinibem (poměr rizik [HR] 0,28; 95% CI 0,19–0,41;
p <
pacientů s ALK+ NSCLC, u nichž došlo k progresi
onemocnění po terapii alektinibem nebo ceritinibem jako první
léčbě ALK TKI nebo po terapii krizotinibem a nejméně
jedním dalším ALK TKI. Od 1. dubna 2022 je v této
indikaci schválena úhrada lorlatinibu z veřejného
zdravotního pojištění i v České republice. Následně
byl americkým Úřadem pro kontrolu potravin a léčiv (Food
and Drug Administration, FDA) a EMA schválen do první
linie léčby ALK+ NSCLC na základě výsledků studie
fáze III CROWN [4]. Na letošním výročním sjezdu
American Association for Cancer Research (AACR) v dubnu
byla publikována aktualizovaná data této studie [5]. Studie CROWN
porovnávala lorlatinib oproti krizotinibu v první linii léčby
ALK+ NSCLC. Celkem 296 pacientů (104 studijních míst; 23
zemí) bylo randomizováno v období od května 2017 do
února 2019. Primární cílový ukazatel přežití bez progrese
(progression free survival, PFS) byl splněn v první průběžné
analýze studie (medián sledování pro PFS činil 18,3 měsíce
u pacientů užívajících lorlatinib a 14,8 měsíce
u pacientů užívajících krizotinib). Mediánu PFS nebylo
dosaženo v rameni s lorlatinibem a činil 9,3 měsíce
(95% interval spolehlivosti [CI] 7,6–11,1 měsíce) pro rameno
s krizotinibem (poměr rizik [HR] 0,28; 95% CI 0,19–0,41;
p <
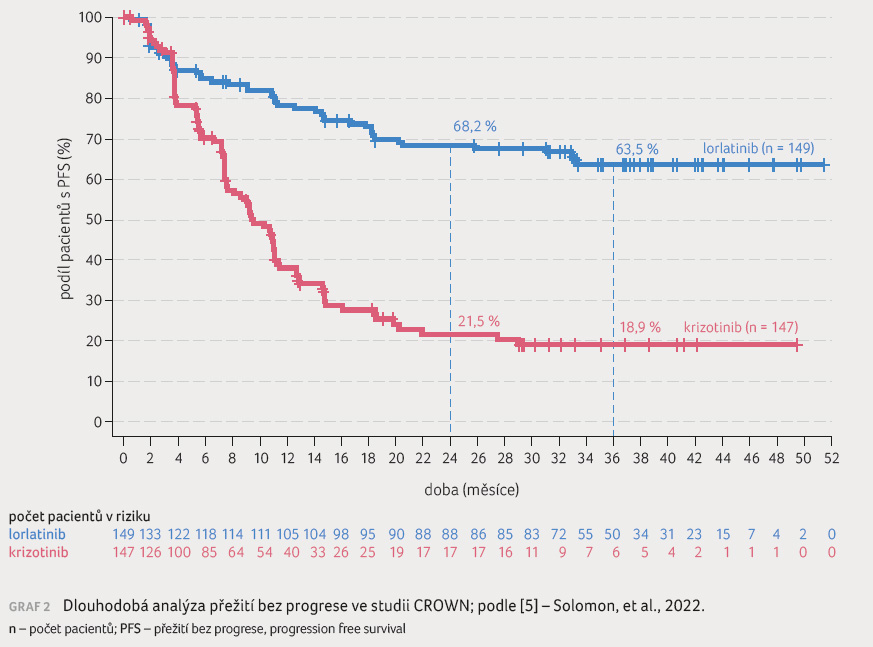
0,001), graf 1 [6]. Potvrzená objektivní odpověď byla vyšší u lorlatinibu (76 %) ve srovnání s krizotinibem (58 %). U pacientů s měřitelnými výchozími mozkovými metastázami byla frekvence potvrzené intrakraniální odpovědi vyšší u lorlatinibu (82 %) oproti krizotinibu (23 %). Neplánovaná analýza byla provedena při střední době sledování 36,7 měsíce u pacientů užívajících lorlatinib a 29,3 měsíce u pacientů užívajících krizotinib. Mediánu PFS hodnoceného nezávislou komisí nebylo dosaženo (95% CI NR–NR [not reached]) pro rameno s lorlatinibem a činil 9,3 měsíce (95% Cl 7,6–11,1) pro rameno s krizotinibem (HR 0,27; 95% CI 0,184–0,388), graf 2 [5].
Imunoterapie
Imunoterapie specifickými protilátkami proti receptoru programované buněčné smrti 1 (programmed cell death 1, PD 1) a jeho ligandu (PD L1) v první linii léčby metastatického NSCLC (mNSCLC) bez prokázaných genetických aberací, ať již v monoterapii, či v kombinaci s chemoterapií, je již standardem. Mezi četnými potenciálními biomarkery zkoumanými k identifikaci pacientů s maximálním přínosem imunoterapie přetrvává jako klinicky nejvýznamnější prediktivní biomarker pro účinnost anti PD (L)1 protilátek exprese PD L1 na nádorových buňkách (tumor proportion score, TPS). K dispozici máme výsledky řady studií, v nichž byla imunoterapie podávána v monoterapii či v různých kombinacích a které jsou průběžně aktualizovány. Na základě těchto výsledků byla řada přípravků schválena FDA a EMA [7].
Imunoterapie v monoterapii v první linii léčby
V monoterapii v první linii léčby u pacientů s mNSCLC bez genetických aberací (EGFR nebo ALK) s vysokou expresí PD L1 TPS ≥ 50 % prokázaly svoji účinnost pembrolizumab a atezolizumab. Jako další v této indikaci byl FDA i EMA schválen na základě výsledků studie EMPOWER Lung 1 [8] cemiplimab, další protilátka proti PD 1, a to nejen pro léčbu mNSCLC, ale také lokálně pokročilého NSCLC nevhodného pro chirurgickou resekci nebo definitivní chemoradiaci. Cemiplimab ve srovnání s chemoterapií u 563 pacientů s pokročilým NSCLC s PD L1 ≥ 50 % významně zlepšil PFS (medián 8,2 měsíce vs. 5,7 měsíce; HR 0,54; 95% CI 0,43–0,68) a celkové přežití (overall survival, OS – mediánu nedosaženo vs. 14,2 měsíce; HR 0,57; 95% CI 0,42–0,77).
Imunoterapie v kombinaci s chemoterapií v první linii léčby
U pacientů s expresí PD L1 1–49 % je standardem léčby kombinace imunoterapie a chemoterapie. Jako první prokázala svoji účinnost kombinace pembrolizumabu s chemoterapií dle histologického typu (neskvamózní – karboplatina/cisplatina + pemetrexed; skvamózní – karboplatina + paklitaxel/nab paklitaxel). U neskvamózní histologie byl pak dále doložen efekt kombinace atezolizumab + karboplatina + paklitaxel + bevacizumab nebo atezolizumab + karboplatina + nab paklitaxel. Nejnověji byla schválena kombinace imunoterapie (protilátek anti PD 1 a anti CTLA 4 – cytotoxický T lymfocytární antigen) a chemoterapie dle histologie na základě výsledků studie fáze III CheckMate 9LA [9].
Studie CheckMate 9LA náhodně
přiřadila 719 pacientů (bez ohledu na expresi PD L1)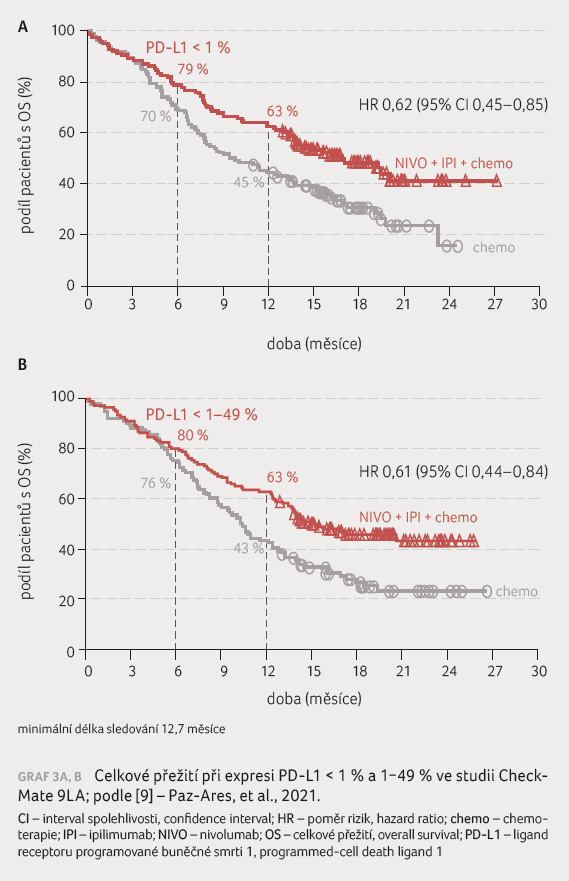 k nivolumabu + ipilimumabu + dvěma cyklům
chemoterapie nebo ke standardní léčbě čtyřmi cykly samotné
chemoterapie. Primární cílový ukazatel OS byl splněn (medián
15,8 měsíce vs. 11,0 měsíce; HR 0,72; 95% CI 0,61–0,86).
Klinický přínos byl konzistentní ve všech podskupinách,
nezávisle na expresi PD L1 a nezávisle na histologii
(graf 3A, B), což vedlo ke schválení tohoto režimu
FDA a EMA. Počáteční pokles doby přežití byl úspěšně
zmírněn kombinací s chemoterapií a dvouletého OS
dosáhlo 38 % oproti 26 % pacientů. Jedna z post hoc
analýz této studie porovnávala také OS pacientů, kteří museli
ukončit terapii předčasně z důvodu nežádoucích příhod
souvisejících s léčbou. Tato skupina nemocných měla
dokonce o něco lepší míru léčebné odpovědi (51 % vs.
38 % u celé populace) i medián přežití – 27,5
měsíce (graf 4). Po roce od ukončení léčby
trvala odpověď stále ještě u 56 % pacientů. Následná
analýza ze světového kongresu WCLC (World Conference of Lung
Cancer) 2021 rovněž ukazovala přežití podskupiny pacientů
s adekvátně zaléčenými a asymptomatickými mozkovými
metastázami [10]. Jednoleté (67 % vs. 26 %) i dvouleté
přežití (35 % vs. 12 %) bylo vyšší po kombinované
imunoterapii se dvěma cykly chemoterapie v porovnání se
samotnou chemoterapií. Medián OS těchto pacientů byl třikrát
delší (19,3 měsíce vs. 6,8 měsíce) s hodnotou HR
0,43. Od 1. prosince 2021 je také v České republice
schválena úhrada pro tuto kombinaci v první linii léčby
dospělých pacientů s mNSCLC s expresí PD L1 (TPS)
0–49 %. Léčba je hrazena po dobu maximálně 24 měsíců.
k nivolumabu + ipilimumabu + dvěma cyklům
chemoterapie nebo ke standardní léčbě čtyřmi cykly samotné
chemoterapie. Primární cílový ukazatel OS byl splněn (medián
15,8 měsíce vs. 11,0 měsíce; HR 0,72; 95% CI 0,61–0,86).
Klinický přínos byl konzistentní ve všech podskupinách,
nezávisle na expresi PD L1 a nezávisle na histologii
(graf 3A, B), což vedlo ke schválení tohoto režimu
FDA a EMA. Počáteční pokles doby přežití byl úspěšně
zmírněn kombinací s chemoterapií a dvouletého OS
dosáhlo 38 % oproti 26 % pacientů. Jedna z post hoc
analýz této studie porovnávala také OS pacientů, kteří museli
ukončit terapii předčasně z důvodu nežádoucích příhod
souvisejících s léčbou. Tato skupina nemocných měla
dokonce o něco lepší míru léčebné odpovědi (51 % vs.
38 % u celé populace) i medián přežití – 27,5
měsíce (graf 4). Po roce od ukončení léčby
trvala odpověď stále ještě u 56 % pacientů. Následná
analýza ze světového kongresu WCLC (World Conference of Lung
Cancer) 2021 rovněž ukazovala přežití podskupiny pacientů
s adekvátně zaléčenými a asymptomatickými mozkovými
metastázami [10]. Jednoleté (67 % vs. 26 %) i dvouleté
přežití (35 % vs. 12 %) bylo vyšší po kombinované
imunoterapii se dvěma cykly chemoterapie v porovnání se
samotnou chemoterapií. Medián OS těchto pacientů byl třikrát
delší (19,3 měsíce vs. 6,8 měsíce) s hodnotou HR
0,43. Od 1. prosince 2021 je také v České republice
schválena úhrada pro tuto kombinaci v první linii léčby
dospělých pacientů s mNSCLC s expresí PD L1 (TPS)
0–49 %. Léčba je hrazena po dobu maximálně 24 měsíců.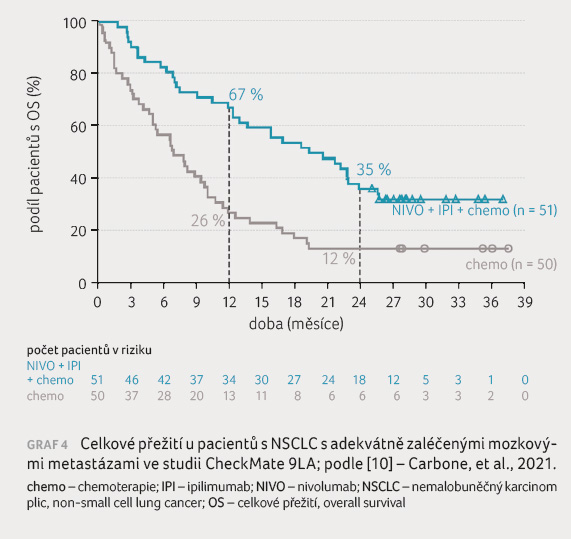
Závěr
Léčba metastatického NSCLC zaznamenala v posledních letech výrazný pokrok. Je důležité stále klást důraz na genetické testování nádorů, kdy především NGS nám umožňuje identifikovat řadu genetických změn, které jsou prediktory odpovědi na cílenou léčbu. Ani touto léčbou však naše pacienty vzhledem k získané rezistenci na cílenou terapii vyléčit neumíme, často je ale dosahováno léčebných odpovědí, které mohou trvat řadu měsíců či let, a můžeme tak mluvit o chronickém průběhu onemocnění. Rovněž u pacientů, kteří dosáhnou při imunoterapii léčebné odpovědi či stabilizace onemocnění, můžeme hovořit o chronickém průběhu, což je dobře patrné ze separace křivek celkového přežití, kterou jsme do této doby při žádné jiné léčbě pokročilého NSCLC neviděli. Vzhledem k rozšiřujícím se léčebným možnostem bronchogenního karcinomu je nezbytný individualizovaný výběr optimální léčby pro každého pacienta.
Podpořeno projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 00064203 FN Motol.
Seznam použité literatury
- [1] NCCN Clinical Practice Guidelines in Oncology, Version 3.2022 – Non‑Small Cell Lung Cancer. Dostupné na: https://www.nccn.org/guidelines/guidelines‑detail?category=1&id=1450
- [2] SPC Lorviqua. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/lorviqua‑epar‑product‑information_cs.pdf
- [3] Solomon J, Besse B, Bauer TM, et al. Lorlatinib in patients with ALK‑positive non‑small‑cell lung cancer: results from a global phase 2 study. Lancet Oncol 2018; 19: 1654–1667.
- [4] Solomon B, Bauer TM, De Marinis F, et al. Lorlatinib vs. Crizotinib in the First‑line Treatment of Patients with Advanced ALK‑Positive Non‑Small Cell Lung Cancer: Results of the Phase III CROWN Study. Ann Oncol 2020; 31(Suppl 4): S1180S1181.
- [5] Solomon B, et al. AACR Annual Meeting 2022 April 8–13, 2022; Abstr CT223.
- [6] Shaw AT, Bauer TM, De Marinis F, et al. First‑Line Lorlatinib or Crizotinib in Advanced ALK‑Positive Lung Cancer. N Engl J Med 2020; 383: 2018–2029.
- [7] Reck M, Remon J, Hellmann MD. First‑Line Immunotherapy for Non‑Small Cell Lung Cancer. J Clin Oncol 2022; 40: 586–597.
- [8] Sezer A, Kilickap S, Gümüş M, et al. LBA52 EMPOWER‑Lung 1: Phase III first‑line (1L) cemiplimab monotherapy vs platinum‑doublet chemotherapy (chemo) in advanced non‑small cell lung cancer (NSCLC) with programmed cell death‑ligand 1 (PD‑L1) ≥50%. Ann Oncol 2020; 31: S1182–S1183.
- [9] Paz‑Ares L, Ciuleanu T‑E, Cobo M, et al. First‑line nivolumab plus ipilimumab combined with two cycles of chemotherapy in patients with non‑small‑cell lung cancer (CheckMate 9LA): An international, randomised, open‑label, phase 3 trial. Lancet Oncol 2021; 22: 198–211.
- [10] Carbone D, Ciuleanu T, Cobo M, et al. First‑Line Nivolumab + Ipilimumab + Chemo in Patients With Advanced NSCLC and Brain Metastases: Results From CheckMate 9la. J Thorac Oncol 2021; 16(10 Suppl): S862.