Ocrelizumab ‒ léčba roztroušené sklerózy
Key words: ocrelizumab, relapsing remitting RS, primary progressive RS, B‑lymphocytes, CD20, biological treatment.
úvod
Roztroušená skleróza (RS) je chronické zánětlivé neurodegenerativní onemocnění centrálního nervového systému (CNS). Historicky je RS definována jako imunopatologické onemocnění s abnormální aktivitou T lymfocytů, především subsetů Th1 a Th17. Přítomnost oligoklonálních imunoglobulinů v likvoru ukazuje na intratekální syntézu protilátek. Převládá názor, že tato protilátková aktivita představovaná imunoglobuliny oligoklonálních pruhů (oligoclonal bands, OCB) je zaměřena především proti vlastním strukturám mozku. Specificita těchto protilátek tvořících OCB u nemocných s RS je zaměřena proti různým strukturám, které souvisejí s CNS a jsou chemicky především lipidového původu. Tyto nálezy jsou interpretovány jako úklidové reakce, které vazbou protilátek mají zajistit odstraňování poškozených struktur CNS [1,2].
Současná představa předpokládá, že B lymfocyty mají schopnost prezentovat antigen, produkovat cytokiny a autoprotilátky a vytvářet na meningách ektopické folikuly, které touto aktivitou jsou velmi pravděpodobně zodpovědné za kortikální demyelinizaci a neurodegeneraci [3].
Histopatologické nálezy u nemocných s progresivní formou RS prokázaly, že v některých strukturách mozku, ale zejména na meningách byly nalezeny agregáty lymfoidních buněk tvořených B lymfocyty v různém stupni diferenciace, folikulárními dendritickými buňkami a dalšími buněčnými typy [1]. Tyto struktury jsou za normálních okolností součástí struktur sekundárních lymfatických orgánů, v nichž probíhá B lymfocytární odpověď po antigenní stimulaci. Nálezy těchto tzv. terciárních lymfoidních struktur byly objeveny také u jiných imunopatologických zánětlivých onemocnění, jako je např. revmatoidní artritida a vaskulitida. Bylo prokázáno, že aktivity B lymfocytů z těchto struktur významně přispívají k imunopatologii. Proto léčba cílená na B lymfocytární systém je v těchto indikacích prokazatelně účinná [1]. Ukázalo se, že ocrelizumab, humanizovaná monoklonální protilátka anti CD20, vedla k významné klinické odpovědi také u nemocných s RS, kde se původně účast B lymfocytů nepředpokládala [4].
Vzniká tak představa, že T i B lymfocytární imunitní odpověď je indukována v sekundárních lymfatických orgánech mimo CNS, kde jsou pro ni vytvořeny podmínky. Aktivované, eventuálně klonálně zmnožené a funkčně polarizované T a B lymfocyty následně migrují složitě řízenými procesy do CNS [1]. Struktury mozku jsou však odděleny za fyziologických okolností hematoencefalickou bariérou, která zajišťuje přísně regulovaný pohyb buněk imunity, protilátek a cytokinů mezi organismem a CNS. Poskytuje nejen ochranu mozku před infekčními agens, ale také podporu při odstraňování poškozených struktur a jejich náhradu. Prostřednictvím cytokinů B lymfocyty abnormálně aktivují astrocyty a glie. Významnou roli v zapojení B lymfocytů do poškozujícího zánětu CNS mají rovněž chemokiny. Zajišťují selektivní migraci B lymfocytů přes hematoencefalickou bariéru do lymfatických folikulů, podílejí se na jejich vývoji a určují interakci s folikulárními dendritickými buňkami. Byly prokázány přímo v ektopických lymfoidních strukturách nalézaných v mozku u nemocných s RS i v jejich likvoru [5].
Membránová molekula CD20 je specificky vyjádřená pouze v B lymfoidní linii a je vytvářena relativně brzo v průběhu diferenciace B lymfocytů. Je rozpoznávána celou řadou protilátek anti CD20. Vazba anti CD20 na B lymfocyty vede k jejich depleci, kterou lze prokázat jak v periferní krvi, tak v kostní dřeni nebo v periferních lymfatických uzlinách. K depleci B lymfocytů, která může zahrnovat až 99 % B lymfocytů, dochází po 1‒2 měsících od zahájení terapie. Pokud dojde k přerušení terapie, nastává rekonstituce B lymfocytárního systému s odstupem asi 7‒10 měsíců. Monoklonální protilátky pronikají přes hematoencefalickou bariéru minimálně, největší koncentrace je v periferní krvi a jejich účinek přímo v CNS není jasný.
Charakteristika a mechanismus účinku
Ocrelizumab je plně humanizovaná monoklonální protilátka, která vazbou na cirkulující B lymfocyty vede k jejich depleci. Role B lymfocytů v patogenezi RS byla dlouho nedoceněna a nedostatečně objasněna. Až testování protilátek proti molekule CD20 potvrdilo jejich význam, zejména klinické hodnocení fáze II s ocrelizumabem u RR RS [6].
Ocrelizumab je rekombinantní humanizovaná monoklonální protilátka, která selektivně cílí na B lymfocyty exprimující CD20. Molekula CD20 je buněčný povrchový antigen, který se nachází na zralých a paměťových B lymfocytech, ale není exprimován na lymfoidních kmenových buňkách a plazmatických buňkách. Přesný mechanismus, jehož prostřednictvím ocrelizumab uplatňuje své terapeutické klinické účinky u RS, není zcela objasněn, ale předpokládá se, že zahrnuje imunomodulaci snížením počtu a funkce B lymfocytů exprimujících CD20. Po navázání na buněčný povrch ocrelizumab selektivně snižuje počet B lymfocytů exprimujících CD20 prostřednictvím buněčné fagocytózy závislé na protilátkách a prostřednictvím apoptózy a cytotoxicity závislé na komplementu. Schopnost rekonstituce B lymfocytů a již existující humorální imunita zůstávají zachovány. Navíc není ovlivněna ani vrozená imunita a celkový počet T lymfocytů.
Farmakokinetické vlastnosti a metabolismus
Farmakokinetika ocrelizumabu ve studiích u RS byla zkoumána na dvoukompartmentálních modelech s clearance závislou na čase a s farmakokinetickými parametry typickými pro IgG1 monoklonální protilátky. Celková expozice (plocha pod křivkou plazmatické koncentrace [AUC] v průběhu 24týdenního intervalu dávkování) byla identická u dávky 2× 300 mg ve studii u PP RS a u dávky 1× 600 mg ve studiích u RR RS za předpokladu, že byly podávány identické dávky. Plocha pod křivkou plazmatické koncentrace po čtvrté dávce 600 mg ocrelizumabu byla 3 510 µg/ml/den a průměrná maximální plazmatická koncentrace (cmax) byla 212 µg/ml u RR RS (infuze 600 mg) a 141 µg/ml u PP RS (infuze 300 mg). Přípravek ocrelizumab je podáván jako intravenózní infuze a nebyly provedeny žádné studie s jinými cestami podání. Na základě populační farmakokinetiky byl odhadovaný centrální distribuční objem 2,78 l. Periferní objem a interkompartmentová clearance byly odhadovány na 2,68 l a 0,294 l/den. Metabolismus ocrelizumabu nebyl přímo studován, protože protilátky jsou odstraňovány hlavně katabolismem (tj. rozkladem na peptidy a aminokyseliny). Konstantní clearance byla odhadnuta na 0,17 l/den a úvodní na čase závislá clearance na 0,0489 l/den klesala s biologickým poločasem 33 týdnů. Konečný eliminační poločas ocrelizumabu byl 26 dnů. Farmakokinetika u zvláštních populací, jako např. pediatrické, nebyla zkoumána. Nebyly provedeny žádné studie analyzující farmakokinetiku ocrelizumabu u dětí a dospívajících.
Léčba ocrelizumabem vede v rámci očekávaného farmakologického účinku k rychlé depleci CD19+ B lymfocytů v krvi po 14 dnech od zahájení (první časový bod hodnocení). To v průběhu léčebného období přetrvávalo. Při počítání B lymfocytů se používá CD19, protože přítomnost ocrelizumabu interferuje při kvantitativním rozboru s rozpoznáním CD20. Ve studiích fáze III vykazovalo až 5 % pacientů mezi každou dávkou ocrelizumabu v nejméně jednom časovém bodě doplnění počtu B lymfocytů. Rozsah a trvání deplece B lymfocytů byly konzistentní ve studiích u PP RS i u RR RS. Nejdelší doba sledování po poslední infuzi ocrelizumabu ukazuje, že medián doby do doplnění počtu B lymfocytů (návrat k výchozí hodnotě) byl 72 týdnů (rozmezí bylo 27‒175 týdnů). U 90 % všech pacientů došlo k doplnění počtu B lymfocytů k dolnímu limitu normy nebo k výchozí hodnotě za přibližně dva a půl roku po poslední infuzi.
Účinnost v klinických studiích
Klinické studie s ocrelizumabem poskytly nové důkazy v imunopatogenezi RS a současně důkazy o účinnosti, nežádoucích účincích a bezpečnosti léčby RR RS a nově PP RS. Jsou to zejména klinické studie fáze III u RR RS – OPERA I a OPERA II ‒ a klinická studie u PP RS ‒ ORATORIO [7,8]. Komparátorem klinických studií u RR RS byl interferon beta 1a (IFNβ 1a) v dávce 44 µg aplikovaný subkutánně 3× týdně. Pacienti byli randomizováni v poměru 1 : 1. Kritéria pro zařazení pacientů do studie OPERA byla standardní jako v klinických studiích s RR RS: věk 18‒55 let, diagnóza RS podle McDonaldových kritérií z roku 2010 [9], stupeň postižení podle Expanded Disability Status Scale (EDSS) 0‒5,5, klinicky dva relapsy za poslední dva roky nebo jeden v posledním roce a na magnetické rezonanci (MR) nález na mozku konzistentní s diagnózou RS. Ve studii ORATORIO vzhledem k tomu, že u PP RS zatím neexistuje standardní léčba, byl ocrelizumab testován proti placebu. Kritéria zařazení do této klinické studie představovala diagnóza RS podle McDonaldových kritérií z roku 2005 [10] – pacienti ve věku 18‒55 let s EDSS 3,0‒6,5, skóre pyramidové funkce minimálně 2 a trvání choroby do 15 let při vstupním EDSS 5,0 a více a do 10 let při vstupním EDSS do 5,0.
Klinická studie OPERA
Primárním cílovým ukazatelem studie byl roční počet relapsů
(annual relapse rate, ARR), sekundárními cílovými ukazateli bylo
hodnocení podílu pacientů s progresí disability,
s kumulativním počtem gadolinium enhancujících lézí, počet
nových nebo zvětšujících se lézí na MR mozku a procentní
změna mozkového objemu v definovaném intervalu. Dále byla
hodnocena změna na škále funkčního hodnocení MSFC
(Multiple Sclerosis Functional Composite) v týdnu 96, procentní
změna skóre fyzické komponenty dotazníku SF 36 mezi začátkem
studie a 96. týdnem, podíl pacientů s EDSS nejméně
2,0 na počátku, kteří dosáhli parametrů NEDA 3 (stavu beze
známek aktivity choroby – bez relapsů, bez progrese
disability hodnocené po 12 nebo 24 týdnech, bez nových nebo
zvětšujících se lézí na MR). Dalšími sekundárními
sledovanými parametry byly farmakokinetika, farmakodynamika,
imunogenicita ocrelizumabu a bezpečnost [7,11].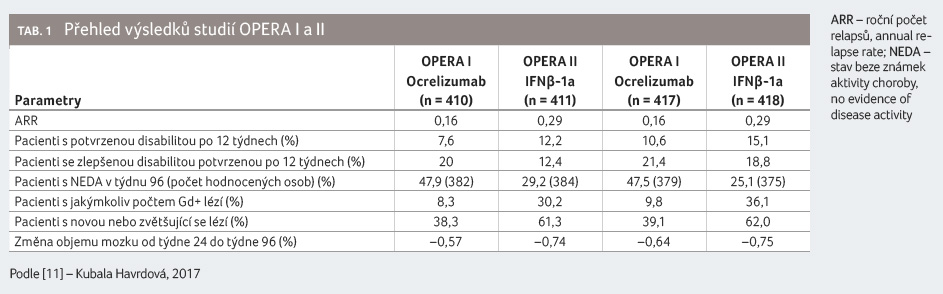
Studii OPERA I dokončilo celkem 366 ze 410 pacientů (89,3 %) léčených ocrelizumabem a 340 ze 411 pacientů (82,7 %) léčených IFNβ 1a v dávce 44 µg. Ve studii OPERA II dokončilo studii 360 ze 417 pacientů (86,3 %) léčených ocrelizumabem a 320 ze 418 (76,6 %) léčených IFNβ 1a. Ve sdružené analýze bylo hodnoceno celkem 827 pacientů léčených ocrelizumabem a 829 pacientů léčených IFNβ 1a (tab. 1).
Klinická studie ORATORIO
V klinické studii ORATORIO byli randomizováni v poměru 2 : 1 pacienti s PP RS k léčbě ocrelizumabem nebo placebem. Způsob podání a premedikace byly totožné jako ve studiích OPERA. Dvojitě zaslepená fáze studie byla plánována na minimálně 120 týdnů, tj. celkem nejméně 5× aplikace 600 mg ocrelizumabu, a 253 potvrzených progresí neurologického nálezu trvajících nejméně 12 týdnů. Proto prvním zařazeným pacientům bylo podáno víc než 5 aplikací ocrelizumabu.
Primárním cílovým ukazatelem studie bylo procento pacientů s progresí disability potvrzenou po 12 týdnech, a to nejméně o 1,0 stupně EDSS u nemocných se vstupním skóre 5,5 a méně a o 0,5 stupně EDSS u nemocných se vstupním skóre více než 5,5. Mezi další cílové ukazatele této studie patřilo procento pacientů s progresí disability potvrzenou po 24 týdnech, vývoj v testu 25FWT (rychlost chůze na vzdálenost 25 stop), změna objemu T2 lézí, změna objemu mozku, změna skóre fyzické komponenty dotazníku SF 36. Vše bylo hodnoceno na začátku studie a ve 120. týdnu, a to jen v případě, že statistická významnost byla vyšší než 0,05. V této klinické studii podobně jako ve studii OPERA byly hodnoceny bezpečnost, nežádoucí účinky, farmakodynamika, farmakokinetika a imunogenicita ocrelizumabu [8].
Do studie ORATORIO bylo zařazeno celkem 488 pacientů
do větve s ocrelizumabem a 244 do větve
s placebem. Klinickou studii ukončilo 120. týdnem 402
(82 %) pacientů léčených ocrelizumabem a 174 (71 %)
pacientů v placebové větvi. Medián trvání studie byl 2,8
roku. Riziko progrese disability bylo po 12 nebo 24 týdnech
ve skupině léčené ocrelizumabem sníženo o 24 %,
resp. o 29,6 % oproti skupině léčené placebem. V klinickém
testu chůze 25FWT bylo riziko zhoršení o 29,3 % nižší
u skupiny léčené ocrelizumabem proti skupině léčené
placebem. Počet nových nebo zvětšujících se lézí na MR
mozku byl nižší u skupiny léčené ocrelizumabem (0,31 vs.
3,88). Změna objemu mozku mezi týdnem 24 a 120 byla 17,5 %
ve prospěch ocrelizumabu (p = 0,02).
Nebyl však prokázán rozdíl mezi definovanými skupinami ve skóre
fyzické komponenty dotazníku SF 36 na začátku
a ve 120. týdnu klinické studie (tab. 2) [8].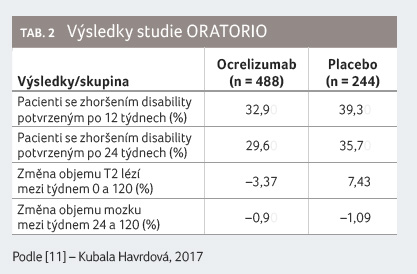
Bezpečnost a nežádoucí účinky
Ve studii OPERA I se u 80 % pacientů vyskytl nejméně jeden nežádoucí účinek a ve studii OPERA II to bylo u 85 % pacientů. Závažné infekce ve studiích OPERA I a II se objevily u 1,3 % nemocných léčených ocrelizumabem a u 2,9 % nemocných léčených IFNβ 1a 3× týdně subkutánně.
Reakce na infuzní aplikaci ocrelizumabu
Z celkem 825 pacientů ve studiích OPERA I a OPERA
II, kteří dostávali 600 mg ocrelizumabu intravenózně každých
24 týdnů, mělo méně než 40 % alespoň jednou infuzní reakci.
Příznaky infuzní reakce mohou nastat v průběhu jakékoliv
infuze, ale byly častěji hlášeny během infuze první. Infuzní
reakce mohou nastat v průběhu 24 hodin od podání. Tyto
reakce mohou probíhat jako pruritus, vyrážka, urtika, erytém,
iritace hrdla, bolest orofaryngu, dyspnoe, faryngeální nebo
laryngeální edém, zrudnutí, hypotenze, horečka, únava, bolest
hlavy, závrať, nauzea a tachykardie. Pouze jedna z těchto
reakcí byla provázena život ohrožujícím bronchospasmem, dva
pacienti byli z důvodu infuzní reakce ze studie vyřazeni.
Hypersenzitivita na léčivou látku nebo na kteroukoliv
pomocnou uvedenou látku by měla být kontraindikací k léčbě
ocrelizumabem s přihlédnutím ke skutečnosti, že se
jedná zpravidla o terapii celoživotní (tab. 3).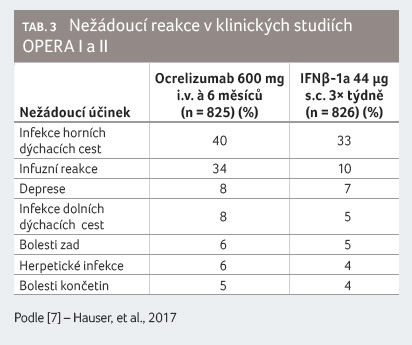
Infekce
Herpetické infekce byly zaznamenány častěji u pacientů léčených ocrelizumabem než IFNβ 1a. Vyskytly se herpes zoster (2,1 % vs. 1,0 %), herpes simplex (0,7 % vs. 0,1 %), labiální herpes (3,0 % vs. 2,2 %), genitální herpes (0,1 % vs. 0,0 %). Infekce byly lehkého nebo středně těžkého stupně, nebyl pozorován generalizovaný herpes.
Současná aktivní infekce je relativní kontraindikací léčby a předpokládá se, že po zvládnutí infekčního agens může být ocrelizumab aplikován. Před podáním se doporučuje zkontrolovat imunitní stav pacienta, protože těžce imunokompromitovaní jedinci (např. s lymfopenií, neutropenií, hypogamaglobulinemií) by neměli být tímto přípravkem léčeni [12].
Četnost výskytu infekcí 4. stupně (život ohrožující) a 5. stupně (fatální) byla ve všech léčebných skupinách nízká, ale výskyt život ohrožujících (1,6 % vs. 0,4 %) a fatálních (0,6 % vs. 0 %) infekcí u pacientů s PP RS užívajících ocrelizumab byl vyšší ve srovnání s placebem. Všechny život ohrožující infekce byly vyřešeny bez přerušení léčby ocrelizumabem. Pacienti s PP RS s obtížným polykáním mají vyšší riziko aspirační pneumonie.
Nevyskytly se žádné oportunní infekce, nebyl identifikován žádný případ progresivní multifokální leukoencefalopatie (PML). Nelze vyloučit riziko PML, riziko infekce vyvolané JCV (John Cunningham virus), která byla pozorována u pacientů léčených jinými anti CD20 protilátkami a přípravky užívanými k léčbě RS [13] a která souvisí s dalšími rizikovými faktory (např. populace pacientů léčených imunosupresivy). Pokud existuje podezření na PML, musí být ukončeno podávání ocrelizumabu. Je nutné vyšetření MR mozku s kontrastní látkou a porovnání s MR před zahájením léčby. Dále jsou nutná vyšetření mozkomíšního moku na přítomnost DNA JCV a opakovaná neurologická vyšetření. Pokud bude potvrzena PML, je nutné natrvalo ukončit léčbu ocrelizumabem.
Nebyl zaznamenán žádný případ reaktivace viru hepatitidy B (HBV) u pacientů léčených ocrelizumabem. Pouze v případě, že nemocní s terapií ocrelizumabem budou předem nebo následně léčeni další imunosupresivní látkou, se předpokládá zvýšení imunosupresivního účinku. U pacientů léčených jinými anti CD20 protilátkami byla hlášena reaktivace HBV, která měla v některých případech za následek fulminantní hepatitidu, jaterní selhání a úmrtí. Z tohoto důvodu musí být před zahájením léčby ocrelizumabem u všech pacientů proveden screening HBV. Nemocní s aktivní infekcí HBV (tj. aktivní infekcí potvrzenou pozitivním testem na přítomnost povrchového antigenu viru HBV [HBsAg] a testování anti HB) nesmějí být léčeni ocrelizumabem. Pacienti s pozitivní sérologií (tj. negativní HBsAg a pozitivní HB core protilátky [HBcAb+]), nosiči HBV (HBsAg+), musejí před zahájením léčby konzultovat odborníka na jaterní onemocnění a je třeba tyto nemocné sledovat a zacházet s nimi podle léčebných standardů tak, aby nedošlo k reaktivaci HBV.
Malignity
Ve studiích byl u pacientů léčených ocrelizumabem zjištěn zvýšený počet malignit (včetně karcinomu prsu) ve srovnání s kontrolními skupinami. Incidence se však neodchylovala od četnosti očekávané v populaci s RS. U nemocných se známými rizikovými faktory pro vznik malignit a u osob aktivně sledovaných pro rekurentní malignitu musí být zvážen individuální poměr přínosů a rizik. Pacienti se známou aktivní malignitou by neměli být léčeni ocrelizumabem. V kontrolovaném období klinických hodnocení byl výskyt nemelanomových karcinomů kůže nízký a mezi léčebnými skupinami neexistovala nerovnováha. Byl zjištěn zvýšený výskyt bazocelulárního karcinomu (bazaliomu) mezi 3. a 4. rokem léčby, v následujících letech však jeho vyšší četnost pozorována nebyla. Výskyt bazaliomu se neodchyloval od četnosti očekávané v populaci s RS [14].
V klinických studiích OPERA I a II a ORATORIO
se jednalo celkem o čtyři pacienty (0,5 %) s postižením
různých orgánů, v polovině případů šlo o karcinom
prsu (tab. 4).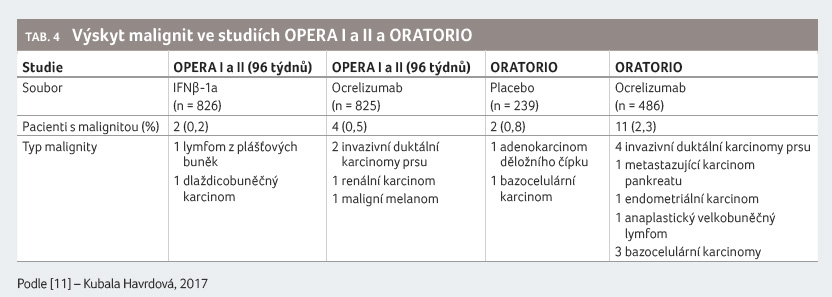
Celkem ve studiích OPERA I a II došlo ke třem úmrtím. Ve skupině s ocrelizumabem a ve skupině s IFNβ 1a bylo zaznamenáno suicidium, v posledním případě byl příčinou úmrtí mechanický ileus [7].
Nežádoucí účinky ve studii ORATORIO
Ve studii ORATORIO mělo alespoň jeden nežádoucí účinek
90‒95 % zařazených pacientů. Většinou se jednalo o infuzní
reakce, infekce horních cest dýchacích, močové infekce a bolesti
hlavy. Závažné infekce mělo 6,2 % léčených ocrelizumabem
a 5,9 % nemocných v placebové skupině. Herpetické
infekce byly zaznamenány u 4,7 % léčených ocrelizumabem
proti 3,3 % ve skupině pacientů s placebem. Stupeň
infekčních nežádoucích reakcí byl lehký nebo středně těžký.
Další nežádoucí reakce jsou ve studii ORATORIO uvedeny
v tabulce 5
a výskyt malignit v tabulce 4 [8].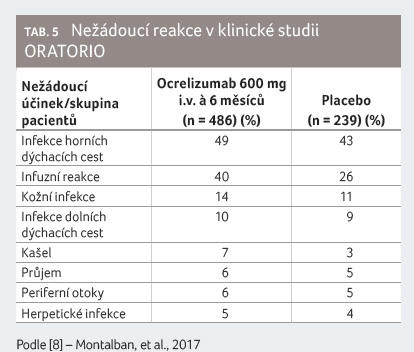
Těhotenství
Údaje o užívání ocrelizumabu v těhotenství jsou omezené. Nebyla zjištěna žádná data o počtu B lymfocytů u kojenců vystavených ocrelizumabu a potenciální doba deplece B lymfocytů u kojenců není známa. U dětí narozených matkám, které byly vystaveny jiným anti CD20 protilátkám v průběhu těhotenství, byla hlášena přechodná deplece periferních B lymfocytů a lymfocytopenie [13]. Ženy ve fertilním věku v průběhu léčby ocrelizumabem a po dobu 12 měsíců po poslední infuzi by měly používat antikoncepci. Není známo, zda ocrelizumab a jeho metabolity přecházejí do mateřského mléka. Protože nelze vyloučit riziko pro novorozence/kojence, není doporučeno ženám v průběhu léčby ocrelizumabem kojit.
Závěr
Výsledky všech tří klinických studií (OPERA I a II, ORATORIO) prokázaly pozitivní účinek ocrelizumabu u RR RS a PP RS. V porovnání s komparátorem IFNβ 1a ocrelizumab snížil počet relapsů ve studii OPERA a prokázal oddálení progrese nemoci ve studii ORATORIO. Průkaz oddálení progrese nemoci u PP RS naznačuje, že zánět zprostředkovaný B lymfocyty hraje přímou nebo nepřímou roli v neurodegeneraci u RS.
Ocrelizumab je indikován k léčbě dospělých pacientů v aktivní fázi onemocnění RR RS a podpořené základní triádou pomocných vyšetření: MR mozku, eventuálně míchy, mozkomíšního moku a zrakových evokovaných potenciálů. Současně je indikován k léčbě dospělých pacientů s časnou PP RS, s ohledem na délku trvání onemocnění, stupeň disability a na zánětlivou aktivitu prokázanou zobrazovacími metodami. Diagnóza RR RS a PP RS splňuje McDonaldova kritéria z roku 2010 [9], revidovaná a doplněná na kongresu ECTRIMS roku 2017 [15].
Ocrelizumab představuje první účinnou léčbu pro pacienty s PP RS [7,8,11,16]. Rozhodující budou výsledky longitudinálního sledování, které by mělo přinést další důkazy o účinnosti a bezpečnosti přípravku. Předpokládá se, že podobně jako u všech ostatních registrovaných léků na léčbu RS bude jeho účinnost také u PP RS tím větší, čím dříve bude terapie zahájena. Účinnost přitom není provázena závažnými bezprostředními nebo dlouhodobějšími nežádoucími účinky léčby [11].
Seznam použité literatury
- [1] Krejsek J. Biologická terapie ocrelizumabem (anti‑CD20) je překvapivě klinicky účinná u nemocných s roztroušenou sklerózou mozkomíšní. Neurol praxi 2017; 18: 403‒407.
- [2] Winger RC, Zamvil SS. Antibodies in multiple sclerosis oligoclonal bands target debris. Proc Natl Acad Sci U.S.A 2016; 113: 7696‒7698.
- [3] Brück W. The pathology of multiple sclerosis is the reset of focal inflammatory demyelination with axonal damage. J Neurol 2005; 252(Suppl 5): v3‒v9.
- [4] Milo R. Therapeutic strategies targeting B‑cells in multiple sclerosis. Autoimmun Rev 2016; 15: 714‒718.
- [5] Lehmann‑Horn K, Kronsbein HC, Weber MS. Targeting B cells in the treatment of multiple sclerosis: recent advances and remaining challenges. Ther Adv Neurol Disord 2013; 6: 161‒173.
- [6] Kappos L, Li D, Calabresi PA, et al. Ocrelizumab in relapsing‑remitting multiple sclerosis a phase 2, randomised, placebo‑controled, multicentre trial. Lancet 2011; 378: 1779‒1787.
- [7] Hauser SL, Bar‑Or A, Giovannoni G, et al., for the OPERA I and OPERA II Clinical Investigators. Ocrelizumab versus Interferon Beta‑1a in Relapsing Multiple Sclerosis. N Engl J Med 2017; 376: 221‒234.
- [8] Montalban X, Hauser SL, Kappos L, et al., for the ORATORIO Clinical Investigators. Ocrelizumab versus Placebo in primary progressive Multiple Sclerosis. N Engl J Med 2017; 376: 209‒220.
- [9] Polman CH, Reingold SC, Banwell B, et al. Diagnostic Criteria for Multiple Sclerosis: 2010 Revisions to the McDonald Criteria. Ann Neurol 2011; 69: 292–302.
- [10] Polman CH, Reingold SC, Edan G, et al. Diagnostic criteria for multiple sclerosis: 2005 revisions to the “McDonald Criteria”. Ann Neurol 2005; 58: 840‒846.
- [11] Kubala Havrdová E. Ocrelizumab v léčbě roztroušené sklerózy. Neurol praxi 2017; 18: 287‒290.
- [12] Winkelmann A, Loebermann M, Reisinger EC, et al. Disease modifying therapies and infectious risks in multiple sclerosis. Nat Rev Neurol 2016; 12: 217‒233.
- [13] Wawker K, O’Connor P, Freedman MS, et al. Rituximab in patiens with primary progresivně multiple sclerosis: results of a randomised double‑blind placebo‑controled multicenter trial. Ann Neurol 2009; 66: 460‒471.
- [14] Kimgwell E, Bajdik C, Phillips N, et al. Cancer risk in multiple sclerosis: findings from British Columbia, Canada. Brain 2012; 135: 2873‒2879.
- [15] Thompson AJ, Banwell BL, Barkhof F, et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2017; doi: org/10.1016/S1474‑4422(17)30470‑2.
- [16] Sørensen PS, Blinkenberg M. The potencial role for ocrelizumab in the treatment of multiple sclerosis: current evidence and future prospects. Ther Adv Neurol Disord 2016; 9: 44‒52.