Omalizumab – terapeutická perspektiva v léčbě těžkého bronchiálního astmatu
V dokumentu GINA z roku 2005 jsou nově do léčebného schématu bronchiálního astmatu řazeny anti-IgE protilátky (omalizumab) a jsou uvedeny jako léčba ke zlepšení kontroly astmatu u pacientů s těžkým perzistujícím alergickým astmatem. Monoklonální anti-IgE protilátka (omalizumab, firemní název Xolair) je molekula, která je z 95 % tvořena lidským imunoglobulinem podtřídy G1 (IgG1), ke kterému je v oblasti hypervariabilních úseků připojena myší anti-IgE protilátka. Omalizumab se selektivně váže na konstantní doménu Fc3 lidského IgE a tímto zabraňuje vazbě IgE na receptory buněk zúčastněných v rozvoji zánětu. Léčba omalizumabem je indikována u obtížně léčitelných a labilních astmatiků s typem astmatu IgE zprostředkovaným, kteří mají klinicky vyjádřenou alergickou vazbu na celoroční aeroalergeny a prokázanou prick testem či reaktivitou in vitro. Dle studií pravidelná subkutánní aplikace omalizumabu v rámci komplexní antiastmatické léčby dle GINA (stupeň 4) je schopna redukovat těžké exacerbace a zlepšuje dlouhodobou kontrolu nad astmatem se snížením spotřeby záchranné medikace a perorálních kortikosteroidů
Úvod
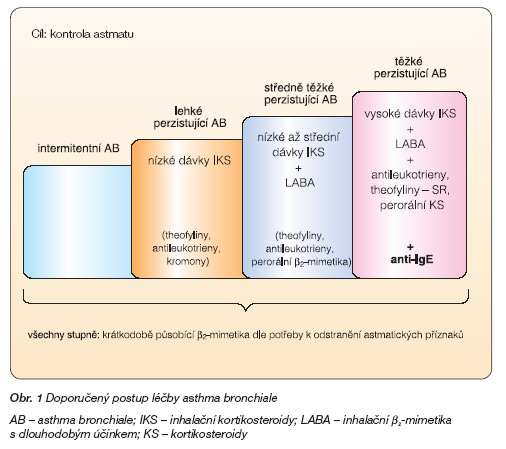
Bronchiálním astmatem trpí ve světě až 300 milionů lidí a do roku 2025 bude podle současných populačních dat toto číslo ještě o 100 milionů vyšší [33]. V Evropě je udáváno, že 20 % nemocných má projevy těžkého perzistujícího astmatu, z toho až jedna pětina pacientů má astma, které i přes komplexní antiastmatickou terapii projevuje příznaky nedostatečně kontrolovaného astmatu [32]. Studie ukazují, že předchozí hospitalizace pro astma má vysokou prediktivní hodnotu pro riziko úmrtí na astma. Je uváděno, že tito hospitalizovaní astmatici jsou až v 16násobném riziku mortality na astma [31]. Pacienti s těžkým perzistujícím astmatem mají navzdory léčbě omezené životní aktivity pro vysoce variabilní denní a noční příznaky a těžké exacerbace. Kontrola astmatu nemusí být u nich vůbec dosažitelná [4]. Primární léčbu představují inhalační kortikosteroidy ve vysoké dávce – denně více než 1000 mg beklometason dipropionátu nebo jeho ekvivalentu v kombinaci s inhalačními b2-mimetiky s dlouhodobým účinkem. Alternativně lze přidat theofyliny s prodlouženým účinkem, antileukotrieny nebo perorální b2-mimetika s dlouhodobým účinkem. Je-li to nezbytné, přistupuje se k dlouhodobé léčbě perorálními kortikosteroidy v nejnižší možné dávce. Takto je doporučena antiastmatická terapie dle dokumentu Globální iniciativy pro astma (GINA) z roku 2002 [18]. V recentním dokumentu GINA z roku 2005 nastal významný posun, kdy anti-IgE protilátky (omalizumab) jsou nově řazeny do základního léčebného schématu bronchiálního astmatu a jsou uvedeny jako léčba ke zlepšení kontroly astmatu u pacientů s těžkým perzistujícím alergickým astmatem [19] (obr. 1).
Přibližně dvě třetiny případů bronchiálního astmatu jsou alergického původu [19]. Ač u těžkého astmatu se v kaskádě imunologických dějů předpokládají i další mechanismy, bylo prokázáno, že více než 50 % těžkých astmatiků má pozitivní kožní testy na běžné aeroalergeny [15]. U těchto pacientů lze přepokládat zlepšení kontroly nad astmatem zásahem do řetězce dějů zprostředkovaných IgE protilátkami.
Vývoj anti-IgE protilátky (omalizumabu)
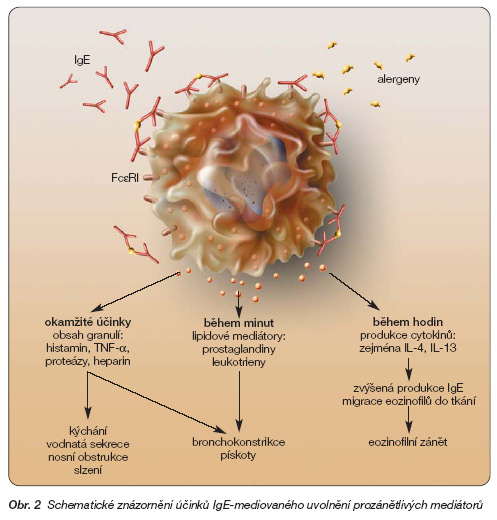
Mechanismy zprostředkované IgE mají dominantní roli v patofyziologii alergického zánětu (obr. 2).
Strategie, které přerušují nebo zpomalují mechanismy vedoucí k tomuto zánětu, jsou terapeuticky velmi účinné.
Z inhibitorů zkoumaných v různých fázích alergické kaskády od výzkumu až po terapeutické užití se prokázala jako účinná monoklonální anti-IgE protilátka – omalizumab. Vývoj molekuly omalizumabu sahá až k přelomu 80. a 90. let minulého století. Rekombinantní technologií byla připravena molekula, která je z 95 % tvořena lidským imunoglobulinem podtřídy G1 (IgG1), ke kterému je v oblasti hypervariabilních úseků připojena myší anti-IgE protilátka. Z 5 % myší protilátky pouhé 3 aminokyselinové zbytky nejsou prezentovány v protilátkách lidských. Omalizumab se selektivně váže na konstantní doménu Ce3 lidského IgE, tedy v místě vazby IgE s vysoko- a nízkoafinními buněčnými receptory [3, 14].
Ve studiích bylo dokladováno, že omalizumab (anti-IgE protilátka) je schopen snížit množství cirkulujícího imunoglobulinu IgE řádově. S vazbou na výši dávky je subkutánně aplikovaný omalizumab schopen snižovat volné celkové IgE až na 96–99 % původní hodnoty [7, 14].
Snížení volného IgE v séru a omezení jeho vazby na vysokoafinní receptory zamezuje degranulaci efektorových buněk, což vede ke snížení aktivace buněk zánětu s následnou redukcí receptorů FceRI na mastocytech a bazofilech [28]. V průběhu léčby omalizumabem (studijní fáze I) byla sledována denzita vysokoafinních receptorů na bazofilech; v rozmezí tří měsíců byl zaznamenán jejich významný pokles – z 220 000 na 8300 FceRI/bazofil [5, 29].
Omalizumab je taktéž schopen vazby s molekulami IgE exprimovanými na B lymfocytech, což vede k inhibici produkce nových IgE protilátek. Recentně bylo prokázáno, že omalizumab rovněž ovlivňuje expresi receptorů na antigen-prezentujících buňkách, čímž zásadně zasahuje do mechanismu aktivace T lymfocytů. Tento mechanismus interakce s reakcí časné a pozdní přecitlivělosti byl ve studiích dokladován i klinicky – jednorázové podání omalizumabu potlačilo jak časnou, tak i pozdní bronchokonstrikci po podání alergenu [12, 16].
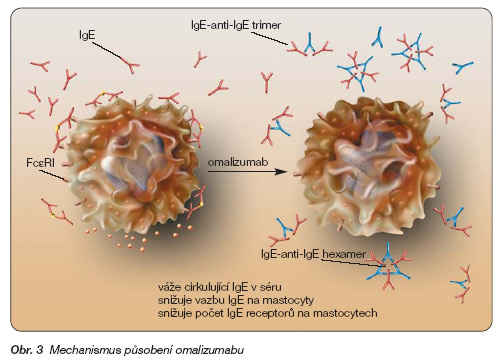
Na druhé straně tato protilátka není schopna vazby s IgE již vázanými na mastocytech, její aplikace tedy není provázena anafylaktogenními účinky v důsledku přemostění navázaných IgE molekul. Vytvořené solubilní komplexy IgE s omalizumabem jsou trimery až hexamery o maximální molekulové hmotnosti 1 milion daltonů (což odpovídá velikosti lidského IgM), a nejsou proto schopny aktivovat komplementový systém (obr. 3). Komplexy jsou vychytávány v retikuloendotelovém systému, převážná část komplexů se vylučuje močí bez akumulace v glomerulech ledvin [24].
Pokud uvedené vlastnosti shrneme, omalizumab zabraňuje vazbě IgE na receptory buněk bez vyvolání protilátkové odpovědi po jejich opakovaném podání.
Klinické studie s omalizumabem
Léčba omalizumabem bude v klinické praxi nejdříve směřovat k těžkým astmatikům s atopickým typem bronchiálního astmatu. V současné době lze shrnout již přesvědčivá data o účinnosti a bezpečnosti omalizumabu z celkem 7 klinických studií. Do studií bylo zařazeno více než 7500 pacientů s astmatem a alergickou rýmou, z nichž více než 5300 bylo léčeno omalizumabem. Pět studií ze sedmi bylo randomizovaných, dvojitě slepých, placebem kontrolovaných, dvě studie byly otevřené s aplikací účinné látky (jedna z nich byla zaměřena preferenčně na bezpečnost). Do analýzy shromážděných dat ze studií bylo začleněno 4308 pacientů, z nichž 93 % mělo těžké perzistující astma [2, 6, 8, 21, 23, 25, 34].
Rozbor dat z různě koncipovaných studií prokázal, že omalizumab je schopen bez ohledu na pohlaví, věk či základní hodnotu IgE redukovat exacerbace bronchiálního astmatu a že největší zlepšení bylo doloženo právě ve skupině těžkých astmatiků. Počet exacerbací astmatu u pacientů léčených omalizumabem byl snížen o 38 % a návštěvy na lékařských pohotovostech o 47 % ve srovnání s kontrolními skupinami. Omalizumab se tímto zařadil do skupiny preventivních antiastmatik, neboť spíše než krátkodobou úlevu poskytuje a zlepšuje dlouhodobou kontrolu nad astmatem se snížením spotřeby záchranné medikace a perorálních kortikosteroidů. V průběhu prvního roku léčby nepotřebovalo perorální kortikosteroidy ke komplexní léčbě 49 % astmatiků dostávajících omalizumab, kdežto ve skupině kontrolní nebylo nutné nasazovat systémové steroidy jen ve 26 % případů. V závěru prvního roku léčby poklesla ve skupině nemocných s aplikovaným omalizumabem spotřeba záchranné medikace o 80 %.
Mezi studiemi zaujala svým způsobem výjimečné místo studie INNOVATE, která se cíleně zaměřila na pacienty s těžkým perzistujícím astmatem nedostatečně kontrolovaným navzdory léčbě vysokými dávkami inhalačních kortikosteroidů v kombinaci s inhalačními b2-mimetiky s dlouhodobým účinkem a s další přídatnou terapií (dle GINA stupeň 4). Studie byla randomizovaná, dvojitě slepá, placebem kontrolovaná, omalizumab byl podáván po dobu 28 týdnů [26]. Dle výsledků studie omalizumab přidaný ke komplexní antiastmatické léčbě dle GINA (stupeň 4) je schopen redukovat signifikantní zhoršení astmatu o 26 % a těžké exacerbace o 50 % u této terapeuticky obtížně zvládnutelné skupiny astmatiků.
Zlepšení kvality života udávalo 60,8 % pacientů ve srovnání se 47,8 % nemocných, kterým bylo podáváno placebo.
Studie s omalizumabem prokázaly, že lék je obecně velmi dobře tolerován a že frekvence, tíže a skladba nežádoucích příhod byla obdobná jako ve skupině dostávající placebo.
Při terapii alergického astmatika omalizumabem je třeba si uvědomit, že astmatický pacient může mít prospěch též z příznivého ovlivnění alergické rýmy. Existují studie, ve kterých byla dokladována účinnost omalizumabu u pacientů s diagnózou sezonní alergické rinitidy. Léčba byla aplikována v předstihu – v průměru 4 týdny před počátkem pylové sezony a následně v jejím průběhu. Bylo prokázáno signifikantní zlepšení skóre nosních příznaků, snížení spotřeby antihistaminik ve srovnání se skupinou užívající placebo [1, 10]. Jako perspektivní se omalizumab jeví v rukou alergologa v kombinaci s užitím alergenové imunoterapie. Studie, které se zabývaly kombinací obou léčebných postupů, prokázaly aditivní efekt omalizumabu k imunomodulačním účinkům alergenové vakcinace [26].
Praktické aspekty
Terapeutické indikace
Omalizumab je určen pro léčbu těžkého perzistujícího bronchiálního astmatu, u kterého nejsme schopni dosáhnout kontroly ani léčbou vysokými dávkami inhalačních kortikosteroidů a léčbou dlouhodobě působícími inhalačními b2-mimetiky. Léčbu je možné zahájit pouze u pacientů s typem astmatu zprostředkovaným IgE, kteří mají prokázanou alergickou vazbu na celoroční aeroalergeny – buď „prick" testem či reaktivitou in vitro. Terapie směřuje k pacientům, kteří mají sníženou funkci plic (FEV1 < 80 %) s častými denními a nočními symptomy, popřípadě s těžkými exacerbacemi astmatu navzdory uvedené léčbě [10, 11]. Léčba není v této fázi doporučena pacientům mladším 12 let.
Omalizumab není určen k léčbě akutní exacerbace astmatu či status asthmaticus [12].
Dávkování a způsob podání
Lék je aplikován subkutánně v pravidelných dvou- až čtyřtýdenních intervalech. Dávka a frekvence podání je individuální a závisí na hodnotě výchozího celkového IgE a hmotnosti pacienta (viz obr. 4).
Lék je indikován pacientům s celkovým IgE mezi 30–700 IU/ml a s tělesnou hmotností do 150 kg, pacientům mimo uvedené limity by neměl lék být podáván. Maximální doporučená dávka, které lze dle schématu dosáhnout, je 375 mg omalizumabu (tedy dvě inj. po 1,2 ml a jedna inj. 0,6 ml) v intervalech každé dva týdny. U pacientů s hodnotami IgE < 76 IU/ml je třeba vzít v úvahu možnost nižší účinnosti přípravku. U těchto nemocných se proto zvlášť doporučuje ubezpečit se o spouštěčích bronchiálního astmatu a aplikaci mít jednoznačně podpořenu vyšetřením specifických IgE protilátek.
Při započetí léčby je třeba si uvědomit a též pacienta informovat o tom, že se jedná o léčbu dlouhodobou, zlepšení stavu lze očekávat postupně v průběhu 16 týdnů aplikace léku. Tento interval je taktéž platný pro indikujícího lékaře.
Paradoxně jsou hodnoty celkového IgE v průběhu léčby zvýšené, neboť laboratorně detekujeme komplexy anti-IgE-IgE s postupnou clearance. Teprve pokud je interval přerušení léčby delší než jeden rok, je možné vypočítat dávku léku z opětného vyšetření celkového IgE [11, 12, 30].
Omalizumab by měl být uchováván při teplotě 2–8 °C. Před aplikací je ředěn sterilní vodou pro injekce a při pokojové teplotě zůstává roztok stabilní po dobu čtyř hodin. Také vzhledem k ceně léku je proto vhodné nepřipravovat lék, dokud pacient není k plánované aplikaci v ordinaci přítomen.
Do lahvičky s obsahem 150 mg omalizumabu je doporučeno aplikovat 1,4 ml sterilní vody. Rozpuštění lyofilizovaného přípravku trvá 20 minut, někdy i déle. Subkutánní podání je doporučeno do oblasti deltového svalu ramene, alternativně do stehna. Vzhledem k viskozitě roztoku trvá aplikace 5 až 10 sekund. Po jednorázové dávce se lék z ložiska absorbuje pomalu a dosahuje maximální koncentrace v séru v průměru po 7 dnech, v průběhu léčby po opakovaných dávkách se doba výrazně zkracuje. Průměrný poločas eliminace ze séra činí 26 dní, léčivo je odbouráváno v retikuloendotelovém systému jater.
Jedinou kontraindikací léčby je prokázaná hypersenzitivita na léčivou nebo pomocnou látku. Je však doporučeno zachovávat určitou opatrnost u pacientů s autoimunitním onemocněním, onemocněním imunokomplexového typu a zhoršenou funkcí ledvin nebo jater. Pacienti s poruchou glycidového metabolismu by měli být upozorněni, že jedna dávka obsahuje taktéž 108 mg sacharózy [11, 30].
Bezpečnost a snášenlivost léčby omalizumabem
Bezpečnost léčby omalizumabem byla sledována u více než 7500 pacientů s astmatem a alergickou rýmou, kteří se zúčastnili klinických studií. Dle získaných výsledků přípravek prokázal jak vynikající bezpečnost, tak snášenlivost. Pouze reakce v místě aplikace se vyskytovaly častěji ve skupině léčené omalizumabem (drobné hematomy, svědění, zarudnutí). Objevovaly se v průběhu 1 hodiny po aplikaci látky a nebyly důvodem k vyřazení pacientů ze studií. Anafylaxe charakterizovaná angioedémem byla ze všech klinických studií hlášena pouze u 3 pacientů. Od července 2003, kdy byl omalizumab zaveden do klinické praxe v USA a je v současnosti aplikován 45 000 pacientům, dosud nebyla hlášena fatální systémová anafylaktická příhoda [22].
V klinických studiích mělo několik pacientů počet krevních destiček pod spodní hranicí normálního laboratorního rozmezí. Žádná z těchto změn nebyla spojena s epizodami krvácení [14].
Placebem kontrolovaná studie u pacientů s chronicky vysokým rizikem helmintóz ukázala mírně zvýšenou četnost výskytu infekcí u pacientů užívajících omalizumab ve srovnání s kontrolní skupinou. Toto zvýšení nebylo statisticky signifikantní. Průběh, závažnost a odpověď na léčbu infekcí se nezměnily [27, 30].
Těhotenství a laktace
Údaje o podávání omalizumabu těhotným ženám nejsou k dispozici. Ve studiích se zvířaty nebyla prokázána embryotoxicita nebo teratogenita v průběhu organogeneze, nebyly pozorovány poruchy v období fetálního a neonatálního růstu či v období kojení. Avšak omalizumab, obdobně jako IgG, prochází placentární bariérou či do mateřského mléka. Omalizumab je řazen mezi léčiva kategorie B a měl by být užit v období gravidity a laktace pouze tehdy je-li skutečně nezbytný [11].
Lékové interakce
Omalizumab není v organismu metabolizován vazbou na protein či cestou P-450 cytochrom-enzymatického systému, což jsou dva hlavní faktory vedoucí k lékovým interakcím. V klinických studiích nebyly prokázány žádné lékové interakce omalizumabu s užívanou antiastmatickou léčbou [12].
Cena léčby omalizumabem
Přípravek s obsahem omalizumabu byl uveden na trh v USA v červnu 2003. V současné době je registrován v USA, Kanadě, na Novém Zélandu, v Austrálii a v Mexiku. V Evropské unii je zaregistrován EMEA (European Medicine Evaluation Agency) od října 2005. Pro Českou republiku platí stejná pravidla jako pro všechny členy EU, v současné době u nás probíhá proces kategorizace a stanovení úhrady pojišťovnou.
Průměrná cena jedné lahvičky v Evropské unii je 375 EU. K ceně léku je nutné připočítat návštěvy u lékaře spojené s aplikací preparátu. I přes cenově náročnou léčbu lze u těžkých astmatiků přepokládat snížení nákladů na léčbu. Vzhledem k indikačním kritériím omalizumabu se jedná o skupinu nemocných často hospitalizovaných, s pobytem na odděleních intenzivní péče či vyhledávajících lékařskou pohotovost a navštěvujících často specialisty. Při kompenzaci stavu nestabilních astmatiků lze předpokládat snížení celkových nákladů spojených s léčbou těžkých chronických pacientů.
Závěr
Jako systémově působící anti-IgE protilátka prokázal omalizumab (firemní název Xolair, spolupráce firem Genentech a Novartis) klinickou účinnost u nemocných se středně těžkým až těžkým astmatem alergického typu s konkomitantní diagnózou alergické rýmy. Jeho klinický účinek na různých etážích alergického procesu zdůrazňuje zásadní význam IgE protilátek v rozvoji alergického zánětu.
Dle uvedeného klinického profilu omalizumabu lze říci, že léčba tímto preparátem vykazuje systémovou biologickou aktivitu a svým komplexním působením zasahuje podstatu alergického onemocnění. Používání omalizumabu lze v České republice očekávat v blízké klinické praxi. Terapie bude nejdříve směřovat k pacientům s obtížně léčitelným a labilním typem atopického astmatu i při užití vysokých dávek inhalačních kortikosteroidů, popř. perorálních kortikosteroidů. Dle našich zkušeností z klinické studie vykazují terapeutickou odpověď na léčbu omalizumabem více ti pacienti, u nichž je i při chronicitě těžkého onemocnění klinicky vyjádřena reaktivita na diagnostikované spouštěče.
Obr. 1 Doporučený postup léčby asthma bronchiale
AB – asthma bronchiale; IKS – inhalační kortikosteroidy; LABA – inhalační b2-mimetika s dlouhodobým účinkem; KS – kortikosteroidy
Obr. 2 Schematické znázornění účinků IgE-mediovaného uvolnění prozánětlivých mediátorů
Obr. 3 Mechanismus působení omalizumabu
Obr. 4 Dávkovací schéma omalizumabu
Seznam použité literatury
- [1] Adelroth E, Rak S, Haahtela T, et al. Recombinant humanized mAb-E25, an anti-IgE mAb, in birch pollen-induced seasonal allergic rhinitis. J Allergy Clin Immunol 2000; 106: 253–259.
- [2] Ayres JG, Higgins B, Chilvers ER, et al. Efficacy and tolerability of anti-immunoglobulin E therapy with omalizumab in patients with poorly controlle (moderate-to severe) allergic asthma. Allergy 2004; 59: 701–708.
- [3] Barnes PJ. Anti-IgE therapy in asthma: rationale and therapeutic potential. Int Arch Allergy Immunol 2000; 123: 196–204.
- [4] Bateman ED, Boushey HA, Bouquet J, et al. Can guideline-defined asthma control be achieved? The Gaining Optimal Asthma ControL study. Am J Respir Crit Care Med 2004; 17: 836–844.
- [5] Beck LA, Marcotte, GV, MacGlashan, D, Togias A, Saini S. Omalizumab-induced educations in mast cell FcRI expression and function. J Allergy Clin Immunol 2004; 114: 527–530.
- [6] Beeh KM, Fox H, Freeman PR, et al. Omalizumab significantly improves quality of life in patients with severe persistent allergic asthma: a pooled analysis. Eur Respir J 2005; 26: 424.
- [7] Boushey HA. Anti-IgE. 57th AAAAI Annual Meeting. Hilton, 16. 3. 2001. In: Novel and non-traditional therapy for IgE-mediated disease, 2001.
- [8] Bousquet J, Cabrera P, Bergman N, et al. The effect of treatment with omalizumab, an anti-IgE antibody, on asthma exacerbations and emergency medical visits in patients with severe persistent asthma. Allergy 2005; 60: 302–308.
- [9] Busse W, Corren J, Lanier BQ, et al. Omalizumab, anti-IgE recombinant humanized monoclonal antibody, for the treatment of severe allergic asthma. J Allergy Clin Immunol 2001; 108: 184–190.
- [10] Casale TB, Bernstein IL, Busse WW, et al. Use of anti-IgE humanized monoclonal antibody in ragweed-induced allergic rhinitis. J Allergy Clin Immunol 1997; 100: 110–121.
- [11] Davis LA. Omalizumab: A novel therapy for allergic asthma. Ann Pharmacother 2004; 38: 1236–1242.
- [12] D´Amato G. Therapy of allergic bronchial asthma with omalizumab – an anti-IgE monoclonal antibody. Expert Opin Biol Ther 2003; 3: 371–376.
- [13] Djukanović R, Wilson SJ, Kraft M, et al. The effects of anti-IgE (omalizumab) treatment on airways inflammation in allergic asthma. Am J Respir Crit Care Med 2004; 170: 583–593.
- [14] Easthope S, Jarvis B. Omalizumab. Drugs 2001; 61: 253–260.
- [15] European Network for Understanding Mechanismus of Severe Asthma (ENFUMOSA). The ENFUMOSA cross-sectional European multicentre study of the clinical phenotype of chronic severe asthma. Eur Respir J 2003; 22: 470–477.
- [16] Fahy JV, Fleming HE, Wong HH, et al. The effect of an anti-IgE monoclonal antibody on the early- and late- phase responses to allergen inhalation in asthmatic subjects (see comments). Am J Respir Crit Care Med 1997; 155: 1828–1834.
- [17] Fregonese L, Patel A, van Schadewijk A, et al. Expression of the high-affinity IgE receptor (FcRI) is increased in fatal asthma [abstract]. Am J Respir Crit Care Med 2004; 169: A297.
- [18] Global Initiative for Asthma. Global strategy for asthma management and prevention. NIH Publication No 02-3659, updated 2002.
- [19] Global Initiative for Asthma. Global strategy for asthma management and prevention. NIH Publication No 02-3659, updated 2005.
- [20] Hamelmann E, Tadeda K, Oshiba A, et al. Role of IgE in the development of allergic airway inflammation and airway hyperresponsiveness – a murine model. Allergy 1999; 54: 297–305.
- [21] Holgate S, Bousquet J, Wenzel S, et al. Efficacy of omalizumab, an antiimmunoglobulin E antibody, in patients with allergic asthma at high risk of serious asthma-related morbidity and mortality. Curr Medic Research Opin 2001; 17: 233–240.
- [22] Holgate S, Casale T, Wenzel S, et al. The anti-inflammatory effects of omalizumab confirm the central role of IgE in allergic inflammation. J Allergy Clin Immunol 2005; 115: 459–465.
- [23] Holgate ST, Chuchalin AG, Hébert J, et al. Efficacy and safety of a recombinant anti-immunoglobulin E antibody (omalizumab) in severe allergic asthma. Clin Exp Allergy 2004; 34: 632–638.
- [24] Holgate ST, Corne J, Jardieu P, et al. Treatment of allergic airways disease with anti-IgE. Allergy 1998; 53: 83–88.
- [25] Humbert M, Beasley R, Ayres J, et al. Benefits of omalizumab as add-on therapy in patients with severe persistent asthma who are inadequately controlled despite best available therapy (GINA 2002 step 4 treatment): INNOVATE. Allergy 2005; 60: 309–316.
- [26] Kuehr J, Brauburger J, Zielen S, et al. Efficacy of combination treatment with anti-IgE plus specific immunotherapy in polysensitized children and adolescents with seasonal allergic rhinitis. J Allergy Clin Immunol 2002; 109: 274–280.
- [27] Lanier BQ, Chang TW. Will anti-IgE therapy compromise normal immune functions? Allergy Clin Immunol Int – J World Allergy Org 2004; 16: 237–240.
- [28] Lin H, Boesel KM, Griffith DT, et al. Omalizumab rapidly decreases nasal allergic response and FcRI on basophils. J Allergy Clin Immunol 2004; 113: 297–302.
- [29] MacGlashan Jr DW, Bochner BS, Adelman DC, et al. Down-regulation of FcRI expression on human basophils during in vivo treatment of atopic patients with anti-IgE antibody. J Immunol 1997; 158: 1438–1445.
- [30] Package insert. Xolair (omalizumab). East Hanover, NJ: Aventis, June 2003.
- [31] Papiris S, Kotanidou A, Malagari K, Roussos C. Clinical review: severe asthma. Crit Care 2002; 6: 30–44.
- [32] Masoli M, Fabian D, Holt S, Beasley R. The global burden of asthma: executive summary of the GINA Dissemination Committee report. Allergy 2004; 59: 469–478.
- [33] Rabe KF, Adachi M, Lai CK, et al. Worldwide severity and control of asthma in children and adults: the global asthma insights and reality surveys. J Allergy Clin Immunol 2004; 114: 40–47.
- [34] Vignola AM, Humbert M, Bousquet J, et al. Efficacy and tolerability of anti-immunoglobulin E therapy with omalizumab in patients with concomitant allergic asthma and persistent allergic rhinitis: SOLAR. Allergy 2004; 59: 709–717.